甘露寡糖对欧洲鳗鲡(Anguilla anguilla)生长、消化酶活性及非特异性免疫的影响
2017-01-03杨敏黎中宝卢静陈强李文静黄永春
杨敏,黎中宝,卢静,陈强,李文静,黄永春
(集美大学水产学院;福建省海洋渔业资源与生态环境重点实验室:福建 厦门 361021)
甘露寡糖对欧洲鳗鲡(Anguilla anguilla)生长、消化酶活性及非特异性免疫的影响
杨敏,黎中宝*,卢静,陈强,李文静,黄永春
(集美大学水产学院;福建省海洋渔业资源与生态环境重点实验室:福建 厦门 361021)
为探讨甘露寡糖(MOS)对欧洲鳗鲡生长、体组成、消化酶活性及非特异性免疫的影响,选取540尾初重为(5.82±0.02)g幼鳗,随机分为6组,每组3个重复,在基础饲料中分别添加不同含量的甘露寡糖(0、0.10%、0.20%、0.30%、0.40%、0.50%),连续投喂42 d。实验结果表明,0.40%组和0.50%组鳗鲡增重率分别比对照组提高了28.01%、23.85%(P<0.05),肝体指数和肥满度于各组间均无显著差异(P>0.05)。相比对照组,MOS添加组鱼体水分含量显著降低,粗蛋白和粗灰分含量显著提高,但各组之间粗脂肪含量差异不显著(P>0.05)。0.20%~0.50%的MOS能够提高鳗鲡肠道胰蛋白酶、淀粉酶和脂肪酶活性。随着MOS含量的增加,血清超氧化物歧化酶(SOD)、溶菌酶(LZM)、碱性磷酸酶(AKP)活性均呈先增后降趋势,0.30%~0.40%添加组欧鳗血清SOD活性显著高于对照组且达各组最高水平(P<0.05),0.40%组LZM和AKP活性达各组最高水平,血清TP随MOS含量的增加不断升高,并于0.5%组达最大值。综上所述,饲料添加MOS有促进鳗鲡生长、增强肠道消化酶活性和提高鳗鲡非特异性免疫力的作用,本实验条件下MOS的适宜添加量为0.4%。研究结果为欧洲鳗鲡在养殖过程中甘露寡糖适宜添加量的确定提供理论参考。[中国渔业质量与标准,2016,6(6):40-46]
欧洲鳗鲡;甘露寡糖;生长;体组成;消化酶;非特异性免疫
水产养殖的规模化在给人们带来丰富食物来源的同时也带来了药物残留、环境污染、抗药性等诸多问题,迫于来自人类健康和环境保护的压力,绿色抗病促长添加剂的研究日益受到重视。作为新型微生态添加剂中的寡糖,由于具有纯天然、性质稳定和效果奇异的优点而成为人们所期望的焦点。甘露寡糖(mannan oligosaccharides,MOS)作为一种典型的功能性寡糖,已经在哺乳动物、畜禽等研究上表现出具有提高养殖品种生产性能、改善肠道微生物区系及提高免疫力等功能[1-3]。在水产养殖动物的研究上,MOS也能表现出改善水产动物生长性能,提高非特异性免疫力的作用。在奥尼罗非鱼(Oreochromisniloticus×O.aureus)[4]的基础饲料中添加不同含量的甘露寡糖,进行30 d的养殖实验,实验结果显示,饲料中添加0.5%、0.75%的MOS均能显著提高奥尼罗非鱼生长性能,增强血清非特异性免疫功能;张红梅[5]在鲤的基础饲料中添加不同含量的甘露寡糖,进行45 d的养殖实验,实验结果显示,饲料中添加0.4%的甘露寡糖可显著提高鲤的增重率和降低饵料系数,显著增强血清SOD活性;Zhang等[6]在凡纳滨对虾(Litopenaeusvannamei)的基础饲料中添加不同含量的甘露寡糖,进行56 d的养殖实验,实验结果显示,添加量为0.4%~0.8%的MOS组血清SOD活性显著高于对照组,生长性能也得到改善。然而,水生动物因其特殊的生理特点及生活环境,到目前为止,对MOS在不同的水产动物上是否具有类似作用效果的研究报道还较少,并且研究报道的结论也存在差异[7-9],需要更多相关方面的研究。
欧洲鳗鲡(Anguillaanguilla),属鳗鲡目,鳗鲡科,鳗鲡属,肉食性鱼类,肉质鲜美、营养丰富是国内外畅销的一种名贵淡水鱼类。欧洲鳗鲡因其养殖产量高、经济价值高而成为广州、福建等沿海地区重要的养殖品种[10]。然而,面对日渐匮乏的鳗鲡苗种,进行人工育苗和营养饲料的研究成为维持鳗鲡产业可持续发展的必由之路。
目前国内对欧洲鳗鲡有进行分子生物学方面的研究[11],也有Hg2+[12]、三唑磷[13]对欧洲鳗鲡急性毒性的研究,也有欧洲鳗鲡对极限高温和低温耐受性的研究[14];但目前国内对欧洲鳗鲡营养饲料的研究极少,仅见多维[15]、复合酶制剂[16]在欧洲鳗鲡饲料上的应用研究,未见MOS在欧洲鳗鲡饲料上的研究报道。本实验通过在饲料中添加MOS投喂欧洲鳗鲡,研究MOS对欧洲鳗鲡生长、体成分、肠道酶活性和血清免疫酶的影响,探讨MOS的适宜添加量,从而为提高欧洲鳗鲡生长性能和非特异性免疫力提供理论依据。
1 材料与方法
1.1实验用鱼及饲养管理
实验用欧洲鳗鲡购于福建省龙岩市养鳗场。将购回的鳗鲡置于集美大学海水试验场循环过滤桶(1 200 L)中暂养15 d,暂养期间,每天两次定时(8:00,18:00)投喂基础饲料。
暂养结束后挑选无病、无伤、活力好、规格均一的幼鳗540尾[初始体重为(5.82±0.02)g],随机分到18个带有过滤系统的玻璃水族缸中(40 cm×40 cm×80 cm),这18个缸共分为6个处理,每个处理设3个重复,每个重复放养30尾鳗。按5.0%~6.0%的日投饵率分两次进行投喂(8:00, 18:00),投喂时将饲料制成小团状,待鱼饱食20 min后,用虹吸管吸去残饵和粪便,并根据水质状况换1/5左右的水。实验期间,水温20.6~25.8 ℃,溶氧>7.3 mg/L,氨氮<0.21 mg/L,pH7.8~8.2。
1.2 实验设计及实验饲料
甘露寡糖(mannan oligosaccharide, MOS)由酵母细胞提取,商品名为奇力素(巴西奥奇特公司研制,纯度≥14%)。基础饲料由福建天马饲料有限公司提供,基本营养成分见表1。将甘露寡糖添加到基础饲料中,按逐级扩大法混匀,配制成甘露寡糖含量分别为:0%、0.10%、0.20%、0.30%、0.40%、0.50%的6组饲料,将制好的饲料自然晾干后,保存于-4 ℃冰箱备用。
表1 基础饲料基本营养成分
Tab.1 The basic nutrient composition of basal diet 干重,%

1.3 样品采集及处理
投喂42 d后,禁食24 h,将每个缸里的鱼全部捞出,用适量丁香酚进行麻醉,称重并记录尾数;另外每个缸随机捞取6尾鱼进行称重和量体长,随后用1 mL注射器在鱼的尾静脉处采血;采血后的鱼立即在放有冰的解剖盘上进行解剖,分离出肠道和肝脏,并将肝脏称重,用冻存管收集肠道和肝脏,收集好的肠道和肝脏立即放入液氮中暂时保存,然后再置于-80 ℃冰箱保存备用。所采集的血液先在4 ℃冰箱中静置8 h,然后用低温离心机(3 000 r/min、4 ℃)离心10 min,收集分离得到的血清,并置于﹣80 ℃冰箱保存备用。另每缸随机取5尾鳗鲡置于﹣20 ℃冰箱保存,用于测定鱼体基本营养成分。
肠道粗酶液的制备:先将从-80 ℃冰箱中拿出的肠道置于冰水浴中解冻并称重,按1 ∶9(m/V)的比例加入4 ℃的生理盐水,用匀浆器冰水浴匀浆5 min制得10 %的匀浆液,将制得的匀浆液在(4 000 r/min,4 ℃,20 min)条件下离心,离心后取上清液即为粗酶液,保存于﹣80 ℃冰箱待用。
1.4 指标测定
1.4.1 生长指标测定
分别按以下式(1)~式(5)计算鳗鲡的增重率(WGR)、特定生长率(SGR)、肝体指数(HSI)和肥满度(CF)、及成活率(SR)5个生长指标。
增重率WGR(%)=(W2-W1)/W1×100
式(1)
特定生长率SGR(%/d)=(lnW2-lnW1)/t×100
式(2)
肝体指数HSI(%)=(Wh/W)×100
式(3)
肥满度CF(%)=W/L3×100
式(4)
成活率SR(%)=(N2/N1)×100
式(5)
其中,W1和W2分别为欧洲鳗鲡初均重和末均重(g),t为实验天数(d),W为样品鱼体重(g),Wh为肝胰脏重(g),L为样品鱼体长(cm),N1和N2分别为放养尾数和收获尾数。
鳗鲡全鱼体成分和饲料基本营养成分的测定方法:粗蛋白质含量的测定采用Foss凯氏定氮法;粗脂肪含量的测定采用索氏抽提法(抽提液为乙醚);采用马福炉灼烧法(550 ℃)测定粗灰分;采用105 ℃常压烘箱干燥恒重法测定水分含量。
1.4.2 肠道消化酶活性测定
肠道消化酶活性指标包括肠道淀粉酶、胰蛋白酶和脂肪酶,以上酶的活性均采用试剂盒进行测定,测定步骤严格按说明书进行,试剂盒购于南京建成生物工程研究所。
1.4.3 非特异性免疫力指标测定
非特异性免疫力指标包括血清碱性磷酸酶(AKP)、溶菌酶(LZM)、总超氧化物歧化酶(T-SOD)活性和血清总蛋白(TP)含量,以上指标均采用南京建成生物工程研究所生产的试剂盒进行测定,测定步骤严格按说明书进行。
1.5 数据的统计与分析
采用SPSS16.0对所有数据进行单因素方差分析
(One-Way ANOVA),多重比较采用Duncan法进行,差异显著水平取P<0.05。所得数据结果用平均值±标准误(Mean±SE)表示。
2 结果与分析
2.1 甘露寡糖对欧洲鳗鲡生长性能的影响
表2所示,随着饲料中MOS含量的递增,增重率和特定生长率呈逐渐上升趋势,0.40%组和0.50%组增重率比对照组分别提高了28.01%、23.85%,达到显著差异(P<0.05),特定生长率与增重率变化趋势基本一致,在0.40%组达各组最高水平(P<0.05)。各组鳗鲡肝体指数和肥满度均无显著差异(P>0.05)。饲料添加MOS能够显著提高鳗鲡成活率(P<0.05),0.20%~0.50%组鳗鲡均无死亡现象发生。
表2 MOS对欧洲鳗鲡生长性能的影响
Tab.2 Effects of MOS on the growth performance ofA.anguilla
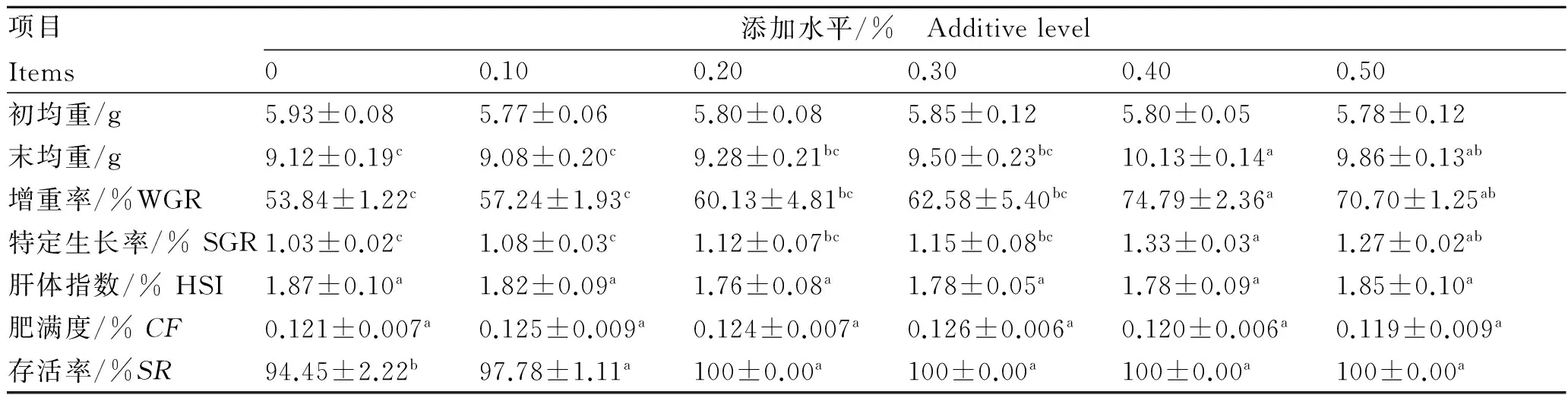
项目Items添加水平/% Additivelevel00.100.200.300.400.50初均重/g5.93±0.085.77±0.065.80±0.085.85±0.125.80±0.055.78±0.12末均重/g9.12±0.19c9.08±0.20c9.28±0.21bc9.50±0.23bc10.13±0.14a9.86±0.13ab增重率/%WGR53.84±1.22c57.24±1.93c60.13±4.81bc62.58±5.40bc74.79±2.36a70.70±1.25ab特定生长率/%SGR1.03±0.02c1.08±0.03c1.12±0.07bc1.15±0.08bc1.33±0.03a1.27±0.02ab肝体指数/%HSI1.87±0.10a1.82±0.09a1.76±0.08a1.78±0.05a1.78±0.09a1.85±0.10a肥满度/%CF0.121±0.007a0.125±0.009a0.124±0.007a0.126±0.006a0.120±0.006a0.119±0.009a存活率/%SR94.45±2.22b97.78±1.11a100±0.00a100±0.00a100±0.00a100±0.00a
注:同行上标小写字母不同者表示差异显著(P<0.05)。下同。
2.2 甘露寡糖对欧洲鳗鲡体组成的影响
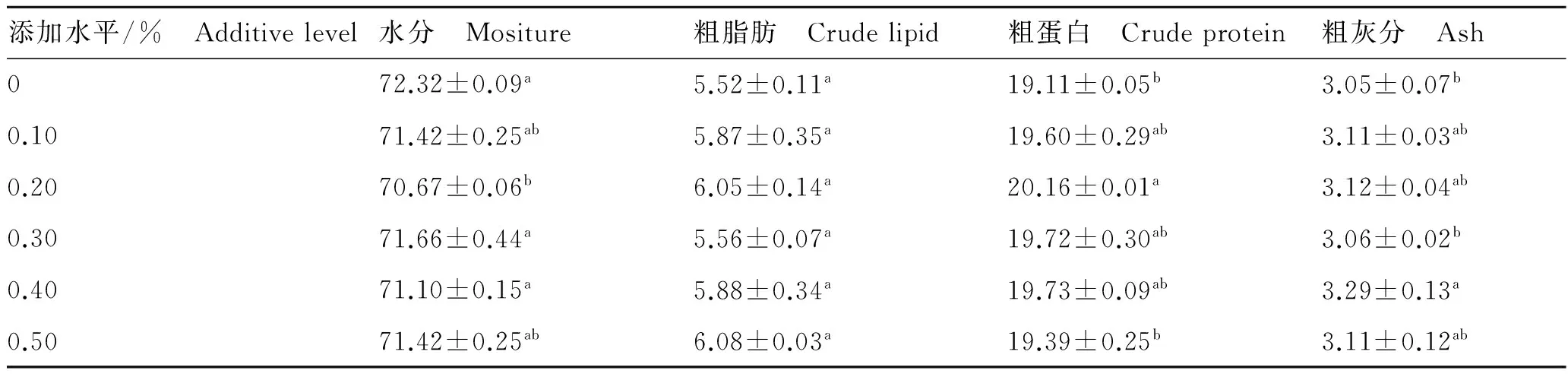
MOS对欧洲鳗鲡体组成的影响见表3。鱼体含水量0.20%组为最低,与对照组形成显著差异(P<0.05),0.20%组鳗鲡粗蛋白含量显著高于对照组及0.50%组(P<0.05),0.40%组鱼体粗灰分含量最高且与对照组相比差异显著(P<0.05),各组之间鱼体粗脂肪含量无显著差异(P>0.05)。
表3 MOS对欧洲鳗鲡体成分的影响
Tab.3 Effects of MOS on the whole-body composition ofA.anguilla湿重,%
2.3 甘露寡糖对欧洲鳗鲡肠道消化酶活性的影响
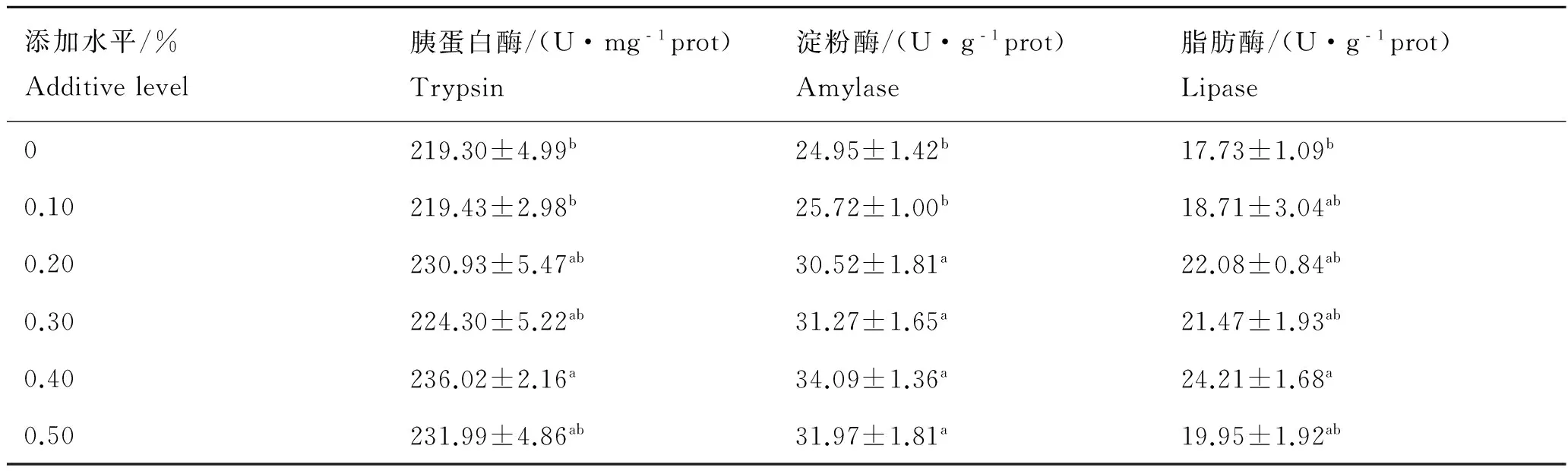
如表4所示,在饲料中添加0.20%~0.50%的MOS能够同时提高鳗鲡肠道胰蛋白酶、淀粉酶和脂肪酶活性,0.40%组胰蛋白酶和脂肪酶活性显著高于对照组(P<0.05),0.20%~0.50%组淀粉酶活性显著高于对照组(P<0.05)。
表4 MOS对欧洲鳗鲡消化酶活性的影响
Tab.4 Effects of MOS on the activities of digestive enzymes ofA.anguilla
添加水平/%Additivelevel胰蛋白酶/(U·mg﹣1prot)Trypsin淀粉酶/(U·g﹣1prot)Amylase脂肪酶/(U·g﹣1prot)Lipase0219.30±4.99b24.95±1.42b17.73±1.09b0.10219.43±2.98b25.72±1.00b18.71±3.04ab0.20230.93±5.47ab30.52±1.81a22.08±0.84ab0.30224.30±5.22ab31.27±1.65a21.47±1.93ab0.40236.02±2.16a34.09±1.36a24.21±1.68a0.50231.99±4.86ab31.97±1.81a19.95±1.92ab
2.4 甘露寡糖对欧洲鳗鲡非特异性免疫的影响
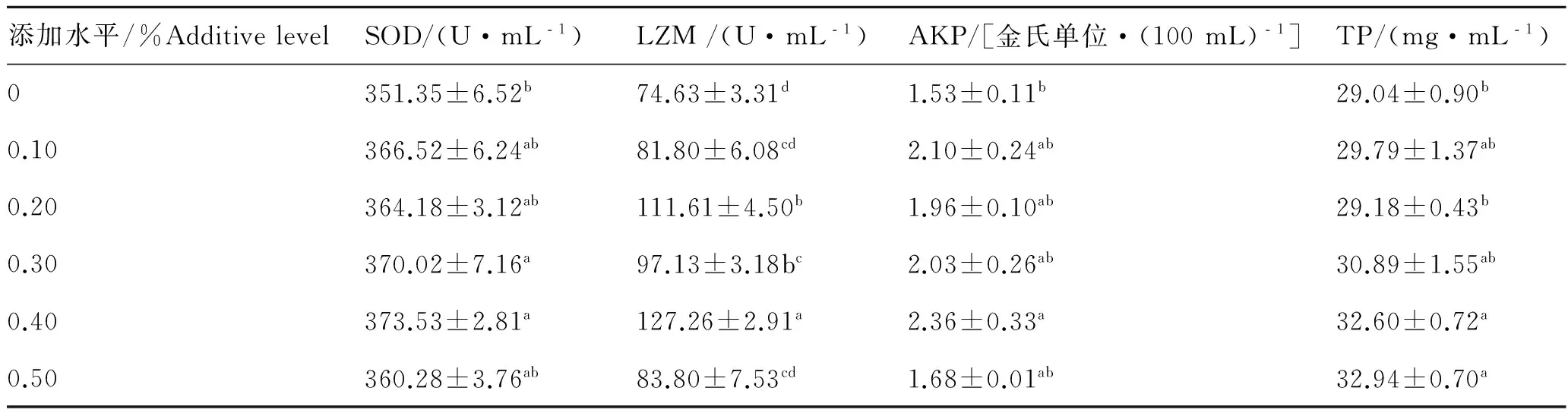
如表5所示,随着饲料中MOS含量的增加,血清SOD、LZM、AKP活性均先升后降,0.30%~0.40%组鳗鲡血清SOD活性显著高于对照组,达各组最高水平(P<0.05),0.40%组LZM和AKP活性达各组最高水平,且0.40%组LZM活力显著高于其他各组(P<0.05);血清TP随MOS含量的增加不断升高,0.50%组TP达各组峰值(P<0.05)。
表5 MOS对欧洲鳗鲡非特异性免疫的影响
Tab.5 Effects of MOS on thenonspecific immunity response ofA.anguilla
添加水平/%AdditivelevelSOD/(U·mL﹣1)LZM/(U·mL﹣1)AKP/[金氏单位·(100mL)﹣1]TP/(mg·mL﹣1)0351.35±6.52b74.63±3.31d1.53±0.11b29.04±0.90b0.10366.52±6.24ab81.80±6.08cd2.10±0.24ab29.79±1.37ab0.20364.18±3.12ab111.61±4.50b1.96±0.10ab29.18±0.43b0.30370.02±7.16a97.13±3.18bc2.03±0.26ab30.89±1.55ab0.40373.53±2.81a127.26±2.91a2.36±0.33a32.60±0.72a0.50360.28±3.76ab83.80±7.53cd1.68±0.01ab32.94±0.70a
3 讨论
3.1 甘露寡糖对欧洲鳗鲡生长性能的影响
基于国内外的研究,MOS因具有选择性促进有益菌增殖、阻止病原菌定植,优化肠道微生态的保健功能而对动物机体产生着重要影响[1]。本实验结果发现,饲料添加MOS有促进欧洲鳗鲡生长,提高鱼增重和特定生长率作用,且呈浓度依赖关系。在建鲤(CyprinuscarpioVar.Jian)[17]上的研究发现,饲料中添加0.27%的MOS使建鲤增重率和特定生长率分别提高8.77%和4.50%。鲤(CyprinuscarpioL.)[18]幼鱼词料中添加0.20%甘露寡糖可使鱼体增重率提高11.6%,饲料系数降低17.6%。在本实验中,0.40%的MOS添加组增重率较对照组提高了28.01%,达各组最高水平。张红梅[5]在鲤饲料中添加不同含量的MOS,结果发现,MOS添加组生长率均较对照组明显提高,0.40%的MOS处理组生长率高出对照组16.8%,与本实验结果较一致。然而,添加高剂量的MOS未能进一步提高欧鳗增重率,这在罗非鱼(Oreochromisniloticus×O.aureus)[4]的实验中也得到证实,0.75%较0.50%的MOS使鱼增重率下降,说明过量添加MOS可能对生长产生不利影响,原因可能是过量的MOS使鱼肠道过度发酵、食糜黏度增加,而影响饲料养分消化吸收[19]。
在本实验中,MOS有降低鱼体水分含量、提高鱼体粗蛋白、粗灰分含量的趋势,然而MOS仅提高了东方鲀(Takifuguflavindus)[20]鱼体粗脂肪含量,MOS对欧洲鲈(Dicentrarchuslabrax)[7]和金头鲷(Sparusaurata)[21]的鱼体成分影响均不显著,以上研究结果存在差异的原因可能跟实验对象饲料营养组成等有关,需进一步研究。
3.2 甘露寡糖对欧洲鳗鲡肠道消化酶活性的影响
鱼类消化酶不但反映其消化机能,而且与饲料养分的吸收有着直接关系。鳗鲡消化酶的研究可为其营养生化与饲料质量评定提供重要依据。迄今为止,关于MOS对鱼类肠道消化酶的影响报道较少。但研究表明,功能性寡糖能够作用于肠道内源性消化酶,提高内源酶活性从而促进鱼类生长[22]。于艳梅[23]研究了在黄颡鱼(Pelteobagrusfulvidraco)饲料中添加不同浓度梯度的魔芋甘露寡糖,结果显示,各添加组均提高了肠道蛋白酶活性,而肠道淀粉酶和脂肪酶活性则随魔芋甘露寡糖添加浓度的增加呈先提高后降低的趋势。强俊等[24]在奥尼罗非鱼(Oreochromisniloticus×O.aureus)饲料中添加低聚木糖,0.03%组鱼肠蛋白酶、脂肪酶和淀粉酶活性均达最高,显著高于对照组。熊沈学等[25]在异育银鲫(Carassaisauratusgibebio)饲料中添加0.01%的低聚木糖,能够明显观察到其促进生长和提高肠道消化酶活性的作用。本实验中,饲料添加0.20%~0.50%的MOS能够较好提升欧洲鳗鲡肠道胰蛋白酶、淀粉酶和脂肪酶活性。说明饲料中适宜浓度的甘露寡糖可以促进欧洲鳗鲡肠道消化酶分泌,从而促进鳗鲡生长。
3.3 甘露寡糖对欧洲鳗鲡非特异性免疫的影响
有研究指出,功能性寡糖可以充当免疫刺激因子,提高动物机体对外来抗原或药物的免疫应答能力,可以通过对病原微生物的识别、黏附和排除等作用来调节动物机体的非特异性免疫防御系统[26]。超氧化物歧化酶(SOD)是酶促抗氧化系统的重要成员,SOD可增强吞噬细菌侵染,发挥非特异性免疫防御作用,是生物体内广泛存在的天然抗菌肽[27]。Zhang等[6]研究认为4.0~8.0 g/kg MOS使凡纳滨对虾(Litopenaeusvannamei)血清SOD活性显著高于对照组,MOS不仅能提高对虾的生长性能,而且对虾抗氨氮胁迫能力也大大增强。在黄颡鱼饲料中添加0.2%~0.3%魔芋甘露寡糖可以显著增强其血清SOD和溶菌酶活性,增加黄颡鱼免疫器官指数[23],0.20%MOS能显著提高欧洲鲈[7]和虹鳟(Oncorhynchusmykiss)[8]血清中LZM活性,提高鱼类免疫力。本实验中0.30%~0.40%添加组欧鳗血清SOD活性达各组最高水平,显著高于对照组,0.40%MOS使血清LZM活性显著高于其他各组,到得了与上述报道较为一致的结论。另有研究证实,血清中的其他两种指标碱性磷酸酶(AKP)活性和血清总蛋白含量(TP)对鱼类免疫水平的高低也具有重要参考价值[28-30]。刘爱君等[4]在饲料中添加MOS不仅能使罗非鱼血清SOD、LZM活性得到显著提高,也能使AKP活性显著升高。徐磊等[9]也指出MOS能使鱼血清AKP活性显著升高,使鱼抗氧化能力增强。陈希等[31]给草鱼投喂添加MOS的饲料使草鱼血清AKP和TP活性显著高于对照组,这与在黄颡鱼[23]实验得出的结论相一致。本实验中鳗鲡血清AKP活性在MOS添加量为0.4%时达到最大值,且显著高于对照组,鳗鲡血清TP随MOS含量的增加不断升高,当含量为0.40%~0.50%时达最高水平,且显著高于对照组。
4 结论
饲料中添加适量甘露寡糖可提高欧洲鳗鲡成活率、增重率,及促进肠道消化酶分泌,提高饲料利用率;可降低欧洲鳗鲡鱼体水分含量,提高粗蛋白含量,使鳗鲡肉质得到改善,同时也可提高欧洲鳗鲡血清免疫酶活性,提高欧洲鳗鲡非特异性免疫力。综合考虑生长、消化及非特异性免疫力等因素,建议欧洲鳗鲡饲料中甘露寡糖的最适添加量为0.40%。
[1] 黎中宝. 饲料添加剂[M]. 厦门: 厦门大学出版社, 2004:160-164.
[2] 阎桂玲,袁建敏,呙于明,等.啤酒酵母甘露寡糖对肉鸡肠道微生物及免疫机能的影响[J].中国农业大学学报, 2008,13(6):85-90.
[3] 曹功明, 卢建雄, 马桂兰, 等. 甘露寡糖对动物肠道环境及生长性能影响的研究进展[J]. 江苏农业科学, 2010(1): 226-227.
[4] 刘爱君, 冷向军, 李小勤, 等. 甘露寡糖对奥尼罗非鱼(Oreochromisniloticus×O.aureus)生长、肠道结构和非特异性免疫的影响[J]. 浙江大学学报(农业与生命科学版), 2009, 35(3): 329-336.
[5] 张红梅. 甘露寡聚糖对鲤鱼生产性能及对鱼体各项生物学指标的影响[D]. 保定:河北农业大学, 2003:20.
[6] Zhang J, Liu Y, Tian L, et al. Effects of dietary mannan oligosaccharide on growth performance, gut morphology and stress tolerance of juvenile Pacific white shrimp,Litopenaeusvannamei[J]. Fish Shellfish Immunol, 2012,33(4):1027-1032.
[7] Torrecillas S, Makol A, Caballero M J, et al. Immune stimulation and improved infection resistance in European sea bass (Dicentrarchuslabrax) fed mannan oligosaccharides[J]. Fish Shellfish Immunol,2007,23(5): 969-981.
[8] Staykov Y,Spring P,Denev S, et al.Effect of a mannan oligosaccharide on the growth performance and immune status of rainbow trout (Oncorhynchusmykiss)[J].Aquacult Int,2007,15(2):153-161.
[9] 徐磊, 刘波, 谢骏, 等. 甘露寡糖对异育银鲫生长性能、免疫及HSP70基因表达的影响[J]. 水生生物学报, 2012, 36(4): 656-664.
[10] 孙剑, 罗国芝, 孙大川, 等. 欧洲鳗半封闭式循环水养殖模式的运行效果研究[J]. 广东农业科学, 2014, 41(5): 203-207.
[11] 吴宁, 黎中宝, 林小云, 等. 6种鳗鲡(Anguilla)线粒体DNA COⅠ序列的比较研究[J]. 海洋与湖沼, 2010,41,(6):930-934.
[12] 郑伟刚, 黎中宝, 李文静, 等. Hg2+对5种鳗鲡白仔急性毒性影响的研究[J]. 南方水产科学, 2011, 7(4): 16-23.
[13] 李文静, 黎中宝, 郑伟刚, 等. 三唑磷对5种鳗鲡幼鳗的急性毒性实验[J]. 南方水产, 2009,5(6):13-18.
[14] 吴宁, 李文静, 黎中宝, 等. 5种鳗鲡幼鳗极限温度的耐受性初步研究[J]. 南方水产, 2010,6(6):14-19.
[15] 卢静, 黎中宝, 陈强, 等. 饲料添加多维对欧洲鳗鲡生长性能、消化酶活性和免疫的影响[J]. 海洋与湖沼, 2014,45(3):489-594.
[16] 卢静, 黎中宝, 陈强, 等. 复合酶制剂对欧洲鳗鲡生长性能、消化酶及非特异性免疫的影响[J]. 海洋与湖沼, 2015,46(2):420-425.
[17] 李云兰. 甘露寡糖对幼建鲤(CyprinuscarpioVar.Jian)肠道菌群和免疫功能的影响[D]. 雅安:四川农业大学, 2004:29.
[18] Staykov Y, Denev S, Spring P. Influence of dietary mannan oligosaccharides (Bio-Mos) on growth rate and immune function of common carp (CyprinuscarpioL.)[J]. Lessons from the past to optimise the future. European Aquaculture Society, Special Publication,2005,(35):431-432.
[19] Chesson A. Probiotics and other intestinal mediators[C]//Cole D J A,Wiseman J,Varley M A. Principles of Pig Science. Nottingham:Nottingham University Press,1994:197-214.
[20] 翟秋玲, 张春晓, 孙云章, 等. 三丁酸甘油酯和甘露寡糖对菊黄东方鲀生长性能、体组成及肠道健康指标的影响[J]. 动物营养学报, 2014,26(8):2197-2208.
[21] Dimitroglou A, Merrifield D L, Spring P, et al. Effects of mannan oligosaccharide (MOS) supplementation on growth performance, feed utilisation, intestinal histology and gut microbiota of gilthead sea bream (Sparusaurata)[J]. Aquaculture, 2010,300(1):182-188.
[22] 明建华, 刘波, 周群兰, 等. 功能性寡糖在水产动物饲料中的应用[J]. 水产科学, 2008,27(9):490-493.
[23] 于艳梅. 魔芋甘露寡糖对黄颡鱼的益生功能研究[D]. 武汉:华中农业大学, 2010:13-15,21-23,27-29.
[24] 强俊, 王辉, 李瑞伟, 等. 低聚木糖对奥尼罗非鱼幼鱼生长、体成分和消化酶活力的影响[J]. 淡水渔业, 2009, 39(6):63-68.
[25] 熊沈学, 刘文斌, 方星星.低聚木糖梯度添加对异育银鲫生长及肠道消化酶活性的影响[J]. 畜牧与兽医, 2005,37(10):23-24.
[26] Mussatto S I, Mancilha I M. Non-digestible oligosaccharides:A review[J]. Carbohyd Polym, 2007,68(3): 587-597.
[27] 徐永平, 汪婷婷, 孙永欣, 等. 水产动物溶菌酶研究的最新进展[J]. 水产科学, 2011, 30(5): 307-310.
[28] Bigaj J, Dulak J,Plytycz B. Lymphoid organs of Gasterosteus aculeatus[J]. J Fish Biol,1987,31(Supplement sA):233-234.
[29] Poelstra K, Bakker W W, Klok P A. et al. Dephosphorylation of endotoxin by alkaline phosphatase in vivo[J]. Am J Path, 1997, 151(4):1163-1169.
[30] Holland M C, Lambris J D.The complement system in teleosts[J]. Fish Shellfish Immunol, 2002, 12(5): 399-420.
[31] 陈希, 吴志新, 刘佳佳, 等.甘露寡糖对草鱼血清生化特性的影响[J]. 南昌大学学报(理科版), 2011, 35(4): 393-397, 420.
Effect of mannan oligosaccharides on growth performance, activities ofdigestive enzymes and nonspecific immunity response in Anguilla anguilla
YANG Min, LI Zhongbao*, LU Jing, CHEN Qiang, LI Wenjing, HUANG Yongchun
(Fisheries College of Jimei University; Key Laboratory of Marine Fishery Resources and Eco-environment, Xiamen 361021, China)
The objective of this study was to determine the effects of mannan oligosaccharides (MOS) on growth performance, activities of digestive enzymes and immune response inAnguillaanguilla. Juveniles [body weight (5.82±0.02) g] were randomly divided into 6 groups (with 3 replicates each). Six experimental diets were administered (adding 0%, 0.10%, 0.20%, 0.30%, 0.40%, 0.50% MOS), respectively for 42 d. The results showed that the weight gain ratios for 0.40% and 0.50% groups were higher than those of the control group by 28.01% and 23.85%. However, no significant difference was found among all hepatosomatic indexes or condition factors. Mannan oligosaccharides decreased the body moisture, while significantly increasing the crude protein and ash content. There was no significant difference among crude lipid contents compared with the control group. The feeds added with 0.20%, 0.3%, 0.4%,0.50% mannan oligosaccharides significantly increased the activities of intestinal trypsin, amylase, lipase. The activities of serum superoxide dismutase, lysozyme and alkaline phosphatase increased and then decreased with increasing mannan oligosaccharides in diets. The activities of superoxide dismutase for additions of 0.30%, 0.40% mannan oligosaccharides were significantly higher than that for the control group; activities of lysozyme and alkaline phosphatase of 0.40% group were higher than other treatments. With the increase of added mannan oligosaccharides, the concentration of serum total protein was raised, and the highest value was found in 0.40%~0.50%MOS given in discrete fashion, and cannot be in the form of a range. In conclusion, the feed added with 0.40% multi-enzyme can promote the growth performance, digestibility and nonspecific immunity response ofAnguillaanguilla.The results provided a scientific reference for suitable addition amount of MOS inAnguillaanguilla.[Chinese Fishery Quality and Standards, 2016, 6(6):40-46]
Anguillaanguilla; mannan oligosaccharides; growth performance; whole-body composition; digestive enzymes; nonspecific immunity response
LI Zhongbao, lizhongbao@jmu.edu.cn
2016-07-06;接收日期:2016-08-08
厦门市科技项目(3502Z20123026)
杨敏(1991-),男,硕士研究生,研究方向为水产动物营养与饲料,1396912602@qq.com 通信作者:黎中宝,教授,博士生导师,研究方向为种群遗传学和保护生物学,lizhongbao@jmu.edu.cn
S94
A
2095-1833(2016)06-0040-07
