Glut9在果糖诱导大鼠高尿酸血症中的作用*
2017-01-03林志健聂安政
王 雨, 林志健, 聂安政, 张 冰
(北京中医药大学中药学院,北京 100029)
Glut9在果糖诱导大鼠高尿酸血症中的作用*
王 雨, 林志健, 聂安政, 张 冰△
(北京中医药大学中药学院,北京 100029)
目的: 观察肾脏转运蛋白葡萄糖转运体9(Glut9)与肾脏尿酸排泄的关系,探讨果糖诱导的高尿酸血症的病理机制。方法:将30只雄性SD大鼠按体质量随机分为正常组、模型组与苯溴马隆组,正常组给予清水,模型组与苯溴马隆组给予10%果糖饮水建立高尿酸血症模型。正常组与模型组给予清水灌胃,苯溴马隆组给予20 mg/kg苯溴马隆灌胃,实验第42天处死。检测大鼠血清尿酸和尿尿酸水平,计算肾脏尿酸清除率,并测定肝脏黄嘌呤氧化酶活性。利用免疫组化观察Glut9在各组大鼠肾脏的表达位点及其蛋白表达含量,实时荧光定量PCR(RT-qPCR)检测各组大鼠肾脏Glut9的mRNA表达水平。结果:实验第20~40天,与正常组比较,模型组的血尿酸水平显著升高,尿尿酸与尿酸清除率的差异无统计学显著性;实验第20天,与模型组比较,苯溴马隆组的血尿酸水平显著降低,但尿尿酸和尿酸清除率的差异无统计学显著性。实验第40天,模型组的肝脏黄嘌呤酶活性较正常组显著升高,但与模型组比较差异无统计学显著性。免疫组化实验结果显示,与正常组比较,模型组肾脏的Glut9蛋白表达显著增加;苯溴马隆组肾脏的Glut9蛋白表达少于模型组。RT-qPCR结果显示,各组肾脏Glut9 mRNA表达水平之间的差异并无统计学显著性。结论:10%果糖饮水可成功诱导大鼠高尿酸血症模型;果糖诱导高尿酸血症病理机制可能与上调肾脏Glut9蛋白水平、增加肾脏对尿酸的重吸收有关。
高尿酸血症; 果糖; 肾脏转运蛋白; 葡萄糖转运体9
高尿酸血症是机体血尿酸水平过饱和的一种病理现象,是导致痛风的主要危险因素。有研究显示,果糖的大量消耗与血尿酸水平升高具有密切联系。人体内的尿酸2/3由肾脏排泄,1/3由肠道排泄。肾脏转运蛋白葡萄糖转运体9(glucose transpoter 9, Glut9)由SLC2A9编码。有学者通过对克罗地亚人基因组研究发现,尿酸浓度变化的1.7%~5.3%与SLC2A9基因序列有关[1]。本实验观察高尿酸血症状态下大鼠肾脏Glut9 mRNA及蛋白表达的变化,从肾脏尿酸排泄角度,切入转运蛋白角度探讨果糖诱导的高尿酸血症大鼠的病理机制。
材 料 和 方 法
1 动物
雄性SD大鼠30只,体质量(240±10) g,购于斯贝福(北京)实验动物科技有限公司,动物合格证号为SCXK(京)2011-0004。
2 主要试剂和仪器
D-果糖(AMRESCO);苯溴马隆片(Heumann Pharma);尿酸试剂盒(中生北控生物科技股份有限公司);肌酐(creatinine,Cre)、黄嘌呤氧化酶(xanthine oxidase,XOD)检测试剂盒(南京建成生物工程研究所);TRIzol(Ambion);氯仿、异丙醇等分析纯试剂(北京化工厂);6×RNA loading buffer和GoldView核酸染料(博迈德生物科技有限公司);琼脂糖(北京拜尔迪有限公司);RevertAid First Strand cDNA Synthesis Kit(Thermo);Universal SYBR Green Super Mix(Bio-Rad);Glut9抗体(Millipore);兔超敏二步免疫组化试剂PV-9001、DAB显色试剂盒和抗体稀释液(北京中杉金桥生物技术有限公司)。
Sunrise酶标仪(Teacan);低温高速离心机(Sigma);恒温水浴箱(北京医疗设备厂);B1-220H电子天平(SHIMADZU);Quawell UV-Vis Spectrotometer Q5000(北京五洲东方科技发展有限公司);CFX96 PCR仪(Bio-Rad);FluorChem凝胶成像系统(香港安莱公司);石蜡组织切片机(AO);显微镜和Image-Pro Plus 6.0图像分析软件(Olympus)。
3 方法
3.1 动物分组及处理 SD大鼠适应性饲养5 d后,按体质量随机分为正常组、模型组与苯溴马隆组,每组10只。正常组给予清水,模型组与苯溴马隆组给予10%果糖饮水造模。正常组与模型组给予清水灌胃,苯溴马隆组给予20 mg/kg苯溴马隆灌胃。
3.2 相关指标检测 动物取血前禁食不禁水12 h,并称量体重,分别于实验的第10、20、30和40天时尾尖取血,3 000 r/min离心10 min,分离血清,检测血清尿酸(serum uric acid,SUA)。于取血第2天,将动物放进代谢笼,禁食不禁水,收集24 h尿液,检测尿尿酸(urinary uric acid,UUA)。尿酸清除率(clearance rate of uric acid,CUA)=UUA/SUA×每分钟尿量(mL/min)。实验结束后,处死动物取材。肝脏于-20 ℃保存,组织与生理盐水1∶9制成10%组织匀浆,根据试剂盒说明书检测肝脏XOD活性。部分肾脏以4%多聚甲醛固定,用于制作组织石蜡切片,部分肾脏立即于-80 ℃保存,用于提取肾脏总mRNA。
3.3 免疫组化染色 4 μm组织石蜡切片60 ℃烤片1 h,常规脱蜡复水,PBS孵育5 min×3次;0.01 mol/L柠檬酸钠缓冲溶液水浴热修复30 min后冷却至室温,PBS孵育5 min×3次;滴加3% H2O2,避光室温孵育15 min,PBS孵育5 min、3次;滴加I抗(1∶1 000稀释),湿盒内4 ℃孵育过夜;37 ℃复温孵育1 h,PBS孵育5 min×3次;滴加PV-9001聚合物辅助剂,37 ℃湿盒孵育1 h,PBS清洗5 min×3次;滴加PV-9001辣根酶标记抗兔IgG聚合物,37 ℃湿盒孵育1 h,PBS清洗5 min×3次;滴加新鲜配制DAB工作液,显微镜下观察,棕色颗粒染色后PBS清洗5 min×3次;乙醇梯度脱水,二甲苯透明,中性光学树脂封固,封片。
3.4 图像采集与分析 Olympus显微镜下采集图像,各组织切片选取5个互不重叠的视野,高速彩色CCD相机采集图像。以Image-Pro Plus 6.0图像分析系统进行免疫组化染色结果分析,测定阳性颗粒积分吸光度(integral absorbance,IA)和阳性表达面积(positive expression area,PEA)。
3.5 RT-qPCR检测Glut9的mRNA表达 取新鲜冻存的大鼠肾脏组织50~100 mg,于液氮中充分研磨至粉末状,置于无酶EP管中,加入1 mL TRIzol,室温孵育5 min,加入200 μL氯仿,剧烈振荡15 s,室温孵育3 min,于4 ℃ 12 000×g离心15 min,取上清500 μL置于新管中,加入等体积异丙醇,混匀,室温孵育10 min,于4 ℃ 12 000×g离心15 min,弃上清,加入1 mL 4 ℃预冷75%乙醇,4 ℃ 7 500×g离心10 min,弃上清,空气干燥10 min,加入30 μL无酶水溶解,55 ℃水浴10 min。于波长260 nm和280 nm下测定吸光度(A)值,计算A260/A280和肾脏总RNA浓度。1%琼脂糖凝胶电泳,180 V,15 min,观察肾脏总RNA完整性。每个样本取4 μg总RNA作为模板按RevertAid First Strand cDNA Synthesis Kit步骤合成cDNA第1链。
用Primer Premier 5.0软件设计PCR引物,选用GAPDH为内参照,由北京博迈德基因技术有限公司合成。Glut9的上游引物序列为5′-TGCATTGGCGTGTTTTCTGG-3′,下游引物序列为5′-GTTTGGAAGGCTTTCGTGGC-3′;GAPDH的上游引物序列为5′-GGTGGACCTCATGGCCTACA-3′,下游引物序列为5′-ATTGTGAGGGAGATCCTCAGTGT-3′。RT-qPCR反应体系为20 μL,包含cDNA模板2 μL,上、下游引物各1 μL,Universal SYBR Green Super Mix 10 μL,无酶水7 μL。扩增条件为: 95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 40个循环。65 ℃~95 ℃ 每5 s升高0.5 ℃进行熔解曲线分析。结果用2-ΔΔCt计算,以相对值表示。
4 统计学处理
使用SAS 9.0软件进行统计分析,数据以均数±标准差(mean±SD)表示,多组间数据比较根据各组正态及方差齐与否选择单因素方差分析或是Kruskal-Wallis轶和检验,组间两两比较根据方差齐与否选择采用Dunnett’st检验或Dunnett’s T3检验,以P<0.05为差异有统计学意义。
结 果
1 实验动物的一般状态
实验期间各组动物生长状态良好,体重逐渐增长且各组组间差异无统计学显著性,见表1。

表1 实验期间大鼠体重的变化情况
2 实验期间大鼠血清尿酸水平的变化
实验第20天至第40天,与正常组相比,模型组的SUA水平均显著升高(P<0.05);实验第20天,与模型组相比,苯溴马隆组的SUA水平显著降低(P<0.05),见表2。

表2 实验期间大鼠血清尿酸水平变化情况
SUA: serum uric acid.*P<0.05,**P<0.01vsnormal;#P<0.05vsmodel.
3 实验期间大鼠肾脏尿酸排泄指标
实验第40天,各组间24 h尿量、UUA和CUA的差异均无统计学显著性,见表3。
4 大鼠肝脏尿酸代谢相关酶XOD活性变化
实验第42天,与正常组比较,模型组肝脏的XOD活性显著升高(P<0.01);苯溴马隆组与模型组比较差异无统计学显著性,见表3。

表3 实验第40天大鼠UUA、CUA水平变化情况和实验第42天大鼠肝脏黄嘌呤氧化酶活性的变化
UUA: urinary uric acid; CUA: clearance rate of uric acid; XOD: xanthine oxidase.**P<0.01vsnormal.
5 大鼠肾脏Glut9免疫组化染色及半定量分析
免疫组化染色结果如图1所示,Glut9在各组大鼠肾脏均有表达,主要表达于肾脏近曲小管顶膜。相较于正常组,模型组IA显著增加(P<0.01);苯溴马隆组的PEA显著少于模型组(P<0.05),IA的差异无统计学显著性,见表4。

Figure 1.The expression of Glut9 in the renal tissues of different groups (immunohistochemical staining, scale bar=50 μm).
图1 Glut9在大鼠肾脏组织中的表达
6 大鼠肾脏Glut9 mRNA表达的变化
RT-qPCR检测大鼠肾脏Glut9的mRNA相对表达量,结果显示各组Glut9的mRNA表达水平之间的差异并无统计学显著性,见表4。
表4 各组大鼠肾脏Glut9的mRNA和蛋白相对表达量的比较
Table 4.The expression of Glut9 at mRNA and protein levels in the renal tissues of different groups (Mean±SD.n=6)
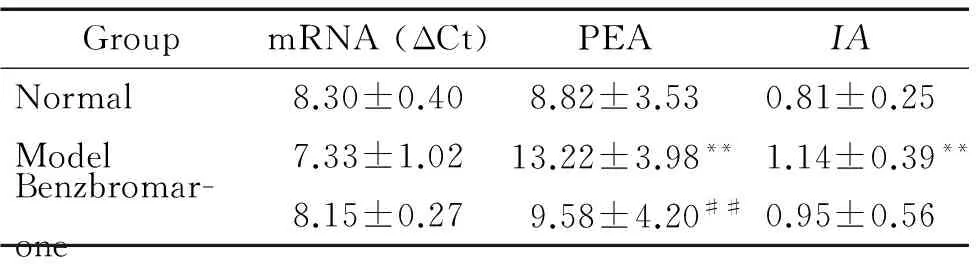
GroupmRNA(ΔCt)PEAIANormal8.30±0.408.82±3.530.81±0.25Model7.33±1.0213.22±3.98**1.14±0.39**Benzbromar-one8.15±0.279.58±4.20##0.95±0.56
PEA: positive expression area;IA: integral absorbance.**P<0.01vsnormal;##P<0.01vsmodel.
讨 论
高尿酸血症(hyperuricemia,HUA)与果糖摄入关系密切。墨西哥一项横断面研究[2]显示,成年人甜味剂摄入量越高,患高尿酸血症的风险越大。Choi等[3]对美国14 761名20岁以上人群体检报告进行分析,发现含糖软饮料的消费量与血尿酸水平及高尿酸血症的发病率密切相关。Pillinger等[4]对49 116名健康男性随访12年,对其果糖摄入量和痛风患病率做风险评价,并进行多元线性回归,发现其二者呈正相关。Wang等[5]对相关文献进行Meta分析,发现果糖的过度摄入可升高血尿酸浓度,增加高尿酸血症发病风险。流行病学及临床研究[6-7]亦表明,果糖摄入过多可引起血尿酸水平升高,甚至引发痛风。本研究模拟临床上果糖诱导的高尿酸血症,连续给予SD雄性大鼠10%果糖饮水40 d,自实验第20天,模型组大鼠SUA水平与正常组相比显著升高。这与Hu等[8]和刘小青等[9]的研究结果一致。
尿酸生成过多与排泄减少均可形成HUA。肝脏是尿酸生成的主要场所,XOD是尿酸生成过程中重要的限速酶,XOD可将尿酸的前体物质催化代谢为尿酸,肝脏XOD活性的升高可增加体内尿酸的生成。本研究中观察到实验第40天,相较于正常组,模型组的肝脏XOD活性显著性升高,提示果糖诱导的高尿酸血症的形成与尿酸生成途径相关,这与本实验室前期研究结果一致[10]。Abdulla等[11]提出高果糖摄入可引起肾脏血液动力学及排泄功能的相关改变,本研究发现实验第40 d,与正常组相比,模型组SUA显著升高,24 h尿量与CUA无差异,表明尿酸排泄量相对减少。同时,本研究设立苯溴马隆组作为对照,苯溴马隆是典型的促尿酸排泄药物,通过抑制近端肾小管对尿酸的重吸收发挥促尿酸作用。相较于模型组,实验第20天,苯溴马隆组SUA水平显著降低。以上提示果糖诱导的高尿酸血症的病理状态可能并不完全依赖于尿酸生成增多。机体内尿酸的排泄,2/3经由肾脏,1/3经由肠道[12],肾脏在尿酸排泄途径中占有重要作用。
肾脏的尿酸排泄主要包括肾小球滤过、肾小管和集合管重吸收以及重吸收后的再分泌,其中,肾小球滤过的尿酸约98%被肾小管重吸收[13]。因此,肾小管的重吸收在肾脏的尿酸排泄过程中占重要地位。近年有研究显示果糖转运体Glut9与SUA水平密切相关[14],是高通量、低能量的尿酸盐转运体[15]。Glut9由基因SLC2A9编码,分为Glut9a和Glut9b两个亚型,Glut9a表达于多个代谢器官,而Glut9b只在肝脏和肾脏中发现,并且肾小管是Glut9的主要表达场所,故Glut9是高尿酸血症的危险因子之一。本研究免疫组化染色显示Glut9在大鼠肾脏近曲小管顶膜表达,模型组Glut9蛋白表达水平显著高于正常组,苯溴马隆组Glut9蛋白表达水平显著低于模型组,这与近年来研究发现的苯溴马隆可抑制Glut9的报道一致[16]。但各组大鼠肾脏Glut9的mRNA表达水平的差异并无统计学显著性。以上结果表明果糖诱导的大鼠高尿酸血症的病理机制,可能是通过调控Glut9蛋白表达,使其在蛋白水平的表达升高,从而增加肾小管对尿酸的重吸收,减少肾脏尿酸排泄量,使血尿酸水平升高。
综上所述,本研究观察肾脏转运蛋白Glut9对肾脏排泄尿酸的影响,研究果糖诱导的高尿酸血症大鼠的病理机制。结果表明,果糖诱导的高尿酸血症大鼠肾脏尿酸排泄量相对下降,其病理机制可能与模型组大鼠Glut9蛋白表达水平上调有关。本研究结果为高尿酸血症药物的防治提供了一定的参考,并可供高尿酸血症的肠道排泄途径的研究以借鉴。
[1] Vitart V, Rudan I, Hayward C, et al. SLC2A9 is a newly identified urate transporter influencing serum urate concentration, urate excretion and gout[J]. Nat Genet, 2008, 40(4):437-442.
[2] Lawrence RC, Hochberg MC, Kelsey JL, et al. Estimates of the prevalence of selected arthritic and musculoskeletal diseases in the United States[J]. J Rheumatol, 1989, 16(4):427-441.
[3] Choi JW, Ford ES, Gao X, et al. Sugar-sweetened soft drinks, diet soft drinks, and serum uric acid level: the Third National Health and Nutrition Examination Survey[J]. Arthritis Rheum, 2008, 59(1):109-116.
[4] Pillinger MH, Abeles AM. Such sweet sorrow: fructose and the incidence of gout[J].Curr Rheumatol Rep, 2010, 12(2):77-79.
[5] Wang DD, Sievenpiper JL, de Souza RJ, et al. The effects of fructose intake on serum uric acid vary among controlled dietary trials[J]. J Nutr, 2012, 142(5):916-923.
[6] Bray GA. Energy and fructose from beverages sweetened with sugar or high-fructose corn syrup pose a health risk for some people[J]. Adv Nutr, 2013, 4(2):220-225.
[7] Batt C, Phipps-Green AJ, Black MA, et al. Sugar-sweetened beverage consumption: a risk factor for prevalent gout with SLC2A9 genotype-specific effects on serum urate and risk of gout[J]. Ann Rheum Dis, 2014, 73(12):2101-2106.
[8] Hu QH, Wang C, Li JM, et al. Allopurinol, rutin, and quercetin attenuate hyperuricemia and renal dysfunction in rats induced by fructose intake: renal organic ion transporter involvement[J]. Am J Physiol Renal Physiol, 2009, 297(4):F1080-F1091.
[9] 刘小青, 张 冰, 林志健, 等. 高果糖大鼠血清TG、UA、血糖的动态变化规律及机制研究[J].中国病理生理杂志, 2009, 25(4):651-655.
[10]李丽玉,林志健,张 冰,等. 连续高果糖饮水对大鼠尿酸水平的影响及其病理机制[J]. 中华临床营养杂志, 2014, 22(6):368-374.
[11]Abdulla MH, Sattar MA, Johns EJ. The relation between fructose-induced metabolic syndrome and altered renal haemodynamic and excretory function in the rat[J]. Int J Nephrol, 2011, 2011:934659.
[12]Abramson RG, Levitt MF. Use of pyrazinamide to assess renal uric acid transport in the rat: a micropuncture study[J]. Am J Physiol, 1976, 230(5):1276-1283.
[13]Lipkowitz MS. Regulation of uric acid excretion by the kidney[J]. Curr Rheumatol Rep, 2012, 14(2):179-188.
[14]Dalbeth N, House ME, Gamble GD, et al. Population-specific influence of SLC2A9 genotype on the acute hyperuricaemic response to a fructose load[J]. Ann Rheum Dis, 2013, 72(11):1868-1873.
[15] Wright AF, Rudan I, Hastie ND, et al. A ‘complexity’ of urate transporters[J]. Kidney Int, 2010, 78(5):446-452.
[16]Bibert S, Hess SK, Firsov D, et al. Mouse GLUT9: evidences for a urate uniporter[J]. Am J Physiol Renal Physiol, 2009, 297(3):F612-F619.
(责任编辑: 林白霜, 罗 森)
Effect of renal transporter Glut9 on hyperuricemia in rats induced by fructose
WANG Yu, LIN Zhi-jian, Nie An-zheng, ZHANG Bing
(SchoolofChineseMateriaMedica,BeijingUniversityofChineseMedicine,Beijing100029,China.E-mail:zhangbing6@263.net)
AIM: To explore the effect of renal transporter glucose transporter 9 (Glu9) on hyperuricemia in the rats induced by fructose.METHODS: SD male rats (n=30) were randomly divided into normal group, model group and benzbromarone group, according to the weight. The rats in normal group was given water, while the rats in model group and benzbromarone group were given 10% fructose solution to establish hyperuricemia model. At the same time, the rats in normal group and model group were given a gavage of distilled water, while the rats in benzbromarone group were given benzbromarone at the dose of 20 mg/kg. The rats were sacrificed on the 40th day. The serum uric acid (SUA) and urinary uric acid (UUA) were detected to calculate the clearance rate of uric acid (CUA) in the kidney. The activity of hepatic xanthine oxidase (XOD) was also measured. The expression of renal Glut9 at mRNA and protein levels was determined by RT-qPCR and immunohistochemical staining. RESULTS: From the 20th day to the 40th day, the SUA in model group was significantly higher than that in normal group, but the UUA and CUA had no difference. On the 20th day, the SUA in benzbromarone group was markedly decreased as compared with model group, but UUA and CUA had no significant difference. On the 40th day, the hepatic XOD activity in model group was significantly elevated, and no difference of XOD between model group and the benzbromarone group was observed. Compared with normal group, the protein expression of Glut9 in the renal tissues of model group were markedly increased, and that in benzbromarone group was significantly lower than that in model group. However, no difference of the Glut9 mRNA expression was observed among groups. CONCLUSION: Fructose drinking induces hyperuricemia in rats, which is probably related to the up-regulation of renal Glut9 expression at protein level, and the increase in the reabsorption of uric acid in the kidneys.
Hyperuricemia; Fructose; Renal transporter; Glucose transporter 9
1000- 4718(2016)12- 2287- 05
2016- 03- 14
2016- 11- 02
北京市自然科学基金资助项目(No.7162117);教育部高等学校博士学科点专项科研基金资助项目(No.20130013120001); 北京中医药大学研究生专项自主课题(No.2016-JYB-XS100)
R363.2
A
10.3969/j.issn.1000- 4718.2016.12.028
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 010-64286335; E-mail: zhangbing6@263.net
