植物乳杆菌Lp-S2直投式发酵剂及其离心、冷冻干燥工艺研究
2016-12-29隋春光
隋春光
梁金钟
王风青
(哈尔滨商业大学,黑龙江 哈尔滨 150076)
植物乳杆菌Lp-S2直投式发酵剂及其离心、冷冻干燥工艺研究
隋春光
梁金钟
王风青
(哈尔滨商业大学,黑龙江 哈尔滨 150076)
以高产γ-氨基丁酸的植物乳杆菌Lp-S2为出发菌株,研制直投式发酵剂。并对发酵剂离心工艺及冷冻干燥工艺进行优化。通过正交试验确定植物乳杆菌Lp-S2 的离心工艺为:离心温度4 ℃,离心时间30 min,转速6 000 r/min,该条件下植物乳杆菌Lp-S2离心收得率为83.8%。通过单因素和正交试验进行冷冻保护剂的优化。冷冻保护剂的最佳组合是15%海藻糖,15%葡萄糖和10%脱脂乳粉。植物乳杆菌Lp-S2直投式发酵剂,冻干存活率为39.2%,最佳预冷时间为6 h。直投式发酵剂活菌数达到1.5×1012CFU/mL。
直投式菌剂;植物乳杆菌;冷冻干燥;γ-氨基丁酸
γ-氨基丁酸(GABA),是一种非蛋白质氨基酸,在动物体内,GABA是一种非常重要的抑制性神经递质。对人体有镇静安神、降低血压、改善脑机能和调节激素分泌等重要作用[1]。植物乳杆菌Lp-S2是本实验室自主分离并保藏的菌株,具有发酵底物高产GABA的能力。由于该菌株具有这些特点,将其制备成直投式发酵剂,应用于发酵食品的制作具有重要的意义。
目前直投式发酵剂(directed vat set,DVS)的研究,主要集中在通过高密培养,提高冻干前菌体数量方面。通过筛选及优化乳酸菌增殖培养基,优化乳酸菌发酵条件,通过细菌菌体发酵动力学技术,运用新型发酵技术,营养与代谢基础上,恒定pH发酵、进行分批补料发酵等,达到高密度培养的目的[2-4]。乳酸菌高密度培养是制备直投式发酵剂的前提,通过高密度培养发酵得到大量的活性乳酸菌,然后将培养液中的菌体进行浓缩收集。由于离心收集法具有不易污染,设备及操作简单等优点,在实践中被广泛应用。在离心的工艺中,会产生机械力及摩擦产生的高温,会对菌体造成损伤。另外,菌体在离心时会有少量的菌体残留在上清液中。因此选择合适的离心工艺参数,获得理想的离心收得率是非常重要的。同时如何保证冻干后菌体的存活率也是直投式发酵剂生产的关键。在冷冻干燥过程中,菌体细胞受到冷冻及真空干燥两种物理过程,会导致蛋白质变性,造成冻干后活菌数降低。如何将冻干工艺的伤害降低到较低的水平,尽可能保持菌体的生理活性及功能,这都是需要解决的问题。除了选择菌体活菌数较多,活力较强的时间进行冷冻干燥外,加入冻干保护剂是较有效的解决方法。由于细胞大小和结构的差异,采用相同的保护剂所得到的保护效果也有差异,同时保护剂对微生物保护作用具有选择性,这些都需要通过试验来最终确定。由于冻干保护剂的研究一般属于专利资料,同时研究报告[5-6]的结果一般存在很大差异。因此对直投式发酵剂的离心及冷冻干燥工艺进行研究,具有重要意义。
目前,对于GABA产生菌的研究[7-8]主要集中在优化发酵条件提高GABA的产量,还未有学者研究高产GABA的植物乳杆菌直投式发酵剂。因此,本研究拟通过对植物乳杆菌LP-S2高密度培养,实现菌体大量增殖,通过优化离心工艺,对冻干保护剂进行筛选和优化,对预冷时间进行优化,最终制成具有高产γ-氨基丁酸能力的乳酸菌直投式发酵剂。
1 材料与方法
1.1 材料
1.1.1 试验菌株
植物乳杆菌Lp-S2:本试验室筛选并保藏。
1.1.2 培养基
乳酸细菌液体培养基(MRS):葡萄糖20 g、酵母膏5 g、牛肉膏10 g、蛋白胨10 g、KH2PO42 g、乙酸钠5 g、柠檬酸铵2 g、MgSO4·7H2O 0.58 g、MnSO4·4H2O 0.25 g、吐温80 1 mL、加蒸馏水定容至1 000 mL,121 ℃灭菌15 min。
1.1.3 主要试剂
海藻糖、葡萄糖、蔗糖、乳糖、麦芽糊精、谷氨酸钠等:分析纯,天津市天力化学试剂有限公司;
γ-聚谷氨酸(γ-PGA):分析纯,西安百川生物科技有限公司。
1.1.4 主要仪器设备
恒温培养箱:DNP-160型,上海一恒科技有限公司;
超净工作台:YJ-875型,苏州顺鑫净化科技有限公司;
立式压力蒸汽灭菌锅:LDXZ-50KB型,上海申安医疗器械厂;
离心机:LG10-2.4A型,北京时代北利离心机有限公司;
超低温冰箱:DW-FW351型,中科美菱低温科技有限责任公司;
真空冷冻干燥机:FD5-3型,美国西盟国际公司。
1.2 方法
1.2.1 乳酸菌活菌数的测定 采用平板菌落计数法测定乳酸菌活菌数,在超净工作台内,取1 mL菌液以加入到9 mL灭菌的生理盐水中,依次递增稀释,选择10-8,10-9,10-103个稀释度。取1 mL稀释液于无菌的空培养皿中,倒入15 mL溶化并冷却至45 ℃的MRS培养基,放置于操作台上混匀,每个稀释度做3个平行样,凝固后37 ℃培养24 h后取出,选择25~200个菌数的平板进行读数,然后乘以稀释倍数[9]。
1.2.2 植物乳杆菌高密度菌悬液的制备 将MRS培养基,分装至10个250 mL的三角瓶中,装液量150 mL,于121 ℃灭菌20 min。在超净工作台接种2%的种子发酵剂,恒温37 ℃培养15 h制取菌悬液。
1.2.3 高密度菌悬液离心条件的研究 将得到的高密度菌悬液进行离心,在文献[10]的基础上,选择不同的离心温度、离心时间、离心机转速进行正交试验,每个因素选择3个水平,因素和水平组合表见表1。
分别记录离心前后活菌数,按式(1)计算样品的离心收得率。将离心收得率做为衡量离心试验效果的指标。

表1 L9(33)因素和水平组合表Table 1 Factor and level of L9(33) test
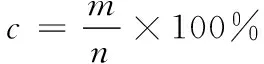
(1)
式中:
c——离心收得率,%;
m——沉淀中活菌数,CFU/mL;
n——离心前活菌数,CFU/mL。
1.2.4 冻干保护剂优化的研究 冷冻干燥过程一般工艺流程为:
高密度培养液→离心→菌泥→添加冻干保护剂→菌悬液→预冷→预冻→真空冷冻干燥→收集菌粉
将高密度培养液进行离心,倒掉上清液,将剩下的菌泥倒于无菌的培养皿中,菌泥与保护剂按1∶3体积比混匀,平衡30 min,制得菌悬液。用保鲜膜封好并扎口,将配置好的菌悬液在4 ℃进行预冷0~12 h进行成型,在-70 ℃超低温冰箱中预冻14 h后置于真空冷冻干燥设备中,在真空度为3~5 Pa条件下冷冻干燥48 h左右得到冻干菌粉[11]。
选取海藻糖、葡萄糖、蔗糖、乳糖、麦芽糊精、γ-PGA、脱脂乳粉、谷氨酸钠作为单一冻干保护剂,通过参考相关文献[12]确定单一保护剂的浓度,分别测得冻干前后的活菌数并计算冻干菌体存活率。通过筛选得到较优的3种冻干保护剂进行正交试验,确定最佳的复合保护剂组合配方。冷冻干燥后菌体存活率按式(2)计算:
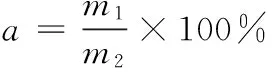
(2)
式中:
a——菌体存活率,%;
m1——冻干后总活菌数,CFU/mL;
m2——冻干前总活菌数,CFU/mL。
1.2.5 预冷时间的优化 预冷是在-70 ℃预冻之前,将菌悬液温度降至4 ℃,并保温一段时间。预冷能够很好地提高乳酸菌的冻干存活率。一方面能将菌悬液各个位置的液体均匀地降到较低温度,同时不形成冰晶。在下一步预冻工艺中能缩短菌悬液渡过最大冰晶生成带的时间,减少大的冰晶形成,从而提高细菌的存活率。另一方面4 ℃预冷给细胞一个低温适应过程,促使细胞做出适应低温环境的一些生化变化,例如某些与抗冻相关蛋白的形成。试验时,使用优化后的复合保护剂配方制备菌悬液,然后分别预冷0,2,4,6,8,10,12 h后,采用相同的工艺进行冷冻干燥操作,测量每个样品冻干存活率,确定最佳预冷时间。
2 结果与分析
2.1 离心条件试验结果
在离心工艺中,影响菌体存活率主要有两个方面因素:① 由于离心力作用产生的摩擦温度及机械剪切作用因素,造成菌体死亡;② 离心工艺不可能把所有的菌体都离心到离心管底部,有少量菌体残留在上清液中造成菌体损失。如果离心参数控制不当,菌体损失率和死亡率增高,必然造成菌体收得率降低,最终直接导致活菌数量降低,影响发酵剂的产品质量[13]。选择不同的离心温度、离心时间、离心机转速进行正交试验。
以离心收得率作为衡量标准获得的正交试验结果分析见表2。由表2可知,对植物乳杆菌Lp-S2离心工艺影响大小的顺序是离心温度>离心时间>离心机转速。最佳组合是A1B3C2,即离心温度为4 ℃,离心时间为30 min,转速为6 000 r/min时离心效果最佳。该条件下,进行3组平行验证实验。植物乳杆菌Lp-S2离心收得率平均达到83.8%。说明正交试验效果较好。

表2 离心正交试验结果表Table 2 Results of centrifugal orthogonal experiment
2.2 冻干保护剂优化试验结果
2.2.1 保护剂单因素试验 本试验选择不同种类的保护剂溶液进行单因素测试。保护剂的种类和添加量见表3。结果显示,加入单一保护剂对菌体在冻干过程中的保护作用差异十分明显,冻干存活率从不加保护剂的0.16%提高到16.2%。在植物乳杆菌冻干工艺中,海藻糖是较优的冻干保护剂,其次是葡萄糖和脱脂乳粉。
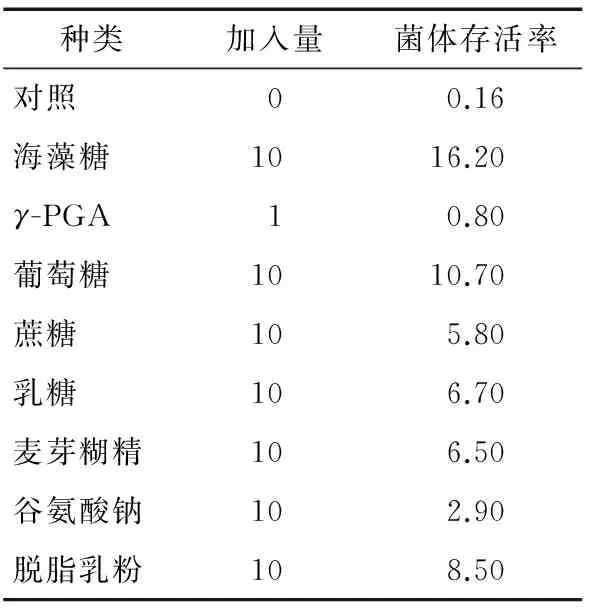
表3 单一保护剂对存活率的影响Table 3 Effect of single protectant on survival rate %
2.2.2 复合保护剂正交试验 根据单因素试验结果,选取冻干效果较好的海藻糖、葡萄糖和脱脂奶粉作为试验因素进行正交试验。复合保护剂因素水平表见表4。

表4 复合保护剂因素水平表Table 4 Compound protectant factor level table %
由表5可知,由海藻糖、脱脂奶粉和葡萄糖组成的混合保护剂对菌体的保护作用明显强于单一成分的保护剂。所有组合的菌体存活率均大于单一因素测试中最高的16.2%,其中混合配方中最高的组合达到38.6%。直观分析可知:海藻糖对复合保护剂效用的影响最大,葡萄糖也有显著影响,脱脂奶粉影响最小。最佳的保护剂组合配方为A3B2C3,即海藻糖15%、脱脂乳粉10%、葡萄糖15%。进行3组平行验证实验,按此配比制备菌悬液然后冻干,显示植物乳杆菌Lp-S2的冻干存活率平均为39.2%,高于正交试验中得到的结果,正交试验优化的结果有效。
复合保护剂提高菌体存活率的原因主要是由不同种类的保护剂通过不同的方式保护菌体,复合保护后达到组合保护的效果。海藻糖、葡萄糖等低分子糖通过维持细胞膜结构的稳定性,达到抑制膜内结合水形成冰晶,减少细胞体的破坏。脱脂乳粉的蛋白是大分子物质,可以减少乳酸菌细胞暴露于介质和空气的面积,并在乳酸菌细胞表面形成保护层,防止因细胞壁破碎而导致的细胞内物质的泄漏,从而起到保护作用[14-15]。当共同使用3种保护剂时,菌体存活率明显增大说明三者复配具有协同累加效应。
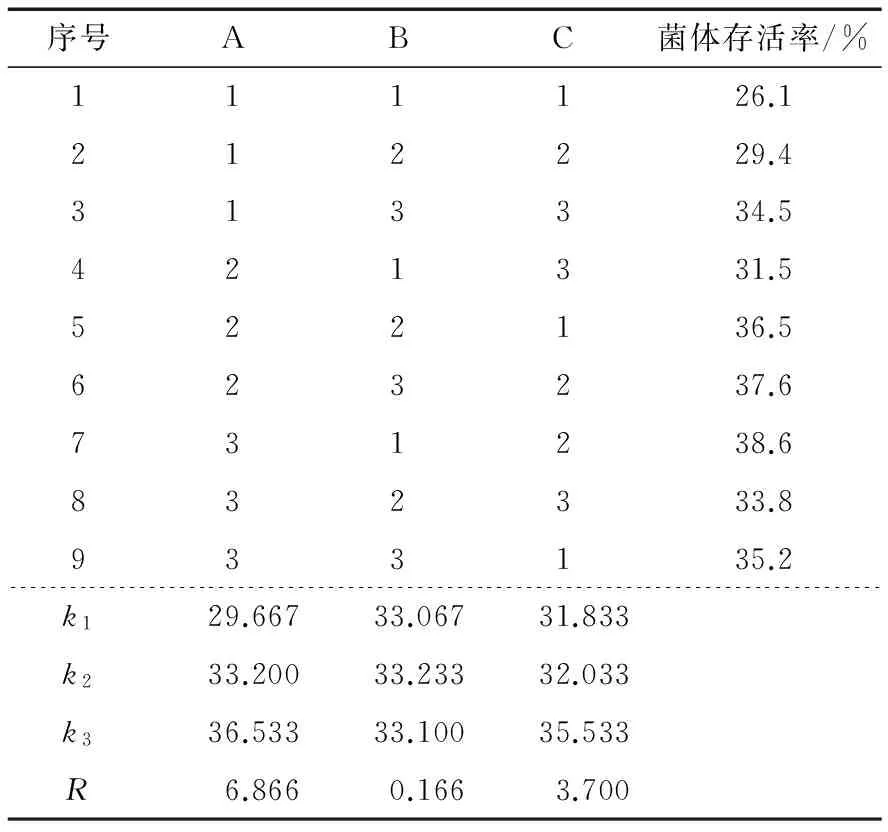
表5 保护剂正交试验结果分析表Table 5 Results of freeze-dried protectants orthogonal experiment
2.3 预冷时间的确定
由图1可知,预冷能有效提高菌体的冻干存活率。当预冻时间在2~6 h,菌体冻干存活率差异显著(P<0.05),菌体存活率随预冻时间延长而增加。可能是通过将菌悬液的温度均匀地降低到较低温度,促进菌体的低温适应性和应激反应,从而提高了菌体的冻干存活率[16-17]。在6 h以后,菌体冻干存活率差异不显著(P>0.05),菌体冻干存活率不再明显增加,可能是与提高冻干存活率相关的低温适应性生化反应基本完成有关[18]。试验得出,预冷能有效提高菌体的冻干存活率,最佳预冻时间为6 h。
利用优化后的离心和冷冻干燥生产的植物乳杆菌Lp-S2直投式发酵剂,其活菌数达到1.5×1012CFU/mL。达到商品发酵剂的要求,具有较高的实际应用价值。
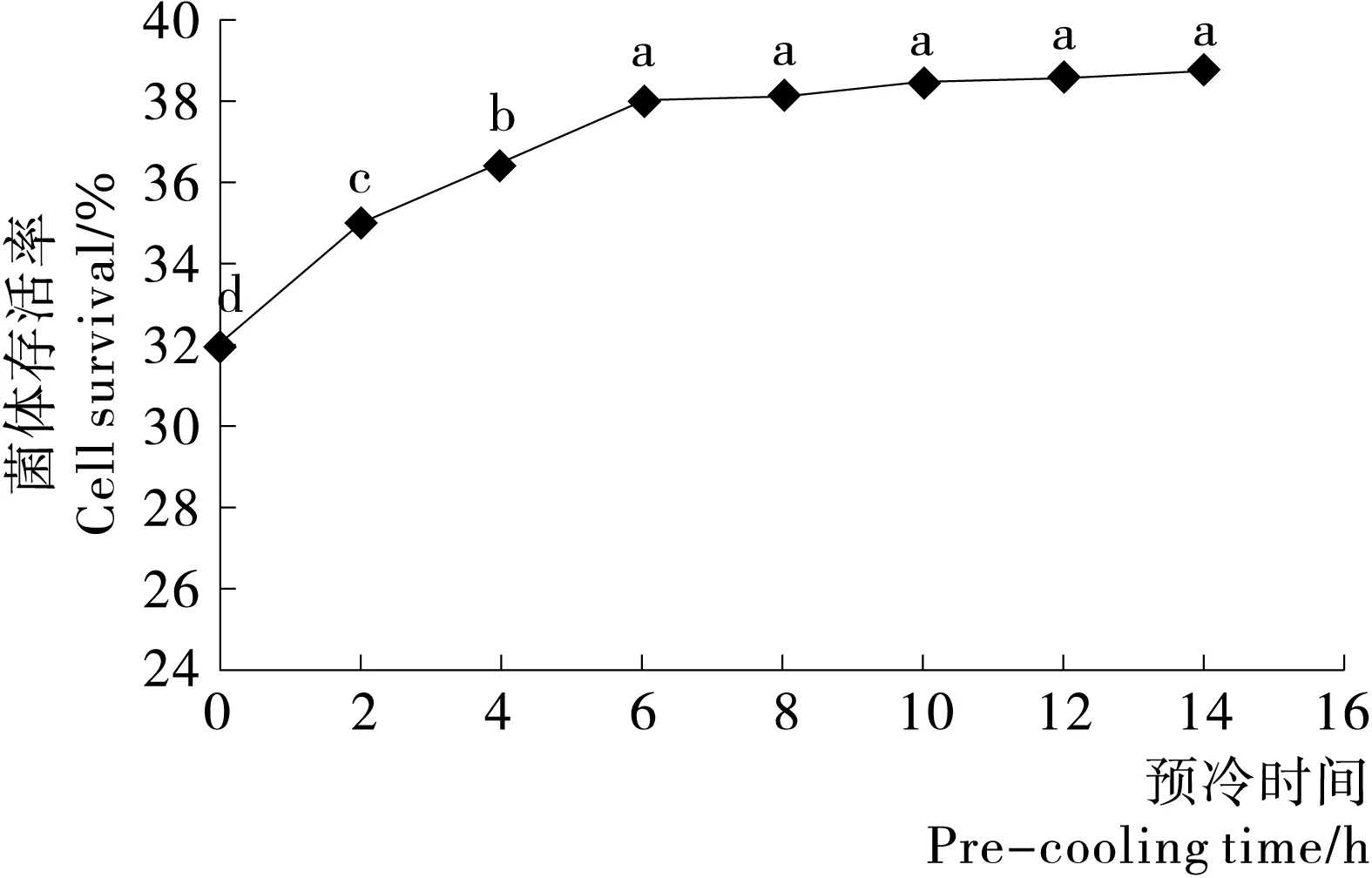
同一小写字母表示差异不显著(P>0.05)。图1 预冷对存活率的影响Figure 1 Effect of pre-cooling onthe survival rate
3 结论
在单因素试验基础上,通过正交试验确定了植物乳杆菌Lp-S2 的最优离心工艺为:离心温度4 ℃,离心时间30 min,离心机转速6 000 r/min。该条件下植物乳杆菌Lp-S2离心收得率达到83.8%。通过正交试验对复合保护剂进行了优化,得到最优的复合保护剂配方:海藻糖15%、脱脂乳粉10%、葡萄糖15%。植物乳杆菌Lp-S2添加该复合保护剂后,冻干存活率达到39.2%。通过对预冻时间进行单因素试验,得到最佳预冷时间为6 h。优化后离心及冷冻干燥工艺得到的Lp-S2直投式发酵剂活菌数达到1.5×1012CFU/mL。符合商品发酵剂的要求。同时该发酵剂具有发酵底物高产GABA的效果,因此产品具有实际应用价值。下一步将对直投式发酵剂保藏过程相关参数进行探索,最终得到植物乳杆菌Lp-S2直投式发酵剂更完整的制备工艺。
[1] 王建峰, 任举.γ-氨基丁酸的生理作用与制备方法综述[J]. 山东化工, 2013, 42(2): 251-252.
[2] 刘振民. 乳酸菌高密度培养剂浓缩型发酵剂的研究[D]. 哈尔滨: 东北农业大学, 2002: 5-14.
[3] 周洋, 赵玉娟, 牛春华, 等. 植物乳杆菌 SC9直投式发酵剂的研究[J]. 农产品加工, 2013(11): 11-14.
[4] 郭兴华. 益生乳酸细菌—分子生物学及生物技术[M]. 北京: 科学出版社, 2008: 50-65.
[5] 梁敏山. 乳酸菌增殖培养及直投式酸奶发酵剂的研究[D]. 成都: 西华大学, 2010: 30-40.
[6] 黄桂东, 毛健, 姬中伟, 等. 一株产γ-氨基丁酸植物乳杆菌MJ0301培养基的优化[J]. 食品科学, 2013, 34(17): 165-166.
[7] 林亲录, 王婧, 陈海军. γ-氨基丁酸的研究进展[J]. 现代食品科技,2008, 24(5): 496-498.
[8] 张玉华, 孟一, 凌沛学, 等. 海藻糖和透明质酸对冻干双歧杆菌细胞的保护作用[J]. 食品科学, 2010(7): 236-241.
[9] 周德庆. 微生物试验手册[M]. 上海: 上海科技出版社, 1995: 25-35.
[10] 李冬华. 直投式植物乳杆菌发酵剂生产工艺及应用的研究[D]. 广州: 华南理工大学, 2010: 31-34.
[11] 孟祥晨, 杜鹏, 李艾黎, 等. 乳酸菌与乳品发酵剂[M]. 北京: 科学出版社, 2009: 14-18.
[12] PRASAD J, JARROW P M, GOPAL P. Heat and osmotic stress responses of probiotic Lactobacillus rhamnosus HN001 (DR20) in relation to viability after drying[J]. Applied and Environmental Microbiology, 2003, 69(2): 917-925.
[13] 姚国强, 高鹏飞. 乳酸菌发酵剂在生产存储及使用中的活性研究[J]. 食品研究与开发, 2013, 34(21): 131-136.
[14] SEI T, GONDA T, ARIMA Y. Growth rate and morphology of ice crystals growing in a solution of trehalose and water[J]. Journal of Crystal Growth, 2002, 240(1): 218-229.
[15] 张玉华, 孟一, 凌沛学, 等. 海藻糖和透明质酸对冻干双歧杆菌细胞的保护作用[J]. 食品科学, 2010(7): 236-241.
[16] BROADBENT J R, LIN C. Effect of heat shock or cold shock treatment on the resistance of Lactococcus lactis to freezing and lyophilization[J]. Cryobiology, 1999, 39(1): 88-102.
[17] 葛宗昌, 孟宪刚. 西北酸菜直投式发酵剂菌株高密度培养的研究[J]. 安徽农业科学, 2012, 40(27): 566-569.
[18] 赵建新, 陈卫, 田丰伟, 等. 预培养对酸奶冻干发酵剂活力的影响[J]. 食品与机械, 2005, 21(4): 7-9.
Study on centrifugal and freeze drying of Lactobacillus plantarum Lp-S2 DVS
SUI Chun-guang
LIANGJin-zhong
WANGFeng-qing
(HarbinUniversityofCommerce,Harbin,Heilongjiang150076,China)
LactobacillusplantarumLp-S2 which has the ability to produce gamma-aminobutyric acid, was used as starting strain to develop Direct vat set(DVS). Then the centrifugation process and freeze-drying process were optimized. By orthogonal experiment the optimal conditions of centrifugation were identified as: centrifugal temperature 4 ℃, Time-consuming 30 minutes, centrifugal force 6 000 r/min. In this condition, the centrifugal recovery rate ofLactobacillusLp-S2 is 83.8%. The cryoprotectant was optimized by single factor and orthogonal test. The best combination of cryoprotectants was 15% trehalose, 15% glucose and 10% skim milk powder. The survival rate ofL.plantarumLp-S2 Direct Vat Set reached 39.2%. The optimum pre-cooling time was 6 h. The number of viable cells of the direct-acting starter was 1.5×1012CFU/mL.
directed vat set;Lactobacillusplantarum; freeze drying;γ-amino butyric acid
黑龙江省高校科技创新团队建设计划项目(编号:2010td04)
隋春光,男,黑龙江农业经济职业学院讲师,博士在读。
梁金钟(1957—),男,哈尔滨商业大学教授。 E-mail:Ljz2050@126.com
2016—09—03
10.13652/j.issn.1003-5788.2016.11.040
