气相色谱—质谱法测定奶粉中香兰素含量的方法建立
2016-12-29郑璇
郑 璇
黄 瑾1
林 洁1,2
李 菊1,2
韦晓群1,2
蔡 纯1
陈燕芬1,2
冯婕莉1,2
郭庆园1,2
(1. 广东出入境检验检疫局,广东 广州 510623;2. 广东省动植物与食品进出口技术措施研究重点实验室,广东 广州 510623)
气相色谱—质谱法测定奶粉中香兰素含量的方法建立
郑 璇1
黄 瑾1
林 洁1,2
李 菊1,2
韦晓群1,2
蔡 纯1
陈燕芬1,2
冯婕莉1,2
郭庆园1,2
(1. 广东出入境检验检疫局,广东 广州 510623;2. 广东省动植物与食品进出口技术措施研究重点实验室,广东 广州 510623)
建立了自动顶空固相微萃取—气相色谱—质谱测定奶粉中香兰素和乙基香兰素的方法,并考察了萃取柱、吸附温度和时间、解吸附温度和时间等因素对方法回收率、精密度的影响。结果表明,该方法检测低限为0.5 mg/kg,样品加标回收率为90.0%~100%,平均相对标准偏差为1.9%~4.1%(n=6)。该法可消除奶粉中复杂基质的干扰,样品预处理简便快速、灵敏度高、准确可靠,适用于奶粉中香兰素和乙基香兰素的快速测定。
香兰素;乙基香兰素;奶粉;气相色谱—质谱;
香兰素是食品行业重要的香精香料添加剂,主要包括香兰素(3-甲氧基-4-羟基苯甲醛)和乙基香兰素(3-乙氧基-4-羟基苯甲醛),因其具有香荚兰香气以及浓烈的奶香味,广泛用作食品增香剂。GB 2760—2014规定了“较大婴儿和幼儿配方食品中可以使用香兰素、乙基香兰素和香荚兰豆浸膏,最大使用量分别为5,5 mg/100 mL和按照生产需要适量使用,其中100 mL以即食食品计,生产企业应按照冲调比例折算成配方食品中的使用量;婴儿谷类辅助食品中可以使用香兰素,最大使用量为7 mg/100 g,其中100 g以即食食品计,生产企业应按照冲调比例折算成谷类食品中的使用量;凡使用范围涵盖0至6个月婴幼儿配方食品不得添加任何食品用香料”。自2016年4月6日起,欧亚经济委员会决定禁止在儿童食品中使用乙基香兰素[1]。因此需要建立相关检测方法对奶粉中的香兰素进行检测。
目前,国内外测定香兰素的方法主要有伏安法[2]、毛细管电泳法[3]、分光光度法[4-5]、高效液相色谱法[6-7]、液相色谱—质谱联用法[8]、气相色谱法[9-10]、气相色谱—质谱法[11-12]等。但上述方法存在需要使用大量的有机溶剂进行提取,步骤繁琐,回收率低,精密度低等缺点。顶空固相微萃取法可专一性收集样品中的易挥发性成分,既可避免在除去溶剂时引起挥发物的损失,又可降低共提物引起的噪音,常被应用于挥发性成分的指纹图谱检测[13-14],少见于定量检测。本研究拟采用顶空固相微萃取—气相色谱—质谱法定量测定奶粉中的香兰素和乙基香兰素,解决香兰素提取难和回收率低的问题,探索顶空固相微萃取法在定量检测香兰素中的适用性,具有广泛的应用前景。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
气相色谱—质谱联用仪(带EI源,配CTC三合一自动进样器):Agilent7890A-5975C型,美国Agilent科技公司;
涡旋混合器:MS3 basic型,德国IKA集团;
固相微萃取装置:包括100 μm聚二甲基硅烷涂层纤维(PDMS),30 μm聚二甲基硅烷涂层纤维(PDMS),7 μm 聚二甲基硅烷涂层纤维(PDMS),65 μm聚二甲基硅烷/二乙烯苯涂层纤维(PDMS/DVB),85 μm聚丙烯酸酯涂层纤维(PA)以及85 μm碳分子筛/聚二甲基硅烷涂层纤维(CAR/PDMS),30 μm二乙烯苯/碳分子筛/聚二甲基硅烷涂层纤维(DVB /CAR/PDMS) ,美国SUPLECO公司。
1.1.2 试剂
氯化钠:分析纯,广州化学试剂厂,400 ℃烘烤2 h,在干燥器内冷却至室温备用;
乙腈:色谱纯,美国TEDIA公司;
香兰素标准品,纯度 ≥99%,法国Extrasynthese公司;
乙基香兰素标准品:纯度≥99.0%,法国Extrasynthese公司。
1.2 试验方法
1.2.1 标准溶液的配置
(1) 香兰素、乙基香兰素标准储备溶液(500 mg/L):准确称取0.050 g标准品,分别用乙醇溶解并定容至100 mL。
(2) 香兰素、乙基香兰素中间混合液(50 mg/L):分别准确移取10 mL香兰素、乙基香兰素标准储备溶液乙腈定容至100 mL。
(3) 香兰素、乙基香兰素标准工作液:根据需要用空白样品基质稀释。
1.2.2 基质标准曲线配制 用空白基质奶粉逐级稀释混合标准中间液,配制成一系列的基质混合标准工作溶液,现配现用。按仪器工作条件测定后,以质量浓度对相应的峰面积绘制基质标准曲线。
1.2.3 样品测定 称取1.0 g奶粉(精确到0.001 g)于20 mL顶空瓶中,加入2 g氯化钠,加入5 mL去离子水。涡旋3 min混匀样品,待分析。如果检测结果超出检测范围,可通过增加或者减少奶粉用量使之落在检测范围之内。
1.2.4 固相微萃取条件
(1) 吸附时间试验:固定参数为振荡器温度80 ℃,转速2 000 r/min,平衡50 min,进样口温度280 ℃,脱附5 min,萃取柱位65 μm PDMS/DVB萃取柱;变量为吸附时间,分别设为20,30,40,50 min,评价指标为总离子色谱图中的响应面积。
(2) 脱附时间试验:固定参数为振荡器温度80 ℃,转速2 000 r/min,平衡50 min,萃取柱为65 μm PDMS/DVB,吸附50 min,进样口温度280 ℃;变量为脱附时间,分别设为2,3,4,5,6 min,评价指标为总离子色谱图中的响应面积。
(3) 吸附温度试验:固定参数为平衡时间50 min,萃取柱为65 μm PDMS/DVB,吸附时间50 min,进样口温度280 ℃,解吸时间5 min,转速2 000 r/min;变量为振荡器温度,分别设为40,50,60,70,80,90 ℃,评价指标为总离子色谱图中的响应面积。
(4) 脱附温度试验:固定参数为振荡器温度80 ℃,转速2 000 r/min,平衡50 min,萃取柱为65 μm PDMS/DVB,吸附50 min,分别解吸时间5 min;变量为进样口温度分别设为230,240,250,260,270,280 ℃,评价指标为总离子色谱图中的响应面积。
1.2.5 色谱质谱条件 色谱柱:DB-5MS(30 m×0.25 mm×0.25 μm);色谱柱温度:初温80 ℃,停留2 min,以15 ℃/min升至280 ℃,停留2 min;进样口温度:60 ℃;接口温度:275 ℃;载气:氦气,纯度大于99.999%,线速度35 cm/s;进样量:1 μL,不分流进样;电离模式:EI;选择离子:m/z152,151,123,109,81(香兰素),m/z166,137,109,81(乙基香兰素);定量离子:m/z151(香兰素),m/z166(乙基香兰素);溶剂延迟:5 min。
2 结果与讨论
2.1 香兰素在GC—MS上的分离与响应
香兰素在GC—MS上有较好的分离响应。在该试验条件下,香兰素和乙基香兰素有较好的分离度,如图1所示,香兰素的气相色谱保留时间为7.613 min,特征离子的质核比分别为151.0,81.0,109.0,123.0,其中以151.0的丰度比最大,因而选择其为定量离子。乙基香兰素的气相色谱保留时间为8.129 min,特征离子的质核比分别为137.0,166.0,109.0,其中137.0的丰度比最大,因而选择其为定量离子。
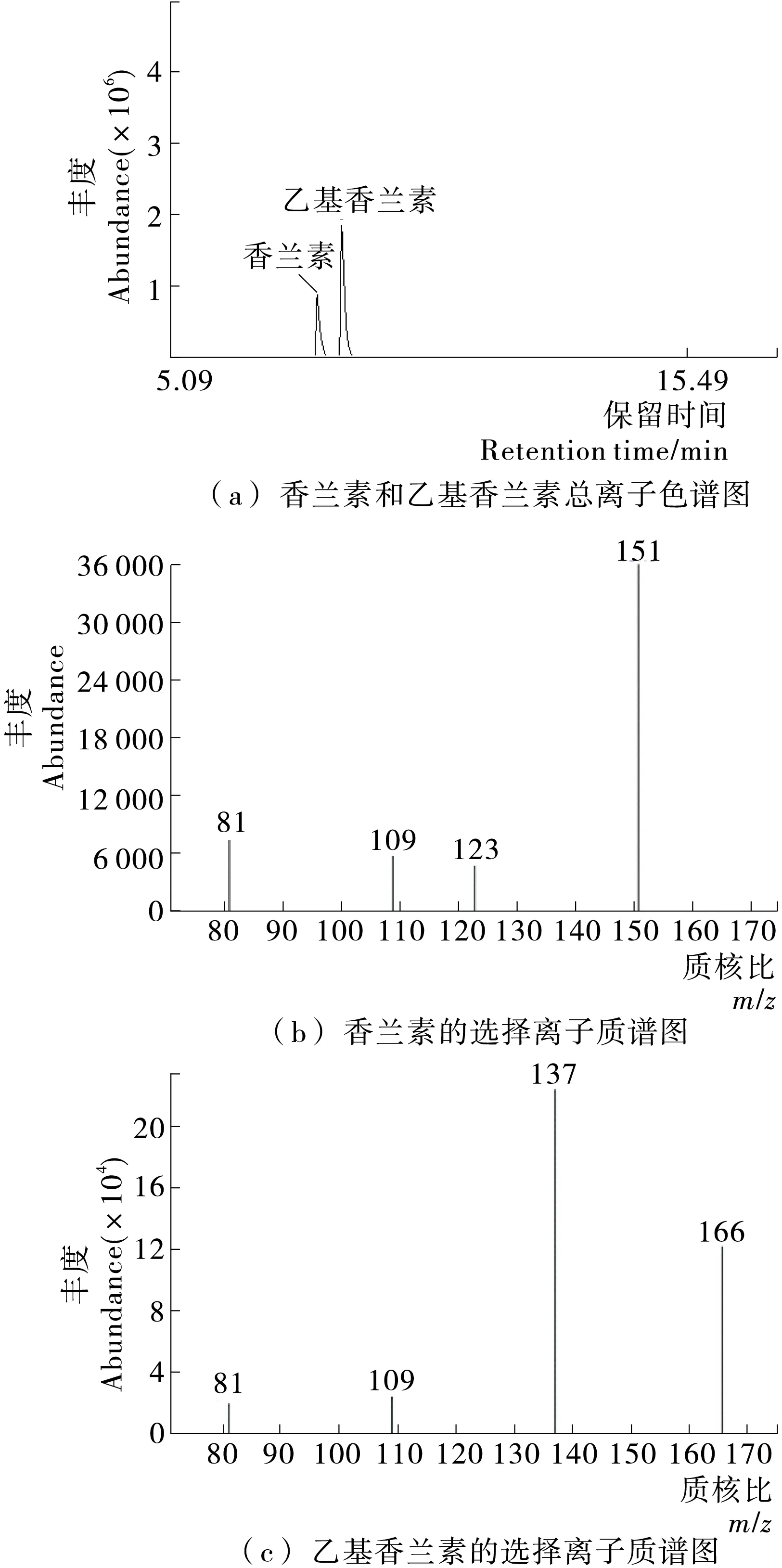
图1 香兰素和乙基香兰素的色谱质谱图Figure 1 Mass spectra and Chromatogram of vanillin and ethyl vanillin
2.2 影响因素
2.2.1 萃取纤维类型的影响 根据相似相溶原理, 非极性纤维涂层对非极性化合物具有较高的萃取效率,而极性纤维涂层对极性化合物具有较高的萃取效率。试验在70 ℃、振荡器转速500 r/min、平衡10 min、顶空固相微萃取20 min 的条件下,考察了7种不同类型的萃取纤维分别对基质标准混合液的萃取效果,结果见图2。从萃取出的香兰素和乙基香兰素的量(以峰面积表示)色谱峰分离度及峰形3个方面比较7种萃取纤维的萃取能力。结果表明:7种纤维萃取材料得到目标成分的峰都能基线分离;85 μm PA、85 μm DVB/CAR/PDMS和100 μm PDMS萃取头的萃取能力较差;30 μm PDMS、85 μm CAR/PDMS和7 μm PDMS对待测化合物的吸附能力有较大的提高,而65 μm PDMS/DVB的萃取能力最强。香兰素含酚羟基、羰基、苯环以及醚基,聚硅氧烷萃取头(PDMS)适用于非极性化合物的萃取,而且粒径越小萃取能力越大,因而针对香兰素的萃取能力是7 μm PDMS>30 μm PDMS>100 μm PDMS;碳分子筛萃取头(CAR)一般针对痕量物质如VOC,而乳品中的挥发成分包括相对较多,在吸附过程中容易出现拖尾、过饱和情况;聚二乙烯基苯萃取头(DVB)对极性挥发物有较强的吸附,因而PDMS/DVB萃取头对香兰素具有较强的吸附。故试验选择65 μm PDMS/DVB作为固相微萃取柱。
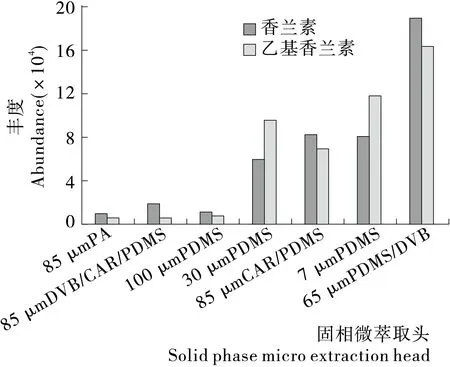
图2 不同固相微萃取柱对香兰素和乙基香兰素的萃取效果Figure 2 Extraction efficiency of different fiber
2.2.2 吸附时间和脱附时间的影响 固相微萃取柱达到吸附平衡需要一定的时间。试验采用65 μm PDMS/DVB萃取柱并在70 ℃下进行吸附,然后在260 ℃的温度下脱附5.5 min后检测,考察吸附时间,结果发现当在70 ℃进行吸附时,香兰素和乙基香兰素的色谱峰随着吸附时间的延长而增大,并且在40 min后达到平衡(见图3)。故选择45 min作为优化的平衡时间。
同样的被吸附到萃取柱上的目标化合物需要一定的时长才能完全释放出来。通过试验发现(图4),随着脱附时间的延长,目标化合物的峰面积增加,在5 min后基本不在变化,考虑到高温会缩短萃取纤维的使用寿命,故选取5.5 min作为解吸时间。
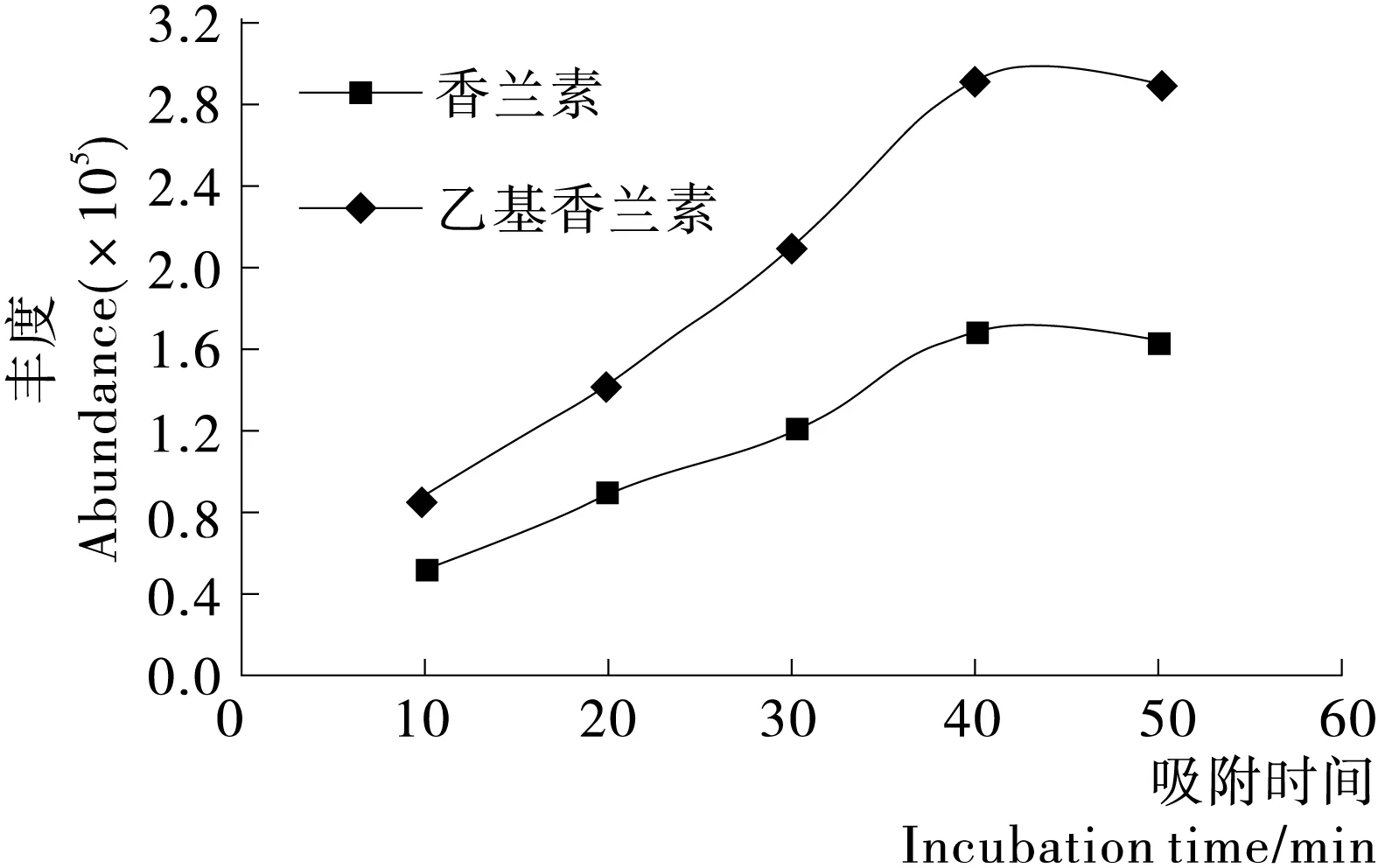
图3 香兰素和乙基香兰素色谱峰面积随吸附时间变化
Figure 3 The change of adsorption time on vanillin and ethyl vanillin chromatographic peak area
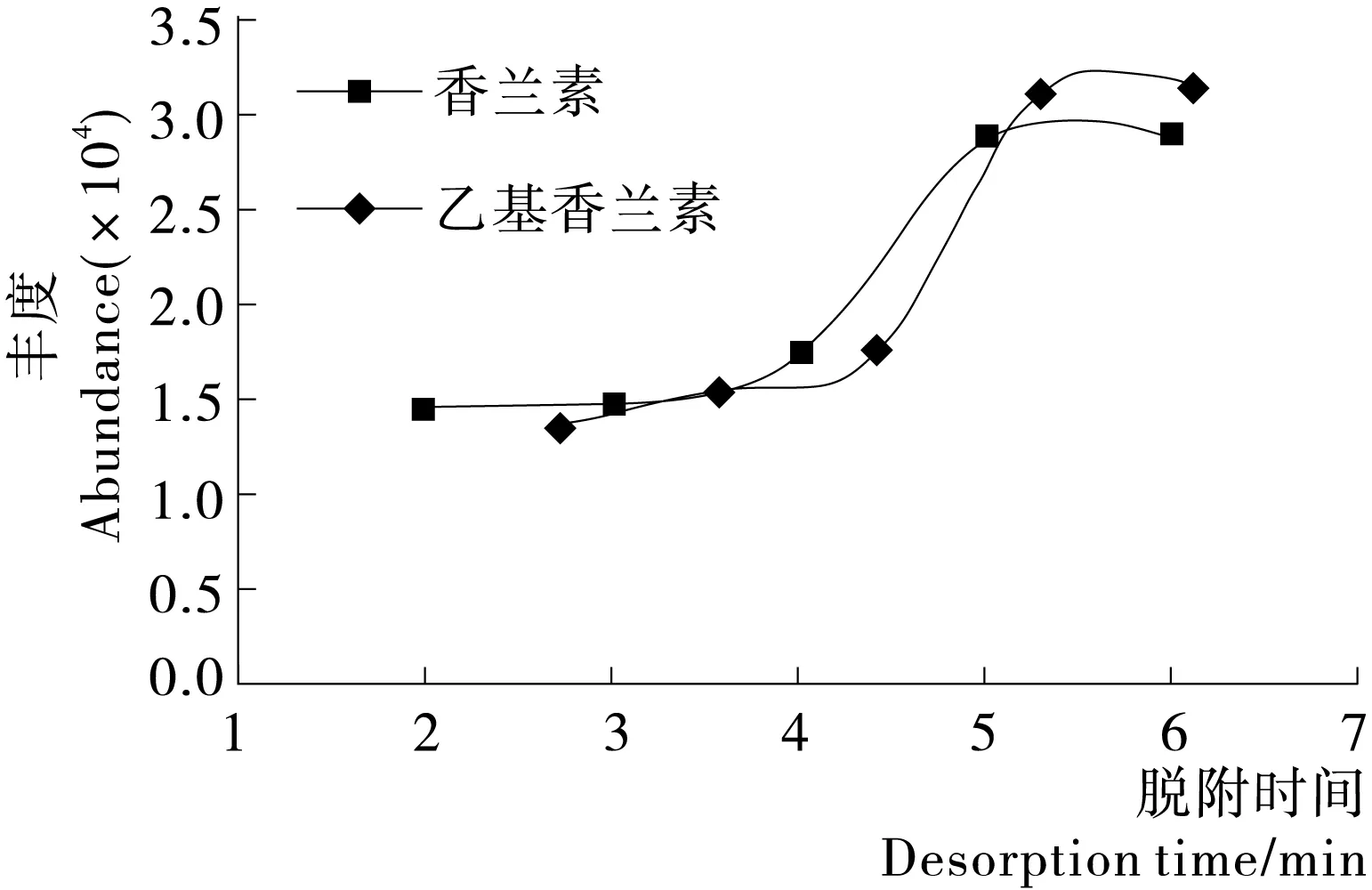
图4 香兰素和乙基香兰素色谱峰面积随脱附时间变化
Figure 4 The change of desorption time on vanillin and ethyl vanillin chromatographic peak area
2.2.3 吸附和脱附温度的影响 萃取温度对萃取时间和萃取容量都有重要影响。通过试验发现,在高温条件下应用65 μm PDMS/DVB在40 min内萃取奶粉中香兰素,有利于目标化合物从基质中萃取出来,但同时也会降低萃取纤维的分配系数和萃取效率。由图5可知,萃取温度为80 ℃时,香兰素和乙基香兰素的峰面积达到最大值。
PDMS/DVB萃取纤维的最高使用温度为270 ℃,由图6可知,当解吸温度为260 ℃时,香兰素和乙基香兰素的响应峰面积达到最大。因此,选取260 ℃作为解吸温度。
2.3 方法线性范围和回收率
在上述试验条件下,以基线3倍噪声值计算结果作为该方法检测低限。该方法稀释倍数为5倍,检测低限为0.5 mg/kg;香兰素和乙基香兰素在0.5~30.0 mg/kg内有良好的线性,香兰素的线性方程为:y=609.8x+168.2,r2=0.999 2,乙基香兰素线性方程为y=1 010.1x+102.8,r2=0.999 1。当实际样品中香兰素和乙基香兰素的限量超过方法的线性范围时,可以减少称样量至0.1 g,使检测结果在线性范围之内。
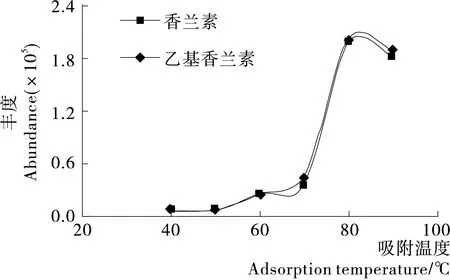
图5 香兰素和乙基香兰素色谱峰面积随吸附温度变化
Figure 5 The change of adsorption temperature on vanillin and ethyl vanillin chromatographic peak area
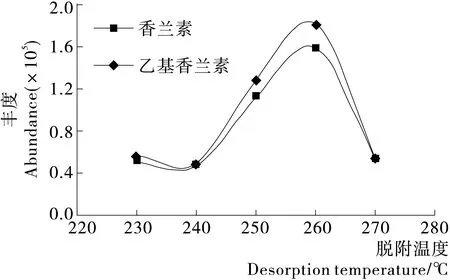
图6 香兰素和乙基香兰素色谱峰面积随脱附时间变化
Figure 6 The change of desorption temperature on vanillin and ethyl vanillin chromatographic peak area
应用实际奶粉样品作为基质,进行3水平6平行添加回收试验。称取空白样品6份,每份1 g,分别添加香兰素以及乙基香兰素标准品0.2,0.4,1.0 mg/kg,按1.2.2处理后,进行测定,结果发现样品中香兰素的加标回收率为90.0%~99.0%,平均相对标准偏差(RSD)为2.3%~4.1%(n=6),乙基香兰素的加标回收率为97.5%~100%,平均相对标准偏差(RSD)为1.9%~4.0%(n=6)。
2.4 样品测定
用所建立的方法测定市售奶粉中香兰素和乙基香兰素含量。结果表明(见表1),其中0~6月婴儿奶粉部分检出香兰素或者乙基香兰素(合计),最大值为1.5 mg/kg,违反GB 2760—2014标准中不得检出的要求;6月以上婴幼儿奶粉最大值为75.0 mg/kg,超过限量值;较大婴儿喝幼儿配方食品最大值为200.0 mg/kg,未超出限量值。

表1 实际样品测定结果Table 1 The results of milk powder sample
3 结论
建立了奶粉中香兰素和乙基香兰素的顶空固相微萃取—气相色谱—质谱测定方法。该方法只需经过简单的前处理步骤,极大消除了奶粉中复杂基质对测定结果的干扰,样品的香兰素和乙基香兰素加标回收率范围为90.0%~100%,平均相对标准偏差为1.9%~4.1%(n=6),检测低限均为0.5 mg/kg。香兰素和乙基香兰素在0.5~30.0 mg/kg浓度范围内有良好的线性,标准曲线相关系数分别为0.999 2和0.999 1。该方法具有分析效率高、操作方便、线性范围宽、检出限低、选择性好、干扰少、精密度和准确度好等优点,适用于奶粉中香兰素和乙基香兰素的快速测定。本方法受限于顶空瓶的体积以及固相微萃取头的吸附容量,检测范围受到一定的限制,此外本方法仅适用于外源性、游离态的有机挥发物。顶空固相微萃取技术还可以连接到GC—FID、GC—MS/MS等多种仪器上,获得更大的应用。
[1] 驻哈萨克经商参处. 欧亚经济联盟国家禁止生产添加香兰素的儿童食品[EB/OL]. (2016-04-08)[2016-06-02]. http://kz.mofcom.gov.cn/article/ddfg/intruduce/201604/20160401292678.shtml.
[2] 邱萍, 倪永年. 微分脉冲溶出伏安法测定食品中的香兰素[J]. 南昌大学学报, 2006, 26(2): 124-127.
[3] 刘玉明, 张术, 黄来龙, 等. 毛细管气相色谱法测定肤疾安药物中香兰素的含量[J]. 药物分析杂志, 2010(2): 336-338.
[4] 张勇, 林国卫, 夏瑾华, 等. 可见分光光度法测定麦片中的香兰素含量[J]. 食品科学, 2010(4): 233-235.
[5] 张国文, 倪永年. 多元校正-光度法同时测定食品中的香兰素和乙基麦芽酚[J]. 分析科学学报, 2005, 21(1): 20-23.
[6] 籍芳, 孙玉慧, 李天宝, 等. 奶粉中香兰素、甲基香兰素和乙基香兰素的测定[J]. 食品研究与开发, 2015, 33(13): 79-81.
[7] 迟秋池, 李晓雯, 何家今, 等. 高效液相色谱法同时测定豆浆中麦芽酚、乙基麦芽酚、香兰素、甲基香兰素和乙基香兰素5种香料[J]. 食品安全质量检测学报, 2016, 7(7): 2 690-2 694.
[8] 景丽洁, 韩伟, 闫光烈. 用反相高效液相色谱法测定香兰素含量[J]. 食品科学, 2006(4): 205-207.
[9] 杨华梅, 杭莉. 超高效液相色谱-串联质谱法同时测定食品中4种常用香精[J]. 色谱, 2015, 33(3): 250-255.
[10] 欧菊芳, 顾秀英, 鲍忠定, 等. 气相色谱法测定婴幼儿配方奶粉中香兰素和乙基香兰素[J]. 江西科学, 2011(1): 23-25, 33.
[11] 章建辉, 李莎, 黄辉, 等. 液液萃取—接受相固化—反萃取—气相色谱/质谱法测定奶粉中的香兰素[J]. 食品与机械, 2015, 31(2): 98-101, 105.
[12] 乙小娟, 朱加叶, 丁萍. 气相色谱-质谱联用法测定巧克力中香兰素、特丁基对苯二酚、咖啡因[J]. 理化检验: 化学分册, 2009(12): 1 404-1 406.
[13] 周宸丞, 陈熠敏, 陈振桂, 等. 静态顶空与固相微萃取法分析婴幼儿辅食营养包中哈喇味的主要成分[J]. 食品工业科技, 2016, 37(16): 49-55,60.
[14] 宫俐莉, 李安军, 孙金沅, 等. 溶剂辅助风味蒸发法与顶空-固相微萃取法结合分析白酒酒醅中挥发性风味成分[J]. 食品与发酵工业, 2016, 42(9): 169-177.
Determination of vanillin and ethyl-vanillin in milk powder by gas chromatography-mass spectrometry
ZHENG Xuan1
HUANGJin1
LINJie1,2
LIJu1,2
WEIXiao-qun1,2
CAIChun1
CHENYan-fen1,2
FENGJie-li1,2
GUOQing-yuan1,2
(1.GuangdongInspectionandQuarantineTechnologyCenter,Guangzhou,Guangdong510623,China; 2.GuangdongKeyLaboratoryofImportandExportTechnicalMeasuresofAnimal,PlantandFood,Guangzhou,Guangdong510623,China)
A method for determination of vanillin and ethyl-vanillin in milk powder was established by auto headspace solid-phase micro-extraction coupled with gas chromatography-mass spectrometry (GC—MS), and the influence factor were also studied, such as solid phase micro-extraction head, time and temperature of adsorption and desorption. As a result, the limits of determination (LOD) of vanillin and ethyl-vanillin were 0.5 mg/kg. The spiked recovery was between 90.0% and 100%, and the RSD ranged from 1.9%~4.1%(n=6). This method could eliminate the interference of complicated matrix, conveniently, quickly and exactly, which was applicable for quick determination of vanillin and ethyl-vanillin content in milk powder.
vanillin; ethyl-vanillin; milk powder; GC—MS
国家质检总局科技项目(编号:2015IK065)
郑璇,女,广东出入境检验检疫局工程师,硕士。
韦晓群(1979-),男,广东出入境检验检疫局高级工程师,博士。E-mail: weixq@iqtc.cn
2016-08-25
10.13652/j.issn.1003-5788.2016.11.008
