天麻提取物对灰树花深层发酵胞外蛋白合成的影响
2016-12-29黄忠
黄 忠
吴天祥
杨祖滔
朱思洁
(贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
天麻提取物对灰树花深层发酵胞外蛋白合成的影响
黄 忠
吴天祥
杨祖滔
朱思洁
(贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
在灰树花深层发酵系统中加入天麻提取物,以灰树花生物量和胞外蛋白合成量为指标,对天麻提取物添加量进行优选;利用HPLC对天麻提取物成分进行分析,研究天麻提取物灭菌前后主要成分(天麻素、对羟基苯甲醇、对羟基苯甲醛及巴利森甙)含量的变化,并研究其促进灰树花生物量和胞外蛋白合成的关键成分在灰树花发酵体系中的含量变化。结果发现,7%(体积分数)天麻提取物可以促进灰树花菌丝体生长和胞外蛋白的合成,生物量和胞外蛋白合成量在发酵第11天时达到最大值;在天麻提取物灭菌后,巴利森甙含量明显减少,天麻素含量明显增加;天麻提取物加入灰树花发酵体系14 d后,天麻素、对羟基苯甲醇、对羟基苯甲醛含量均降低,但巴利森甙含量增加了161.11%。
天麻;提取物;灰树花;深层发酵;胞外蛋白;生物量
天麻(GastrodiaelataBl.) 为兰科多年生寄生菌植物,是一种名贵的中药材,主要产于贵州、云南及四川等地,其主要成分包括天麻素(gastrodin)、对羟基苯甲醛(p-hydroxylbenzaldehyde)、对羟基苯甲醇(p-hydroxybenzyl alcohol)等[1-2]。
灰树花(Grifolafrondosa)又名栗子蘑、贝叶多孔菌等,是一种高档的珍稀食用菌,同时灰树花还是珍贵的药用真菌,具有极高的营养和保健价值[3-4]。灰树花的化学成分主要有多糖、蛋白质、多酚、核酸、微量元素等,其中灰树花蛋白质中含有多种氨基酸,特别是色氨酸的含量较高,因此当灰树花和其他食物一起食用时,能够起到氨基酸的互补作用;还含有较高的天冬氨酸和谷氨酸,具有抗疲劳和保护人脑神经的作用[5-6]。
近些年国内外的科研文章表明,真菌蛋白已表现出显著的免疫调节、抗病毒及抗肿瘤作用[7-8];灰树花中提取的小分子蛋白具有抗HSV-1的作用[9],刺激小鼠自然杀伤树突状细胞和增强小鼠抗肿瘤免疫[10],分离得到的热稳定蛋白具有抑制烟草花叶病毒(TMV)侵染活性[11],而且灰树花抗肿瘤多糖组分中含有的1%~20%的蛋白可能具有独特作用[12]。
本课题组[13-18]之前的研究表明,中药尤其是天麻提取物能够有效促进灰树花菌丝体生长和胞外多糖合成,而天麻提取物对灰树花的另一重要活性物质灰树花蛋白的影响未进行研究,本试验通过研究天麻醇提物对灰树花胞外蛋白合成的影响以及对灰树花胞外蛋白合成起关键作用的物质,以期为后期相关代谢组学和基因组学的研究提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
天麻:贵州省德江县的天麻种植基地;
灰树花菌株(ACCC51616):中国农业微生物菌种保藏管理中心;
考马斯亮蓝G-250、牛血清蛋白:分析纯,北京索莱宝科技有限公司;
KH2PO4:分析纯,天津市福晨化学试剂厂;
蛋白胨:分析纯,上海盛思生化科技有限公司;
MgSO4·7H2O:分析纯,天津市瑞金特化学品有限公司;
无水乙醇:分析纯,成都金山化学试剂有限公司;
天麻素标品:化学纯,成都曼思特生物科技有限公司;
对羟基苯甲醇、对羟基苯甲醛、巴利森甙:化学纯,美国Sigma公司;
磷酸:分析纯,天津市富宇精细化工有限公司;
其余试剂均为市售分析纯。
1.1.2 主要仪器设备
立式灭菌锅:BXM-30R型,上海博讯实业有限公司医疗设备厂;
紫外可见分光光度计:UV-7502PC 型,上海欣茂仪器有限公司;
低速离心机:TG2-16G型,上海安亭科学仪器厂;
净化工作台:SW-CJ-1D型,苏州净化设备有限公司;
数显鼓风干燥箱:GZX-9070 MBE型,上海博迅实业有限公司;
电子天平:CP114型,上海奥豪斯仪器有限公司;
旋转蒸发仪:RE52AA型,上海亚荣生化仪器厂;
循环水真空泵:SHZ-III型,上海亚荣生化仪器厂;
高效液相色谱仪及检测器:Agilent 1100型,安捷伦科技有限公司。
1.2 方法
1.2.1 天麻预处理及制备天麻提取物流程 将天麻用清水洗净,在55 ℃条件下烘干,经粉碎机粉碎后,过80目筛后得到天麻粉末备用。精确称取天麻粉末10 g,加入体积分数75%的乙醇溶液100 mL,常温(25 ℃左右)浸泡48 h后过滤得滤液,然后将滤液60 ℃减压蒸馏除去乙醇至浸膏状,将浓缩物重溶于蒸馏水中,定容到100 mL,即得天麻提取液。
1.2.2 培养基制备及培养方法
(1) 斜面培养基:马铃薯(去表皮)200 g/L,葡萄糖20 g/L,蛋白胨2 g/L,琼脂20 g/L,MgSO4·7H2O 1 g/L,KH2PO42 g/L,pH 值自然。
(2) 种子培养基:葡萄糖30 g/L,酵母膏6 g/L,蛋白胨2 g/L,MgSO4·7H2O 0.5 g/L,KH2PO40.5 g/L,pH值自然。
(3) 发酵培养基:葡萄糖50 g/L,MgSO4·7H2O 2 g/L,酵母膏10 g/L,KH2PO42 g/L,蛋白胨5 g/L,pH值自然。
(4) 斜面种子培养方法:在母种管中用接种铲取黄豆粒大小的菌丝块到斜面培养基的中部,接种完成后置于25 ℃的恒温培养箱中培养至菌丝布满斜面。
(5) 种子液培养方法:用接种扒在培养好的菌种斜面上尽可能多地刮取绿豆大小颗粒,接种于灭菌后的液体种子培养基中,每支种子管接种1瓶种子液。三角锥形瓶(250 mL)装液量为100 mL并放置一个转子,150 r/min、25 ℃、摇床培养7 d,每天将种子液置于旋转仪上均匀3~5 min,待三角锥形瓶中长出大量均匀细小的菌丝球且培养液清亮即可。
(6) 发酵培养基培养方法:每瓶发酵液按照每100 mL发酵液接种10 mL种子液的接种量接种。用移液枪吸取种子液10 mL,接种于发酵培养基中。250 mL三角锥形瓶装液量为100 mL,并置于150 r/min、25 ℃的恒温摇床培养,培养时间按试验设计设定。
1.2.3 标准曲线的绘制 采用考马斯亮蓝法[19]。精确称取10 mg牛血清蛋白标准品,加入到100 mL容量瓶中,用蒸馏水定容后摇匀,即得0.1 mg/mL的标准液,分别取0.0,0.1,0.2,0.3,0.4,0.5,0.6,0.7 mL于10 mL具塞试管中,加蒸馏水至1 mL,再分别向具塞试管中加入配制好的考马斯亮蓝G-250溶液5 mL,摇匀后,避光反应5~10 min后,在最大吸收波长595 nm处测定其吸光度值,绘制出标准曲线。
1.2.4 胞外蛋白的测定及计算方法 将待测发酵液用移液管移入离心管中,置于离心机中在4 000 r/min离心10 min,待结束后,取一定量上清液并加蒸馏水至1 mL,加入配制好的考马斯亮蓝G-250溶液5 mL,摇匀,避光反应5~10 min后,在595 nm处测定其吸光度,并通过标准曲线计算出所取上清液中所含胞外蛋白质量。胞外蛋白计算公式:

(1)
式中:
M——胞外蛋白总量,mg;
m1——所取上清液中蛋白质量,mg;
n——所取上清液占发酵液的体积分数。
1.2.5 生物量测定 灰树花发酵培养(温度25 ℃、摇床转速150 r/min)一定时间以后,将灰树花发酵液用纱布过滤后,用蒸馏水反复清洗并尽量挤干菌丝体,得到的湿菌丝体置于60 ℃鼓风干燥箱中干燥至恒重后称量。
1.2.6 HPLC检测条件 色谱柱: Agilent TC-C18(4.6 mm×250 mm,5 μm);流动相:0.1%磷酸水(A)和乙腈(C),以梯度洗脱:0~35 min,C 3%~30%(体积分数);35~40 min,C 30%~100%(体积分数);40~45 min,C 100%~3%(体积分数)。柱温30 ℃,流速1.0 mL/min,进样量20 μL,检测波长221 nm。
1.2.7 试验数据处理及绘图 试验数据利用SPSS 17.0软件统计分析,并采用Origin 9.0和Excel 2010软件作图。
2 结果与讨论
2.1 标准曲线的制作
在波长为595 nm处测量牛血清蛋白标品不同浓度的吸光度,以蛋白质浓度为横坐标, 吸光度值为纵坐标,得到标准曲线见图1,回归方程为y= 8.740 5x+ 0.009 3,R2= 0.999 2。

图1 标准曲线Figure 1 Standard curve
2.2 天麻提取物浓度对灰树花生物量和胞外蛋白的影响
在灰树花深层发酵体系中添加不同浓度的天麻提取物,发酵12 d后生物量和胞外蛋白见图2。由图2可知,随着天麻提取物体积分数的增加,灰树花菌丝体和胞外蛋白的产量也逐渐增高,在体积分数达到7%时,灰树花菌丝体和胞外蛋白的产量达到最大,与对照组(不添加天麻提取物)相比,分别增加了50.65%和13.21%。真核生物细胞中内质网重要的功能是促进蛋白质进行正确的折叠和修饰,此过程需要分子伴侣以及折叠酶的协助,包括:钙连蛋白与钙网蛋白、重链结合蛋白(binding protein,BiP)和蛋白二硫键异构酶(protein disulfide isomerase,PDI)等,这可能是天麻提取物能促进或增强这些蛋白和酶在内质网中的功能[20-22];也可能是天麻提取物在增加基因拷贝数、降低蛋白水解活力及与内源基因融合等促进胞外蛋白分泌的方式中发挥着重要作用[23]。而天麻提取物的体积分数进一步提高时,灰树花菌丝体和胞外蛋白的产量开始下降。因此,初步研究表明,天麻提取液的体积分数为7%(相当于天麻量约为7 g/L)时能够最大程度地促进灰树花菌丝体的生长和胞外蛋白的合成。
2.3 灰树花深层发酵过程中生物量和胞外蛋白的动态变化
图3和图4为对照(不添加天麻提取物)和体积分数7%天麻提取物两个试验组在灰树花深层发酵(13 d)期间生物量和胞外蛋白随发酵天数的动态变化曲线。在此发酵过程中,两组的生物量逐渐增加到最大值后趋于平衡,胞外蛋白量先减少后增加至最大值后趋于平衡。在发酵0~5 d时,两组的生物量较低且相差不大;5~11 d时,生物量开始快速增加;11 d后趋于稳定。这表明从发酵的第5天开始,菌丝体开始大量利用发酵液中的营养物质来促进菌丝体的生长;而且,在深层发酵7 d后,天麻提取物组的生物量显著高于对照组(P<0.05)。

图2 天麻提取物浓度对灰树花生物量和胞外蛋白的影响Figure 2 Effect of the concentrations of Gastrodia elata Bl. extracts on biomass and exocellular protein productions by submerged culture of Grifola frondose

图3 动态分析发酵时间对灰树花生物量的影响Figure 3 Kinetic analysis of the effect of Culture time on biomass of Grifola frondosa
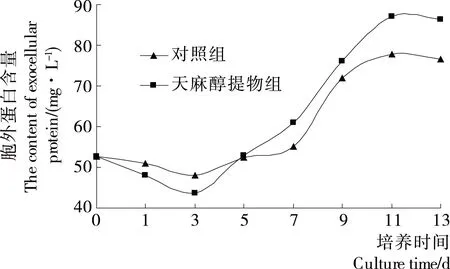
图4 动态分析发酵时间对灰树花胞外蛋白的影响Figure 4 Kinetic analysis of the effect of Culture time on extracellular protein of Grifola frondosa
在发酵0~3 d时,两组的胞外蛋白逐渐降低,表明菌丝体在吸收利用胞外蛋白,而且试验组的吸收速率大于对照组;3~11 d时,胞外蛋白开始快速增加;11 d后趋于稳定。这表明从发酵的第3天开始,菌丝体开始大量分泌胞外蛋白,在深层发酵9 d后,天麻提取物组的胞外蛋白量显著高于对照组(P<0.05)。试验结果表明,灰树花在深层发酵11 d后进入稳定期,此时灰树花生物量及胞外蛋白含量最高。
2.4 天麻提取物主要成分分析
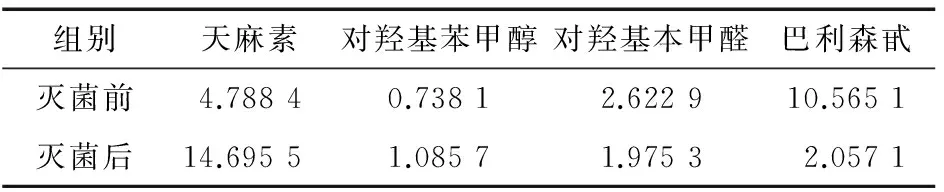
由表1可知,天麻醇提物成分的含量灭菌前后发生了很大的变化。对羟基苯甲醇和对羟基苯甲醛的含量分别增加47.09%和24.69%。天麻素的含量明显增加,而巴利森甙的含量明显降低,可能是巴利森甙在高温高压的条件下分解产生了天麻素[24]64-67。
2.5 天麻醇提物各成分在灰树花发酵前后含量的变化
在探究天麻醇提物对灰树花菌丝体生长和产胞外蛋白的影响的同时,跟踪和检测天麻醇提物各成分在灰树花发酵期间的变化。发酵第0天、第14天及空白组的色谱图见图5。
表1 天麻提取物灭菌前后成分含量的变化
Table 1 Change components content forGastrodiaelataBl. extracts before and after sterilization
mg/g

GA. 天麻素 HA. 对羟基苯甲醇 HBA. 对羟基苯甲醛
parishin. 巴利森甙
图5 发酵第0天、第14天及空白组的色谱图
Figure 5 HPLC chromatogram of the experimental group of 0 d, 14 d and the control group
通过峰面积的比对计算,得到相应成分的含量值,见表2。由表2可知,空白组(未添加天麻成分)没有检测到天麻的任何成分,而试验组在发酵第14天与第0天相比,天麻素含量降低了47.86%;对羟基苯甲醇含量下降了11.84%;对羟基苯甲醛含量下降了74.64%;而巴利森甙含量提高了161.11%。综合4种主要成分的变化情况可以发现,天麻素可能在灰树花生长过程中重新合成了巴利森甙,因为巴利森甙化学结构是由3个天麻素分子和1个柠檬酸分子连接而成[24]64-67;对羟基苯甲醇、对羟基苯甲醛等物质可能作为含碳有机物被灰树花吸收利用,因为微生物生长需要的碳源大多来自含碳有机物,也可能被灰树花自身酶系转化合成为一种新物质。
表2 天麻提取物在灰树花发酵过程中的变化†
Table 2 The changes ofGastrodiaelataBl. extracts inGrifolafrondosafermentation mg/100 mL

† —表示未检出。
3 结论
通过添加适宜体积分数的天麻提取物到灰树花发酵体系中可以显著促进灰树花菌丝体的生长及胞外蛋白的生物合成,确定了天麻提取物浓度为7%(体积分数);动态分析了7%(体积分数)天麻提取物对灰树花生物量和胞外蛋白合成量的影响,灰树花在深层发酵11 d后进入稳定期,此时灰树花生物量及胞外蛋白含量最高,分别达到2.898 g/L和87.152 mg/L;目前,可以从真菌蛋白表达和分泌相关的基因组学及功能基因组学上进行研究,以阐明与蛋白产量相关的分泌和翻译后修饰等机制[25]。利用HPLC对天麻提取物成分进行分析,研究了天麻提取物灭菌前后主要成分(天麻素、对羟基苯甲醇、对羟基苯甲醛及巴利森甙)含量的变化,对羟基苯甲醇和对羟基苯甲醛的含量增加量较低,巴利森甙含量明显减少,天麻素含量明显增加;并研究其促进灰树花生物量和胞外蛋白合成的关键成分在灰树花发酵体系中的含量变化,天麻素、对羟基苯甲醇、对羟基苯甲醛含量均降低,但巴利森甙含量增加了161.11%;可能是这些关键成分作为含碳有机物被灰树花吸收利用了,或者是在灰树花菌体中进行了生物转化,微生物体内往往含有大量的酶类能够将一些底物转化合成为另一种新物质,接下来仍需要对灰树花生物转化天麻成分进行研究,而且中药的转化也是近来研究比较多的一个领域。
[1] 王亚威, 李志峰, 何明珍, 等. 天麻化学成分研究[J]. 中草药, 2013, 44(22): 2 974-2 976.
[2] PYO M K, JIN Jing-ling, KOO Y K, et al. Phenolic and furan type compounds isolated fromGastrodiaelataand their anti-platelet effects[J]. Archives of Pharmacal Research, 2004, 27(4): 381-385.
[3] 马青, 陈石良. 灰树花保健饮料加工工艺的研究[J]. 食品与机械, 2003(3): 22-23.
[4] 孙金旭, 朱会霞, 李书珍. 灰树花真菌发酵条件优化研究[J]. 食品与机械, 2009, 25(6): 131-133, 144.
[5] 王增池, 孔德平, 田晓亮. 灰树花的生态条件与药用价值[J]. 中国食用菌, 1998, 17(6): 40-41.
[6] 张彦, 郭倩. 灰树花菌丝体与子实体的营养功能成分分析[J]. 食品科学, 2002, 23(1): 137-139.
[7] CHANG Hui-hsin, HSIEH K Y, YEH C H, et al. Oral administration of an Enoki mushroom protein FVE activates innate and adaptive immunity and induces anti-tumor activity against murine hepatocellular carcinoma[J]. International Immunopharmacology, 2010, 10 (2): 239-246.
[8] 何海燕, 张丹, 李斌. 真菌提取物抑制烟草花叶病毒(TMV)研究进展[J]. 应用与环境生物学报, 2016,22(1): 167-172.
[9] GU Chang-qing, LI Jun-wen, CHAO Fu-huan, et al. Isolation, identification and function of a novel anti-HSV-1 protein fromGrifolafrondosa[J]. Antiviral Research, 2007, 75(3): 250-257.[10] TSAO Yao-wei, KUAN Yen-chou, WANG Jia-lin, et al. Characterization of a novelMaitake(Grifolafrondosa) protein that activates natural killer and dendritic cells and enhances antitumor immunity in mice[J]. Journal of Agricultural and Food Chemistry, 2013, 61(41): 9 828-9 838.
[11] 陈宁, 吴祖建, 林奇英, 等. 灰树花中一种抗烟草花叶病毒的蛋白质的纯化及其性质[J]. 生物化学与生物物理进展, 2004, 31(3): 283-286.
[12] NANBA H, HAMAGUCHI A, KURODA H. The chemical structure of an antitumor polysaccharide in fruit bodies ofGrifolafrondosa(maitake)[J]. Chemical & Pharmaceutical Bulletin, 1987, 35(3): 1 162-1 168.
[13] 赵亮, 张大为, 吴天祥. 苦荞、天麻对灰树花深层发酵胞外多糖产量的影响[J]. 食品与发酵工业, 2008, 34(4): 115-117.
[14] 贺宗毅, 吴天祥, 徐晓宝. 中药天麻成分对灰树花胞外多糖合成及相关关键酶的影响[J]. 食品科学, 2013, 34(11): 199-202.
[15] WANG Na, WU Tian-xiang, ZHANG Yong, et al. Experimental analysis on the effect of addition ofRhizomagastrodiaeon mycelia and exopolysaccharide productions by submerged culture ofGrifolafrondosa[J]. African Journal of Biotechnology, 2012, 11(20): 4 666-4 672.
[16] XU Xiao-bao, WU Tian-xiang, WANG Feng. The effect of exopolysaccharide biosynthesis and related enzyme activities ofGrifolafrondosaby the addition of ethanol extracts from traditional Chinese medicine,Gastrodiatuber[J]. African Journal of Biotechnology, 2012, 11(15): 3 656-3 662.
[17] ZHONG Yong, WANG Na, WU Tiang-xiang. Effect of the extracts fromGastrodiaelataBL. on mycelial growth and polysaccharide biosynthesis byGrifolafrondosa[J]. African Journal of Microbiology Research, 2012, 6(2): 379-384.
[18] 张勇, 吴天祥. 天麻提取物的制备及其对灰树花发酵的影响[J]. 食品与机械, 2012, 28(1): 150-153.
[19] BRADFORD M M. A Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(7): 248-254.
[20] SALOHEIMO M, PAKULA T M. The cargo and the transport system: secreted proteins and protein secretion in Trichoderma reesei (Hypocrea jecorina) [J]. Microbiology, 2012, 158(1): 46-57.
[21] 钟耀华, 王晓利, 汪天虹. 丝状真菌高效表达异源蛋白研究进展[J]. 生物工程学报, 2008, 24(4): 531-540.
[22] 周娜娜, 王禄山, 公维丽, 等. 丝状真菌胞外蛋白高效分泌机制的研究进展[J]. 生物化学与生物物理进展, 2016, 43(1): 44-54.
[23] 汪天虹. 微生物分子育种原理与技术[M]. 北京:高等教育出版社, 2005: 249-309.
[24] 王莉. 天麻化学物质基础及质量控制方法研究[D]. 大连: 中国科学院, 2007.
[25] NEVALAINEN H, TE'O V, PENTTILM, et al. Heterologous gene expression in filamentous fungi: a holistic view[J]. Applied Mycology and Biotechnology, 2005, 5: 211-237.
Effect of Gastrodia elata Bl. extracts on the biosynthesis of extracellular proteins in the Grifola frondosa under submerged fermentation
HUANG Zhong
WUTian-xiang
YANGZu-tao
ZHUSi-jie
(SchoolofLiquor&FoodEngineering,GuizhouUniversity,Guiyang,Guizhou550025,China)
GastrodiaelataBl. extracts was added into the system ofGrifolafrondosasubmerged fermentation, and then supplement-ation ofGastrodiaelataBl. extracts were optimized according to the biomass and the synthetic quality of extracellular proteins inG.frondosa. The changes of components inG.elataBl. extracts before and after the sterilization, including gastrodin, p-hydroxybenzyl alcohol, p-hydroxybenzaldehyde, and parishin, were analyzed using HPLC. Moreover, the relationship of this changes betweenG.elataBl. extracts and the inG.frondosafermentation system were also investigated. The results revealed that 7% (v/v)G.elataBl. extracts could facilitateG.frondosato grow and produce extracellular proteins, and the content of two experimental indexes reached the maximum 11 days after the submerged fermentation ofG.frondosa. It was found that the content of parishin in the extracts fromG.elataBl. decreased after sterilization, while the content of gastrodin increased obviously. Furthermore, the extracts fromG.elataBl. were added into the system ofG.frondosasubmerged fermentation and then they were incubated for 14 days. Finally, the contents of p-hydroxybenzyl alcohol and p-hydroxybenzaldehyde decreased, nevertheless parishin increased by 161.11%.
GastrodiaelataBl. extracts;Grifolafrondosa; submerged fermentation; extracellular protein; biomass
国家自然科学基金资助项目(编号:[2014]31460537)
黄忠,男,贵州大学在读硕士研究生。
吴天祥(1965—),男,贵州大学教授,博士。 E-mail:txwu@gzu.edu.cn
2016—08—12
10.13652/j.issn.1003-5788.2016.11.006
