Li含量对Li1+x[Ni0.35Mn0.65]O2性能的影响
2016-12-29周春仙廖达前习小明
周春仙,廖达前,郭 忻,习小明
(长沙矿冶研究院有限责任公司,湖南 长沙 410012)
Li含量对Li1+x[Ni0.35Mn0.65]O2性能的影响
周春仙,廖达前,郭 忻,习小明
(长沙矿冶研究院有限责任公司,湖南 长沙 410012)
采用高温固相法合成Li1+x[Ni0.35Mn0.65]O2(x=0.35、0.40、0.45和0.50)富锂锰基正极材料,进行XRD、SEM、电化学阻抗谱(EIS)分析和电化学性能测试。所得材料具有α-NaFeO2层状结构,一次颗粒为类球形,平均粒径约为500 nm,最佳x值为0.45。x=0.45的材料于25 ℃时在2.0~4.8 V充放电,0.05C首次放电比容量和首次循环的库仑效率分别为227.7 mAh/g和71.7%,1.00C最高放电比容量为182.6 mAh/g。EIS测试表明:材料组装的电池的电荷转移阻抗较低。
锂离子电池; 正极材料; Li1+x[Ni0.35Mn0.65]O2; 电化学性能
目前,锂离子电池正极材料的可逆容量仅为负极材料的1/2~1/3,限制了锂离子电池的成本和能量密度。富锂锰基正极材料因具有目前所用正极材料2倍左右的高理论比容量,成为近年来锂离子电池正极材料的研究热点[1-2]。根据锂离子电池的工作原理,Li+在材料结构中的迁移实现充放电,因此,材料中Li+的含量将直接影响充放电容量,并决定材料的性能。
本文作者采用高温固相法合成Li1+x[Ni0.35Mn0.65]O2(x=0.35、0.40、0.45和0.50),以克服液相合成法周期长、可控性差等缺点,并重点讨论合成过程中的Li含量对材料结构、形貌及电化学性能的影响。
1 实验
1.1 材料的制备
将Ni0.35Mn0.65(OH)2(湖南产,电池级)前驱体与Li2CO3(江苏产,电池级)按化学计量比混匀,得到烧前中间材料。将烧前中间材料在马弗炉中、1 000 ℃下烧结12 h,即得到Li1+x[Ni0.35Mn0.65]O2(x=0.35、0.40、0.45和0.50)材料。
1.2 电池的组装
将制得的Li1+x[Ni0.35Mn0.65]O2材料、导电乙炔黑(上海产,电池级)和粘结剂聚偏氟乙烯(上海产,电池级)按质量比90∶5∶5混合,与适量N-甲基吡咯烷酮(河南产,电池级)搅拌均匀,涂覆在17 μm厚的铝箔(上海产,电池级)上,在90 ℃下鼓风干燥2 h,制得正极片。将正极片冲成直径为14 mm的圆片(含13.32 mg活性物质),以金属锂片(上海产,电池级)为对电极,Celgard 2400膜(日本产)为隔膜,1 mol/L LiFP6/EC+DMC+EMC(体积比1∶1∶1,北京产,99.9%)为电解液,在充满氩气的手套箱内组装CR2016扣式电池。
1.3 材料分析与性能测试
用D8-Aduonee型X射线粉末衍射仪(德国产)对材料进行物相分析,CuKα,管压40 kV、管流100 mA,步宽为0.02 °,扫描速度为8 (°)/min;用JSM-5600LV场发射扫描电子显微镜(日本产)分析材料的形貌。
用TAS-990super型原子吸收分光光度计(北京产)通过原子吸收光谱法[3]测定Li元素含量;用丁二酮肟重量法[4]测定Ni元素含量;用化学滴定法[5]测定Mn元素含量。将材料按固液质量比1∶10在去离子水中搅拌20 min,过滤后,用PHS-3C型酸度计(上海产)测试上层清液的pH值。
用CT2001A型电池测试系统(武汉产)进行电化学性能测试,电压为2.0~4.8 V,电流为0.05~1.00C,1.00C=250 mA。用PMC电化学工作站(美国产)在100 kHz~5 mHz范围内对电池进行电化学阻抗谱(EIS)测试。
2 结果与讨论
2.1 Li含量对材料结构的影响
图1为Li1+x[Ni0.35Mn0.65]O2的XRD图。

图1 Li1+x[Ni0.35Mn0.65]O2的XRD图
Fig.1 XRD patterns of Li1+x[Ni0.35Mn0.65]O2
从图1可知,各材料除了在20 °~25 °的衍射峰外,其他衍射峰的强度和位置均与层状六方α-NaFeO2(PDF卡号:82-1495)的标准衍射峰对应,而20 °~25 °的衍射峰为过渡金属层Li和Mn元素超晶格有序所致,证实了Li2MnO3相的存在。此外,没有其他明显的杂相峰,表明固相法可合成纯相富锂锰基材料。20 °~25 °的衍射峰随着Li含量的增加逐渐变弱,并趋于稳定,说明Li含量会影响富锂材料中Li2MnO3和Li2MO2两相的比例。六方结构材料(006)和(102)、(108)和(110)晶面衍射峰分离,代表有序的层状结构[6]。图1中,随着x的增加,材料(108)和(110)峰的劈裂度增加,峰分离变明显,但当x=0.50时,(108)和(110)的劈裂度又减小,表明当x≤0.45时,Li+量的增加更有利于材料的层状有序性,但过多的Li+会进入晶格间,占据Ni2+位,引发Li+/Ni2+混排,影响材料有序性,且Li+含量越高,混排趋势越明显。
Li1+x[Ni0.35Mn0.65]O2的晶胞参数和峰强度比见表1。
表1 Li1+x[Ni0.35Mn0.65]O2的晶胞参数和峰强度比
Table 1 Crystal lattice parameters and peak intensity ratio of Li1+x[Ni0.35Mn0.65]O2
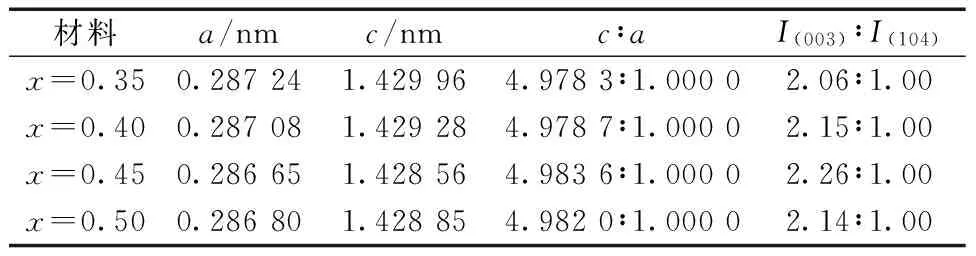
材料a/nmc/nmc∶aI(003)∶I(104)x=0.350.287241.429964.9783∶1.00002.06∶1.00x=0.400.287081.429284.9787∶1.00002.15∶1.00x=0.450.286651.428564.9836∶1.00002.26∶1.00x=0.500.286801.428854.9820∶1.00002.14∶1.00
从表1可知,所有材料的(003)峰强度I(003)与(104)峰强度I(104)的比值I(003)/I(104)都超过了1.2,说明材料有序性良好[7],c/a与材料六方层状结构存在对应关系,该值越高,说明材料的六方层状有序性越好。随着x值的增加,材料的c/a和I(003)/I(104)先增大、后减小,说明层状有序性随着x值的增加先增强、后减弱,与材料(108)和(110)峰劈裂度的变化趋势一致。材料层状有序性降低,主要是由于Li+增加时,进入Ni2+位的几率增大,从而影响材料的二维传输通道,降低Li+在晶格中的迁移能力,进而影响材料的电化学性能。
2.2 Li含量对材料电荷转移阻抗的影响
对电池进行电化学阻抗测试,经过Zview软件拟合的Nyquist曲线见图2,所采用的等效电路图见图3。
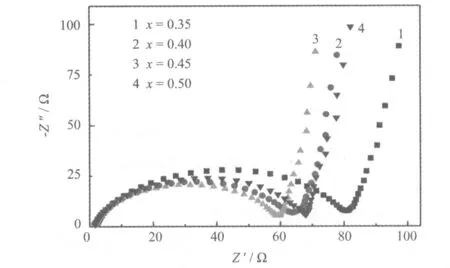
图2 Li1+x[Ni0.35Mn0.65]O2的Nyquist曲线

图3 拟合所用的等效电路图
Nyquist曲线包括高频率范围内的半圆和低频率范围内的直线。半圆对应电荷转移阻抗(Rct),反映Li+通过材料表面的迁移,即等效电路对应的Rct;直线反映Li+在材料内部的迁移状况。从图2可知,x=0.35、0.40、0.45和0.50时,材料所组装成电池的Rct分别为80.75 Ω、63.72 Ω、59.20 Ω和68.20 Ω,x=0.45的材料所组装电池的Rct最小。
2.3 Li含量对材料电性能的影响
Li1+x[Ni0.35Mn0.65]O2的首次充放电曲线及倍率性能曲线见图4,首次充放电比容量、库仑效率及1.00C放电比容量列于表2。
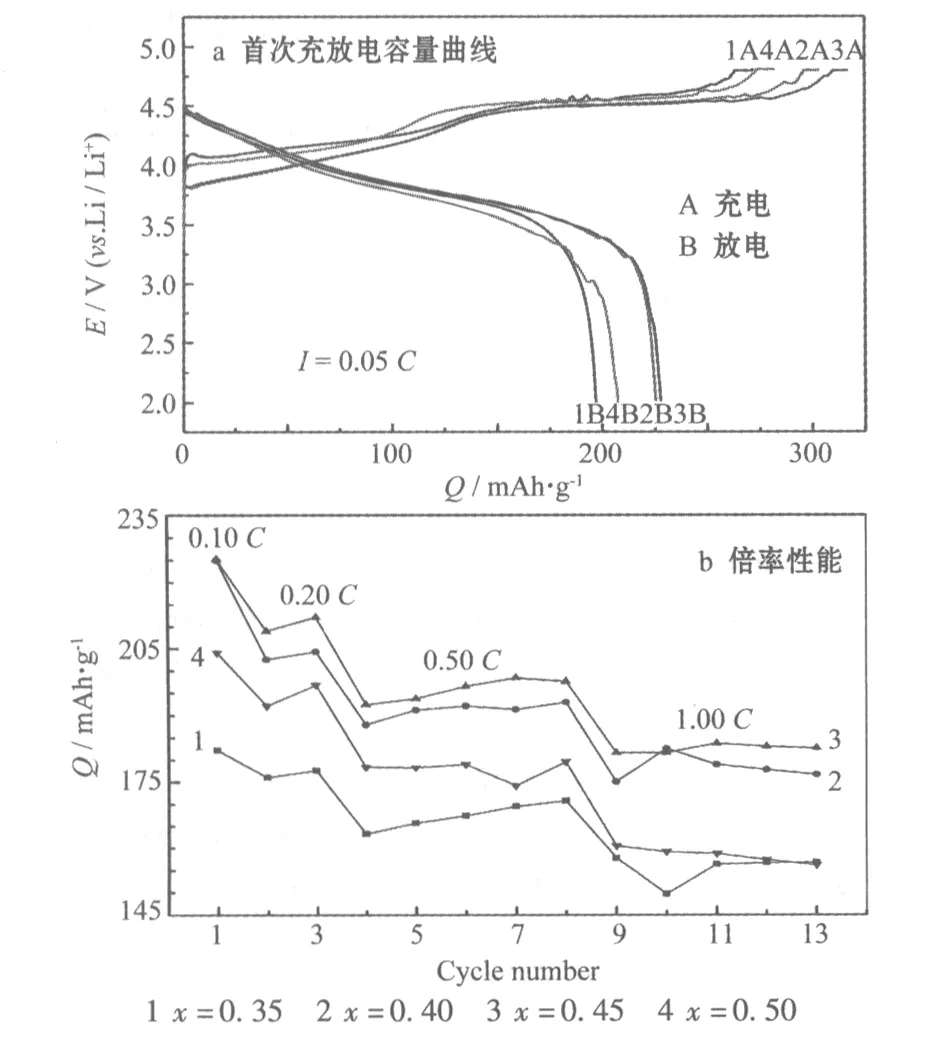
1 x=0.35 2 x=0.40 3 x=0.45 4 x=0.50
Fig.4 Initial charge-discharge curves and rate capability of Li1+x[Ni0.35Mn0.65]O2
表2 Li1+x[Ni0.35Mn0.65]O2的首次充放电比容量、库仑效率及1.00C放电比容量
Table 2 Initial charge and discharge specific capacity,coulombic efficiency and 1.00Cspecific discharge capacity of Li1+x[Ni0.35Mn0.65]O2
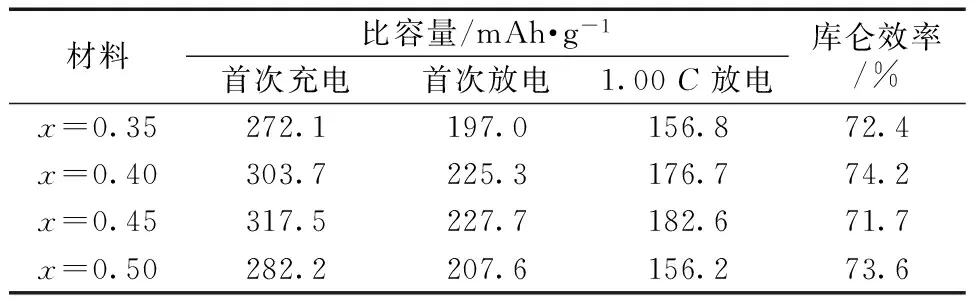
材料比容量/mAh·g-1首次充电首次放电1.00C放电库仑效率/%x=0.35272.1197.0156.872.4x=0.40303.7225.3176.774.2x=0.45317.5227.7182.671.7x=0.50282.2207.6156.273.6
从图4a可知,Li1+x[Ni0.35Mn0.65]O2材料的充放电曲线均出现了富锂材料的充放电曲线的特征,整个充电曲线均由一斜坡区和一个长的4.5 V特征平台组成[8],其中斜坡区由Li层中的Li+脱出导致,在此过程中,Ni2+被氧化成Ni4+。4.5 V平台是由晶格中锂和氧的缺失所致[9],在此过程中,Li2MnO3脱锂形成电化学活性的MnO2,带来该材料随后循环过程中的高容量。随着x的增加,充放电曲线的极化先减小、再增大。当x=0.40和0.45时,材料的放电比容量较接近,x=0.45的材料,放电比容量略高约2 mAh/g,且充电比容量较高,但首次循环的库仑效率略低。当x=0.50时,材料的放电比容量降低,曲线的极化也增大。从图4b可知,材料倍率放电性能随x变化的规律与首次充放电曲线一致。
综上所述,当x=0.40和0.45时,材料的电化学性能相对较好。当x=0.45时,材料的0.05C首次充、放电比容量分别为317.5 mAh/g和227.7 mAh/g。结合XRD及电化学阻抗分析可推测,x=0.50的材料比容量下降的原因是:Li+过量导致Li/Ni混排加剧,影响了材料的层状有序结构。
2.4 Li含量对材料形貌的影响
图5为Li1+x[Ni0.35Mn0.65]O2的SEM图。

图5 Li1+x[Ni0.35Mn0.65]O2的SEM图
Fig.5 SEM photographs of Li1+x[Ni0.35Mn0.65]O2
从图5可知,材料的一次颗粒形貌相似,为类球形,颗粒分明,紧密堆积成二次颗粒。随着x的增加,材料形貌变化趋势不明显,相对于x=0.35的材料,x=0.50材料的颗粒稍大,一次颗粒间晶界更分明。
2.5 Li含量对材料物化指标的影响
Li1+x[Ni0.35Mn0.65]O2目标产物的化学式和实际检测计算所得化学式,以及可溶Li+含量和水溶液pH数据见表3。

表3 Li1+x[Ni0.35Mn0.65]O2的化学式、可溶Li+含量和水溶液pH值
从表3可知,不同x的材料,均有一定的Li损失,主要是由高温烧结过程中Li挥发所致。理论x=0.35、0.40、0.45和0.50的材料,实测x分别为0.25、0.30、0.32和0.37,当理论x=0.40和0.45时,材料中残余的Li量较接近,二者的可溶Li+量也最接近。当理论x=0.50时,实测x=0.37,同时,材料的可溶Li+浓度为53.41 mg/L,说明Li的残余量随着x的增加而增加。材料水溶液的pH值与可溶Li+量呈正相关,也受测试环境的影响。随着x的增加,材料可溶Li+升高,水溶液的pH呈上升的趋势。实验时发现,受测试过程温度、湿度及空气中CO2的影响,测试结果略有偏差。
3 结论
以Ni0.35Mn0.65(OH)2前驱体和Li2CO3为原料,采用高温固相法合成Li1+x[Ni0.35Mn0.65]O2材料。配料过程中Li的加入量,对最终材料的形貌、结构及电化学性能有影响:随着x的增加,材料一次颗粒呈长大的趋势;材料结构的层状有序性先增强、后减弱;电荷转移阻抗先增大、后减小;同时,可溶锂的量增加。
综合材料的结构、形貌、电化学阻抗和物化指标,当x=0.45时最佳。最佳材料制备的CR2016型扣式电池在2.0~4.8 V充放电,以0.05C首次始放电比容量为227.7 mAh/g,首次效率为71.7%,1.00C最高放电比容量为182.6 mAh/g;材料组装成电池的电荷转移阻抗最小,为59.20 Ω。
[1] ZHANG Kai-qing(张凯庆),LING Ze(凌泽),WANG Li-zhen(王力臻). 高电压锂离子电池正极材料的研究进展[J]. Battery Bimonthly(电池),2013,43(4):235-238.
[2] ZHAO Yu-juan(赵煜娟),YUE Ying-ying(岳影影),SUN Yu-cheng(孙玉成),etal. 纳米材料Li1.2Ni0.2Mn0.6O2的合成与性能研究[J]. Battery Bimonthly(电池),2014,44(4):198-201.
[3] ZHANG Yang-zu(张扬祖). 原子吸收光谱分析技术应用基础[M]. Shanghai(上海):Press of East China university of Science and Technology(华东理工大学出版社),2007.
[4] WANG Li(王丽),YI Hua(易华). 丁二酮肟重量法对泵轴中镍含量的测定[J]. Chemical Engineer(化学工程师),2005,19(9):44-44.
[5] WU Yi-gen(伍一根),TONG Yan(童岩),HE Chang-rong(何长荣). 化学滴定法测定三元材料中镍、钴、锰[J]. Dianyuan Jishu(电源技术),2012,36(11):1 637-1 639.
[6] MAROM R,AMALRAJ S F,LEIFER N,etal. A review of advanced and practical lithium battery materials[J]. J Mater Chem,2011,21:9 938-9 954.
[7] KANG S H,KEMPGENS P,GREENBAUM S,etal. Interpreting the structural and electrochemical complexity of 0.5Li2MnO3·0.5LiMO2electrodes for lithium batteries(M=Mn0.5-xNi0.5-xCo2x,0≤x≤0.5)[J]. J Mater Chem,2007,17(20):2 069-2 077.
[8] VAN BOMMEL A,DAHN J R. Kinetics study of the high potential range of lithium-rich transition-metal oxides for lithium-ion batteries by electrochemical methods[J]. Electrochem Solid-State Lett,2010,13(5):A62-A64.
[9] JIANG M,KEY B,MENG Y S,etal. Electrochemical and struc-tural study of the layered ‘Li-excess’ lithium-ion battery electrode material Li[Li1/9Ni1/3Mn5/9]O2[J]. Chem Mater,2009,21(13):2 733-2 745.
Effects of lithium content on the performance of Li1+x[Ni0.35Mn0.65]O2
ZHOU Chun-xian,LIAO Da-qian,GUO Xin,XI Xiao-ming
(ChangshaResearchInstituteofMiningandMetallurgyCo.,Ltd.,Changsha,Hunan410012,China)
Lithium riched manganese based cathode materials Li1+x[Ni0.35Mn0.65]O2(x=0.35,0.40,0.45 and 0.50) were synthesized by high temperature solid state method. XRD,SEM,electrochemical impedance spectroscopy(EIS)analyses and electrochemical performance test were taken. The structure of obtained material was α-NaFeO2. The morphology of the primary particle with a average size about 500 nm was spherical,the optimalxvalue was 0.45. When material of optimalxvalue with 0.45 was assembled into coin cells and tested with 0.05Cin 2.0~4.8V,the initial specific discharge capacity was 227.7 mAh/g and the coulombic efficiency in initial cycle was 71.7%.When discharged at 1.00C,the highest specific discharge capacity was 182.6 mAh/g. Low charge transfer resistance of the cell assembled with optimal material was obtained when EIS was tested.
Li-ion battery; cathode material; Li1+x[Ni0.35Mn0.65]O2; electrochemical performance
周春仙(1980-),女,湖南人,长沙矿冶研究院有限责任公司高级工程师,研究方向:新能源材料与器件,本文联系人;
国家科技部转制科研院所创新能力专项经费(2014EG113173)
TM912.9
A
1001-1579(2016)05-0263-04
2016-02-28
廖达前(1976-),男,湖南人,长沙矿冶研究院有限责任公司高级工程师,研究方向:锂离子电池正极材料;
郭 忻(1987-),女,湖南人,长沙矿冶研究院有限责任公司工程师,研究方向:锂离子电池正极材料;
习小明(1962-),男,江西人,长沙矿冶研究院有限责任公司教授级高级工程师,研究方向:新能源材料与器件。
