脐带间充质干细胞对胶质瘤细胞转移侵袭能力影响初探
2016-12-29刘高米洋刘菊芬阮光萍李自安潘兴华
刘高米洋,朱 慧,何 洁,刘菊芬,阮光萍,李自安,潘兴华
脐带间充质干细胞对胶质瘤细胞转移侵袭能力影响初探
刘高米洋,朱 慧,何 洁,刘菊芬,阮光萍,李自安,潘兴华
目的观察人源脐带间充质干细胞(HUCMSC)对胶质瘤细胞株U87转移、侵袭能力的影响。方法建立细胞共培养体系,CCK8法、transwell法和Matrigel法分别检测 HUCMSC与U87非接触共培养后,U87增殖、转移、侵袭能力变化。结果体外细胞共培养体系中,HUCMSC共培养U87组(实验组)比U87单独培养组(对照组)转移和侵袭能力都有显著提高(P<0.05),HUCMSC共培养对U87有促增殖作用。结论在体外共培养体系中,HUCMSC可能通过促进EMT转化而提高胶质瘤细胞株U87增殖、转移和侵袭潜能。因此,在HUCMSC的临床转化应用中,应该考虑其可能的促肿瘤作用。
脐带;间充质干细胞;胶质瘤;转移;侵袭
由于脐带间充质干细胞的免疫原性较低、易取材、容易扩增等优点,被认为是一种潜在的组织修复、抗衰老的新型生物治疗手段。近年研究发现,间充质干细胞能够定向迁移到某些特定的肿瘤部位,一部分研究显示,间充质干细胞能够促进肿瘤的发生发展,但也有学者报道,迁移到肿瘤部位的间充质干细胞有抑制肿瘤生长的作用。本实验以恶性程度较高的胶质瘤细胞株U87为研究对象,旨在研究脐带间充质干细胞对U87细胞的生物学行为的影响及其可能机制,为脐带干细胞的临床转化应用提供资料,进一步明确脐带干细胞应用的安全性和适用性。
1 材料与方法
1.1 主要试剂与器材 DMEM/F12培养基 (美国Hyclone公司),胎牛血清(美国BI公司),双抗(美国BI公司),Trizol(美国Invitrigen公司),GoTag qPCR Master Mix(美国Promega公司),Anti-Ki67 antibody、Anti-E-cadherin antibody、Anti-N-cadherin antibody、anti-GAPDH antibody(美国abcam公司),兔抗鼠IgG H&L(HRP),羊抗兔IgG H&L(HRP),qPCR引物由Thermo公司设计合成;百万层级层流超净工作台(SW-CL-2F型,苏州佳宝净化工程设备有限公司),细胞培养37℃、CO2孵箱(美国Thermo公司),电泳槽(Bio-rad公司),Matrigel Invasion Chamber(BD公司),Transwell Chamber(美国Costar公司)。
1.2 细胞株和实验动物 U87细胞株购于中科院昆明动物所,人源脐带间充质干细胞(HUCMSC)来自本实验室分离培养的剖腹产脐带3~5代间充质干细胞。
1.3 人脐带间充质干细胞分离和培养 在产妇及其家属知情同意下,取本院足月剖腹产新生儿脐带,经检测产妇无传染性疾病,胎儿无先天性疾病和畸形。无菌条件下,将采集的脐带用生理盐水反复冲洗,去掉残留血液。将脐带剪碎后转移到培养瓶中,用含20%FBS的DMEM/F12培养基培养,次日补液,3 d后换液,7 d后观察细胞生长状态,达到80%融合后传代培养。
1.4 增殖能力检测 消化对数生长期U87细胞,计数后将细胞悬液贴壁轻柔加入96孔板中,实验组采用50%MSC培养上清加50%DMEM/F12完全培养基,对照组采用DMEM/F12完全培养基。6 h后为检测起始点,此后每隔24 h检测1次。CCK8法记录细胞生长曲线。
1.5 转移侵袭能力检测 Transwell实验:消化第5代对数生长期HUCMSC,在24孔板中分别种入0、1.0×104、2.0×104、3.0×104个 HUCMSC;12 h后在8 μm Transwell Chamber中种入无血清培养的1.5× 104个U87细胞,将小室轻轻放入已种入HUCMSC的24孔板中。24 h后取出小室风干片刻,4%甲醛固定30 min,去除甲醛,结晶紫染色30 min。拍照计数细胞。
Matrigel实验:消化第5代对数生长期HUCMSC,计数细胞密度,在24孔板中分别种入0、1.0×104、2.0× 104、3.0×104个 HUCMSC,无血清培养;12 h后在8 μm Matrigel Chamber中种入无血清培养的1.5× 104个U87细胞,将小室轻轻放入已种入HUCMSC的24孔板中。24 h后4%甲醛固定30 min,去除甲醛,结晶紫染色30 min。拍照计数细胞。
1.6 统计学方法 应用Graphpad统计软件进行统计学分析,计量资料以均数±标准差表示,组间比较采用独立样本t检验,组内比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 HUCMSC的分离培养 将新鲜脐带剪碎后,采用无酶直接贴壁法将组织块直接放入培养瓶中,采用20%FBS的DMEM/F12培养基培养,待长满传代后,换用10%FBS的DMEM/F12培养基培养,大约次日即可看见少许细胞贴壁(图1a),约3 d后可见细胞爬出(图1b),传代后的细胞转移时呈纤维样(图1c),稠密呈漩涡状生长(图1d)。

图1 脐带间充质干细胞的生长形态
2.2 HUCMSC培养上清对U87增值能力的影响CCK8法检测各组细胞增殖能力,结果提示,实验组较对照组有更强的增殖能力(P<0.05,图2)。
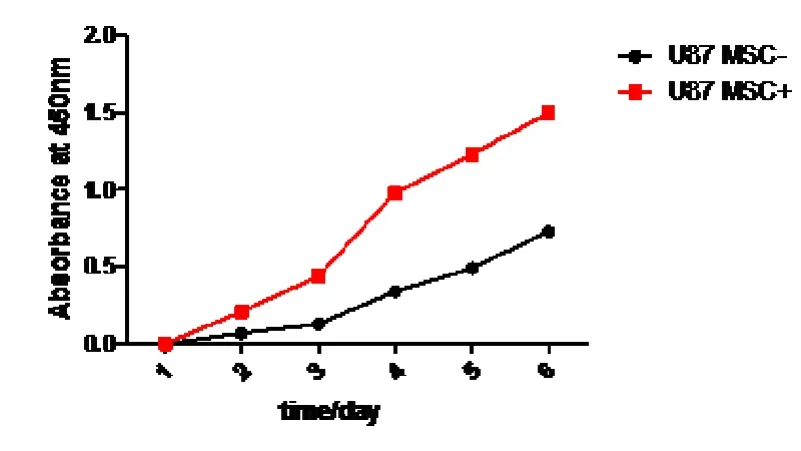
图2 CCK8实验检测HUCMSC对U87细胞增殖能力的影响
2.3 非接触共培养HUCMSC对U87转移侵袭能力的影响 穿梭实验检测U87在HUCMSC非接触共培养条件下显示,随共培养HUCMSC数目增加,U87转移能力递增(图3)。显微镜下计数穿过小室的细胞进行统计学分析,结果显示有显著差异(P<0.05)。侵袭实验检测U87在HUCMSC非接触式共培养条件下其侵袭能力的变化,见图4,共培养组较对照组显示出较强的侵袭能力(P<0.05)。

图3 Transwell实验检测非接触共培养下MSC对U87细胞转移能力的影响

图4 Matrigels实验检测非接触共培养下MSC对U87细胞侵袭能力的影响
3 讨论
间充质干细胞具有免疫调控、造血支持、连续传代和冻存后仍有自我修复和多向分化潜能等特点,在特定条件下,可分化为多种组织细胞,可作为种子细胞用于组织器官损伤修复和抗衰老[1]。HUCMSCs较其他来源间充质干细胞有增殖能力强、取材方便的优势,因此,其临床转化应用前景广泛,但安全性是间充质干细胞临床转化应用前必须明确的重要问题。近年研究发现,间充质干细胞能特异的向肿瘤部位迁移;部分研究显示,迁移到肿瘤部位的间充质干细胞能促进肿瘤的生长[2];而另一部分研究显示,迁移到肿瘤部位的间充质干细胞能抑制肿瘤的生长[3-5]。
胶质瘤是一种最为常见的原发性脑肿瘤,同时也是一个全球性重大疾病问题,在美国每年有超过12 000人罹患胶质瘤[6]。恶性胶质瘤患者预后较差,半数生存时间为15个月[7],手术和放化疗治疗效果都不理想,患者复发率极高。有文献报道,间充质干细胞能够向肿瘤部位迁移,这为肿瘤治疗提供了一种理想的药物载体[8]。本课题拟选用临床上最常见的脑部肿瘤胶质瘤为切入点,选择胶质瘤细胞系U87为研究对象,试图探究脐带间充质干细胞对胶质瘤细胞U87的增殖、转移和侵袭能力的影响。
本研究采用CCK8法检测了HUCMSC培养上清对U87的增殖能力的影响,结果提示,HUCMSC培养上清能够促进U87增殖;非接触式培养,提示HUCMSC可能促进U87细胞的增殖。这些结果提示,HUCMSC对肿瘤细胞增殖能力的影响不可一概而论,需要进一步明确其促增殖的作用机制。
EMT转化是肿瘤发生转移的重要理论之一,目前研究表明,肿瘤转移复发不一定需要发生EMT转化,但发生EMT转化的肿瘤细胞转移侵袭能力更强[9]。本研究中Transwell和Matrigel实验结果提示,非接触培养条件下,HUCMSC能够明显促进U87细胞的转移和侵袭能力,并且随着共培养的HUCMSC数量越多,其促转移侵袭作用越明显,提示HUCMSC可能通过分泌某些成分促进U87细胞的转移和侵袭能力。还有研究发现,间充质干细胞能够分泌一种直径为20~100 nm的分泌小泡,又称外泌体 (exosome),外泌体中包含miRNA、lncRNA和多种细胞生长因子[10]。间充质干细胞可能通过分泌外泌体释放相关蛋白,促进U87的转移侵袭能力,但需要进一步验证。
综上所述,HUCMSC作为一种潜在肿瘤药物载体,其与肿瘤尤其是难治性肿瘤的相互影响是其临床前应用的需要解决的基本问题。本研究结果表明,HUCMSC在非接触式培养方式下,能促进U87细胞增殖、转移和侵袭能力,但具体机制不甚明确,需进一步探求。
[1] Kalwitz G1,Endres M,Neumann K,et al.Gene expression profile of adult human bone marrow-derived mesenchymal stem cells stimulated by the chemokine CXCL7[J].Int J Biochem Cell Biol,2009,1(3):649-658.
[2] Karnoub AE,Dash AB,Vo AP,et al.Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J]. Nature,2007,449:557-563.
[3] Khakoo AY,Pati S,Anderson SA,et al.Human mesenchymal stem cells exert potent antitumorigenic effects in a model of Kaposi's sarcoma[J].J Exp Med,2006,203:1235-1247.
[4] Qiao L,Xu Z,Zhao T,et al.Suppression of tumorigenesis by human mesenchymal stem cells in a hepatoma model[J].Cell Res, 2008,18:500-507.
[5] Zhu Y,Sun Z,Han Q,et al.Human mesenchymal stem cells inhibit cancer cell proliferation by secreting DKK-1[J].Leukemia, 2009,23:925-933.
[6] Kleihues P,Cavenee WK.Pathology and genetics of tumours of the nervous system[J].Lyon:International Agency for Research on Cancer,2000,84(1):148.
[7] Panditharatna E,Yaeger K.Clinicopathology of diffuse intrinsic pontine glioma and its redefined genomic and epigenomic landscape[J].Cancer Genet,2015,208(7-8):367-373.
[8] Karnoub AE,Dash AB,Vo AP,et al.Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J].Nature, 2007,449(7162):557-563.
[9] Zhao Peng,Chen-Xiao Wang,Er-Hu Fang,et al.Role of epithelial-mesenchymal transition in gastric cancer initiation and progression[J].World J Gastroenterology,2014,20(18):5403-5410. [10] Tang MK,Wong AS.Exosomes:emerging biomarkers and targets for ovarian cancer[J].Cancer Lett,2015,367(1):26-33.
Preliminary study on impacts of UC-MSCs on metastasis and invasion of GCs
Liugao Miyang,Zhu Hui,He Jie,Liu Jufen,Ruan Guangping,Li Zi'an,Pan Xinghua Cell Biological Therapy Center,Kunming General Hospital of Chengdu Military Command,Kunming,Yunnan,650032,China;National Joint Engineering Laboratory of Stem Cells and Immune Cells and Biological Medicine Technology,Kunming,Yunnan,650032,China;Key Laboratory of Cell Therapy Technology and Translational Medicine of Yunnan Province,Kunming,Yunnan,650032,China;Yunnan Stem Cell Engineering Laboratory,Kunming, Yunnan,650032,China;Key Laboratory of Stem Cell and Regenerative Medicine of Kunming,Kunming,Yunnan,650032,China
Objective To observe the impacts of human umbilical cord mesenchymal stem cells(HUC-MSCs)on the metastasis and invasion of glioma cell(GC)line U87.MethodsA cell co-culture system was established.The changes in the proliferation, metastasis and invasion of U87 after the non-contact co-culture with HUC-MSCs were detected by CCK8 method,transwell method and Matrigel method.ResultsThe metastasis and invasion of U87 co-cultured with HUC-MSCs(in the experiment group)were much better than those of U87 separately cultured (the control group).ConclusionIn the co-culture system in vitro,HUC-MSCs may improve the proliferation,metastasis and invasion of glioma cell line U87 by promoting EMT transformation.Therefore,the potential tumor promoting effects of HUC-MSCs should be considered in the clinical transformation application.
HUC;MSC;glioma;metastasis;invasion
R 318.1
A
1004-0188(2016)12-1398-03
10.3969/j.issn.1004-0188.2016.12.013
2016-06-28)
国家科技支撑计划项目(2014BI01B0);国家973计划项目(2012CB5181060);云南省科技计划重点项目(2013CA005)
650032昆明,成都军区昆明总医院细胞生物治疗中心,干细胞与免疫细胞生物医药技术国家地方联合工程实验室,云南省细胞治疗技术转化医学重点实验室,云南省干细胞工程实验室,昆明市干细胞与再生医学研究重点实验室
潘兴华,E-mail:xinghuapan@aliyun.com
