Notch1基因沉默抑制骨髓源性脂肪祖细胞向成熟脂肪细胞分化
2016-12-29王金祥王小华白盈盈蔡学敏刘菊芬李自安余争平朱光旭潘兴华
王金祥,王小华,白盈盈,周 芳,蔡学敏,刘菊芬,李自安,余争平,朱光旭,潘兴华
Notch1基因沉默抑制骨髓源性脂肪祖细胞向成熟脂肪细胞分化
王金祥,王小华,白盈盈,周 芳,蔡学敏,刘菊芬,李自安,余争平,朱光旭,潘兴华
目的探讨Notch1对骨髓源性脂肪祖细胞(BMAPCs)向脂肪细胞分化的影响。方法无菌取SD大鼠股、胫骨骨髓制作细胞悬液,差速贴壁法培养,流式分析检测细胞表面标志表达;实时荧光定量聚合酶链式反应(real-time qPCR)检测脂肪相关基因和Notch信号分子表达。Notch1基因沉默实验分为空载体组和Notch1小RNA干扰组。Western blotting检测干扰效率;STEMPROAdipogenesis Differentiation Kit行细胞成脂诱导。结果BMAPCs表达CD34、CD44、CD45及CD90,且表达6种脂肪相关基因及Notch信号分子;成脂诱导促进Notch1 mRNA表达(P<0.01);Notch1小RNA干扰抑制Notch1蛋白表达(P<0.05)。Notch1小RNA干扰组的Cebpa、Lpl和Ppaγ、Slc2a4与Fabp4 mRNA表达均较对照显著降低,而pread1 mRNA表达显著增加(P<0.05~P<0.01);Notch小RNA干扰显著抑制脂肪细胞百分率(P<0.05)。结论Notch1基因沉默抑制BMAPCs向成熟脂肪细胞分化。
骨髓源性脂肪祖细胞;造血干细胞;间充质干细胞;Notch1
最近本室从骨髓培养出一类细胞,该细胞有一定成骨分化和较强的成脂肪分化能力,表达造血干细胞 (hematopietic stem cells,HSCs)主要标志CD34,也高表达脂肪相关基因,可高效分化为脂肪细胞,我们认为可定义为脂肪祖细胞 (bone marrow adipocyte progenitor cells,BMAPCs)。关于Notch信号在干/祖细胞向脂肪细胞分化中的作用已有部分文献报道,但是呈现一些比较矛盾的结论。文献报道Notch1活化促进脂肪源性干细胞(adipose-derived mesenchymal stem cells,ADSCs)分化为脂肪细胞[1],但是另有研究发现Notch信号活化会抑制ADSCs向脂肪细胞分化[2]。本实验旨在探讨Notch1在BMAPCs向脂肪细胞分化中的调控作用。
1 材料与方法
1.1 主要材料 1~2月龄健康雄性SD大鼠,由昆明医科大学实验动物中心提供,动物生产许可证号为SCXK(滇)2011-0004,使用许可证号为SYXK(滇)K2013-0011,均喂养于环境适中,饮食良好的环境。优质胎牛血清(FBS,PAA公司),STEMPROAdipogenesis Differentiation Kit(Gibco),内皮基础培养基-2(EBM-2,Lonza),内皮生长因子添加剂(ECGs, Millipore),GoScript反转录系统、GoTaqqPCRMaster MiX(Progema公司),荧光标记CD34(Abcam),CD45、CD44、CD90抗体 (Ebioscience),Notch 1 siRNA及siRNA Reagent System (Santa Cruz),PCR引物由奥科鼎盛生物有限公司合成。
1.2 BMAPC体外培养 PBS冲洗SD大鼠股、胫骨骨髓,将悬液转移到离心管,静置8~10 min后转移到另一离心管,离心弃上清,以EBM-2(含20% FBS、15 μg/ml ECGs及青、链霉素各100 U/ml)培养基吹打混匀,以1×107/cm2接种于培养瓶,37℃、5% CO2条件培养,连续两次进行细胞悬液转移培养;对第三次贴壁细胞进行培养,每4 d换液一次,待细胞铺满瓶底约80%~90%后,进行传代,取P3~P5细胞用于流式分析及相关实验。
1.3 实时荧光定量聚合酶链式反应检测基因表达
按照GoScript反转录系统试剂说明,将实验细胞分为BMAPC组、空载体组和Notch1小RNA干扰组,提取mRNA并进行反转录,获得cDNA,所获得的cDNA用GoTaqqPCRMaster MiX,按照操作说明进行实时定量PCR测定。取PCR产物进行电泳,Gel Doc 2000图像扫描仪分析。引物序列见表1。
1.4 基因转染 取培养的P4代细胞,待细胞长至约90%融合,参照RNA干扰说明书行基因转染,18 h后去除转染试剂,换上含正常EBM-2培养基培养72 h后,Western blotting检测RNA干扰效率。
1.5 Western blotting检测蛋白表达 取Notch1干预的细胞,用PBS洗涤,PMSF裂解,将裂解液移至离心管,离心收集上清,蛋白定量、上样,SDSPAGE电泳后电转至PVDF膜室温封闭,加入抗大鼠GAPDH抗体(1∶800)、Notch1(1∶600),4℃孵育过夜,再与HRP标记的兔抗羊IgG、抗鼠IgG 37℃孵育1 h,显色后用凝胶成像系统扫描,半定量分析显影带,目的蛋白量以GAPDH相对量表示。
1.6 成脂诱导分化 基因转染48 h后加入新培养液,24 h后弃培养液,加入成脂肪分化诱导液培养,每隔3 d换液,诱导14 d后,用4%多聚甲醛固定后加入油红O进行染色。DAPI标记细胞核,计算脂肪细胞百分率,计算公式为:脂肪细胞百分率=油红O染色阳性细胞数÷细胞总数×100%。

表1 实时定量聚合酶链式反应引物
1.7 统计学方法 计量资料以Mean±SD表示,应用SPSS10.0统计软件包进行组间单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 BMAPCs的生长特征 第三次贴壁细胞培养至第3 d,少部分细胞变为梭形(图1A),至第5 d,大部分细胞形态均变为梭形或长三角状(图1B),至第10 d,细胞呈融合生长状态(图1D)。除P0~P2外,P3~P7细胞形态未见明显变化。培养细胞表达脂肪相关基因包括过氧化物酶体增殖激活受体γ(Ppaγ)、脂肪酸结合蛋白4(fFabp4)、脂蛋白脂肪酶(Lpl)、CCAAT/增强子结合蛋白α(Cebpa)、葡萄糖转运蛋白4(Slc2a4)以及前脂肪细胞因子1(pread1)(图1G)。流式分析表明细胞表达CD34、CD44、CD45以及CD90(图1I)。取P4细胞进行成脂肪分化诱导(图1H),诱导后第8 d成脂率为(87.2±11.67)%(n=6)。
2.2 成脂分化诱导调节的 Notch1 mRNA在BMAPCs表达 JAG1、2及 Notch1~3均表达于BMAPCs(图2)。与0 d相比为(1.000±0.241)%,对BMAPCs进行成脂肪分化诱导第2 d,Notch1 mRNA表达显著增加(2.636±0.375)%(n=4,P<0.01),到第4 d有所下降(1.495±0.252)%(n=4,P<0.05)。
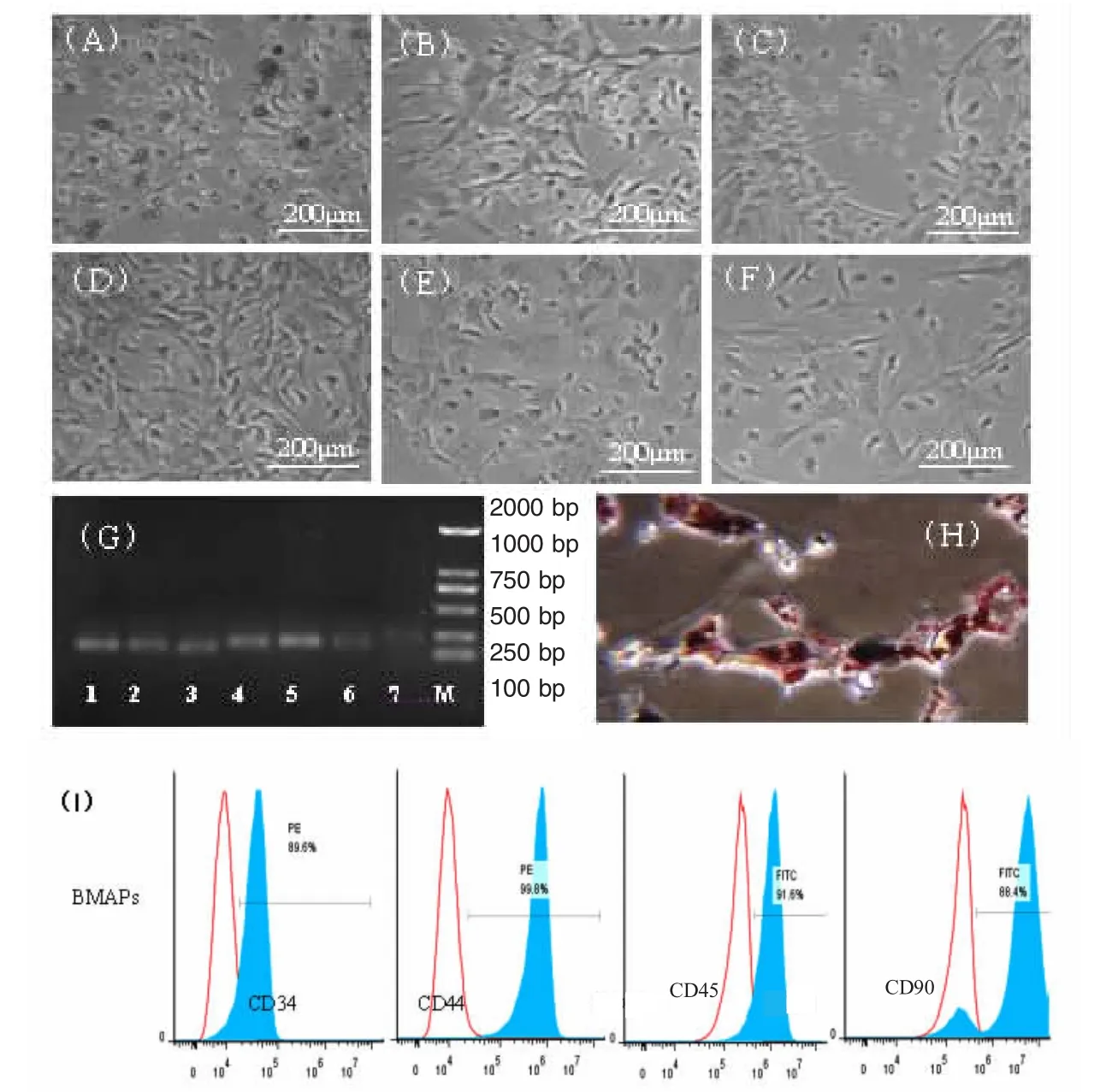
图1 BMAPCs的生长特征
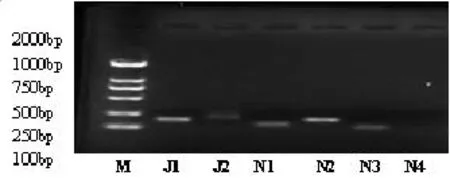
图2 Notch信号分子在BMAPCs表达以及成脂诱导对Notch1 mRNA在BMAPCs表达的调节作用
2.3 Notch1 RNA干扰下调Notch1蛋白在BMAPCs表达 基因转染后72 h进行Western blotting检测,Notch1小RNA干扰组蛋白表达量(39.4±4.2)%较空载体组显著降低(49.7±5.8)%(n=4,P<0.05)(图3)。

图3 基因转染72 h后检测BMAPCs Notch1蛋白表达
2.4 Notch1 RNA干扰调节BMAPCs脂肪分化基因表达及抑制其脂肪细胞分化 成脂诱导至第3 d,可见对照组疑似脂肪细胞数目较Notch siRNA组明显增加,诱导至第5 d,对照组内疑似脂肪细胞数和油滴大小与Notch siRNA组相差更为明显 (图4A)。成脂诱导第5 d,Notch siRNA组的Cebpa、Lpl、Ppaγ、Slc2a4与Fabp4 mRNA(分别为0.87%±0.04%、0.76%± 0.11%、0.81%±0.06%、0.86%±0.08%、0.71%±0.04%)表达均较对照(分别为1.00%±0.04%、1.00%±0.09%、1.00%±0.04%、1.00%±0.07%、1.00%±0.09%)显著降低,而pread1 mRNA表达(1.16±0.03)%则较对照(1.00± 0.04)%显著增加(n=4,P<0.05~P<0.01)。诱导第5 d(图4B),与对照组的 (49.7±5.8)%比较,Notch siRNA组(39.4±4.2)%脂肪细胞百分率显著降低(n= 4,P<0.05)。
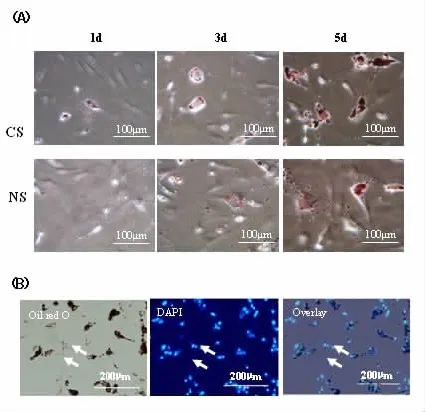
图4 Notch1 RNA干扰调节BMAPCs脂肪分化基因表达及抑制其成脂分化
3 讨论
本实验培养的细胞既表达HSCs的主要标志CD34和脂肪相关特异性基因,又可高效分化为脂肪细胞,因此我们将此细胞定义为BMAPCs。实验表明 Notch信号分子包括配体 JAG1、2以及受体Notch1~3均表达于BMAPCs,成脂肪诱导显著促进Notch1 mRNA在BMAPCs表达,提示Notch1可能在BMAPCs向脂肪细胞分化中也起促进作用[1]。
本研究结果显示,Notch1基因沉默显著影响BMAPCs成脂肪分化能力,诱导至第3 d,在光镜下观察到对照组的疑似脂肪细胞数目较Notch siRNA组明显增加,至第5 d对照组内疑似脂肪细胞数和油滴大小与Notch siRNA组相差更为显著。与对照相比,Notch1基因沉默显著抑制Cebpa、Lpl、Ppaγ、Slc2a4和Fabp4,而促进pread1 mRNA表达,Notch siRNA显著降低脂肪细胞百分率,表明Notch siRNA显著抑制BMAPCs向脂肪细胞分化。
Notch通路成员作用较为复杂,同一Notch信号分子在不同细胞或同一细胞的不同分化阶段功能可能完全不同,如Notch2可能抑制平滑肌细胞增殖,而Notch3却促进SMCs增殖[3];即使同一受体在不同类型细胞中作用也有所不同,Notch1在某些肿瘤的是癌基因,但是在其他类型肿瘤中则可能为抑癌基因[4]。既往关于Notch信号在干/祖细胞向脂肪细胞分化中的作用出现的矛盾结论,可能源于并未探讨该通路中具体某一受体或配体的详细作用[5]。本实验证实Notch1基因沉默抑制BMAPCs向脂肪细胞诱导分化,从一侧面证实了Notch1活化促进BMAPCs向脂肪细胞分化,为脂肪组织再生机制提供了部分新的理论基础。
[1] Ba K,Yang X,Wu L,et al.Jagged-1-mediated activation of notch signalling induces adipogenesis of adipose-derived stem cells[J].Cell Prolif,2012,45(6):538-44.
[2] Osathanon T,Subbalekha K,Sastravaha P,et al.Notch signalling inhibits the adipogenic differentiation of single-cell-derived mesenchymal stem cell clones isolated from human adipose tissue [J].Cell Biol Int,2012,36(12):1161-1170.
[3] Baeten JT,Lilly B.Differential regulation of NOTCH2 and NOTCH3 contribute to their unique functions in vascular smooth muscle cells[J].J Biol Chem,2015,290(26):16226-16237.
[4] Fan X,Mikolaenko I,Elhassan I,et al.Notch1 and notch2 have opposite effects on embryonal brain tumor growth[J].Cancer Res, 2004,64(21):7787-7793.
[5] Song BQ,Chi Y,Li X,et al.Inhibition of Notch signaling promotes the adipogenic differentiation of mesenchymal stem cellsthrough autophagy activation and PTEN-PI3K/AKT/mTOR pathway[J].Cell Physiol Biochem,2015,36(5):1991-2002.
Inhibition of adipocyte differentiation of BMAPCs to mature fat cells by Notch1 gene silencing
Wang Jinxiang1,Wang Xiaohua2,Bai Yingying1,Zhou Fang1,Cai Xuemin1,Liu Jufen1,Li Zi'an1,Yu Zhengping3,Zhu Guangxu1,Pan Xinghua11.Cell Biological Therapy Center,Kunming General Hospital of Chengdu Military Command,Kunming,Yunnan,650032, China;National Joint Engineering Laboratory of Stem Cells and Immune Cells and Biological Medicine Technology,Kunming, Yunnan,650032,China;Key Laboratory of Cell Therapy Technology and Translational Medicine of Yunnan Province,Kunming, Yunnan,650032,China;Clinical College of Kunming General Hospital of Chengdu Military Command,Kunming Medical University, Kunming,Yunnan,650032,China;2.Material Evidence Identification Center of Chongqing Public Security Bureau Yuzhong District Branch,Chongqing,400013,China;3.Research Institute of Biological Effects of Electromagnetic Radiation,Preventive Medicine College of the Third Military Medical University,Chongqing,400038,China
Objective To explore the effects of Notch1 on the adipocyte differentiation of bone marrow adipocyte progenitor cells(BMAPCs).MethodsThe femoral and tibial bone marrow of SD rats was sampled in a sterile manner to prepare cell suspension, which was cultivated by differential adhesion method.The cell surface marker expression was analyzed and detected by flow analysis; the molecular expression of adipose related genes and Notch signaling was detected by means of real-time qPCR.Notch1 gene silencing experiment was divided into non-carrier group and Notch1 small RNA interference group.The interference efficiency was detected by Western blotting;cell fat induction was conducted by STEMPROAdipogenesis Differentiation Kit.ResultsBMAPCs expressed CD34,CD44,CD45 and CD90,and six fat-related genes and Notch signaling molecule;fat induction promoted the expression of Notch1 mRNA(P<0.01);Notch1 small RNA interference inhibited the expression of Notch1 protein(P<0.05).The levels of Cebpa,Lpl and Ppaγ,Slc2a4 and Fabp4 mRNA in Notch1 small RNA interference group were significantly lower than those in the control group,while the level of pread1 mRNA increased greatly(P<0.05~P<0.01);Notch small RNA interferencesignificantly inhibits the percentage of fat cells(P<0.05).ConclusionNotch1 gene silencing inhibits the BMAPCs from differentiating into mature fat cells.
BMAPC;HSC;MSC;Notch1
R 318.1
A
1004-0188(2016)12-1374-05
10.3969/j.issn.1004-0188.2016.12.007
2016-07-04)
国家科技支撑计划项目(2014BI01B00);国家自然科学基金(No.81170316);云南省科技计划项目(20111HB050,2013DA004)
650032昆明,成都军区昆明总医院细胞生物治疗中心、干细胞与免疫细胞生物医药技术国家地方联合实验室、云南省细胞治疗技术转化医学重点实验室、昆明医科大学成都军区昆明总医院临床学院(王金祥,白盈盈,周 芳,蔡学敏,刘菊芬,李自安,朱光旭,潘兴华);重庆市公安局渝中区分局物证鉴定所(王小华);第三军医大学预防医学院电磁辐射生物学效应研究所(余争平)
朱光旭:E-mail:zhguxu@aliyun.com;潘兴华:E-mail:panxinghua@aliyun.com
