模拟增温对青藏高原高寒草甸根系生物量的影响
2016-12-28徐满厚翟大彤尤全刚
徐满厚,刘 敏,翟大彤,薛 娴,彭 飞,尤全刚
1 太原师范学院 地理科学学院, 晋中 030619 2 中国科学院寒区旱区环境与工程研究所 沙漠与沙漠化重点实验室, 兰州 730000
模拟增温对青藏高原高寒草甸根系生物量的影响
徐满厚1,*,刘 敏1,翟大彤1,薛 娴2,彭 飞2,尤全刚2
1 太原师范学院 地理科学学院, 晋中 030619 2 中国科学院寒区旱区环境与工程研究所 沙漠与沙漠化重点实验室, 兰州 730000
在青藏高原高寒草甸布设模拟增温实验样地,采用土钻法于2012—2013年植被生长季获取5个土层的根系生物量,探讨增温处理下根系生物量在生长季不同月份、不同土壤深度的变化趋势及其与相应土层土壤水分、温度的关系。结果表明:(1)根系生物量在2012年随月份呈增加趋势,其中7—9月较大,其平均值在对照、增温处理下分别为3810.88 g/m2和4468.08 g/m2;在2013年随月份呈减小趋势,其中5—6月较大,其平均值在对照、增温处理下分别为4175.39 g/m2和4141.6 g/m2。增温处理下的总根系生物量高出对照处理293.97 g/m2,而各月份总根系生物量在处理间的差值均未达到显著水平。表明在增温处理下根系生物量略有增加,但在生长季不同月份其增加的程度不同,致使年际间的增幅出现差异。(2)根系生物量主要分布在0—10 cm深度,所占百分比为50.61%。在增温处理下,0—10 cm深度的根系生物量减少,减幅为8.38%;10—50 cm深度的根系生物量增加,增幅为2.1%。相对于对照处理,增温处理下0—30 cm深度的根系生物量向深层增加,30—50 cm深度的根系生物量增加趋势略有减缓。可见,在增温处理下根系生物量的增幅趋向于土壤深层。(3)根系生物量与土壤水分呈极显著的递减关系,在增温处理下线性关系减弱;与土壤温度呈极显著的递增关系,在增温处理下线性关系增强。表明土壤水分、温度都可极显著影响根系生物量,但在增温处理下土壤温度对根系生物量的影响较土壤水分更为敏感而迅速。
青藏高原;高寒草甸;根系生物量;模拟增温
现今,生态学家对陆地生态系统的地上部分已经进行了相当深入的研究,而对于它的地下部分依然了解甚少[1-2]。生态系统地上与地下过程的关联主要是通过根系来实现的,根系作为植物体的重要组成部分,其空间分布特征及与土壤环境间的复杂关系对植被地上部分的生长产生重要影响[3]。在根系作用下土壤形成团粒结构,根系活动改善了土壤的物理性质,根系死亡后留下的孔隙能增加土壤的透气性和渗透性;根系分泌的某些化学物质能促进有益微生物的活性,同时还有利于某些营养元素的吸收,改善土壤的化学性质和生物学性质[3]。根系不仅是连接植物与土壤的桥梁,而且作为感知土壤环境的器官,对土壤环境的变化反应敏感[4]。根系生物量的地下分配格局对整个生态系统产生重要影响[5],尤其是提供给植物生长所需水分和养分的细根(直径≤2 mm),其空间结构不仅决定了根系对地下资源的利用效果及潜力,同时还反映了土壤中水分和养分的分配格局,并且会对不同的土壤养分、水分梯度及土壤其他特性做出响应[6]。所以在植物群落中,根系也是生态系统结构功能的重要组成部分,它作为提供植物养分和水分的“源”和消耗碳的“汇”,已成为生态系统生态学及全球变化研究中最受关注的热点[2, 7]。
全球变化最显著的特征是温度、降水等气候要素发生变化[1]。作为全球变化的敏感区和生态脆弱带,青藏高原以其强大的热力和动力作用对区域乃至全球的气候变化、水循环、生态环境等产生重要影响[8-9],因此被看作是研究陆地生态系统对全球变化响应机制的理想场所[10-11]。从1981—2010年的气象数据来看,青藏高原地区平均气温以每年0.04 ℃的速率增加[12]。可见,青藏高原正经历着明显的温暖化过程[13-14]。同时,青藏高原作为全球冰冻圈的重要区域,上面广泛发育着多年冻土(面积约1.5×106km2),由于多年冻土环境对气候变化响应剧烈,使得该地区高寒草地生态系统表现出异常的脆弱性[15]。高寒草甸是适应高原隆起与长期低温环境形成的特殊产物,是典型的高原地带性和山地垂直地带性植被[16-17]。但高寒草甸生态系统极其脆弱,对气候变化和人类活动影响极为敏感,一旦遭受破坏很难在短期内得到恢复,进而导致草地退化和沙漠化发生[18-19]。青藏高原恶劣的气候和环境条件,加之根系研究手段欠缺、采样破坏性大和工作量大[3],阻碍了高寒草甸根系研究的深入开展。因此,本研究以青藏高原高寒草甸为研究对象,从群落水平方面探讨在气候变暖背景下高寒草甸根系生物量的动态变化及其与环境因子的关系,为高海拔地区植被的保护和合理利用,为防止草地退化和沙漠化发生提供理论参考和科学依据。
1 研究方法
1.1 研究区概况
研究区位于中国科学院冻土工程国家重点实验室青藏高原研究基地,地理坐标34°49′34″—34°49′37″ N、92°55′57″—92°56′06″ E,平均海拔4630 m[20- 22]。该地属青藏高原干寒气候区,年均气温-5.9 ℃,年均降水量267.6 mm,年均潜在蒸发量1316.9 mm。试验地位于青藏高原北麓河多年冻土区,该区冻土活动层厚度一般为2—3m,冻结期为9 月至翌年4月。在高寒草甸生长季(5—9月),研究区的植物群落组成以莎草科和菊科的物种居多,植被盖度达83%。其中,以莎草科的高山嵩草(Kobresiapygmaea)为建群种,并伴生有莎草科的青藏苔草(Carexmoorcroftii),豆科的细小棘豆(Oxytropispusilla),报春花科的垫状点地梅(Androsacetapete),以及菊科的矮火绒草(Leontopodiumnanum)和美丽风毛菊(Saussureapulchra)等,蓼科的珠芽蓼(Polygonumviviparum)也较为常见。研究区土壤属高山草甸土,以沙粒居多,剖面发育具有薄层性和粗骨性特点;表层具有5—15 cm厚草皮层,土层一般仅为4—6 cm,有机质含量达8—25 g/kg;表层以下常夹带多量砾石,呈As-A1-C/D结构,B层发育不明显。
1.2 样地设置
实验采用随机区组设计,设置对照、增温(使地面温度约增加3 ℃)、刈割(留茬高度约1 cm)及增温+刈割交互作用4种处理(图1)[20, 23-24]。每种处理5个重复(即5个区组),共20个样地,每个样地面积2 m×2 m,相邻样地间隔4—5 m。本研究所用数据来自其中的对照和增温样地。对照样地设置:该样地内不进行增温、刈割处理,保持植被自然状态。增温样地设置:增温装置采用红外线辐射器,灯体为165 cm长、15 cm宽的三棱形,灯管为150 cm长、8 mm直径的圆柱体,将其架设在样地正上方距地面1.5 m高度处,于2010年7月开始全年不间断增温。每一区组样地外围都用铁丝网围拦,以防破坏。在实验样地外部空旷处架设一小型生态气象观测站,用于常规气象数据观测,包括温度、水分、水汽压、风速等。
图1 增温、刈割实验样地分布图Fig.1 The distribution schematic diagram of warming and clipping plots
1.3 根系生物量测定
于2012和2013年植被生长季获取根系样品(5—9月,每月中旬调查一次,时间间隔不超过2—3d)[23-24]。所采用方法为土钻法,即每个样地用内径为7 cm的土钻分不同土层钻取根系样品(为减少样地破坏,钻数确定为1),土层分为5层:0—10、10—20、20—30、30—40、40—50 cm。取得的土样密封后放进低温箱运回实验室进行风干,然后用60目标准土壤筛(0.28 mm孔径)将根系与土壤分离。根系部分用自来水冲洗干净之后放置阴凉通风处进行风干,然后根据根的颜色、柔韧性和是否附着毛根辨别出活根,将活根放进75℃的烘箱中烘干至恒重,最后称量。
1.4 土壤水热测定
观测设备由美国Campbell公司生产,传感器选择国际认证并符合国家标准的型号[21- 25]。土壤温度由109SS-L型温度探头分4个深度测定,分别为20、40、60、100 cm;土壤水分由FDR(Envior SMART型)水分探头分5个深度测定,分别为10、20、40、60、100 cm。所用传感器均连接到CR1000型数据采集仪,以10 min为间隔自动记录数据,分析计算时将24 h内的数据取平均值作为日数据。
1.5 数据分析
(1)以生长季不同月份为横坐标、不同土壤深度为纵坐标,绘制根系生物量时空分布的等值线图,分析根系生物量在生长季不同月份、不同土壤深度的变化规律。图中,根系取样土层和土壤深度的对应情况为:0—50 cm土层对应0 cm深度,0—10 cm土层对应10 cm深度,10—20 cm土层对应20 cm深度,20—30 cm土层对应30 cm深度,30—40 cm土层对应40 cm深度,40—50 cm土层对应50 cm深度。
(2)取5个土层根系生物量的总和作为总根系生物量,绘制不同月份总根系生物量的柱状图,分析总根系生物量在生长季不同月份的变化规律。然后,取5个月份同一土层根系生物量的平均值,计算每一土层根系生物量占总根系生物量的百分比,绘制不同土层根系生物量百分比的柱状图,分析根系生物量的垂直分布规律。根系生物量在不同月份、深度、处理间的显著性检验由单因素和多因素方差分析得到。
(3)建立5个土层根系生物量与土壤深度的回归方程,推导出50—60 cm土层的根系生物量。若某月份此土层的值出现负值,表示0—50 cm土层已获得全部根系,则该土层的值定义为0。然后,根据根系分布深度(0—60 cm),选择20、40、60 cm深度的土壤水分和土壤温度,分析根系生物量与相应土层土壤水分、温度的关系。在此关系中,因变量为10—20、30—40、50—60 cm 土层的根系生物量。
以上分析过程中的二维图绘制由Origin 8.1软件完成,方差分析由SPSS 17.0软件完成。
2 结果与分析
2.1 根系生物量在生长季不同月份的变化
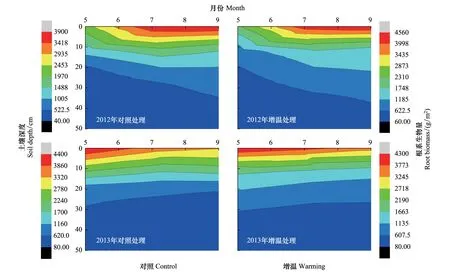
图2 实验处理下根系生物量不同土壤深度的变化趋势Fig.2 Variations of root biomass in different soil depths in control and warming
不同土壤深度根系生物量随时间的变化趋势如图2所示:0—30 cm深度的根系生物量在2012年随月份呈增大趋势,而在2013年随月份呈减小趋势;30—50 cm深度的根系生物量在2012年和2013年的不同月份均未出现较明显变化。同时,图3显示总根系生物量在2012年随月份呈递增趋势,而在2013年出现递减趋势。可见,根系生物量在2012年和2013年出现差异。
在2012年,7—9月的根系生物量较大,其平均值在对照处理下为3810.88 g/m2,在增温处理下略有增加,达到4468.08 g/m2;在2013年,5—6月的根系生物量较大,其平均值在对照处理下为4175.39 g/m2,在增温处理下略有减小,为4141.6 g/m2。表1得到,除了5月份,不同月份增温处理下的总根系生物量与对照处理的差值均为正值,而且图3也显示5月份增温处理下的总根系生物量略低于对照处理,其他月份增温处理均高于对照处理,这说明在增温处理下根系生物量具有增加趋势。
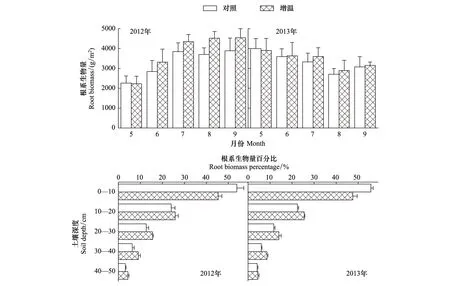
图3 实验处理下根系生物量不同月份和不同土层的分布规律Fig.3 Distributions of root biomass in different months and soil layers in control and warming
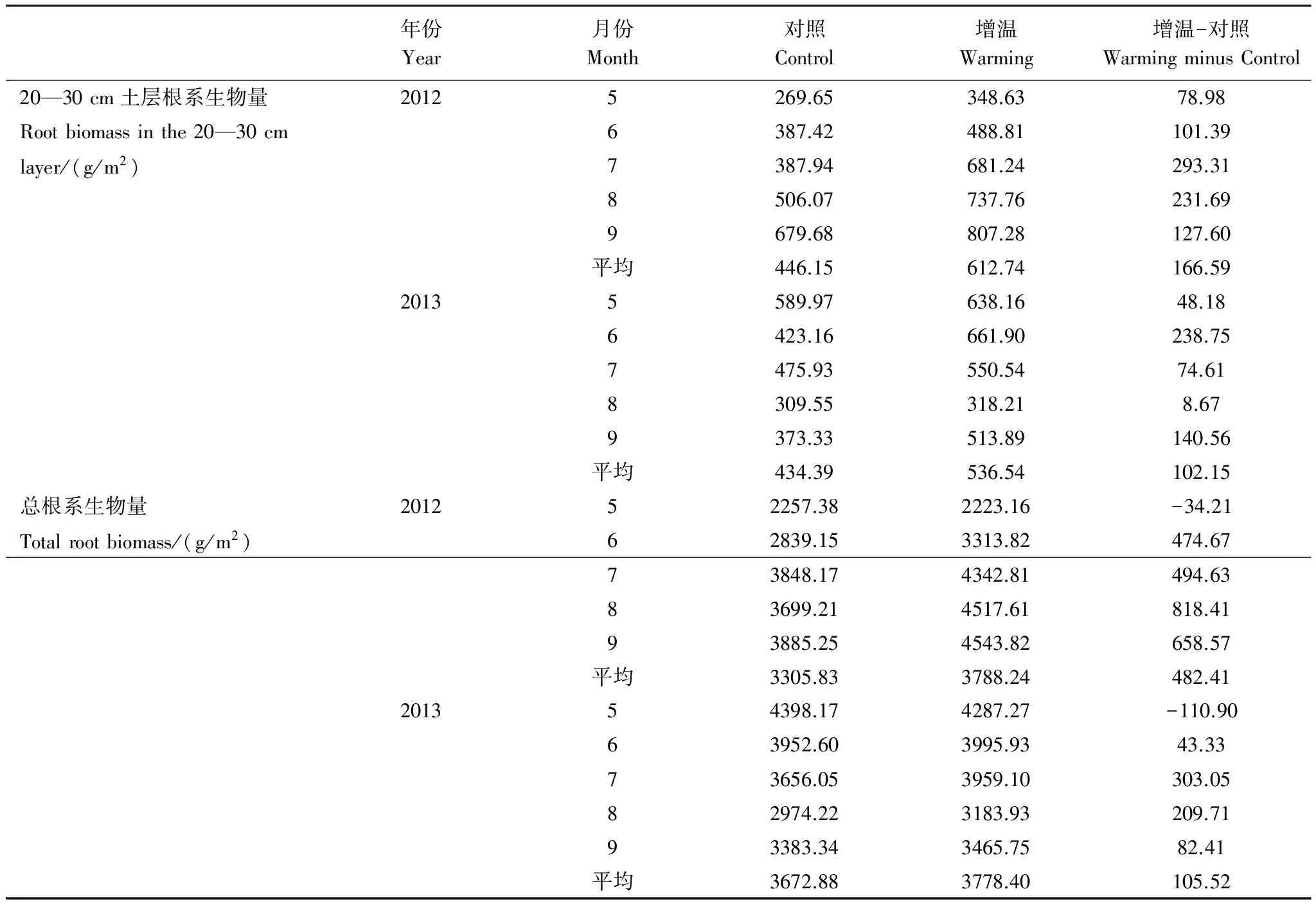
年份Year月份Month对照Control增温Warming增温-对照WarmingminusControl20—30cm土层根系生物量20125269.65348.6378.98Rootbiomassinthe20—30cm6387.42488.81101.39layer/(g/m2)7387.94681.24293.318506.07737.76231.699679.68807.28127.60平均446.15612.74166.5920135589.97638.1648.186423.16661.90238.757475.93550.5474.618309.55318.218.679373.33513.89140.56平均434.39536.54102.15总根系生物量201252257.382223.16-34.21Totalrootbiomass/(g/m2)62839.153313.82474.6773848.174342.81494.6383699.214517.61818.4193885.254543.82658.57平均3305.833788.24482.41201354398.174287.27-110.9063952.603995.9343.3373656.053959.10303.0582974.223183.93209.7193383.343465.7582.41平均3672.883778.40105.52
就整个生长季而言,2012年增温处理下的总根系生物量高于对照处理482.41 g/m2,但在2013年此差值减小,为105.52 g/m2。此外,单因素方差分析表明,不同月份增温处理与对照处理的总根系生物量差值均未达到显著水平(P>0.05)。以上分析显示,在增温处理下根系生物量略有增加,但在生长季的不同月份其增加的程度不同,致使年际间根系生物量的增幅出现差异。
2.2 根系生物量在土壤不同深度的变化
图2展示了不同处理下根系生物量的垂直分布规律:随土壤深度增加,根系生物量呈递减趋势。从图3各土层根系生物量的百分比可以看出,根系生物量主要分布在0—10 cm深度,百分比在2012年和2013年分别为49.57%和51.65%。在增温处理下,不同土壤深度的根系生物量分配具有较大差异。
图3显示,在0—10 cm深度,增温处理下的根系生物量百分比低于对照处理,减幅在2012年为8.52%,在2013年为8.23%;在10—50 cm深度,增温处理下的根系生物量百分比高于对照处理,增幅在2012年平均为2.13%,在2013年平均为2.06%。从图2中还可以看出,相对于对照处理,增温处理下0—30 cm深度的根系生物量向深层增加,30—50 cm深度的根系生物量的增加趋势略有减弱。可见,增温能够促使根系生物量在土壤中的垂直分布发生变化。
为进一步阐释这一现象,表1中以20—30 cm深度的根系生物量为例。增温处理下该深度的根系生物量在不同月份均高于对照处理,增温与对照的差值在2012年平均为166.59 g/m2,在2013年平均为102.15 g/m2。此外,表2中的多因素方差分析显示,根系生物量和总生物量在实验处理间均未达到显著水平(P>0.05),而根系生物量及其百分比在土壤深度间达到极显著水平(P<0.001)。因此,在增温处理下根系生物量的增幅趋向于土壤深层,即根系逐渐向土壤深层迁移。
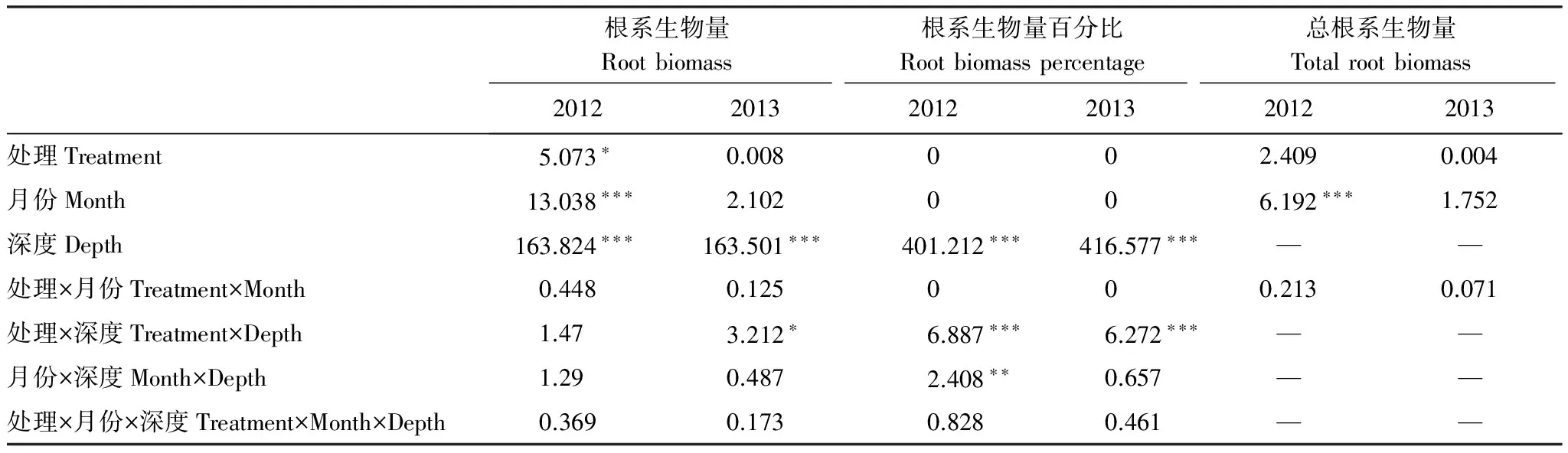
表2 基于广义线性模型根系生物量的多因素方差分析(F值)
*P<0.05,**P<0.01,***P<0.001;0:此项未进入分析,—:无此分析项
2.3 根系生物量与土壤水分、温度的关系
建立根系生物量与相应土层土壤水分、温度的线性回归关系(表3):根系生物量与土壤水分的相关性达到极显著水平(P<0.01),且随土壤水分增加而减小;在增温处理下,其回归方程的斜率绝对值增大,决定系数略有减小,显著性值增大,这说明增温减弱了根系生物量与土壤水分的线性递减关系。
根系生物量与土壤温度的相关性也达到极显著水平(P<0.01),且随土壤温度增加而增大;在增温处理下,其回归方程的斜率增大,决定系数略有增加,显著性值减小,这说明增温加强了根系生物量与土壤温度的线性递增关系。
另外,土壤温度与根系生物量回归方程的斜率大于土壤水分,其差值平均为20.67,表明土壤温度对根系生物的影响更大。以上分析显示,土壤水分、温度都可极显著影响根系生物量,但在增温处理下,土壤温度对根系生物量的影响较土壤水分更为敏感而迅速。
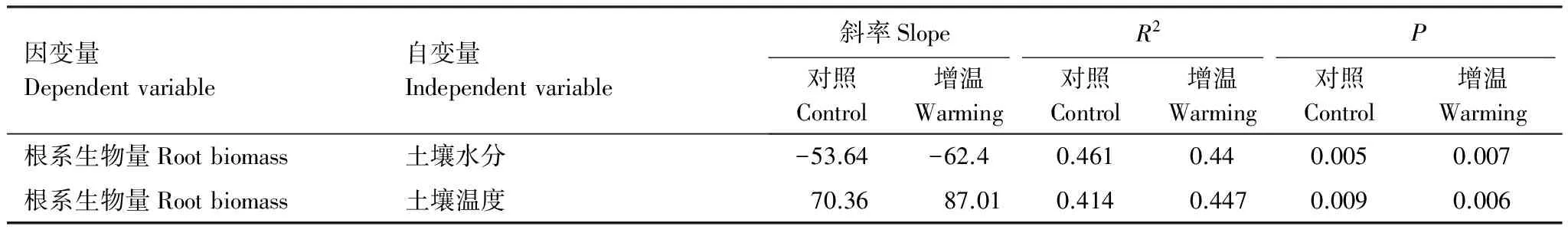
表3 根系生物量与相应土层土壤水分、温度的线性回归方程
数据来自生长季10—20、30—40、50—60 cm土层,进行5月份3土层根系生物量与相应深度土壤水分、土壤温度的回归分析
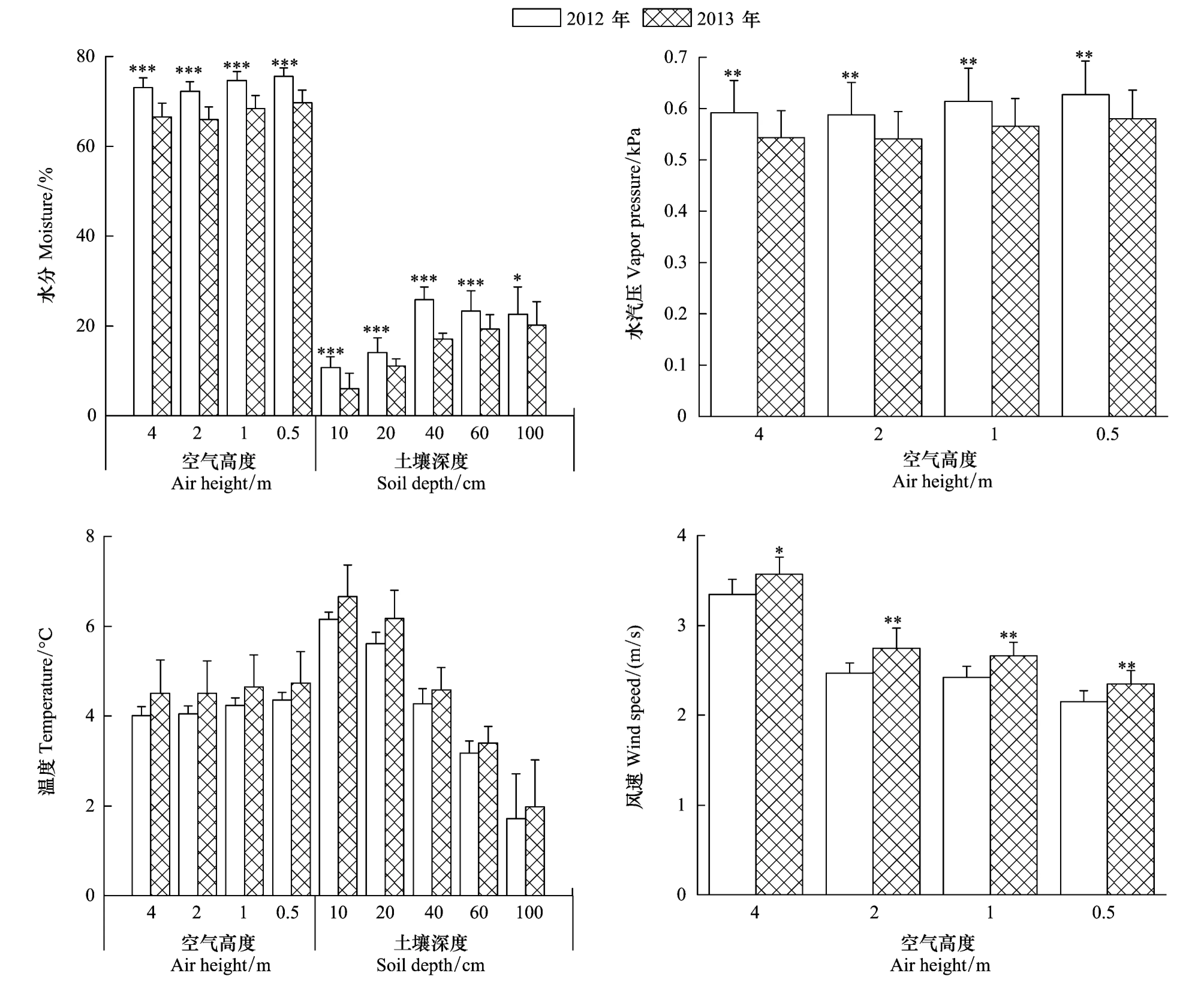
图4 2012年和2013年实验样地环境因子分析Fig.4 Analysis on environmental factors in experimental plots*、**和***分别代表显著性检验中P<0.05、0.01和0.001
3 讨论与结论
3.1 根系生物量与环境因子的关系
根系作为植物三大营养器官之一,在植物生长发育过程中起着极为重要的作用。它不仅是固定和支撑植物地上部分的关键器官,也是植物从土壤中获取养分和水分的重要器官,更是植物地上与地下部分物质及信息交换的系统[26]。植物吸取水分、养分的能力在很大程度上取决于根系在土壤中的形态分布,揭示根系分布规律及其与周围土壤环境的相互关系,对于改善生态环境和提高植物生产力具要重要意义。
本研究得到,根系生物量在2012年随月份呈递增趋势,在2013年出现递减趋势,致使2012年和2013年的根系生物量出现差异。究其原因,与当地环境因子的变化有关。图4显示,从2012年到2013年,空气相对湿度、水汽压和土壤水分均显著减小,风速显著增加,而空气温度与土壤温度未出现显著变化,略有增加。这表明青藏高原年际间的强风可导致当地水分蒸发强烈,使其含量减少,但由于该地长期处于低温的冻土环境,风速对其温度的影响不是很明显。由于空气-土壤水分的显著减少,高寒草甸根系生物量在2013年出现降低。前期研究也发现,2010—2011年高寒草甸地上-地下生物量的减小趋势与土壤温度、土壤水分和空气温度的显著减小密切相关,并且地上生物量较地下生物量对温度和水分更为敏感[21]。因此,在自然状态下,高寒草甸根系生物量的生产与水分因子的关系更为密切。
温度升高在一定程度上满足了植物对热量的需求,但也改变了植物群落的小气候环境,从而通过多种途径直接或间接影响植物的生理过程,进而影响植物的生长发育和生物量生产[27- 29]。然而,当前有关植物生物量对增温响应的研究还存有较大争议,主要表现在:第一,增温可通过降低土壤含水量或增加植物呼吸作用减少植物生物量。Melillo等[30]研究认为,增温后土壤含水量减少或植物呼吸作用增强,都能导致植物净初级生产力下降。Boeck等[31]的研究结果也显示,由于增温导致土壤含水量减少,地上和地下生物量都明显下降,地上、地下生物量分别下降了18%和23%。第二,增温可通过提高新陈代谢速率增加植物的光合能力或通过较高的分解作用增强植物对矿物营养的吸收,进而增加植物生物量。研究表明,温度升高能提高极地和高山地区植物的营养生长,促进该区植物的生理活动和表现,使生物量增加[32, 33]。对于大多数温寒带和北方树种而言,在水分和养分充足的条件下,增温也会促进植物生物量积累[34]。但Weltzin 等[35]认为不同物种和不同生活型对增温的响应不同,所以增温效应需视物种类型区别对待。
对青藏高原的研究得出,高寒草甸根系生物量主要分布在土壤浅层(其中0—10 cm深度所占百分比为50.61%),在增温处理下0—10 cm深度的根系生物量减少8.38%,10—50 cm深度的根系生物量增加2.1%,即根系生物量趋向于土壤深层,此结论与李娜等[36]的研究相似。李娜等[36]研究表明,小幅度增温使高寒草甸0—5 cm根系层的生物量增加,地下5—20 cm根系层生物量分配比例减少,但变化均不显著;大幅度增温处理后,由于受到水分条件的限制更明显,地下生物量开始向着深层土壤的根系层转移,但统计检验也不显著。我们以前的研究也发现,增温后0—40 cm内的土壤水分较少蒸发到空气中,而是大部分下移到土壤深层,且150 W/m2处理下的下移幅度大于130 W/m2[21]。这样,土壤水分的深层迁移就有可能导致根系生物量向深层转移。而我们对高寒草甸根系生物量和土壤碳氮含量迁移变化的研究恰恰表明了,根系生物量的深层转移可能与土壤水分、有机碳、活性碳、全氮的下移有关[24]。因此,增温对植物生物量的影响较为复杂,而且根系生物量的深层转移与土壤水分的向下迁移有极大关系。
现在越来越多的增温实验支持争议一,证实根系生物量与土壤水分的关系更为密切。如石福孙等[13, 37]研究发现,增温使地下0—30 cm 的根系生物量出现不同程度的减少,认为这主要与土壤增温后相对含水量明显下降有密切关系;Dubrovsky 等[38]的研究表明,增温后表层土壤干旱,阻碍了表土根系生长;Edwards等[39]也认为,土壤增温会导致根系死亡率增加,从而减少根系的数量和聚集度。本研究得到,根系生物量与土壤水分呈极显著的递减关系,在增温处理下线性关系减弱;与土壤温度呈极显著的递增关系,在增温处理下线性关系增强。之所以会这样,是因为本文研究所选择的高寒草甸地处青藏高原多年冻土区,该地的土壤和植被受多年冻土影响较大,而且是在植被生长季(5—9月)进行的植被调查和土壤采样。Li等[40]对青藏高原植物生产力和土壤碳氮库的研究表明,在高寒草甸植被生长季,温度升高使冻土融化、土壤活动层增厚,因此土壤有机碳和其他土壤营养元素可能随着土壤水分的下渗迁移到土壤深层,使得土壤有机碳的分配比例从土壤浅层转移到深层,从而促使土壤深层的有机碳含量增加。以前的研究也得到,在增温、刈割及增温+刈割交互作用处理下,土壤活性碳、有机碳和全氮的分配比例从土壤浅层转移到深层,而根系生物量也具有相似的迁移趋势[24]。于是,我们推测在高寒草甸生长季,特别是5月至7月,伴随温度回升冻土融化深度增大,浅层土壤水分迅速增加,而后随表层蒸散发增强而逐渐减少,这就导致根系生物量与土壤水分存在显著负相关;但在增温处理下,各土层冻土融化速度和水分迁移速度加快,出现了增温处理可减缓这种负相关程度的现象。由此可知,土壤水分、温度都可显著影响根系生物量,但在增温处理下土壤温度对根系生物量的影响较土壤水分更为敏感而迅速。
另外,根系生物量的迁移变化与植物不同功能群也有很大关系。石福孙等[13]采用开顶式生长室进行模拟增温,研究得到0—10 cm土层的生物量分配比例增加,可能是因为禾草等须根系单子叶植物大量繁殖所致;而20—30 cm土层生物量分配比例的减少,可能是因为杂草等直根系双子叶植物因增温导致生物量减少所致。周华坤等[41]对矮嵩草草甸的模拟研究表明,在短期的增温条件下群落的总生物量变化不明显,但增温导致禾草生物量显著增加,杂草生物量显著减少,而莎草生物量增加较少。这是由于禾草具有从生理上调控资源分配模式的能力,延长了对土壤元素的获得时期,加之具有较大的叶面积,并分布于不同的高度层,在增温条件下有利于光合速率的增加和分蘖能力的增强,所以其地上生物量增加较多;而莎草科的青草及其苔草较禾草耐阴,当禾草植物占据群落上层时,形成郁闭环境,莎草成为群落下层,而且莎草一般为短根茎地下芽植物,与禾草竟争吸收氮素的能力不高,所以莎草地上生物量增加较少;杂草则由于禾草和莎草与之过度竞争了光照和养分,生长受抑制,使生物量减少[13, 41]。Alward等[42]研究认为,在全球变暖背景下,对于任一植物群落来说,由于各物种的生物学特性等不同,总有一些物种对增温的响应更为敏感,从而破坏种间竞争关系,引起群落优势种和组成发生改变。因此,增温可使高寒地区植被的物种多样性比原生植被有所减少,导致植物种群优势度发生倾斜,由于不同功能群植物根系的数量和分布存有较大差异,原以适应寒冷、湿中生境的草甸植被类型可能逐渐被以旱生为主的植被类型所替代。
3.2 根系采样的误差分析
本研究的根系采集时间为植被生长季,此时根系大多具有活性,从根的颜色、柔韧性和是否附着毛根等方面对活根和死根进行了鉴别,但结果显示根系生物量比Yang等[43]和王亮等[44]的研究大,这可能与采样尺度、植被类型及环境因素等有关[21]。王亮等[44]研究的个体数据采样点和群落水平采样点都是内蒙古温带草地及青藏高寒草地的典型植被样地,地理位置和采样时间并不完全一致,可能会存在小环境的差别。而本研究只选择高寒草甸,且样地布置位于同一生境,小环境的影响可以忽略。Yang等[43]的研究能够很好的反映中国草地地下-地上生物量比 (R/S),但由于采样尺度、放牧干扰及植物物候的影响,使R/S的估测仍具有不确定性。本实验样地设在植被分布均匀、地势较为平坦且未受放牧、鼠兔啃食等干扰的地区,并用铁丝网将实验样地围栏,于植被生长季进行根系采集,但结果显示2012年和2013年对照组的根系生物量差值达367 g/m2,而增温处理下的这个差值仅为9.8 g/m2。因此,在鉴别活根和死根的过程中出现了人为误差。王亮等[44]认为虽然通过颜色等方法区分了活根和死根,但由于草地群落中植物的种类众多,根的颜色和形态多样,使区分活根和死根的难度很大,从而使地下部分被高估。因此,今后需要探索出更准确、更便捷的方法对根系活性进行鉴定。
[1] 贺金生, 王政权, 方精云. 全球变化下的地下生态学: 问题与展望. 科学通报, 2004, 49(13): 1226- 1233.
[2] Copley J. Ecology goes underground. Nature, 2000, 406: 452- 454.
[3] 王长庭, 王启兰, 景增春, 冯秉福, 杜岩功, 龙瑞军, 曹广民. 不同放牧梯度下高寒小嵩草草甸植被根系和土壤理化特征的变化. 草业学报, 2008, 17(5): 9- 15.
[4] 梁建生, 张建华, 曹显祖. 根系环境温度变化对根系吸水和叶片蒸腾的影响. 植物学报, 1998, 40(12): 1152- 1158.
[5] Peters D P C. Plant species dominance at a grassland-shrubland ecotone: an individual-based gap dynamics model of herbaceous and woody species. Ecological Modelling, 2002, 152(1): 5- 32.
[6] Schenk H J. Vertical vegetation structure below ground: scaling from root to globe. Progress in Botany, 2005, 66: 341- 373.
[7] Morgan J A. Looking beneath the surface. Science, 2002, 298(5600): 1903- 1904.
[8] 徐振锋, 胡庭兴, 张力, 张远彬, 鲜骏仁, 王开运. 青藏高原东缘林线交错带糙皮桦幼苗光合特性对模拟增温的短期响应. 植物生态学报, 2010, 34(3): 263- 270.
[9] Wu G X, Liu Y M, He B, Bao Q, Duan A M, Jin F F. Thermal controls on the Asian summer monsoon. Scientific Reports 2, 2012: Article number: 404.
[10] 尹华军, 赖挺, 程新颖, 蒋先敏, 刘庆. 增温对川西亚高山针叶林内不同光环境下红桦和岷江冷杉幼苗生长和生理的影响. 植物生态学报, 2008, 32(5): 1072- 1083.
[11] Qiu J. China: the third pole. Nature, 2008, 454(7203): 393- 396.
[12] 王朋岭, 唐国利, 曹丽娟, 刘秋锋, 任玉玉. 1981—2010年青藏高原地区气温变化与高程及纬度的关系. 气候变化研究进展, 2012, 8(5): 313- 319.
[13] 石福孙, 吴宁, 罗鹏. 川西北亚高山草甸植物群落结构及生物量对温度升高的响应. 生态学报, 2008, 28(11): 5286- 5293.
[14] 杨晓霞, 任飞, 周华坤, 贺金生. 青藏高原高寒草甸植物群落生物量对氮、磷添加的响应. 植物生态学报, 2014, 38(2): 159- 166.
[15] 金会军, 李述训, 王绍令, 赵林. 气候变化对中国多年冻土和寒区环境的影响. 地理学报, 2000, 55(2): 161- 173.
[16] 张新时. 西藏植被的高原地带性. 植物学报, 1978, 20(2): 140- 149.
[17] 崔树娟, 布仁巴音, 朱小雪, 白玲, 汪诗平. 不同季节适度放牧对高寒草甸植物群落特征的影响. 西北植物学报, 2014, 34(2): 349- 357.
[18] 王建兵, 张德罡, 曹广民, 田青. 青藏高原高寒草甸退化演替的分区特征. 草业学报, 2013, 22(2): 1- 10.
[19] 刘艳书, 樊江文, 李愈哲, 张良侠. 三江源地区不同剥蚀退化高寒草甸群落生物量与多样性特征. 草业学报, 2014, 23(3): 1- 7.
[20] 徐满厚, 刘敏, 薛娴, 翟大彤, 彭飞, 尤全刚, 刘洋. 增温、刈割对高寒草甸地上植被生长的影响. 生态环境学报, 2015, 24(2): 231- 236.
[21] 徐满厚, 薛娴. 青藏高原高寒草甸夏季植被特征及对模拟增温的短期响应. 生态学报, 2013, 33(7): 2071- 2083.
[22] 徐满厚, 薛娴. 青藏高原高寒草甸植被特征与温度、水分因子关系. 生态学报, 2013, 33(10): 3158- 3168.
[23] Xu M H, Peng F, You Q G, Guo J, Tian X F, Liu M, Xue X. Effects of warming and clipping on plant and soil properties of an alpine meadow in the Qinghai-Tibetan Plateau, China. Journal of Arid Land, 2015, 7(2): 189- 204.
[24] Xu M H, Peng F, You Q G, Guo J, Tian X F, Xue X, Liu M. Year-round warming and autumnal clipping lead to downward transport of root biomass, carbon and total nitrogen in soil of an alpine meadow. Environmental and Experimental Botany, 2015, 109: 54- 62.
[25] Xu M H, Peng F, You Q G, Guo J, Tian X F, Liu M, Xue X. Initial effects of experimental warming on temperature, moisture, and vegetation characteristics in an alpine meadow on the Qinghai-Tibetan Plateau. Polish Journal of Ecology, 2014, 62(3): 491- 507.
[26] 黄建辉, 韩兴国, 陈灵芝. 森林生态系统根系生物量研究进展. 生态学报, 1999, 19(2): 270- 277.
[27] Saxe H, Ellsworth D S, Heath J. Tree and forest functioning in an enriched CO2atmosphere. New Phytologist, 1998, 139(3):395- 436.
[28] Cai T B, Dang Q L. Effects of soil temperature on parameters of a coupled photosynthesis-stomatal conductance model. Tree Physiology, 2002, 22(12): 819- 828.
[29] Aerts R. The freezer defrosting: global warming and litter decomposition rates in cold biomes. Journal of Ecology, 2006, 94(4): 713- 724.
[30] Melillo J M, Steudler P A, Aber J D, Newkirk K, Lux H, Bowles F P, Catricala C, Magill A, Ahrens T, Morrisseau S. Soil warming and carbon-cycle feedbacks to the climate system. Science, 2002, 298(5601): 2173- 2176.
[31] De Boeck H J, Lemmens C M H M, Gielen B, Bossuyt H, Malchair S, Carnol M, Merckx R, Ceulemans R, Nijs I. Combined effects of climate warming and plant diversity loss on above- and below-ground grassland productivity. Environmental and Experimental Botany, 2007, 60(1): 95- 104.
[32] Wada N, Shimono M, Miyamoto M, Kojima S. Warming effects on shoot developmental growth and biomass production in sympatric evergreen alpine dwarf shrubsEmpetrumnigrumandLoiseleuriaprocumbens. Ecological Research, 2002, 17(1): 125- 132.
[33] Sandvik S M, Heegaard E, Elven R, Vandvik V. Responses of alpine snowbed vegetation to long-term experimental warming. Ecoscience, 2004, 11(2): 150- 159.
[34] Danby R K, Hik D S. Responses of white spruce (Piceaglauca) to experimental warming at a subarctic alpine treeline. Global Change Biology, 2007, 13(2): 437- 451.
[35] Weltzin J F, Pastor J, Harth C, Bridgham S D, Updegraff K, Chapin C T. Response of bog and fen plant communities to warming and water-table manipulations. Ecology, 2000, 81 (12): 3464- 3478.
[36] 李娜, 王根绪, 杨燕, 高永恒, 柳林安, 刘光生. 短期增温对青藏高原高寒草甸植物群落结构和生物量的影响. 生态学报, 2011, 31(4): 895- 905.
[37] 石福孙, 陈华峰, 吴宁. 增温对川西北亚高山高寒草甸植物群落碳、氮含量的影响. 植物研究, 2008, 28(6): 730- 736.
[38] Dubrovsky J G, North G B, Nobel P S. Root growth, developmental changes in the apex, and hydraulic conductivity forOpuntiaficus-indicaduring drought. New Phytologist, 1998, 138(1): 75- 82.
[39] Edwards E J, Benham D G, Marland L A, Fitter A H. Root production is determined by radiation flux in a temperate grassland community. Global Change Biology, 2004, 10(2): 209- 227.
[40] Li N, Wang G X, Yang Y, Gao Y H, Liu G S. Plant production, and carbon and nitrogen source pools, are strongly intensied by experimental warming in alpine ecosystems in the Qinghai-Tibet Plateau. Soil Biology and Biochemistry, 2011, 43(5): 942- 953.
[41] 周华坤, 周兴民, 赵新全. 模拟增温效应对矮嵩草草甸影响的初步研究. 植物生态学报, 2000, 24(5): 547- 553.
[42] Alward R D, Detling J K, Milchunas D G. Grassland vegetation changes and nocturnal global warming. Science, 1999, 283(5399): 229- 231.
[43] Yang Y H, Fang J Y, Ma W H, Guo D L, Mohammat A. Large-scale pattern of biomass partitioning across China′s grasslands. Global Ecology and Biogeography, 2010, 19(2): 268- 277.
[44] 王亮, 牛克昌, 杨元合, 周鹏. 中国草地生物量地上-地下分配格局: 基于个体水平的研究. 中国科学: 生命科学, 2010, 40(7): 642- 649.
Effects of experimental warming on the root biomass of an alpine meadow on the Qinghai-Tibetan Plateau, China
XU Manhou1,*, LIU Min1, ZHAI Datong1, XUE Xian2, PENG Fei2, YOU Quangang2
1TaiyuanNormalUniversity,Jinzhong030619,China2ColdandAridRegionsEnvironmentalandEngineeringResearchInstitute,UniversityofChineseAcademyofSciences,Lanzhou730000,China
The Qinghai-Tibetan Plateau (QTP) has been considered an ideal region in which to study the responses of terrestrial ecosystems to climate change. The alpine meadow, a typical vegetation type of the QTP, is extremely fragile and highly sensitive to climate change. Once destroyed, reestablishing these meadows in a short timeframe has proven to be very difficult; their loss would result either in landscape degradation or desertification. Therefore, an understanding of the dynamic changes to the alpine meadow vegetation of the QTP caused by climate change is extremely important and urgently needed. In previous research, we chose an alpine meadow in the QTP as our study area and established 20 experimental plots with a randomized block design, comprising five replicates and four treatments: a control, warming alone, clipping alone, and a combination of warming and clipping. In this study, we tested the control and the warming plots independently and sampled root biomass using a soil auger with an inner diameter of 7 cm. Samples were collected from soil layers of 0—10 cm, 10—20 cm, 20—30 cm, 30—40 cm, and 40—50 cm during the growing season, from May to September in 2012 and 2013. This study explored variations in root biomass occurring in different months and at different soil depths during the growing season, as well as correlations between biomass and the moisture and temperature of the corresponding soil layers. The results show that (1) root biomass tended to increase over time in 2012, peaking from July to September and with the mean being 3811 g/m2and 4468 g/m2in the control and warming treatments, respectively. However, root biomass decreased over time in 2013, peaking in May and June with an average value of 4175 g/m2and 4142 g/m2in the control and warming treatments, respectively. Total root biomass was larger in the warming treatments than in the control, with a mean difference of 293.97 g/m2. Conversely, there were no significant differences in total root biomass between treatments in the various months. Warming treatments resulted in slightly increased root biomass, but the magnitude of the increase varied widely among months in the growing season, which resulted in differences in the increase in inter-annual root biomass. (2) The root biomass was primarily distributed at depths of 0—10 cm, where 50.61% of all roots were localized. In the warming treatments, root biomass declined by 8.38% in the 0—10 cm soil layer, whereas it increased by 2.1% in the 10—50 cm soil layer. Relative to the control treatments, the root biomass at depths of 0—30 cm tended to increase in the deeper soil layers, with the increasing trends being slightly less pronounced at depths of 30—50 cm. Therefore, in warming treatments, the root biomass tended to be greater in deeper soil layers. (3) Warming treatments caused a highly significant decrease in root biomass and soil moisture. However, root biomass increased very significantly with increase in soil temperature, which was elevated in the warming treatments. This illustrates that soil moisture and temperature both had highly significant effects on root biomass, but the effects of soil temperature were more intense and took effect more rapidly than the effects of soil moisture.
Qinghai-Tibetan Plateau; alpine meadow; root biomass; experimental warming
国家自然科学基金项目(41501219)
2015- 05- 03;
日期:2016- 03- 03
10.5846/stxb201505030904
*通讯作者Corresponding author.E-mail: xumanhou@163.com
徐满厚,刘敏,翟大彤,薛娴,彭飞,尤全刚.模拟增温对青藏高原高寒草甸根系生物量的影响.生态学报,2016,36(21):6812- 6822.
Xu M H, Liu M, Zhai D T, Xue X, Peng F, You Q G.Effects of experimental warming on the root biomass of an alpine meadow on the Qinghai-Tibetan Plateau, China.Acta Ecologica Sinica,2016,36(21):6812- 6822.
