氮添加对长白山阔叶红松林2种树木幼苗光合生理生态特征的影响
2016-12-28孙金伟吴家兵张冠华任斐鹏姚付启
孙金伟, 吴家兵, 任 亮, 张冠华, 任斐鹏, 姚付启
1 长江科学院, 武汉 430010 2 森林与土壤生态国家重点实验室,中国科学院沈阳应用生态研究所, 沈阳 110016
氮添加对长白山阔叶红松林2种树木幼苗光合生理生态特征的影响
孙金伟1, 吴家兵2,*, 任 亮1, 张冠华1, 任斐鹏1, 姚付启1
1 长江科学院, 武汉 430010 2 森林与土壤生态国家重点实验室,中国科学院沈阳应用生态研究所, 沈阳 110016
植物的光合作用是评估全球变化背景下碳循环的重要环节。目前,氮沉降增加日益明显,作为植物生长关键因子的可利用氮将对植物的光合生理生态过程产生影响。以长白山阔叶红松林主要树种红松和紫椴的幼苗为例,通过模拟氮沉降增加(氮添加量分别为0、23、46和69 kgN hm-2a-1)的方法,利用Li- 6400光合测定系统分别测算了两个树种的最大净光合速率(Amax)、气孔导度(Gsmax)和水分利用效率(WUE)的值,并测算了叶氮含量、叶绿素含量、比叶面积、光合氮利用效率(PNUE)的值。通过分析Amax随不同施氮量的变化规律,同时结合其他叶片特征参数的变化,进一步探讨植物光合随氮添加的变化原因。研究结果显示:两个树种的Amax值在0—46 kgN hm-2a-1的氮添加范围内随施氮量的增加而增大,继续增加施氮量至69 kgN hm-2a-1则出现下降。叶绿素含量、Gsmax、PNUE和比叶面积在不同的氮添加水平下的变化规律与Amax的一致,且均与Amax呈显著正相关关系。叶氮含量与Amax的值仅在0—46 kgN hm-2a-1氮添加范围内呈显著正相关。Amax与WUE的相关关系不显著。相同氮添加水平下,氮添加对阔叶树种紫椴各生理生态参数(Amax、Gsmax、叶氮含量、比叶面积、PNUE和WUE)的促进程度高于对针叶树种红松各生理生态参数的促进程度。研究结果可为评估氮沉降增加背景下我国东北地区的碳循环提供依据。
氮添加;光合;生理生态;阔叶红松林;全球变化
植物的光合作用是生态系统中能量流动与物质循环的基础,也是生物碳固定的重要方式。陆地植物通过光合作用固定的碳量约占地球植物光合固碳量的60%[1]。陆地生态系统碳固定量的2/3来自森林生态系统,森林作为陆地生态系统的主体,在全球碳循环中发挥着重要的作用[2- 3]。因此,分析植物光合作用对未来气候变化的响应成为中外学者共同关注的重要研究内容[4- 6]。
在植物的生长过程中,可利用的营养元素的变化对于植物碳代谢过程的调节作用具有重要的意义。营养元素中的可利用氮是植物的生长中发挥关键性作用的因子[7-8],尤其是在很多温带森林中更是起着重要的限制作用[9]。氮的反应性树种自19世纪后期以来约增加了10倍,陆地生态系统的氮输入量增加了近2倍[10-11]。因此,分析植物光合生理生态特征对氮添加的响应将为全球变化背景下碳循环的准确评估提供重要的理论依据。
近年来,氮添加影响下植物生理变化的研究不断增加,一方面,研究表明氮添加可明显促进植物叶片的光合作用[12- 15],认为主要原因为植物叶片中的氮含量增加,进而改变了与光合密切相关的酶的含量[14]。另一方面,也有研究认为少量的氮添加对光合作用存在促进作用,过量的氮无助于光合作用的提高[16- 18],Whytemare等[17]的研究得出当氮添加过量时,植物体内的营养元素比例失衡,此时光合作用受到抑制。闫艳红等[18]的研究认为过量的氮添加使得叶面积指数过高,影响通风和透光,进而降低了植物的光合作用。
中国是全球的三大氮沉降区之一,其年均氮沉降量可达12.9kg hm-2a-1[19]。然而,近年来,国内关于氮添加对植物光合生理生态特征影响的研究多集中在草本植物和农作物[13, 20- 22],近年来,逐渐在亚热带森林中开展相关研究[15, 23],但对我国东北地区的温带阔叶红松林内关于氮沉降增加下植物生理响应的研究还比较少[24]。关于全球变化对我国温带森林光合作用影响的研究亟待丰富。
本研究选取长白山阔叶红松林的主要树种(红松和紫椴)为研究对象,分析了主要树种的叶片光合对氮添加的响应,为进一步探讨氮添加下光合变化的原因,对不同氮添加影响下的主要叶片特征参数也进行了分析。研究结果为评估未来我国东北地区的碳循环提供依据。
1 材料与方法
1.1 试验地与试验材料
本研究在中国科学院长白山森林生态系统定位站(42°24′09″N, 128°05′45″E)内阔叶红松林的空旷地进行,海拔738 m。该地区属于季风影响下的温带大陆山地气候,该地区年平均气温为3.6 ℃,年平均降水量为695 mm,氮沉降背景值为23 kgN hm-2a-1。林地的优势树种为红松(Pinuskoriaensis)、紫椴(Tiliaamurensis)、水曲柳(Fraxinusmandshurica)和色木槭(Acermono)等。本研究选取红松和紫椴两个树种的盆栽幼苗进行实验。幼苗树龄大概为6 a,平均株高为1.5 m,平均基径约为2 cm。
1.2 实验设计
以长白山地区的氮沉降背景值为基础,选取红松和紫椴的盆栽幼苗,共设置对照组(无氮添加)、低氮组(添加23 kgN hm-2a-1)、中氮组(添加46 kgN hm-2a-1)和高氮组(添加69 kgN hm-2a-1)4个氮添加水平,用NH4NO3的水溶液进行人工喷施,对照组只喷施对应量的水。每年分两次进行,分别于5月初和7月中旬施加。每个树种的各施氮组均选取长势良好且生长相似的植株作为4个重复。
1.3 相关测定1.3.1 光合测定
利用便携式LI- 6400光合测定系统(LI-COR, Lincoln, NE, USA)对各处理下的幼苗进行光合测定,每株幼苗选取生长健康的3片树叶。测定一系列光照强度(PPFD:1600、1200,800、600、400、200、150、50、0 μmol m-2s-1)下的净光合速率(An, μmol m-2s-1),得到光响应曲线An-PPFD。测量过程中CO2浓度的值控制为大气CO2浓度值(约380 μmol/mol),叶片温度控制在25℃,相对湿度为60%,流速为500 μmol/s。实验在生长季6—9月进行,测定时间在天气晴朗的约8:30至12:00之间进行。
1.3.2 叶片元素含量测定
将采集叶片置于烘箱内,在105℃下进行杀青(大约15min),再将温度调节至70℃下烘干24h。完成烘干过程后再用万分之一天平称其干重,并研磨,过80目筛。将待测样品用锡纸包样后,用稳定同位素比例质谱仪(Delta plus XP)进行测定,得到叶片全碳、全氮元素含量。
1.3.3 叶绿素含量的测定
叶绿素含量采用分光光度计测定,从植株的阴、阳面和上、下层选取有代表性的叶片数片,用脱脂棉擦拭干净后去除主脉和叶片两端,然后剪碎、混匀。称0.2 g左右,用80%的丙酮溶液定容至50 mL,每个样品3个重复。将定容好的容量瓶置于黑暗环境中并经常摇动,直至叶片完全变白,分别在663 nm和645 nm处比色,记录吸光度值(A)。根据测量得到的663 nm和645 nm下的吸光度值代入方程(1),计算出叶绿素的含量:
CT=20.3×A645+8.04×A663
(1)
式中,A663和A645分别是叶绿素溶液在663 nm和645 nm处的吸光度值,CT是叶绿素总量的浓度(mg/L)。通过公式(2)计算后,换算为单位质量的叶绿素含量(mg/g)。
叶绿素总量=(CT×V)/(W×1000)
(2)
式中,V表示提取液总体积(mL),W代表叶片鲜重(g)。
1.4 数据分析
最大净光合速率(Amax)通过光响应曲线的非直角双曲线模型拟合得到[25]。通过SPSS 17.0(SPSS, Chicago, IL, USA)进行统计分析,对各处理下的各测定指标进行方差分析后,进行多重比较的检验。同处理下针阔叶树种红松和紫椴之间的差异根据Student′s T检验分析。根据数据趋势进行线性或非线性关系的拟合。所有的检验均以P<0.05为显著性水平。
2 结果分析
2.1 氮添加对光合气体交换的影响2.1.1 净光合速率

图1 氮添加对长白山主要树种红松和紫椴最大光合速率(Amax)的影响Fig.1 Response of the maximum net photosynthetic rate (Amax) of P. koraiensis and T. amurensis to increasing nitrogen input levels 图中数据为均值±标准误,n=4
图1显示的是最大净光合作用速率(Amax)随不同施氮梯度的变化。从图中可以看出红松和紫椴Amax的值随氮添加增加的变化规律一致,在对照组至中氮组区间呈增加趋势,高氮组的值则出现下降。红松的Amax的值由对照组的6.9 μmol m-2s-1增加至中氮组的9.6 μmol m-2s-1。继续增加氮添加量,Amax在高氮组的值减小为7.0 μmol m-2s-1。紫椴Amax的值从对照组的10.2 μmol m-2s-1到增大至中氮组的16.7 μmol m-2s-1,在高氮组Amax则下降至14.8 μmol m-2s-1。红松和紫椴叶片Amax的值在低氮组和中氮组均显著高于对照组Amax的值,而高氮组Amax的值与对照组Amax的值差异不显著。
由上述研究结果可知,低、中氮处理增大了叶片Amax的值,为比较氮添加对Amax值的促进程度在红松和紫椴之间的差异,进一步分析了两个树种低、中氮组的Amax值相对于对照组的增加程度(表1)。从表1中可以看出,紫椴低、中氮水平下Amax的增加程度(41.2%,63.7%)均高于红松对应水平下的增加值(17.0%,39.2%)。
2.1.2 气孔导度
图2显示的Gsmax在不同施氮梯度下的变化。从图中可以看出,红松和紫椴的Gsmax值在对照组至中氮组呈逐渐增加的趋势,继续增加施氮量则出现Gsmax值的下降。本研究中红松的Gsmax值由对照组的0.06 mol H2O m-2s-1增加到中氮组的0.09 mol H2O m-2s-1。当施氮量继续增加,Gsmax的值出现下降,在高氮组下降为0.06 mol H2O m-2s-1。紫椴Gsmax值在对照组为0.11 mol H2O m-2s-1,继续增加施氮量,Gsmax的值也逐渐增加至中氮组的0.21 mol H2O m-2s-1,高氮下的Gsmax值下降为0.14 mol H2O m-2s-1。红松和紫椴叶片在各氮添加水平下的Gsmax值总体上显著高于对照组的值,仅有红松高氮组的Gsmax的值与对照组差异不显著。
表1 不同氮添加处理对红松和紫椴幼苗各生理生态参数的促进程度变化表
Table 1 The increased degree of the eco-physiological parameters under nitrogen input levels compared with these parameters under the without nitrogen addition treatment for the seedlings ofT.amurensisandP.koraiensis
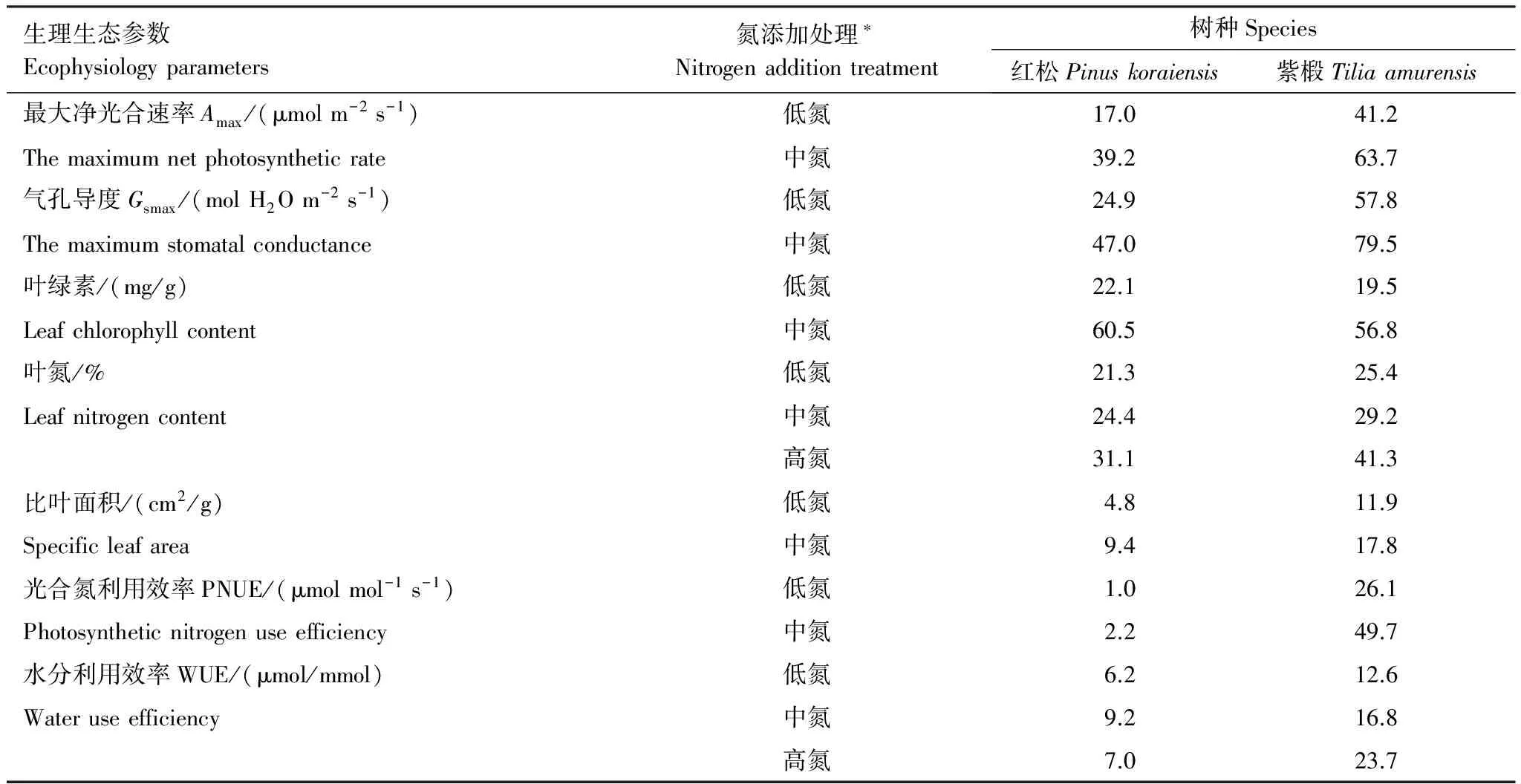
生理生态参数Ecophysiologyparameters氮添加处理∗Nitrogenadditiontreatment树种Species红松Pinuskoraiensis紫椴Tiliaamurensis最大净光合速率Amax/(μmolm-2s-1)低氮17.041.2Themaximumnetphotosyntheticrate中氮39.263.7气孔导度Gsmax/(molH2Om-2s-1)低氮24.957.8Themaximumstomatalconductance中氮47.079.5叶绿素/(mg/g)低氮22.119.5Leafchlorophyllcontent中氮60.556.8叶氮/%低氮21.325.4Leafnitrogencontent中氮24.429.2高氮31.141.3比叶面积/(cm2/g)低氮4.811.9Specificleafarea中氮9.417.8光合氮利用效率PNUE/(μmolmol-1s-1)低氮1.026.1Photosyntheticnitrogenuseefficiency中氮2.249.7水分利用效率WUE/(μmol/mmol)低氮6.212.6Wateruseefficiency中氮9.216.8高氮7.023.7
*低氮、中氮和高氮添加处理分别为23、46、69 kgN hm-2a-1

图2 氮添加对长白山主要树种红松和紫椴叶片最大气孔导度(Gsmax)的影响Fig.2 Response of the maximum stomatal conductance (Gsmax) of P. koraiensis and T. amurensis to increasing nitrogen input levels图中数据为均值±标准误,n=4
由上文可知,低、中氮处理增大了叶片Gsmax的值,为比较氮添加对Gsmax值的促进程度在红松和紫椴之间的差异,进一步分析了两个树种低、中氮组的Gsmax值相对于对照组的增加程度(表1)。从表1中可以看出,两个树种Gsmax值增加程度与Amax的变化相同,低、中氮组紫椴Gsmax值的增加程度(57.8%,79.5%)均明显高于红松对应组的增加值(24.9%,47.0%)。
2.2 其他叶片特征参数2.2.1 叶绿素和叶氮含量
图3是长白山主要树种红松和紫椴的叶绿素含量随氮添加的变化图。从图中可以看出叶绿素含量随氮添加量的增加存在先增加后降低的趋势。从对照组到中氮组,紫椴的叶绿素含量由2.8 mg/g增加至4.2 mg/g,但在高氮组则出现降低,减小为3.8 mg/g。红松叶绿素含量从对照组的1.2 mg/g逐渐增加,到中氮时增加至1.9 mg/g,继续增加氮添加的量时,红松的叶绿素含量在高氮组降至1.4mg/g。红松和紫椴在不同的氮添加下叶片的叶绿素含量均显著高于对照组的值,且高氮组的值均显著低于中氮组的值。
研究结果表明,低、中氮处理增大了叶绿素含量,为比较氮添加对叶绿素含量的促进程度在红松和紫椴之间的差异,进一步分析了两个树种低、中氮组的叶绿素含量相对于对照组的增加程度(表1)。从表1中可以看出,两个树种叶绿素含量的增加程度与Amax、Gsmax的变化不同,低、中氮水平下紫椴叶绿素含量的增加程度(19.5%,56.8%)均略低于红松对应水平下的增加值(22.1%,60.5%)。

图3 长白山主要树种红松和紫椴4个氮添加水平下的叶绿素含量随氮添加的变化Fig.3 Variation in leaf chlorophyll content of P. koraiensis and T. amurensis with increasing nitrogen input levels 图中数据为均值±标准误,n=4
图4显示的是叶片氮含量随不同施氮梯度的变化图。从图中可以看出红松和紫椴两个树种的叶片氮含量均随施氮量的增加逐渐增大。紫椴中叶片氮含量的值由对照组的1.9%逐渐增加至高氮组的2.7%,红松的叶片氮含量由0.9%增加为1.2%。紫椴和红松的叶片氮含量在3个氮添加组下的值均显著高于对照组。
红松、紫椴叶片氮含量的值在整个氮添加范围内(0—69 kgN hm-2a-1)呈增加趋势,为比较氮添加对叶片氮含量的促进程度在红松和紫椴之间的差异,进一步分析了两个树种低、中、高氮组的叶氮含量相对于对照组的增加程度(表1)。低、中、高氮水平下紫椴叶氮含量的增加程度(25.4%,29.2%,41.3%)均略高于红松对应氮添加水平下的增加值(21.3%,24.4%,31.1%)。
2.2.2 比叶面积
从图5中可以看出,两个树种在一定的氮添加范围内是逐渐增加的,继续增加施氮量,则比叶面积的值出现下降。红松比叶面积在对照组至中氮组的值由157.1 cm2/g增加到171.8 cm2/g。紫椴比叶面积的变化规律与红松一致,在这段施氮区间内比叶面的值由186.0 cm2/g增加到219.2 cm2/g。继续增加施氮量红松和紫椴比叶面积的值均出现下降,红松比叶面积下降至154.5 cm2/g,紫椴该值减小为215.1 cm2/g。紫椴各施氮组比叶面积的值均显著高于对照组,低氮至高氮组之间没显著差异。红松中氮组的比叶面积的值显著高于对照组,高氮组的值显著低于中氮组。

图4 氮添加对长白山主要树种红松和紫椴叶氮含量的影响Fig.4 Response of leaf nitrogen content of P. koraiensis and T. amurensis to increasing nitrogen input levels 图中数据为均值±标准误,n=4

图5 氮添加对长白山主要树种红松和紫椴比叶面积的影响Fig.5 Response of specific leaf area of P. koraiensis and T. amurensis to increasing nitrogen input levels 图中数据为均值±标准误,n=4
红松、紫椴叶片比叶面积的值在低、中氮组较对照组的增加程度见表1。两个树种叶绿素含量的增加程度与Amax、Gsmax、叶氮含量的变化相同,低、中氮水平下紫椴比叶面积的增加程度(11.9%,17.8%)均高于红松对应水平下的增加值(4.8%,9.4%)。
2.2.3 光合氮利用效率和水分利用效率
光合氮利用效率(PNUE)是光合能力与叶片氮含量的比值,它是衡量植物利用氮营养和合理分配氮的能力,也是关系到植物生长的重要指标。表2显示的是红松和紫椴两个树种的光合氮利用效率(PUNE)在不同施氮水平下的值。从表中可以看出,PNUE的值从对照组到中氮组逐渐增加。红松和紫椴高氮组的PNUE值均出现下降。
红松、紫椴PNUE的值在低氮组和中氮组分别较对照组的增加程度见表1。两个树种PNUE值的增加程度与Amax、Gsmax、叶氮含量的变化相同,低、中氮水平下紫椴比叶面积的增加程度(26.1%,49.7%)均高于红松对应水平下的增加值(1.0%,2.2%)。
由表2可知,红松和紫椴各氮添加处理组的水分利用效率(WUE)均高于对照组的值,但在不同氮添加(低、中和高氮)之间无明显差异。
红松和紫椴在各氮添加处理下,WUE的值较对照组的增加程度见表1。由表1可知,紫椴WUE在各氮添加组的值(12.6%,16.8%和23.7%)均高于对应氮添加水平下红松的值(6.2%,9.2%和7.0%)。
表2 4个氮添加水平(对照组、低氮组、中氮组和高氮组)下红松和紫椴的光合氮利用效率(PNUE)和水分利用效率(WUE)
Table 2 Photosynthetic nitrogen use efficiency (PNUE) and water use efficiency (WUE) ofT.amurensisandP.koraiensisunder four nitrogen input levels (i.e., CK, +LN, +MN and +HN)

氮添加处理/(kgNhm-2a-1)Nitrogenadditiontreatment对照组CK/(0kgNhm-2a-1)低氮组LN/(23kgNhm-2a-1)中氮组MN/(46kgNhm-2a-1)高氮组HN/(69kgNhm-2a-1)光合氮利用效率/(PNUE,μmolmol-1s-1)红松Pinuskoraiensis169.8±9.7b171.5±14.5b207.7±14.5a129.3±11.3cPhotosyntheticnitrogenuseefficiency紫椴Tiliaamurensis140.8±12.3c177.5±13.1b210.5±13.8a167.0±10.7b水分利用效率/(WUE,μmol/mmol)红松Pinuskoraiensis5.00±0.03b5.31±0.18a5.46±0.11a5.35±0.12aWateruseefficiency紫椴Tiliaamurensis5.08±0.08b5.72±0.58a5.94±0.47a6.29±0.56a
*表中数据为均值±标准误;标注的字母表示两个树种在不同的氮处理之间显著性差异的比较(单因素方差分析,P<0.05)
2.3 各光合生理生态参数之间的相关关系
为探讨不同氮添加下叶片光合参数的响应规律及其原因,分析了叶片光合Amax与各生理生态参数之间的相关关系。线性拟合得出红松和紫椴Amax的值在整个施氮水平下与叶绿素含量、PNUE、比叶面积、Gsmax均呈显著正相关关系。Amax的值与叶氮含量仅在对照组至中氮组区间存在显著正相关关系,即两者的线性关系只存在于一定的施氮范围内。这说明氮添加对光合的促进作用存在一个阈值。上述参数之间具体的相关关系见表3。

表3 红松和紫椴叶片的最大净光合速率与各生理生态参数之间的拟合关系
*Amax(μmol m-2s-1)与叶氮含量的关系基于对照组至中氮组的数据计算,其余拟合关系基于所有施氮水平下的数据计算;上述拟合关系均通过0.05的显著性水平
3 讨论
本文研究结果表明Amax的值在一定氮添加范围内随施氮量的增加而增大,这与Nakaji等和Nakaji等[26-27]对树木幼苗的研究结果一致。此外,本文研究得出增加氮添加量能够增加植物的叶氮含量,前人的许多研究同样得出这一结论[28-29],同时,很多国内外研究得出叶氮含量是植物光合能力的重要限制因素[30-32],Bouma等[33]也报道90%的氮存在于植物细胞的蛋白质中,它的更替与修复需要植物的光合过程提供物质来源。前人研究认为叶片的叶绿素含量是光合作用的指示指标,与光合呈正相关关系[34],本研究对叶片光合与叶绿素间的关系进行分析,证明两者存在显著的正相关关系,Amax随施氮量的增加是逐渐增加的叶绿素促进光合作用的结果。本研究得出一定施氮范围内,比叶面积随施氮量的增加而增大,Knops和Reinhart[35]的研究与该研究结果一致,认为随着施氮量的增加,比叶面积逐渐增加并引起植物地上部分对光的竞争能力的增强,从而增加在生态系统中的竞争能力,使得植物具有较高的光合值。本研究中Gsmax的值一定施氮范围内随施氮量的增加而增大,且Wang等[24]对温带阔叶红松林树种进行研究,研究表明氮添加后增加的气孔导度能促进光合过程中CO2的传输,水分利用效率WUE的值也会增加。此外,郑淑霞等[36]对不同功能型植物的叶片参数进行分析得到PNUE的值与光合速率的值呈显著正相关。上述研究均与本文研究结果相似,比叶面积、Gsmax和PNUE均与Amax呈正相关关系,这些参数随氮添加量的增加而增大,进而促进光合作用。
继续增加氮添加的量时,红松和紫椴两个树种的Amax在高氮组出现下降。这可能是高氮下植物不再将多余的氮用于合成更多的Rubisco酶,而是合成一种植物胁迫指示物——腐胺[37],从而使得叶氮含量对Amax的促进作用存在一个阈值。与Amax呈显著正相关关系的叶绿素含量、PNUE、比叶面积和Gsmax均在高氮组出现下降,这都可能导致光合速率的下降。有研究表明,N/P和Mn/Mg的值在高氮条件下显著增加,认为高氮条件下植物体内的矿物营养会失衡[26-27],这也可能引起植物光合作用的降低。
红松和紫椴生理生态参数随氮添加的变化呈现相同的规律,但氮添加对两个树种各叶片参数的促进程度存在差异。除叶绿素含量外,紫椴叶片的各参数的值(Amax、Gsmax、叶氮含量、比叶面积、PNUE和WUE)在低、中氮水平下的增加程度均高于红松叶片在对应氮添加水平下的增加程度,表明阔叶树种紫椴对氮添加的响应较针叶树红松更为敏感。红松叶绿素含量的增加程度略高于紫椴的值,可能与红松为常绿树种有关,原因有待于后续研究的进一步分析。
4 结论
以长白山主要树种红松和紫椴为例,分析了植物光合及其他叶片特征参数随不同的氮添加量的变化。研究结果表明在一定的施氮范围内,氮添加对红松和紫椴的光合作用有促进作用,超过一定阈值后出现下降。叶绿素含量、Gsmax、PNUE和比叶面积的变化规律与Amax一致,且在不同的氮添加水平下均与Amax呈正相关关系。Amax随氮添加的变化可能是上述参数变化的结果。叶氮含量与Amax仅在一定氮添加范围内呈显著正相关,说明叶氮含量对Amax的促进作用存在阈值。此外,多数生理生态参数对氮添加的敏感程度表现为阔叶树种紫椴高于针叶树种红松。研究结果将为后续氮沉降增加下植物生理过程响应的机理解释奠定基础,为未来全球变化情景下温带森林生态系统碳循环的评估提供重要依据。
[1] 李合生. 现代植物生理学. 北京: 高等教育出版社, 2002.
[2] Kramer P J. Carbon dioxide concentration, photosynthesis, and dry matter production. BioScience, 1981, 31(1): 29- 33.
[3] Waring R H, Schlesinger W H. Forest Ecosystems: Concepts and Management. Orlando, FL, USA: Academic Press, 1985: 313- 335.
[4] 方精云, 郭兆迪. 寻找失去的陆地碳汇. 自然杂志, 2007, 29(1): 1- 6.
[5] Pan Y, Birdsey R A, Fang J, Houghton R, Kauppi P E, Kurz W A, Phillips O L, Shvidenko A, Lewis S L, Canadell J G, Ciais P, Jackson R B, Pacala S W, McGuire A D, Piao S, Rautiainen A, Sitch S, Hayes D. A large and persistent carbon sink in the world′s forests. Science, 2011, 333(6045): 988- 993.
[6] Smith N G, Dukes J S. Plant respiration and photosynthesis in global-scale models: incorporating acclimation to temperature and CO2. Global Change Biology, 2013, 19(1): 45- 63.
[7] Chapin III F S, Vitousek P M, Van Cleve, K. The nature of nutrient limitation in plant communities. American naturalist, 1986, 127(1): 48- 58.
[8] Schulze E D, Kelliher F M, Korner C, Lloyd J, Leuning R. Relationships among maximum stomatal conductance, ecosystem surface conductance, carbon assimilation rate, and plant nitrogen nutrition: a global ecology scaling exercise. Annual Review of Ecology and Systematics, 1994, 25: 629- 660.
[9] Ågren G I. Limits to plant production. Journal of Theoretical Biology, 1985, 113(1): 89- 92.
[10] Galloway J N. The global nitrogen cycle: changes and consequences. Environmental Pollution, 1998, 102(1): 15- 24.
[11] Galloway J N, Dentener F J, Capone D G, Boyer E W, Howarth R W, Seitzinger S P, Asner G P, Cleveland C C, Green P A, Holland E A, Karl D M, Michaels A F, Porter J H, Townsend A R, Vöosmarty C J. Nitrogen cycles: past, present, and future. Biogeochemistry, 2004, 70(2): 153- 226.
[12] Ericsson A, Nordén L G, Näsholm T, Walheim M. Mineral nutrient imbalances and arginine concentrations in needles ofPiceaabies(L.) Karst. from two areas with different levels of airborne deposition. Trees: Structure and Function, 1993, 8(2): 67- 74.
[13] 姜东, 于振文, 李永康, 余松烈. 施氮水平对高产小麦蔗糖含量和光合产物分配及籽粒淀粉积累的影响. 中国农业科学, 2002, 35(2): 157- 162.
[14] Magill A H, Aber J D, Hendricks J J, Bowden R D, Melillo J M, Steudler P A. Biogeochemical response of forest ecosystems to simulated chronic nitrogen deposition. Ecological Applications, 1997, 7(2): 402- 415.
[15] 闫慧, 吴茜, 丁佳, 张守仁. 不同降水及氮添加对浙江古田山4种树木幼苗光合生理生态特征与生物量的影响. 生态学报, 2013, 33(14): 4226- 4236.
[16] 郭天财, 宋晓, 马冬云, 王永华, 谢迎新, 查菲娜, 岳艳君, 岳彩凤. 施氮水平对冬小麦旗叶光合特性的调控效应. 作物学报, 2007, 33(12): 1977- 1981.
[17] Whytemare A B, Edmonds R L, Aber J D, Lajtha K. Influence of excess nitrogen deposition on a white spruce (Piceaglauca) stand in southern Alaska. Biogeochemistry, 1997, 38(2): 173- 187.
[18] 闫艳红, 杨文钰, 张新全, 陈小林, 陈忠群. 施氮量对套作大豆花后光合特性、干物质积累及产量的影响. 草业学报, 2011, 20(3): 233- 238.
[19] Lü C Q, Tian H Q. Spatial and temporal patterns of nitrogen deposition in China: Synthesis of observational data. Journal of Geophysical Research: Atmospheres (1984- 2012), 2007, 112(D22): D22S05, doi:10.1029/2006JD007990.
[20] 吕丽华, 赵明, 赵久然, 陶洪斌, 王璞. 不同施氮量下夏玉米冠层结构及光合特性的变化. 中国农业科学, 2008, 41(9): 2624- 2632.
[21] 杨浩, 罗亚晨. 糙隐子草功能性状对氮添加和干旱的响应. 植物生态学报, 2015, 39(1): 32- 42.
[22] 张雷明, 上官周平, 毛明策, 于贵端. 长期施氮对旱地小麦灌浆期叶绿素荧光参数的影响. 应用生态学报, 2003, 14(5): 695- 698.
[23] 王晓荣, 潘磊, 唐万鹏, 庞宏东, 郑兰英. 氮素添加对中亚热带栎属不同树种幼苗生长及生物量分配的短期影响. 东北林业大学学报, 2014, 42(6): 24- 28.
[24] Wang M, Shi S, Lin F, Hao Z Q, Jiang P, Dai G H. Effects of soil water and nitrogen on growth and photosynthetic response of manchurian ash (Fraxinusmandshurica) seedlings in northeastern China. PLoS One, 2012, 7(2): e30754.
[25] Long S, Baker N, Raines C. Analysing the responses of photosynthetic CO2assimilation to long-term elevation of atmospheric CO2concentration, CO2and biosphere. Springer, 1993: 33- 46.
[26] Nakaji T, Fukami M, Dokiya Y, Izuta T. Effects of high nitrogen load on growth, photosynthesis and nutrient status ofCryptomeriajaponicaandPinusdensifloraseedlings. Trees: Structure and Function, 2001, 15(8): 453- 461.
[27] Nakaji T, Takenaga S, Kuroha M, Izuta T. Photosynthetic response ofPinusdensifloraseedlings to high nitrogen load. Environmental Science, 2002, 9(4): 269- 282.
[28] Jia S, Wang Z, Li X, Zhang X, Mclaughlin N B. Effect of nitrogen fertilizer, root branch order and temperature on respiration and tissue N concentration of fine roots inLarixgmeliniiandFraxinusmandshurica. Tree Physiology, 2011, 31(7): 718- 726.
[29] Manter D K, Kavanagh K L, Rose C L. Growth response of Douglas-fir seedlings to nitrogen fertilization: importance of Rubisco activation state and respiration rates. Tree Physiology, 2005, 25(8): 1015- 1021.
[30] Barker D H, Vanier C, Naumburg E, Charlet T N, Nielsen K M, Newingham B A, Smith S D. Enhanced monsoon precipitation and nitrogen deposition affect leaf traits and photosynthesis differently in spring and summer in the desert shrubLarreatridentata. New Phytologist, 2006, 169(4): 799- 808.
[31] Chen S P, Bai Y F, Zhang L X, Han X G. Comparing physiological responses of two dominant grass species to nitrogen addition in Xilin River Basin of China. Environmental and Experimental Botany, 2005, 53(1): 65- 75.
[32] Wang M, Shi S, Lin F, Hao Z Q, Jiang P, Dai G H. Effects of soil water and nitrogen on growth and photosynthetic response of manchurian ash (Fraxinusmandshurica) seedlings in northeastern China. PLoS One, 2012, 7(2): e30754.
[33] Bouma T J, De Visser R, Janssen J H J A, De Kock M J, Van Leeuwen P H, Lambers H. Respiratory energy requirements and rate of protein turnover in vivo determined by the use of an inhibitor of protein synthesis and a probe to assess its effect. Physiologia Plantarum, 1994, 92(4): 585- 594.
[34] Evans J R. The relationship between carbon-dioxide-limited photosynthetic rate and ribulose- 1, 5-bisphosphate-carboxylase content in two nuclear-cytoplasm substitution lines of wheat, and the coordination of ribulose-bisphosphate-carboxylation and electron-transport capacities. Planta, 1986, 167(3): 351- 358.
[35] Knops J M H, Reinhart K. Specific leaf area along a nitrogen fertilization gradient. The American Midland Naturalist, 2000, 144(2): 265- 272.
[36] 郑淑霞, 上官周平. 不同功能型植物光合特性及其与叶氮含量、比叶重的关系. 生态学报, 2007, 27(1): 171- 181.
[37] Minocha R, Stephanie L, Bauer G A, Berntson G M, Magill A H, Aber J, Bazzaz F A. Nitrogen Availability and net primary production in temperate forests: the role of leaf physiology, foliage turnover and canopy structure. [2001]. http://abstracts.aspb.org/pb2001/public/P34/0093.html.
Response of photosynthetic physiological characteristics to nitrogen addition by seedlings of two dominant tree species in a broadleaved-Korean pine mixed forest on Changbai Mountain
SUN Jinwei1, WU Jiabing2,*, REN Liang1, ZHANG Guanhua1, REN Feipeng1, YAO Fuqi1
1ChangjiangRiverScientificResearchInstitute,Wuhan430010,China2StateKeyLaboratoryofForestandSoilEcology,InstituteofAppliedEcology,ChineseAcademyofSciences,Shenyang110016,China
Photosynthesis is an important factor when evaluating the carbon cycle under global climate change scenario. Available nitrogen is a key nutritional factor for plant growth, which affects plant photosynthesis in case of high nitrogen deposition. The ecophysiology parameters of two dominant species (PinuskoraiensisandTiliaamurensis) were studied in a broadleaved-Korean pine mixed forest on Changbai Mountain through nitrogen deposition experiments. The nitrogen input levels were 0, 23, 46, and 69 kg N hm-2a-1, respectively. The maximum net photosynthetic rate (Amax), stomatal conductance (Gsmax), and water use efficiency (WUE, μmol/mmol) were measured using a Li- 6400 portable photosynthesis system under different nitrogen input levels. Additionally, leaf nitrogen content, leaf chlorophyll content, specific leaf area, and photosynthetic nitrogen use efficiency (PNUE, μmol mol-1s-1) were also measured. In this paper, the variation inAmaxwith increasing nitrogen input was analyzed, and the reason was explored combined with variations in other leaf traits parameters (Gsmax, leaf chlorophyll content, leaf nitrogen content, PNUE, WUE, and specific leaf area) under the same treatments. The results showed that nitrogen addition (0—46 kg N hm-2a-1) resulted in a significant increase inAmax, and when the added nitrogen was further increased to 69 kg N hm-2a-1, theAmaxdecreased. The variations ofGsmax, leaf chlorophyll content, PNUE, and specific leaf area was similar to that ofAmaxunder different nitrogen input levels. Significantly positive relationships were noted betweenAmaxand leaf traits such asGsmax, leaf chlorophyll content, PNUE, and specific leaf area under the different nitrogen input levels. A positive relationship was noted betweenAmaxand leaf nitrogen content only for nitrogen addition of 0—46 kg N hm-2a-1. No significant correlation was noted betweenAmaxand WUE. The increase of eco-physiological factors ofTiliaamurensis(Amax,Gsmax, leaf nitrogen content, specific leaf area, PNUE, and WUE) were higher than that ofPinuskoraiensisunder each nitrogen addition treatment. Our study results will provide the basis for assessing the effects of nitrogen deposition on carbon cycle in the northeast of China.
nitrogen addition; photosynthesis; ecophysiology; broadleaved-Korean pine mixed forest; global climate change
国家自然科学基金资助项目(51309016, 41301298, 41301201);湖北省自然科学基金资助项目(2013CFB401);中央级公益性科研院所基本科研业务费资助项目(CKSF2014041/NS)
2014- 12- 08;
日期:2016- 03- 03
10.5846/stxb201412082428
*通讯作者Corresponding author.E-mail: wujb@iae.ac.cn
孙金伟, 吴家兵, 任亮, 张冠华, 任斐鹏, 姚付启.氮添加对长白山阔叶红松林2种树木幼苗光合生理生态特征的影响.生态学报,2016,36(21):6777- 6785.
Sun J W, Wu J B, Ren L, Zhang G H, Ren F P, Yao F Q.Response of photosynthetic physiological characteristics to nitrogen addition by seedlings of two dominant tree species in a broadleaved-Korean pine mixed forest on Changbai Mountain.Acta Ecologica Sinica,2016,36(21):6777- 6785.
