大型海藻在珊瑚礁退化过程中的作用
2016-12-28廖芝衡余克服王英辉
廖芝衡,余克服,王英辉
1 广西大学珊瑚礁研究中心,南宁 530004 2 广西大学海洋学院,南宁 530004 3 广西大学林学院,南宁 530004 4 中国科学院南海海洋研究所,广州 510301
大型海藻在珊瑚礁退化过程中的作用
廖芝衡1,2,3,余克服1,2,4,*,王英辉1,2
1 广西大学珊瑚礁研究中心,南宁 530004 2 广西大学海洋学院,南宁 530004 3 广西大学林学院,南宁 530004 4 中国科学院南海海洋研究所,广州 510301
随着全球范围珊瑚礁的退化,大型海藻在珊瑚礁区的覆盖度呈增多的趋势。大型海藻的大量生长,妨碍了珊瑚的生长、繁殖、恢复等过程。概括起来,大型海藻对珊瑚生长、繁殖及恢复过程所产生的不利影响主要包括:(1)大型海藻通过与珊瑚竞争空间和光照而影响珊瑚生长;(2)大型海藻与珊瑚直接接触时,通过摩擦作用及释放化感物质而影响珊瑚生长;(3)大型海藻的大量生长打破了珊瑚与海藻的竞争平衡,珊瑚为应对大型海藻的入侵而把用于生长和繁殖的能量转移到组织修复与防御上,进而造成珊瑚繁殖能量的减少;(4)大型海藻通过影响珊瑚幼虫的附着及附着后的存活率,而阻碍珊瑚群落的发展;(5)海藻还能通过富集沉积物、释放病原体及扰乱珊瑚共生微生物的生长等而间接影响珊瑚生长。明确的竞争机制有利于研究海藻与珊瑚的相互作用过程。在总结前人对海藻与珊瑚的竞争机制研究的基础上,把两者的竞争机制划分成物理机制、化学机制、微生物机制三大类,物理机制是研究得比较透彻的竞争机制,而化学机制与微生物机制则需要更深入的研究,是当前研究的热点。目前,我国对珊瑚礁中底栖海藻与珊瑚的相互作用研究甚少;鉴于此,对底栖海藻功能群的划分类型以及三大类型底栖海藻对珊瑚的作用特点做了简要介绍,并对珊瑚礁退化的现状和退化珊瑚礁区内海藻的表现做了概述。在此基础上,再综述国外关于大型海藻对珊瑚的影响研究进展,指出我国应该加强对南海珊瑚礁区大型海藻的种类分布及丰富度等的调查,评价大型海藻对南海珊瑚礁的影响现状;并结合生理学、分子生物学技术和生态学研究手段,在细胞与分子水平上探索海藻对珊瑚的影响机制,以期为珊瑚礁生态系统的保护提供参考。
珊瑚;海藻;大型海藻;珊瑚礁退化;竞争机制
热带珊瑚礁拥有丰富的生物多样性和极高的初级生产力,主要以造礁珊瑚支撑礁区复杂的生态结构[1]。珊瑚礁生态系统为人类社会提供了大量的资源服务,如食物供给、旅游开发、药材及海岸带防护等[2]。然而近几十年来,由于人类活动的影响和自然环境的变化,世界范围内的珊瑚礁生态系统大幅度地退化,活珊瑚覆盖度急剧下降,而礁区大型海藻的覆盖度和生物量则呈现快速增加的趋势[3]。珊瑚礁的退化严重影响了礁栖生物的生境及其生物多样性[4]。
珊瑚礁的退化一方面表现为活珊瑚覆盖度的下降,另一方面表现为礁区大型海藻覆盖度的增加。这种由造礁珊瑚占主导转变成海藻占主导的过程,称之为生态相变(phase shifs)[5]。珊瑚与海藻在珊瑚礁中互为消长的竞争关系,对珊瑚礁生态系统的结构和组成有重要影响。然而,关于珊瑚礁中海藻与珊瑚的动态变化关系仍然缺乏直接的实验证据支撑,得到的多数证据只是相关的或者间接的[6]。海藻的大量生长是否就是珊瑚覆盖度下降的直接原因目前尚没有定论[7];但是,海藻的大量生长占据了珊瑚的生长空间、影响了珊瑚共生虫黄藻的光合作用却是不争的事实[8]。目前,我国对珊瑚礁生态系统的研究多集中在珊瑚本身,对大型海藻的生态作用关注甚少。因此,本文综述国外关于大型海藻对珊瑚礁的影响研究成果,希望为我国珊瑚礁生态系统的研究提供相关依据。
1 珊瑚礁中的海藻
大型海藻的种类繁多,至少包含绿藻门、红藻门、褐藻门及蓝藻门这4个门的藻类[9]。礁区内的底栖海藻通常是按照功能群来划分的,包括皮壳状珊瑚藻(Crustose Coralline Algae)、草皮海藻(Turf Algae)和大型海藻(Macroalgae),每一种功能群都包含着不同种类的海藻[10]。关于底栖海藻功能群类型的划分,不同的学者有不同的划分类型。Steneck等[11]依据腹足类动物对大型海藻取食性把大型海藻划成7种功能群类型,即丝状海藻(Filamentous Algae)、叶状海藻(Foliose Algae)、具皮层叶状海藻(Corticated Foliose Algae)、具皮层大型海藻(Corticated Macrophyte)、革质大型海藻(Leathery Macrophyte)、铰接钙化藻(Articulated Calcareous Algae)、皮壳状海藻(Crustose Algae)。在此基础上,Littler等[12]依据大型海藻的养分吸收率、生产力和抗食能力等把大型海藻分成六种不同的功能群类型。
海藻是珊瑚礁生态系统的重要组成部分,为珊瑚礁区提供了关键的生态学功能,如稳定珊瑚礁的结构、参与热带海域沙滩形成、礁区营养盐的保持和循环、产生初级生产力和提供摄食等[13]。皮壳状珊瑚藻,包括铰接钙化藻和具壳海藻,通常被认为与珊瑚礁的健康状况有关,对珊瑚是有利的;珊瑚藻在促进珊瑚虫的附着和存活方面起到重要作用[14]。珊瑚礁区内只有大型海藻和草皮海藻对珊瑚产生不利影响[15]。草皮海藻是短丝状海藻、大型海藻幼体和蓝藻的异质集合体[16]。草皮海藻对珊瑚的影响大多数都是负面的,对毗邻珊瑚组织的完整性、生理机能和繁殖能力都有不利影响[16- 17]。此外,草皮海藻对珊瑚幼虫的附着以及存活也有影响[18]。然而大型海藻包含有叶状海藻、具皮层叶状海藻、具皮层大型海藻、革质大型海藻等功能群类型的海藻。多数大型海藻都会抑制珊瑚的生长,会降低珊瑚的生长率及其共生虫黄藻的光合效率,引起珊瑚白化[8];大型海藻与珊瑚竞争时,还会导致珊瑚繁殖能力的下降[18];另外,大型海藻对退化珊瑚群落的恢复也有影响[19]。然而大型海藻并不总是损害珊瑚,某些大型海藻对珊瑚的遮蔽作用还能使珊瑚避免白化,季节性生长的大型海藻对珊瑚组织也没有明显的损害作用[20]。本文主要讲述珊瑚礁区的大型海藻对珊瑚产生的负面作用过程,并简要介绍海藻与珊瑚的3种常见竞争机制。
2 珊瑚礁退化概况
在2008年,Wilkinson对全球珊瑚礁的健康状况做出了评估,认为全球珊瑚礁减少了19%,处于紧急状态的珊瑚礁为15%,20%的珊瑚礁正受到威胁,仅有46%的珊瑚礁相对健康[21]。McClanahan 等[22]对位于中美洲东北部伯利兹的一个环礁观测了25年后发现环礁内的石珊瑚覆盖度减少了75%,其中鹿角珊瑚的覆盖度减少了99%。即便是受人类活动影响较小的澳大利亚大堡礁,在1986—2004年间活珊瑚覆盖度也减少了22%—28%[23]。赵美霞等[24]对海南三亚鹿回头的珊瑚礁调查发现,礁区活珊瑚覆盖度从20世纪五六十年代的80%—90%下降到2006年的12.16%。更大尺度上的调查研究也表明世界范围内的珊瑚礁正处于退化过程。Bruno 等[25]在2003年对印度-太平洋的390个珊瑚礁进行调查发现:珊瑚的平均覆盖度只有22.1%,只有2%的珊瑚礁中的活珊瑚覆盖度超过60%。对大多数珊瑚礁的长期动态变化的研究都表明,世界范围内的珊瑚礁正处于退化状态,但不同区域的珊瑚礁退化程度有所差别[22- 23]。
近几十年来,全球范围内的珊瑚礁普遍发生了退化现象[26]。导致珊瑚礁退化的因素是错综复杂的,包括海水温度升高[27]、过度捕捞和海水富营养化[28]、热带风暴损害、珊瑚疾病[29]等。虽然许多的研究者对珊瑚礁做了很好的研究,但是仍然不能充分地确认导致珊瑚礁退化的真正原因[30]。
3 大型海藻在珊瑚礁退化中的表现
在礁区内,对生存空间的竞争是构建珊瑚礁群落的主要作用[31];而底栖海藻与石珊瑚之间的竞争,在整个珊瑚礁中处于基础地位,特别是在由造礁珊瑚占主导转变成由大型海藻占优势的生态相变过程中[6]。退化珊瑚礁中,珊瑚原有的生存空间通常会被海藻所占据[32]。Nugues 等[33]在1979—2006年间对库拉索岛珊瑚礁区匍扇藻(Lobophoravariegate)的观测发现,其覆盖度由1998年的1%—5%,增加到2006年的18%—25%。在严重退化的珊瑚礁内,大型海藻覆盖度增加的现象尤为明显。如在中美洲东北部伯利兹的一个环礁内,石珊瑚的覆盖度在25年内减少了75%,而大型海藻的覆盖度却从原来的20%增加到80%[22]。在退化的珊瑚礁内,大型海藻的覆盖度通常都会大幅度地增加,因此,这也是评价珊瑚礁生态系统健康状况的重要指标之一[33]。
目前还没有实验能证明大型海藻在珊瑚群落上的大量生长是两者竞争的结果。大型海藻不能在占据珊瑚礁之前就引起珊瑚的大量死亡[34];大型海藻的大量生长似乎是珊瑚受到外界干扰(如白化、风暴损害等)而死亡之后的结果[35]。Diaz-Pulido 等[36]在观测中岛、中途岛和巴伦岛礁坡的珊瑚和大型海藻的覆盖度动态变化过程发现,珊瑚的白化先于匍扇藻的大量生长,大型海藻的过度生长只发生在白化或者死亡的珊瑚上。珊瑚礁区大型海藻的普遍增多,也可能是礁区富营养化所导致的[37]。目前,大型海藻的增加是否就是珊瑚覆盖度下降的直接原因尚没有定论[7];但清楚的是,大型海藻在珊瑚礁的定植会影响珊瑚的生长和共生虫黄藻的光合作用[8]、引起珊瑚组织的损伤与降低珊瑚的繁殖能力[38]、以及抑制珊瑚群落的恢复等[19]。
4 大型海藻对珊瑚的直接影响
4.1 竞争空间与光照
大型海藻在礁区的大量生长,通常是发生在珊瑚礁生态系统受到干扰之后,并优先抢占礁区的生存空间而抑制珊瑚的恢复定植[6]。能形成遮蔽作用而抑制珊瑚对空间的需求的大型海藻主要是叶状海藻、革质大型海藻等[20]。除了遮蔽作用,一些丝状的草皮海藻和贴壁生长的壳状、片状海藻还会导致珊瑚窒息而死亡[39]。某些大型海藻聚集形成的冠层起遮光作用,会减弱冠层下的珊瑚体内虫黄藻的光合作用,进而影响珊瑚的生长率[40]。Buckley 等[41]发现芥末滨珊瑚(Poritesastreoides)的RNA/DNA的比率随光照的减弱而减小,暗示低光照条件会导致珊瑚生长率的减小。然而,也有学者发现某些大型海藻的遮蔽作用对珊瑚的影响是相对比较小的,甚至能使珊瑚免受高温白化[20]。总之,大型海藻确实与珊瑚竞争空间与光照,特别是在礁区受到干扰之后;大型海藻过量生长而占据礁区生存空间,在一定程度上影响了珊瑚的生长[8]。
4.2 大型海藻与珊瑚的接触影响
大型海藻与珊瑚直接接触时,主要通过摩擦作用(Abrasion)和化感作用(Allelopathy)对珊瑚的生长造成影响[42]。珊瑚礁区内大型海藻的生长,不可避免地与珊瑚发生接触。已有实验证明,某些大型海藻与珊瑚接触会导致珊瑚生长率的降低,甚至白化和死亡。Lirman 等[40]通过实验发现,芥末滨珊瑚在与大型海藻接触处理后的生长率下降了10倍。此外,Titlyanov 等[8]发现,澄黄滨珊瑚(Poriteslutea)与大型海藻Lyngbyabouillonii接触后,澄黄滨珊瑚体内虫黄藻的光合作用Ⅱ阶段的光化学效率(Fv/Fm)与叶绿素的浓度都显著地减小,并引起珊瑚组织的损伤和白化。
4.2.1 摩擦作用
摩擦作用是大型海藻影响珊瑚的一种物理机制,会直接影响珊瑚的生长。礁区内能对珊瑚造成摩擦损伤的海藻功能群类型主要是革质大型海藻、具皮大型海藻以及具皮直立叶状海藻[6]。River 等[43]在研究大型海藻Sargassumhystrix对指滨珊瑚(Poritesporites)的生长及珊瑚虫的伸展的影响时发现,珊瑚在有海藻存在时,生长率下降了80%,而这种影响在隔离海藻时却消失了;在用Sargassumhystrix与模拟海藻(塑料)接触处理珊瑚时,珊瑚生长率分别为80%和25%,珊瑚虫的收缩率分别为97%和71%[43]。大型海藻通过摩擦作用刺激珊瑚虫的收缩,影响了珊瑚虫的摄食行为和钙化作用,进而抑制珊瑚的生长[6]。
4.2.2 化感作用
化感作用是海藻影响珊瑚的一种化学防御机制。藻类的化感作用是指藻类向环境中释放化学物质影响其它藻类或者其它生物生长的一种生态学、生理学现象[44]。能产生化感作用的大型海藻主要是丝状海藻[6];但最近的研究表明,多数种类的大型海藻都能通过化感作用损害珊瑚[42,45- 46]。Rasher 等[45]发现指滨珊瑚与多种海藻接触培养20d后,珊瑚发生了显著的白化现象;珊瑚与大型海藻中提取的可溶性磷脂培养24h后也发生了白化现象。大型海藻对珊瑚的化感作用具有一定的选择性与专一性。Rasher 等[42]通过丝状乳节藻(Galaxaurafilamentosa)、匍枝马尾藻(Sargassumpolycystum)的提取物胁迫处理Poritescylindrica时发现,丝状乳节藻处理组产生高浓度的化感物质而损伤珊瑚组织,而匍枝马尾藻处理组对珊瑚无显著影响。但是,目前关于大型海藻对珊瑚的化感作用机制和生理影响过程的研究还很缺乏[42]。
4.3 大型海藻对珊瑚繁殖的影响
珊瑚礁区内的海藻与珊瑚是相互竞争的,当竞争平衡被海藻的大量生长而打破时,珊瑚为应对海藻入侵造成的竞争损伤,把用于生长和繁殖的能量转移到防御和修复损伤组织上,进而造成珊瑚繁殖能量分配的减少而降低珊瑚的繁殖能力[47]。Rinkevich 等[48]认为珊瑚的繁殖过程是一种高耗能的行为,任何消耗珊瑚储存能量的外界压力都会影响珊瑚的繁殖能力。大型海藻与珊瑚的相互竞争,无疑会造成珊瑚繁殖能量的损耗。所以,与珊瑚竞争的多数功能群类型的大型海藻都有可能会降低珊瑚的生殖力[18]。
大型海藻大量生长时,通过物理和化学作用对珊瑚组织造成损伤,进而减弱珊瑚群落的有性繁殖能力[18]。Tanner 等[47]发现鹿角珊瑚生境内存在过量大型海藻时,浮浪幼虫的产量减少了50%。而Foster 等[49]在用网地藻属的某些种(Dictyotaspp.)、匍扇藻和混合藻群分别与高星珊瑚(Montastraeaannularis)接触处理时发现,这些大型海藻都能使高星珊瑚卵的直径减小;而在移除海藻后,高星珊瑚的每个生殖腺内卵的数量与直径以及生殖腺的数量都有所增加[49]。有性繁殖是珊瑚群落基因多样性来源的重要的途径,珊瑚卵的数量与质量的下降,必然会降低浮浪幼虫的数量与存活率,进而影响珊瑚群落的多样性与稳定性[50]。
4.4 大型海藻对珊瑚群落恢复的影响
大型海藻对珊瑚群落恢复的抑制作用,是退化的珊瑚群落得以恢复的关键瓶颈[19]。珊瑚浮浪幼虫成为固着幼体包括沉降与形变两个阶段,珊瑚浮浪幼虫附着后的存活也是珊瑚群落成功恢复的必要条件。大型海藻对珊瑚补充的持续过程造成的不利影响,会影响到珊瑚个体的成功补充,进而影响珊瑚群落的恢复[19]。
礁区内阻碍珊瑚幼虫附着的海藻功能群主要是皮质大型海藻和革质大型海藻[6]。Diaz-Pulido 等[51]通过检测不同功能群的大型海藻对精巧扁脑珊瑚(Platygyradaedalea)浮浪幼虫的附着影响发现,8天后浮浪幼虫在肉质大型海藻处理组的附着率小于5%,而在皮壳状珊瑚藻和草皮海藻处理组的附着率分别为30%和25%。Kuffner 等[52]在检测鞘丝藻属的某些种(Lyngbyaspp.)、网地藻属的某些种(Dictyotaspp.)、匍扇藻和Laurenciapoiteaui等大型海藻对芥末滨珊瑚浮浪幼虫附着的影响发现,除了Laurenciapoiteaui外,其余的大型海藻都能抑制浮浪幼虫的附着或使浮浪幼虫产生回避行为。此外,Kuffner 等[53]在用同种海藻处理不同种的珊瑚浮浪幼虫时发现,巨大鞘丝藻(Lyngbyamajuscula)对风信子鹿角珊瑚(Acroporahyacinthus)浮浪幼虫的附着影响,大于其对鹿角杯形珊瑚(Pocilloporadamicornis)浮浪幼虫的附着影响。大型海藻对珊瑚幼虫补充恢复的影响依据两者的种类而定,多数大型海藻都会阻碍浮浪幼虫的附着,即便有合适的基质存在[53]。
海水的水质条件也能够直接影响珊瑚幼虫的存活与附着,对新补充的珊瑚个体存在潜在影响[54]。大型海藻能够向水体中释放出水溶性化学物质,海水中的化学物质浓度过高时,就会对珊瑚幼体的补充会产生影响[46]。Dixson 等[55]通过检测多孔鹿角珊瑚(Acroporamillepora)、鼻形鹿角珊瑚(Acroporanasuta)、柔枝轴孔珊瑚(Acroporatenuis)的浮浪幼虫对保护区(大型海藻覆盖度为1%—2%,珊瑚覆盖度为38%—56%)与非保护区(大型海藻覆盖度为49%—91%,珊瑚覆盖度为4%—16%)海水的偏好性,发现游向保护区的浮浪幼虫数量是游向非保护区的6倍。然而,并非所有种类的海藻都对珊瑚群落恢复造成不利影响,珊瑚藻和某些钙化藻通常认为对珊瑚个体的补充有促进的作用[56]。
4.5 大型海藻对珊瑚的其它影响
大型海藻除了直接影响珊瑚的生长,还通过间接的方式影响珊瑚的生长,如通过富集沉积物[57]、释放病原体感染珊瑚或者造成珊瑚缺氧[58]。沉积物的存在对珊瑚的生长与附着都会产生负面影响,草皮海藻经常会富集沉积物而影响珊瑚幼虫的附着[57]。大型海藻也能通过扰乱健康珊瑚体内共生微生物的正常功能,或者向邻近珊瑚释放出病原体,使珊瑚感染疾病[59]。此外,大型海藻还能通过释放水溶性有机物(DOC),增加珊瑚附近微生物的活性,进而造成低氧环境或引起珊瑚疾病[58]。
5 大型海藻与珊瑚的竞争机制
5.1 物理机制
大型海藻与珊瑚竞争的物理机制主要是指大型海藻通过物理方法直接或间接影响珊瑚的生长、恢复的过程,物理机制是最初研究大型海藻与珊瑚相互竞争的关注点,是研究得比较透彻的一种机制[6]。大型海藻与珊瑚竞争的物理机制主要包括:大型海藻过度生长导致的覆盖作用、大型海藻的冠层形成的遮蔽作用、大型海藻对珊瑚造成的擦伤作用、以及大型海藻对空间的优先抢占等[6]。大型海藻在珊瑚表面的覆盖作用通常会造成珊瑚的窒息死亡[39],遮蔽作用则通过降低光照强度而影响珊瑚生长[20],擦伤作用是由于柔软的大型海藻在海流作用下抽打在珊瑚表面造成的直接伤害[6];大型海藻对空间的优先抢占作用通常表现在珊瑚群落受到干扰后,一些快速生长的大型海藻能阻碍受干扰珊瑚群落的恢复[19]。
关于各种功能群类型的大型海藻与不同生活型的珊瑚的可能竞争机制类型(主要是物理机制),McCook等[6]已经做了详细的汇总,见表1。从表1中可以看出,两者的竞争机制类型与大型海藻的功能群类型和珊瑚的生活型有很大的相关性[5],但是两者的竞争机制类型更加取决于海藻的性质[6]。表1中,几乎所有类型的海藻功能群对珊瑚都有过度生长的作用;产生化学作用的主要是丝状海藻,但是现在很多的研究都表明,对珊瑚起化学作用的不止是丝状海藻[42,45];对珊瑚起遮蔽作用的多数都是革质大型海藻,但也有研究认为叶状的大型海藻对珊瑚也起到遮蔽作用[20];对珊瑚起擦伤作用的海藻多数为具皮或革质的大型海藻;海藻对珊瑚新个体的影响是比较敏感的,各种竞争机制都有可能阻碍珊瑚新个体的生长。
表1 大型海藻影响珊瑚生长的竞争机制(依据大型海藻的功能群和珊瑚的生活型进行分类)[6]
Table 1 The competitive mechanisms of macroalgae affecets corals(Matrix of mechanisms by macroalgae functional groups and coral life forms)[6]
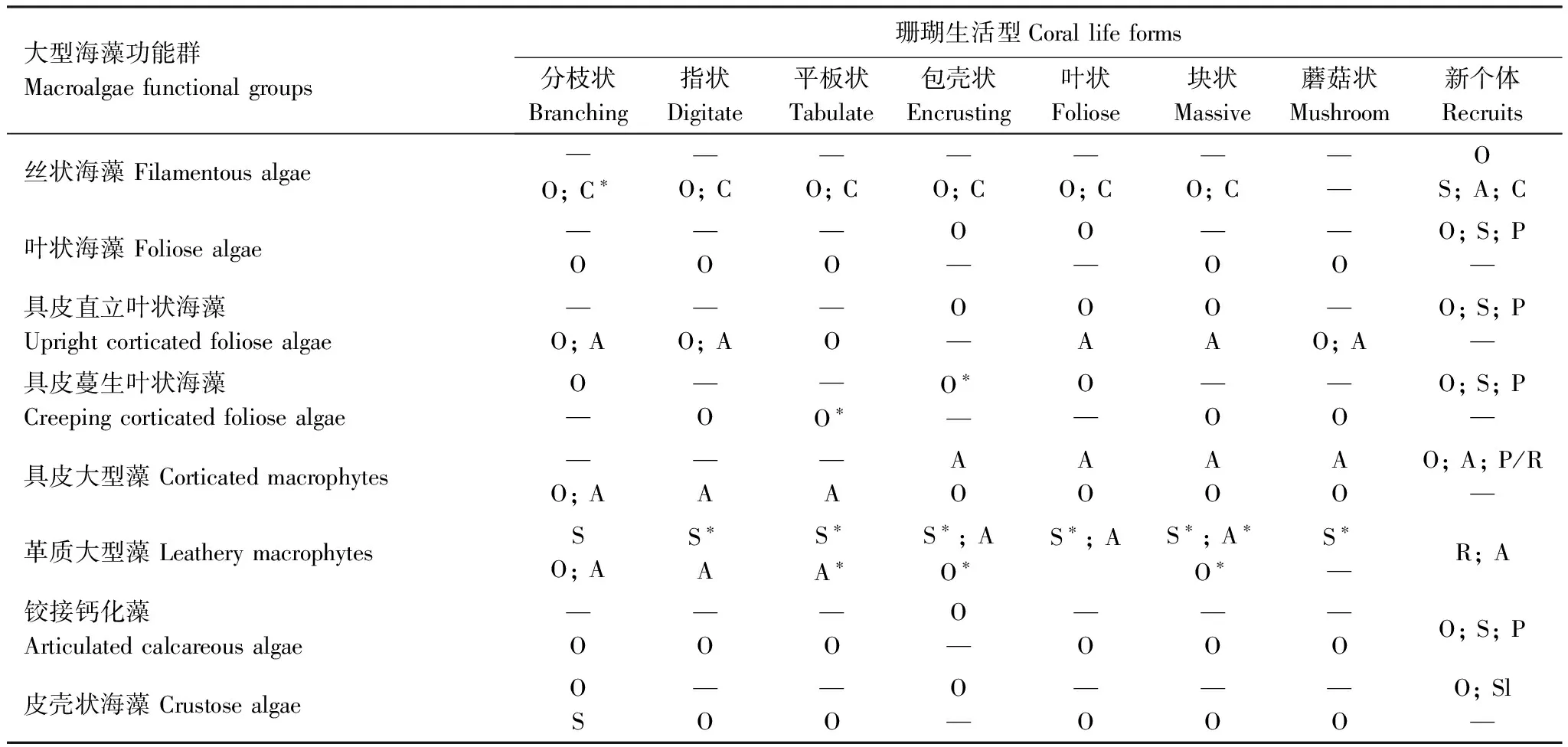
大型海藻功能群Macroalgaefunctionalgroups珊瑚生活型Corallifeforms分枝状Branching指状Digitate平板状Tabulate包壳状Encrusting叶状Foliose块状Massive蘑菇状Mushroom新个体Recruits丝状海藻Filamentousalgae—O;C∗—O;C—O;C—O;C—O;C—O;C——OS;A;C叶状海藻Foliosealgae—O—O—OO—O——O—OO;S;P—具皮直立叶状海藻Uprightcorticatedfoliosealgae—O;A—O;A—OO—OAOA—O;AO;S;P—具皮蔓生叶状海藻CreepingcorticatedfoliosealgaeO——O—O∗O∗—O——O—OO;S;P—具皮大型藻Corticatedmacrophytes—O;A—A—AAOAOAOAOO;A;P/R—革质大型藻LeatherymacrophytesSO;AS∗AS∗A∗S∗;AO∗S∗;AS∗;A∗O∗S∗—R;A铰接钙化藻Articulatedcalcareousalgae—O—O—OO——O—O—OO;S;P皮壳状海藻CrustosealgaeOS—O—OO——O—O—OO;Sl—
每个单元有两行,第一行的竞争机制是可能的或者普遍的;第二行的竞争机制是作者认为会发生,但没那么重要或普遍;O:过度生长;S:遮蔽;A:擦伤;C:化学作用;P:优先抢占;R:恢复阻碍;Sl:上皮脱落;—:无适用机制;*由作者观测或未发表的数据所支撑的机制
5.2 化学机制
海藻与珊瑚竞争的化学机制主要是指海藻产生的化感物质(脂溶性或者水溶性有机次生代谢物)进入珊瑚体内,对珊瑚造成不利影响的一种化学过程[45,58]。但是也有研究认为,海藻产生的化感物质是通过接触珊瑚表面后才进入珊瑚体内,而不是通过溶解在水里,所以大型海藻产生的化感物质是脂溶性的而不是水溶性的次生代谢物[60]。化感物质进入到珊瑚细胞内会改变珊瑚正常的生理活动,引起珊瑚白化、珊瑚组织坏死以及降低珊瑚共生藻的光合效率等[42,45]。Rasher 等[45]发现匍扇藻、仙掌藻(Halimedaopuntia)、脆叉节藻(Amphiroafragilissima)等多种大型海藻不仅引起指滨珊瑚的显著白化,还能抑制指滨珊瑚的光合效率(52%—90%)。某些化感物质进入珊瑚体内后还能够刺激珊瑚上的微生物的生长而损害珊瑚。Morrow等[61]通过室内研究发现,从两种网地藻中提取的亲脂性提取液,对珊瑚表面50%的细菌都有影响。尽管有许多的模拟实验演示了化学机制在介导海藻与珊瑚竞争过程中的潜在重要性,但是还没有一种海藻产生的化合物被证实能够调解海藻与珊瑚的相互作用[51,58]。海藻影响珊瑚生长的化学机制还需要更深入的研究。
5.3 微生物机制
珊瑚疾病通常是由微生物引起的,已经成为危害珊瑚健康的一个重要因素[62]。目前已知的珊瑚疾病类型有30多种,而确定病原体的却只有6种[29]。在大型海藻与珊瑚上都携带着各种微生物,Morrow 等[61]从大型海藻与珊瑚接触后的部位及接触后珊瑚产生的粘液中分离出250种细菌。通常情况下,健康珊瑚体内的细菌群落由于缺乏一些新陈代谢过程(如有机硫的代谢)而不会对珊瑚的健康造成影响[15]。
海藻通过微生物影响珊瑚的生长是一种间接方式。大型海藻能通过释放化学物质(包括可溶性有机物(DOC)、化感物质等)而干扰珊瑚上的微生物群落,可溶性有机物(DOC)被认为会增加珊瑚体内微生物的活性而引发珊瑚疾病[58]。在一些实验中,移除大型海藻或者添加广谱抗生素后,海藻与珊瑚相互竞争造成的缺氧环境都能得到缓解,这表明缺氧环境可能是海藻引起细菌活跃的结果[15,58]。通过DDAM模型能认识到,大型海藻通过释放可溶性有机物(DOC)增加细菌活性而引起珊瑚疾病和死亡[10]。此外,某些海藻还会向邻近珊瑚传输病原体而引起珊瑚疾病。Nugues 等[59]发现仙掌藻通过释放橙单细胞菌(Aurantimonascoralicida)使造礁珊瑚Montastraeafaveolata患上白色瘟疫-Ⅱ疾病。珊瑚的抗病能力与其共生微生物群落关系密切,而共生微生物群落的稳定性与外界环境因子的改变密切相关[29]。虽然进行了很多的研究,但是大多数珊瑚疾病的病原学介质还不是很清楚的[63]。微生物感染珊瑚机会的增多,可能是大型海藻与珊瑚的竞争加剧造成的,也可能是海水温度升高、海水透明度减小、富营养化、过度捕捞等的后果[10]。
6 研究展望
我国珊瑚礁主要分布在南沙群岛、中沙群岛、西沙群岛、东沙群岛、海南岛、华南大陆沿岸、台湾岛等七大区域[2]。相较国外发达国家,我国在珊瑚礁生态系统的研究方面缺乏长期的现场观测和实验生物学的研究,特别是大型海藻在珊瑚礁生态系统中的作用亟待加强。目前,我国学者对大型海藻的研究,多集中在区域性大型海藻的群落结构、区系分析、多样性变化等方面[64];此外,在利用大型海藻防治海水富营养化、控制赤潮方面等方面也做了相关研究[65- 66]。底栖海藻是珊瑚礁区不可或缺的成员,是珊瑚礁生态系统初级生产力的主要来源,对维持珊瑚礁生态系统的稳定有重要作用[13]。
综上所述,大型海藻对礁区珊瑚的影响途径是多种多样的,大型海藻的大量生长给珊瑚带来的不利影响,是退化珊瑚礁恢复的关键屏障。珊瑚礁区内的大型海藻与珊瑚是相互竞争的,大型海藻能通过物理机制、化学机制及微生物机制直接或间接地对珊瑚的生长、繁殖、补充恢复过程造成不利影响,进而阻碍退化珊瑚礁的恢复或促使受干扰珊瑚群落的进一步退化。我国在大型海藻对珊瑚礁生态系统的影响方面的研究几乎是空白,有必要在以下几个方面加强研究:
(1)调查我国珊瑚礁区主要大型海藻的种类、分布与丰富度等,评价大型海藻对珊瑚礁生态系统的影响状况;
(2)开展现场调查与室内模拟实验,研究大型海藻对珊瑚生长、退化和恢复过程的作用机理;
(3)开展大型海藻与珊瑚竞争过程的长期观测研究,观测两者的动态变化关系;
(4)研究大型海藻抑制珊瑚的生长、繁殖和补充的影响机制,特别是通过大型海藻起作用的化学机制和微生物机制,结合生理学和分子生物学技术及生态学研究手段,从微观角度研究大型海藻对珊瑚的影响机制。
[1] Knowlton N. Ecology-Coral Reef Biodiversity-Habitat Size Matters. Science, 2001, 292(5521): 1493- 1495.
[2] 余克服. 南海珊瑚礁及其对全新世环境变化的记录与响应. 中国科学:地球科学, 2012, 42(8): 1160- 1172.
[3] Steneck R S, Vavrinec J, Leland A V. Accelerating trophic-level dysfunction in kelp forest ecosystems of the western North Atlantic. Ecosystems, 2004, 7(4): 323- 332.
[4] Knowlton N, Jackson J B C. Shifting baselines, local impacts, and global change on coral reefs. PLoS Biology, 2008, 6(2): 215-220.
[5] Littler M M, Littler D S. Models of tropical reef biogenesis: the contribution of algae. Progress in Phycological Research, 1984, 3: 323- 364.
[6] McCook L J, Jompa J, Diaz-Pulido G. Competition between corals and algae on coral reefs: a review of evidence and mechanisms. Coral Reefs, 2001, 19(4): 400- 417.
[7] Aronson R B, Precht W F. Conservation, precaution, and Caribbean reefs. Coral Reefs, 2006, 25(3): 441- 450.
[8] Titlyanov E A, Yakovleva I M, Titlyanova T V. Interaction between benthic algae (Lyngbyabouillonii,Dictyotadichotoma) and scleractinian coralPoritesluteain direct contact. Journal of Experimental Marine Biology and Ecology, 2007, 342(2): 282- 291.
[9] Lee R E. Phycology. 4th ed. Cambridge: Cambridge University Press, 2008: 1- 560.
[10] Barott K L, Rohwer F L. Unseen players shape benthic competition on coral reefs. Trends in Microbiology, 2012, 20(12): 621- 628.
[11] Steneck R S, Watling L. Feeding capabilities and limitation of herbivorous molluscs: A functional group approach. Marine Biology, 1982, 68(3): 299- 319.
[12] Littler M M, Littler D S. A relative-dominance model for biotic reefs// Proceedings of the joint meeting of the atlantic reef committee society of reef studies. Miami, 1984.
[13] Fong P, Paul V J. Coral reef algae// Dubinsky Z, Stambler N eds. Coral reefs: an ecosystem in transition. New York: Springer, 2011: 241- 272.
[14] Arnold S N, Steneck R S. Settling into an increasingly hostile world: the rapidly closing "recruitment window" for corals. PLoS One, 2011, 6(12): e28681.
[15] Barott K L, Rodriguez-Mueller B, Youle M, Marhaver K L, Vermeij M J A, Smith J E, Rohwer F L. Microbial to reef scale interactions between the reef-building coralMontastraeaannularisand benthic algae. Proceedings of the Royal Society B-Biological Sciences, 2012, 279(1733): 1655- 1664.
[16] Fricke A, Teichberg M, Beilfuss S, Bischof K. Succession patterns in algal turf vegetation on a Caribbean coral reef. Botanica Marina, 2011, 54(2): 111- 126.
[17] Vermeij M J A, van Moorselaar I, Engelhard S, Hörnlein C, Vonk S M, Visser P M. The Effects of Nutrient Enrichment and Herbivore Abundance on the Ability of Turf Algae to Overgrow Coral in the Caribbean. PLoS One, 2010, 5(12): e14312.
[18] Hughes T P, Rodrigues M J, Bellwood D R, Ceccarelli D, Hoegh-Guldberg O, McCook L, Moltschaniwskyj N, Pratchett M S, Steneck R S, Willis B. Phase shifts, herbivory, and the resilience of coral reefs to climate change. Current Biology, 2007, 17(4): 360- 365.
[19] Birrell C L, McCook L J, Willis B L, Diaz-Pulido G A. Effects of benthic algae on the replenishment of corals and the implications for the resilience of coral reefs. Oceanography and Marine Biology: An Annual Review, 2008, 46: 25- 63.
[20] Jompa J, McCook L J. Coral-algal competition: macroalgae with different properties have different effects on corals. Marine Ecology Progress Series, 2003, 258: 87- 95.
[21] Wilkinson C. Status of coral reefs of the world: 2008. Townsville, Australia: Australian Institute of Marine Science, 2008: 1- 304.
[22] McClanahan T R, Muthiga N A. An ecological shift in a remote coral atoll of Belize over 25 years. Environmental Conservation, 1998, 25(2): 122- 130.
[23] Sweatman H, Delean S, Syms C. Assessing loss of coral cover on Australia′s Great Barrier Reef over two decades, with implications for longer-term trends. Coral Reefs, 2011, 30(2): 521- 531.
[24] 赵美霞, 余克服, 张乔民, 施祺. 近 50 年来三亚鹿回头岸礁活珊瑚覆盖率的动态变化. 海洋与湖沼, 2010, 41(3): 440- 447.
[25] Bruno J F, Selig E R. Regional decline of coral cover in the Indo-Pacific: timing, extent, and subregional comparisons. PLoS One, 2007, 2(8): e711.
[26] Wilkinson C R. Status of Coral Reefs of the World: 2004. Townsville: Australian Institute of Marine Science, 2004: 1- 316.
[27] Miranda R J, Cruz I C S, Leão Z M A N. Coral bleaching in the Caramuanas reef (Todos os Santos Bay, Brazil) during the 2010 El Nio event. Latin American Journal of Aquatic Research, 2013, 41(2): 351- 360.
[28] Kuntz N M, Kline D I, Sandin S A, Rohwer F. Pathologies and mortality rates caused by organic carbon and nutrient stressors in three Caribbean coral species. Marine Ecology Progress Series, 2005, 294(1): 173- 180.
[29] 黄玲英, 余克服. 珊瑚疾病的主要类型、生态危害及其与环境的关系. 生态学报, 2010, 30(5): 1328- 1340.
[30] Bellwood D R, Hughes T P, Folke C, Nyström M. Confronting the coral reef crisis. Nature, 2004, 429(6994): 827- 833.
[31] Lang J C, Chornesky E A. Competition between scleractinian reef corals: a review of mechanisms and effects// Dubinsky Z. Ecosystems of the World: Coral Reefs, 1990: 209- 252.
[32] Diaz-Pulido G, McCook L J. Effects of live coral, epilithic algal communities and substrate type on algal recruitment. Coral Reefs, 2004, 23(2): 225- 233.
[33] Nugues M M, Bak R P M. Long-term dynamics of the brown macroalgaLobophoravariegataon deep reefs in Curacao. Coral Reefs, 2008, 27(2): 389- 393.
[34] Ramos C A C, de Kikuchi R K P, Amaral F D, Fauth J E. A test of herbivory-mediated coral -algae interaction on a Brazilian reef during a bleaching event. Journal of Experimental Marine Biology and Ecology, 2014, 456: 1- 7.
[35] Diaz-Pulido G, Di-Az J M. Algal assemblages in lagoonal reefs of Caribbean Oceanic Atolls// Lessios H A, Macintyre I G. Proceedings of the 8th International Coral Reef Symposium. Balboa, Panama: Smithsonian Tropical Research Institute, 1997: 827- 832.
[36] Diaz-Pulido G, McCook L J, Dove S, Berkelmans R, Roff G, Kline D I, Weeks S, Evans R D, Williamson D H, Hoegh-Guldberg O. Doom and boom on a resilient reef: Climate change, algal overgrowth and coral recovery. PLoS One, 2009, 4(4): e5239.
[37] Greenaway A M, Gordon-Smith D A. The effects of rainfall on the distribution of inorganic nitrogen and phosphorus in Discovery Bay, Jamaica. Limnology and Oceanography, 2006, 51(5): 2206- 2220.
[38] Haas A, el-Zibdah M, Wild C. Seasonal monitoring of coral-algae interactions in fringing reefs of the Gulf of Aqaba, Northern Red Sea. Coral Reefs, 2010, 29(1): 93- 103.
[39] Hughes T P. Communnity structure and diversity of coral reefs: the role of history. Ecology, 1989, 70(1): 275- 279.
[40] Lirman D. Competition between macroalgae and corals: effects of herbivore exclusion and increased algal biomass on coral survivorship and growth. Coral Reefs, 2001, 19(4): 392- 399.
[41] Buckley B A, Szmant A M. RNA/DNA ratios as indicators of metabolic activity in four species of Caribbean reef-building corals. Marine Ecology Progress Series, 2004, 282: 143- 149.
[42] Rasher D B, Hay M E. Competition induces allelopathy but suppresses growth and anti-herbivore defence in a chemically rich seaweed. Proceedings of the Royal Society B: Biological Sciences, 2014, 281(1777): 481- 494.
[43] River G F, Edmunds P J. Mechanisms of interaction between macroalgae and scleractinians on a coral reef in Jamaica. Journal of Experimental Marine Biology and Ecology, 2001, 261(2): 159- 172.
[44] Inderjit, Dakshini K M M. Algal allelopathy. The Botanical Review, 1994, 60(2): 182- 196.
[45] Rasher D B, Hay M E. Chemically rich seaweeds poison corals when not controlled by herbivores. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(21): 9683- 9688.
[46] Rasher D B, Stout E P, Engel S, Kubanek J, Hay M E. Macroalgal terpenes function as allelopathic agents against reef corals. Proceedings of the National Academy of Science of the United States of America, 2011, 108(43): 17726- 17731.
[47] Tanner J E. Competition between scleractinian corals and macroalgae: an experimental investigation of coral growth, survival and reproduction. Journal of Experimental Marine Biology and Ecology, 1995, 190(2): 151- 168.
[48] Rinkevich B, Loya Y. Variability in the pattern of sexual reproduction of the coralStylophorapistillataat Eilat, Red Sea: a long-term study. Biological Bulletin, 1987, 173(2): 335- 344.
[49] Foster N L, Box S J, Mumby P J. Competitive effects of macroalgae on the fecundity of the reef-building coralMontastraeaannularis. Marine Ecology Progress Series, 2008, 367: 143- 152.
[50] Stöcklin J, Winkler E. Optimum reproduction and dispersal strategies of a clonal plant in a metapopulation: a simulation study with Hieracium pilosella. Evolutionary Ecology, 2004, 18(5/6): 563- 584.
[51] Diaz-Pulido G, Harii S, McCook L J, Hoegh-Guldberg O. The impact of benthic algae on the settlement of a reef-building coral. Coral Reefs, 2010, 29(1): 203- 208.
[52] Kuffner I B, Walters L J, Becerro M A, Paul V J, Ritson-Williams R, Beach K S. Inhibition of coral recruitment by macroalgae and cyanobacteria. Marine Ecology Progress Series, 2006, 323: 107- 117.
[53] Kuffner I B, Paul V J. Effects of the benthic cyanobacteriumLyngbyamajusculaon larval recruitment of the reef coralsAcroporasurculosaandPocilloporadamicornis. Coral Reefs, 2004, 23(3): 455- 458.
[54] Ritson-Williams R, Arnold S V, Fogarty N, Steneck R S, Vermeij M J, Paul V J A. New perspectives on ecological mechanisms affecting coral recruitment on reefs. Smithsonian Contributions to Marine Science, 2010, 38(437): 457.
[55] Dixson D L, Abrego D, Hay M E. Chemically mediated behavior of recruiting corals and fishes: A tipping point that may limit reef recovery. Science, 2014, 345(6199): 892- 897.
[56] Price N. Habitat selection, facilitation, and biotic settlement cues affect distribution and performance of coral recruits in French Polynesia. Oecologia, 2010, 163(3): 747- 758.
[57] Birrell C L, McCook L J, Willis B L. Effects of algal turfs and sediment on coral settlement. Marine Pollution Bulletin, 2005, 51(1/4): 408- 414.
[58] Smith J E, Shaw M, Edwards R A, Obura D, Pantos O, Sala E, Sandin S A, Smriga S, Hatay M, Rohwer F L. Indirect effects of algae on coral: algae mediated, microbe induced coral mortality. Ecology Letters, 2006, 9(7): 835- 845.
[59] Nugues M M, Smith G W, Hooidonk R J, Seabra M I, Bak R P M. Algal contact as a trigger for coral disease. Ecology Letters, 2004, 7(10): 919- 923.
[60] Thacker R W, Becerro M A, Lumbang W A, Paul V J. Allelopathic interactions between sponges on a tropical reef. Ecology, 1998, 79(5): 1740- 1750.
[61] Morrow K M, Paul V J, Liles M R, Chadwick N E. Allelochemicals produced by Caribbean macroalgae and cyanobacteria have species-specific effects on reef coral microorganisms. Coral Reefs, 2011, 30(2): 309- 320.
[62] Bruno J F, Selig E R, Casey K S, Page C A, Willis B L, Harvell C D, Sweatman H, Melendy A M. Thermal stress and coral cover as drivers of coral disease outbreaks. PLoS Biology, 2007, 5(6): 1220-1227.
[63] Bourne D G, Garren M, Work T M, Rosenberg E, Smith G W, Harvell C D. Microbial disease and the coral holobiont. Trends in Microbiology, 2009, 17(12): 554- 562.
[64] 夏邦美, 王广策, 王永强. 三沙市南海诸岛底栖海藻区系调查及其与其它相关区系的比较分析. 海洋与湖沼, 2013,44(6): 1681- 1704.
[65] 张善东, 俞志明, 宋秀贤, 宋飞, 王悠. 大型海藻龙须菜与东海原甲藻间的营养竞争. 生态学报, 2005,25(10): 2676- 2680.
[66] 张善东, 宋秀贤, 王悠, 俞志明. 大型海藻龙须菜与锥状斯氏藻间的营养竞争研究. 海洋与湖沼, 2005, 36(6): 556- 561.
Review on the effect of macroalgae on the degeneration of coral reefs
LIAO Zhiheng1,2,3, YU Kefu1,2,4,*, WANG Yinghui1,2
1CoralReefResearchCenterofChina,GuangxiUniversity,Nanning530004,China2SchoolofMarineSciences,GuangxiUniversity,Nanning530004,China3ForestrycollegeofGuangxiUniversity,Nanning530004,China4SouthChinaSeaInstituteofOceanology,ChineseAcademyofSciences,Guangzhou510301,China
In light of the global scope of coral reefs degradation, macroalgae cover is becoming increasingly common in reef regions. The overgrowth of macroalgae in reef regions hampers the growth, reproduction and recovery of coral colonies, primarily because: (1) macroalgae compete with corals for space and light, lowering the growth rate of corals, causing death through suffocation and inhibiting the engraftment of coral larvaes; (2) macroalgae negatively affect corals growth via physical abrasion and the release of allelochemicals when in direct contact with corals; abrasion causes coral polyps to shrink and influences the ingestion behaviour and calcification of polyps, while the release of allelochemicals into the surrounding environment of corals may cause coral bleaching and the damage of coral tissue. (3) The reproduction of corals is a highly energy consuming process. Any outside pressure which may drain a coral′s stored energy will influence the fertility of the coral. In reef regions, the overgrowth of macroalgae breaks its competitive balance with corals, since, in response to the invasion of macroalgae, corals re-allocate energy needed for growth and reproduction to tissue repair and protection, causing a decrease in the quantity and quality of coral eggs, which decreases the energy allocated to reproduction; (4) The inhibiting effects of macroalgae on corals is the key factor to cause the degeneration of coral communities. Macroalgae influence the settlement and survival rate of coral larvas, thereby preventing the development of coral communities; (5) seaweeds accumulate sediments, release pathogens, and disrupt the growth of coral symbiotic microbes, indirectly influencing coral growth. This paper includes a brief overview of the primary competitive mechanisms (physical, chemical, and microbial) of macroalgae and corals. Understanding these competitive mechanisms will be very helpful when studying the interaction process between macroalgae and corals. We know much about the physical competition mechanisms, but the chemical and microbial mechanisms require more in-depth research; indeed, they are the hotspot of current research in coral reef sciences. In addition, this paper categorizes macroalgae according to their functional groups, lists the effects of three types of benthic seaweeds on corals, and summarizes the present status of coral reef degradation and the effect of macroalgae in areas with degraded reefs. Finally, it includes a review of the progress made by the latest research on the effect of macroalgae on corals, and suggests that our study should strengthen its research on the distribution and abundance of macroalgae species in the coral reef regions of the South China Sea in order to better evaluate the extent of macroalgae influence on the coral reefs of this region. Physiological, molecular, and ecological methods should be utilized to explore the mechanisms via which macroalgae influence corals at the cellular and molecular levels, in order to provide reference data for coral reef ecosystem conservation.
corals; seaweed; macroalgae; coral reef degeneration; competition mechanisms
国家重大科学研究计划项目(2013CB956102);国家自然科学基金项目(41025007, 91428203);广西八桂学者项目
2015- 05- 04;
日期:2016- 03- 03
10.5846/stxb201505040909
*通讯作者Corresponding author.E-mail: Kefuyu@scsio.ac.cn
廖芝衡,余克服,王英辉.大型海藻在珊瑚礁退化过程中的作用.生态学报,2016,36(21):6687- 6695.
Liao Z H, Yu K F, Wang Y H.Review on the effect of macroalgae on the degeneration of coral reefs.Acta Ecologica Sinica,2016,36(21):6687- 6695.
