魁蚶溶藻弧菌分离鉴定与药敏试验
2016-12-27韩风杰徐文娜李启蒙王雪鹏山东农业大学动物科技学院山东泰安271018山东省济宁市泗水县水利局
韩风杰 徐文娜 刘 敏 李启蒙 王雪鹏*(山东农业大学动物科技学院 山东 泰安 271018 山东省济宁市泗水县水利局)
魁蚶溶藻弧菌分离鉴定与药敏试验
韩风杰①徐文娜②刘 敏①李启蒙①王雪鹏①*(①山东农业大学动物科技学院 山东 泰安 271018 ②山东省济宁市泗水县水利局)
本文从山东某魁蚶养殖区发病魁蚶和养殖水体中分离到一株优势菌,人工感染试验结果显示,该菌能引起供试魁蚶发病,死亡率为100%,且发病症状与原发病症状相同,提示该菌是引起魁蚶死亡的主要致病菌。本研究对该菌形态、生理生化特征、16SrDNA及致病性进行了初步分析。结果显示该菌株为溶藻弧菌(Vibrio alginolyticus),该菌对头孢拉定等9种药物高度敏感,对氟哌酸等5种药物中度敏感,对青霉素具有耐药性。
魁蚶 溶藻弧菌 生理生化 致病性
魁蚶是我国沿海常见的一种重要经济贝类,因其肉质细嫩、营养丰富,深受国内外消费者欢迎,是出口创汇的重要水产品之一。但是近十几年来,随着魁蚶养殖规模的逐年扩大,养殖环境恶化导致微生物疾病的流行而引发的养殖魁蚶的大规模死亡屡屡发生,已造成巨大的经济损失,而弧菌(Vibrios)是导致魁蚶发病的主要致病菌。本研究对发病魁蚶优势菌株进行分离、鉴定,并进行人工感染试验和药物敏感性分析,探讨分析导致山东魁蚶大规模死亡的病原,旨在为魁蚶疾病研究提供理论依据,为魁蚶健康养殖提供一些参考资料。
1 材料与方法
1.1 发病魁蚶 于2015年8月份山东魁蚶发病高峰期,采集病状特征明显、濒临死亡的魁蚶。患病魁蚶(壳长3cm左右),表皮部分脱落、表面粘液较少,解剖发现外套膜萎缩,闭壳肌松弛、开合无力,有些发烂发白,软体部消瘦,颜色淡红,血管无色,部分病蚶腮黏液明显增多。
1.2 分离方法 无菌盐水洗净,用70%的酒精棉球对体表擦拭消毒,无菌手术刀开启,取肝胰脏等部位无菌匀浆器中匀浆处理,zobell 2216E平板和TCBS平板划线接种,28℃培养24 h后,选取优势菌落进行重复划线纯化,纯培养物于4℃冰箱中保存。
1.3 人工感染试验 人工感染试验在20L水族箱中进行,条件为温度28℃,盐度26.4,pH8.2,连续充气,每组放16只2cm大小的魁蚶。每天换水1次,试验组调节水体中细菌浓度为108cfu/mL,每日投单胞藻1次;对照组不加入菌体,按上述方法饲养;连续观察12d,纪录死亡状况,并进行解剖和病原的再分离以确定是否死于攻毒活菌引起的感染。
1.4 细菌生化鉴定 按一般细菌常用鉴定方法[6]进行分离菌的生物学性状测定,包括革兰氏染色、形态观察、生理生化特性测定(所用试剂购自杭州天和微生物试剂有限公司)。
1.5 16SrDNA克隆、测序 采用细菌16SrDNA序列扩增的通用引物对纯培养的细菌16SrDNA序列进行PCR扩增。正向引物为5'-AGAGTTTGATCMTGGCTCAG-3',反向引物为5'AAGGAGGTGWTCCARCC-3'。所得PCR产物经纯化后送上海生工进行序列测定。
1.6 药敏试验 采用纸片琼脂扩散法,在zobell 2216E培养基上培养24h,测量抑菌圈直径。药敏纸片购自杭州天和微生物试剂有限公司。
2 结果与分析
2.1 细菌分离及其形态特征 经分离纯化后,从病蛤中分离到1株优势菌,分离到的菌株均为革兰氏阴性直杆菌(图1),菌体直或稍弯,无荚膜,靠鞭毛运动。在TCBS (硫代硫酸钠-柠檬酸盐-胆盐)琼脂平板上培养18h后,该分离菌株形成黄色扁平的大菌落(图1)。
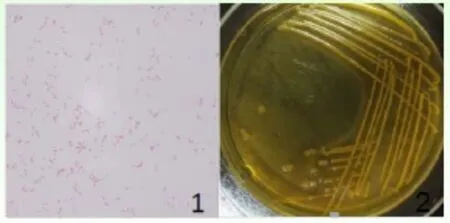
图1 1:革兰氏染色显微镜观察(1000x);2: 分离菌在TCBS上的生长特性
2.2 人工感染试验 人工感染7d后,魁蚶开始出现死亡,9d后全部死亡,病死率为100%。于是初步判定2015年8月山东某养殖区魁蚶大批死亡主要是以该分离菌为主要病原体的传染病所造成。
2.3 分离菌株生化特性 细菌分离株在40℃以上和4℃以下不生长,无盐不生长,其生活特性见表1,根据表1可以可以看出,这些特性与相关文献对溶藻弧菌的描述基本一致,认为该分离菌为溶藻弧菌,命名为Va-kh1。

表1 分离菌生化特征及其与标准溶藻弧菌的比较
2.4 16SrDNA克隆、测序 对Va-kh1株16S rDNA序列进行进化树分析PCR扩增,所得结果见图2,进一步证实该菌为溶藻弧菌。

图2 Va-kh1进化树
2.5 药物敏感性试验 利用纸片法测定16种抗菌药物对致病菌的抑制作用,由结果可知,分离菌株该菌对头孢拉定等9种药物高度敏感,对氟哌酸等5种药物中度敏感,对青霉素产生耐药性。
3 讨论
(1)溶藻弧菌感染海水养殖动物的报道比较多,但导致贝类病害发生的报道却很少。本次样品采集是在高水温期,表明溶藻弧菌是容易高温环境下生长并导致海水养殖动物的弧菌病,通过人工感染实验可知,感染后的试验魁蚶出现明显的病症:表皮部分脱落、表面粘液较少,解剖发现外套膜萎缩,闭壳肌松弛、开合无力,有些发烂发白,软体部消瘦,颜色淡红,血管无色,部分病蚶腮黏液明显增多,死亡率高达100%,从浸泡感染方式发病魁蚶处分离到与自然发病相同的细菌,因此可以确定该分离株是魁蚶发病的病原体。(2)从药敏试验结果来看,该溶藻弧菌对阿米卡星、复方新诺明、卡那霉素、菌必治、先锋必、链霉素、庆大霉素、新霉素、头孢拉定9种药物高度敏感,对氟哌酸、利福平、头孢噻吩、头孢氨苄、氨苄青霉素5种药物中度敏感,对四环素、青霉素G低度敏感,因此在疾病发生时可以适量投放一些抗菌性药物,但值得注意的是目前在养殖过程中误用、滥用抗生素和消毒剂等,影响了水体中微生态环境的平衡,可能导致了一些耐药菌株的出现,但是合理选择和使用有效的抗生素仍是目前和近期内控制疾病主要方法。为了更好的预防病害发生,塘养或池养魁蚶(滩涂除外)可以适量投放微生态制剂,如:芽孢杆菌和光合细菌,以达到生态防治的目的。
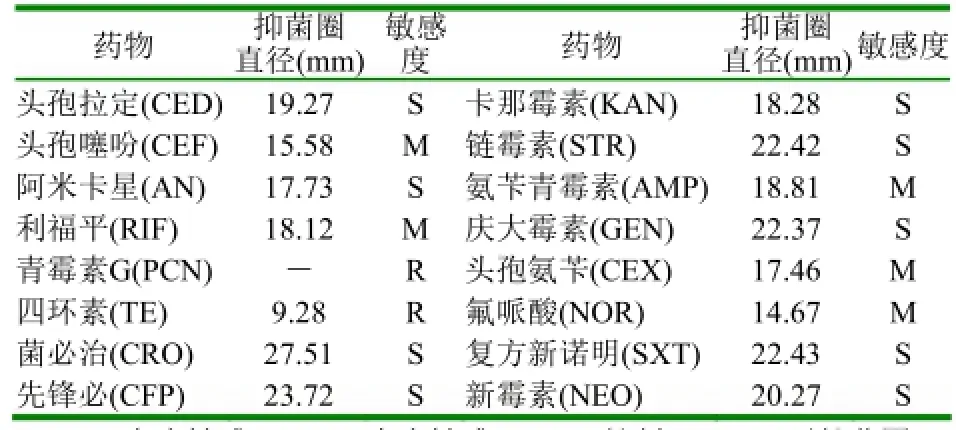
表2 菌株Va-kh药敏试验结果
[1] 苑淑宾, 朱爱意. 溶藻弧菌对水产动物致病性及其防治的研究进展[J]. 浙江海洋学院学报. 2012(31)3: 256-264.
[2] 张晓艳, 宁喜斌. 海水及海产品中溶藻弧菌的分离与鉴定[J]. 微生物学杂志, 2011(31)3: 21-24.
[3] 林永添. 紫贻贝大量死亡原因的初步研究[J]. 现代渔业信息, 2006, 21(7): 23-26.
[4] 张朝霞, 王军, 张蕉南等. 东山九孔鲍细菌性疾病研究[J]. 台湾海峡, 2001, 20(2): 193-199.
[5] SANGSTER C R, SMOLOWITZ R M. Description of Vibrio alginolyticus infection in cultured Sepia officinalis, Sepia apama, and Sepia pharaonis[J]. Biol Bull, 2003, 205: 233-234.
[6] 陈强, 鄢庆枇, 马甡. 溶藻弧菌致病性研究进展[J]. 海洋科学, 2006, 30(8): 83-89.
[7] 吴后波, 潘金培. 病原弧菌的致病机理[J]. 水生生物学报, 2003, 27(4): 422-426.
[8] 刘淇, 李海燕, 王群等. 梭子蟹牙膏病病原菌—溶藻弧菌的鉴定及其系统发育分析[J].海洋水产研究. 2007(28)4: 9-13.
S851.61+3
A
1007-1733(2016)05-0013-02
2016–04–14)
山东省现代农业产业技术体系贝类创新团队项目(SDAIT-14-07)
*通讯作者
