具有谷胱甘肽过氧化物酶活力的含硒三肽
2016-12-27尹居鑫李祖宏吕绍武罗贵民
尹居鑫, 李祖宏, 牟 颖, 吕绍武, 罗贵民
(1. 吉林大学分子酶学工程教育部重点实验室, 2. 生命科学学院, 长春 130012;3. 浙江大学智能系统与控制研究所, 杭州 310027)
具有谷胱甘肽过氧化物酶活力的含硒三肽
尹居鑫1,2, 李祖宏1,3, 牟 颖1,3, 吕绍武1,2, 罗贵民1
(1. 吉林大学分子酶学工程教育部重点实验室, 2. 生命科学学院, 长春 130012;3. 浙江大学智能系统与控制研究所, 杭州 310027)
合成了由硒代半胱氨酸(U)、 谷氨酰胺(Q)和色氨酸(W)组成的QUW, QWU, WQU, WUQ, UWQ和UQW 6个具有谷胱甘肽过氧化物酶(GPx)活力的含硒三肽; 采用双酶偶联法进行了GPx活力测定和稳态动力学分析; 通过噻唑蓝(MTT)比色法、 划痕愈合实验和Western blot技术表征了含硒三肽对肝癌HepG2细胞生长和迁移能力的影响. 结果表明, 当U位于氨基端时, 含硒三肽的GPx活力高于U位于中间位置或者羧基端时. UWQ催化谷胱甘肽(GSH)还原H2O2的活力最高, 其催化机制为乒乓机制. UWQ可使HepG2细胞运动能力减弱, 降低肝癌细胞的浸润转移能力.
谷胱甘肽过氧化物酶; 模拟物; 含硒三肽

Fig.1 Catalytic triad of GPx(PDB data: 1gp1)[3]
谷胱甘肽过氧化物酶(GPx, EC.1.11.1.9)是生物体内最重要的抗氧化酶之一[1,2], 结构解析结果表明, 硒代半胱氨酸(Sec, U)、 谷氨酰胺(Gln, Q)和色氨酸(Trp, W)组成了天然GPx的催化三联体(图1)[3], 但未阐明催化三联体中各氨基酸的催化贡献规律. GPx能发挥维持体内活性氧(ROS)平衡的重要作用, 对预防和治疗癌症、 心血管病等多种疾病效果明显[4]. 但作为天然GPx催化中心的U由终止密码子UGA编码, 难以采用基因工程方法量产, 限制了其深入研究和应用, 因此GPx模拟物的研究成为该领域的热点之一[5]. 为了模拟GPx活性部位的结构, 已合成了多种类型的以Ebselen为代表的有机硒化合物[6]. 虽然引入个别氨基酸会使Ebselen展示不同的GPx活力, 但这些氨基酸残基对活性中心硒原子(Se)活性的影响尚不明确[7,8].
本文合成了由天然GPx催化三联体U, W和Q形成的QUW, QWU, WQU, WUQ, UQW和UWQ 6个具有GPx活力的含硒三肽, 研究了催化三联体中各氨基酸残基的活力贡献规律; 并以肝癌为研究对象[9], 表征了活力最佳的UWQ抗肝癌细胞转移的能力. 本文结果对设计高活力含硒肽或氨基酸掺杂化合物等GPx模拟物, 深入研究其抗癌机制具有一定的指导意义.
1 实验部分
1.1 试剂与仪器
N-芴甲氧羰基-N-叔丁氧羰基-L-色氨酸[Fmoc-Trp(Boc)-OH]、N-芴甲氧羰基-N-三苯甲基-L-谷氨酰胺[Fmoc-Gln(Trt)-OH]、N-芴甲氧羰基-N-叔丁氧羰基-L-色氨酸-4-苄氧基苄酯[Fmoc-Trp(Boc)-Wang-Resin]、N-芴甲氧羰基-N-三苯甲基-L-谷氨酰胺-4-苄氧基苄酯[Fmoc-Gln(Trt)-Wang-Resin]、N-羟基苯并三氮唑(HOBt)、 三氟乙酸(TFA)和1,2-乙二硫醇(EDT), 吉尔生化(上海)有限公司;N,N-二甲基甲酰胺(DMF)和乙腈, 美国TND公司; 还原型谷胱甘肽(GSH)、 还原型烟酰胺腺嘌呤二核苷酸磷(NADPH)、 谷胱甘肽还原酶(GR)和辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗, Sigma公司; 杜尔伯科改良伊格尔培养基(DMEM)及胎牛血清, Gibco公司; 其它试剂均为国产分析纯; 参照文献[10]方法制备N-芴甲氧羰酰基-1,4-对甲氧基苄基-硒代半胱氨酸[Fmoc-Sec(PMB)-OH]; 人肝癌细胞(HepG2细胞)来源于中国科学院上海细胞库.
MIKRO-22型台式高速离心机(德国Hettich公司); HZQ-X100型恒温振荡培养箱(哈尔滨东联电子技术公司); Waters 600型高效液相色谱(HPLC)仪(美国Waters公司); ALPHA 2-4型冻干机(德国CHIST公司); MCO-15AC型CO2培养箱(日本Sanyo公司); IMT-2型倒置显微镜(日本Olympus公司).
1.2 含硒三肽的制备
采用Fmoc固相肽合成法合成含硒三肽, 用反相高效液相色谱进行分离纯化[11], 经冷冻干燥后含硒三肽样品纯度可达95%以上. 含硒三肽样品通过质谱和氢化物原子荧光光谱鉴定为二聚体.
1.3 性能表征
采用酶偶联法[4]进行含硒三肽的GPx活力测定和稳态动力学分析. 将37 ℃下每分钟氧化1 μmol NADPH所需含硒三肽的量定义为1个酶活力单位, 比活力用U/μmol表示. 进行动力学分析时, 保持一种底物的浓度不变, 改变另一种底物的浓度, 通过测定NADPH在340 nm处光吸收值的变化来确定其初速度. 采用噻唑蓝(MTT)比色法测定含硒三肽对人肝癌细胞HepG2的体外杀伤作用[12]. 采用划痕愈合实验测定含硒三肽对人肝癌细胞HepG2体外迁移能力的影响[13]. 建模前裂痕宽度为Wbefore, 24 h后的裂痕宽度为Wafter, 迁移距离为Wbefore-Wafter. 相对迁移率定义为迁移距离与建模前裂痕宽度的比值, 即(Wbefore-Wafter)/Wbefore×100%. 采用Western blot技术[14]检测含硒三肽对HepG2细胞中MMP-9和AFP蛋白表达情况的影响.
2 结果与讨论
2.1 含硒三肽的酶学性质分析
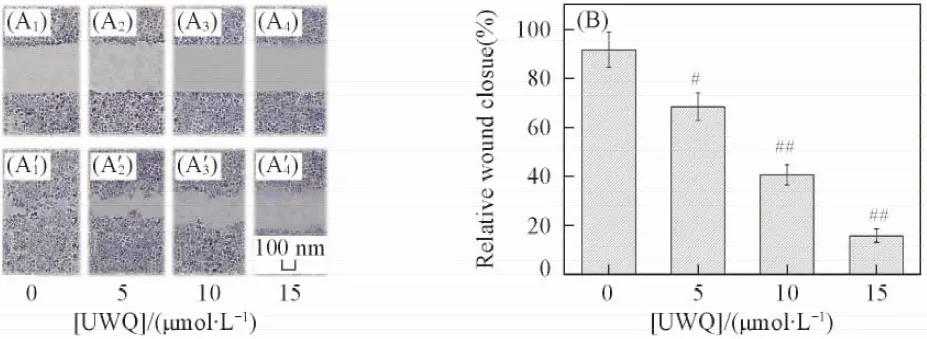
对比6个含硒三肽的GPx活力数据(见表1)可知, 其活力顺序为UWQ>UQW>WUQ/QUW>QWU/WQU. 含硒三肽中U所处位置的不同会导致其GPx活力存在差异, 即U位于氨基端时其GPx活力明显高于U位于中间位置或者羧基端时. 前文[15]已证实, 将含有氨基/亚氨基的基团引入到催化中心Se原子附近能明显提高模拟物的GPx活力. 这是由于硒原子附近引入的氨基/亚氨基可以将催化中间体硒醇活化为在动力学上更有活性的硒醇阴离子[16], 从而提高酶活力. 当U位于氨基端时, W和Q分子内的亚氨基/氨基(酰胺键)结构所处空间位置与催化中心的Se原子相距较远, 对催化的贡献比U分子内的游离氨基小很多; 当U位于羧基端时, U分子内的游离羧基不利于底物H2O2将Se原子氧化为亚硒酸而进入催化循环[17], 因此GPx的活力最低.

Table 1 GPX-like activies of 3P and other GPX mimics

由动力学参数可知, 在UWQ和UQW中, W和Q所处位置不同对形成催化中间体的贡献相近, 因

Fig.2 Double-reciprocal plots for the reduction of H2O2 by GSH catalyzed by UWQ

Table 2 Kinetic parameters of GPx mimics
此kmax(UWQ)和kmax(UQW)值接近.Km是酶的特征常数之一, 其值可反映酶与底物的亲和力大小:Km值大表明亲和力小;Km值小表明亲合力大. 在天然GPx的结构中, Q中酰胺键的氧原子可与底物GSH的游离氨基形成氢键从而增加底物结合能力[19], 而位于羧基端QUWQ的自由度比位于中间位置QUQW的自由度大, 更容易与GSH的游离氨基形成氢键, 因此Km,GSH(UWQ) 2.2 UWQ对人肝癌HepG2细胞的生物活性 Fig.3 Cell viability of HepG2 cells treated by WUQ for 24 h 体外细胞实验可用于评价模拟物的药效, UWQ是一种分子量小、 结构简单且活性较高的GPx模拟物, 本文以HepG2细胞为对象, 研究了UWQ对其生长增殖及运动侵袭性的影响. MTT法因具有灵敏度高及重复性好的优点而成为评价细胞存活的重要手段, 由图3可见, 不同浓度的UWQ可使HepG2细胞的存活率降低, 随着UWQ浓度的增加, HepG2细胞存活率降低更加显著, 呈现剂量依赖关系. 在UWQ的浓度为10 μmol/L时, HepG2细胞的存活率下降至约50%, 以Ebselen为阳性对照, 在相同的实验条件下, Ebselen的浓度达到32 μmol/L时才能使HepG2细胞存活率下降至约50%. 上述结果表明, UWQ可以有效杀伤HepG2细胞, 降低其细胞存活率, 且杀伤效果强于Ebselen. 细胞迁移是细胞正常的生理学过程, 采用划痕愈合实验可以研究细胞的迁移能力. 划痕24 h后, 用显微镜测量划痕宽度, 观察各组细胞划痕的“愈合”情况, 迁移率高的实验组中细胞相对迁移能力强. 结果表明, 未加UWQ的HepG2细胞基本爬满划痕区域[图4(A)], 其迁移率为91.5%, 达到划痕愈合; 而加入UWQ后, HepG2细胞的迁移能力明显降低, 细胞划痕愈合能力随着UWQ浓度的增加而减弱, 当加入的UWQ浓度为15 μmol/L时, 迁移率仅为15.8%[图4(B)]. 实验结果表明, GPx模拟物UWQ可使HepG2细胞的运动侵袭能力显著下降, 这是由于癌细胞与正常细胞相比处于氧化还原异常的状态[20], 而细胞内的抗氧化酶GPx能降低细胞内ROS水平, 削弱癌细胞的生存优势, 降低其运动侵袭能力, 因此GPx模拟物UWQ能发挥降低癌细胞运动侵袭能力的作用. Fig.4 Cell migratory ability(A) and relative wound closue(B) of HepG2 cells treated by WUQ for 24 h 基底的降解是肿瘤侵袭和转移的重要过程, 基质金属蛋白酶MMP-9是参与基底降解的最重要基质金属蛋白酶(MMP)之一[21]. 通过Western blot技术检测了UWQ对HepG2细胞中MMP-9表达的影响[图5(A)]. HepG2细胞中MMP-9明显表达, 分别在92000和83000处显示前体(pro-MMP-9)和活化型(MMP-9)的特异条带. 加入不同浓度的UWQ均能抑制该蛋白的表达[图5(B)], 经5, 10和15 μmol/L UWQ处理的HepG2细胞中pro-MMP-9(MMP-9)的表达率分别为61.2%(66.3%), 40.9%(45.8%)和26.3%(24.7%), 表明UWQ可抑制92000前体生成, 进而导致83000活化型的减少. 上述结果说明, UWQ能明显抑制MMP-9的表达, 且呈现一定的计量依赖关系. 由于癌细胞的浸润和转移的起始都是从分泌基质金属蛋白酶开始的, 而UWQ抑制MMP-9蛋白表达即可减少基底的降解, 从而降低了肿瘤细胞的侵袭性. 由于癌细胞内异常增加的活性氧(ROS)具有刺激其增殖、 转移及提高基因突变率等生物学功能[22], 而GPx模拟物UWQ可以高效地清除癌细胞内的ROS, 通过抑制MMP-9蛋白表达的方式降低肿瘤细胞的侵袭性, 这与划痕愈合实验结果一致. Fig.5 Western blot analysis of MMP-9 and AFP protein expression(A) and relative protein expression(B) in HepG2 cells treated by WUQ for 24 h(B) Error bars represent mean±SE for n=3. # p<0.05; ## p<0.01. 肝癌的侵袭和转移是其最主要的生物特征, 甲胎蛋白(AFP)是肝癌发生、 侵袭过程中表达的重要蛋白质, 是肝癌诊断的标志性蛋白. 采用不同剂量的UWQ处理HepG2细胞12 h后, 提取细胞总蛋白进行Western blot检测. 结果表明, 与未经UWQ处理的HepG2细胞相比, 经UWQ处理的HepG2细胞的AFP蛋白表达均被抑制, 且呈现剂量依赖关系, 当UWQ浓度为15 μmol/L时抑制率可达83.7%[图5(B)]. HepG2细胞表达的AFP蛋白是促进癌细胞的生长、 增殖及迁移等生理现象的重要蛋白, 而能够抑制AFP蛋白表达的UWQ可以有效抑制上述生理现象的产生, 与细胞存活率、 划痕愈合及MMP-9蛋白表达的研究结果一致. 综上所述, 合成了由天然GPx催化三联体U, W和Q组成的6个具有GPx活力的含硒三肽, 研究了催化三联体中各氨基酸残基的活力贡献规律, 证明了活力最佳的UWQ是一种能有效抑制肝癌侵袭和转移的GPx模拟物, 具有开发成预防和治疗肝癌药物的应用前景. [1] Flohé L., Günzler W. A., Schock H. H.,FEBSLett., 1973, 32(1), 132—134 [2] Toppo S., Flohé L., Ursini F., Vanin S., Maiorino M.,Biochim.Biophys.Acta, 2009, 1790(11), 1486—1500 [3] Epp O., Ladenstein R., Wendel A.,Eur.J.Biochem., 1983, 133(1), 51—69 [4] Lv S. W., Wang X. G., Mu Y., Zang T. Z., Liu J. Q., Shen J. C., Luo G. M.,FEBSJ., 2007, 274(15), 3846—3854 [5] Dong Z. Y., Luo Q., Liu J. Q.,Chem.Soc.Rev., 2012, 41, 7890—7908 [6] Mugesh G., du Mont W. W., Sies H.,Chem.Rev., 2001, 101, 2125—2180 [7] Satheeshkumar K., Mugesh G.,Chem.Eur.J., 2011, 17(17), 4849—4857 [8] Selvakumar K., Shah P., Singh H. B.,Chem.Eur.J., 2011, 17(45), 12741—12755 [9] Chen W. Q., Zheng R. S., Zeng H. M., Zou X. N., Zhang S. W., He J.,ChinaCancer, 2015, 24(1), 1—10(陈万青, 郑荣寿, 曾红梅, 邹小农, 张思维, 赫捷. 中国肿瘤, 2015, 24(1), 1—10) [10] Koide T., Itoh H., Otaka A.,Yasui H., Kuroda M., Esaki N., Soda K., Fuji N.,Chem.Pharm.Bull., 1993, 41(3), 502—506 [11] Cheng B. P., Li L. S., Zhou R. D., Li L., Zhang H. F.,Chem.J.ChineseUniversities, 2015, 36(5), 872—880(程彪平, 李来生, 周仁丹, 李良, 张宏福. 高等学校化学学报, 2015, 36(5), 872—880) [12] Liu Z. J., Hou Y. L., Zhang G. G., Xu N., Mi B., Gong P., Zhao Y. F.,Chem.Res.ChineseUniversities, 2015, 31(4), 235—243 [13] Wang C., Shen N., Yan G. L.,Sui C. H., Zhuang J. J., Lü S. W., Luo G. M., Mu Y.,Int.J.Pept.Res.Ther., 2014, 20(3), 307—324 [14] Wang W. Q., Shi A. P., Fan Z. M.,Chem.Res.Chinese.Universities, 2014, 30(2), 108—113 [15] Lü B. C., Dong S., Xue Q., Zong H., Lü S. W., Luo G. M.,Chem.J.ChineseUniversities, 2013, 34(9), 2146—2151(吕冰聪, 董森, 薛峤, 宗慧, 吕绍武, 罗贵民. 高等学校化学学报, 2013, 34(9), 2146—2151) [16] Iwaoka M., Tomoda S.,J.Am.Chem.Soc., 1994, 116(6), 2557—2561 [17] Takebe G., Yarimizu J., Saito Y.,Hayashi T., Nakamura H., Yodoi J., Nagasawa S., Takahashi K.,J.Biol.Chem., 2002, 277(43), 41254—41258 [18] Bell I., Hilvert D.,Biochemistry., 1993, 32(50), 13969—13973 [19] Ren B., Huang W., Akesson B., Ladenstein R.,J.Mol.Biol., 1997, 268(5), 869—885 [20] Lau A. T., Wang Y., Chiu J. F.,J.Cell.Biochem., 2008, 104(2), 657—667 [21] Siegel R., Naishadham D., Jemal A.,Ca-Cancer.J.Clin., 2013, 63(1), 11—30 [22] Marina S. K., Elizaveta S. E.,Plos.One., 2013, 8(10), e77469 † Supported by the National Major Scientific Instruments Development Project, China(No.2013YQ470781) and the Natural Science Foundation of Jilin Province, China(No.20130101159JC). Tripeptide Containing Selenium with Glutathione Peroxidase Activity† YIN Juxin1,2, LI Zuhong1,3, MU Ying1,3, LÜ Shaowu1,2*, LUO Guimin1 (1.KeyLaboratoryforMolecularEnzymologyandEngineering,MinistryofEducation,2.CollegeofLifeSciences,JilinUniversity,Changchun130012,China;3.InstituteofCyber-SystemsandControl,ZhejiangUniversity,Hangzhou310027,China) Six selenium-containing tripeptides(QUW, QWU, WQU, WUQ, UWQ and UQW) were synthesized by solid-phase synthesis technology based on the catalytic triad of native glutathione peroxidase(GPx). The GPx activities and the kinetics of the tripeptide were determined by the enzyme coupling method. The effects of tripeptide on HepG2 cells growth and migration were assessed using the 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) assay, wound assay and Western blot method. The results showed that the GPx activity of the tripeptide with U at the amino terminal was higher than that of U at the middle position or the carboxyl terminal. Among the six tripeptide, the activity of UWQ catalyzed by glutathione(GSH) reduced by hydrogen peroxide(H2O2) was higher than those of other tripeptides, and its catalytic mechanism was Ping-Pong mechanism. UWQ can dosedependently discrease migration speed of HepG2 cells to exercise, and reduce the invasion and metastasis of HepG2 cells. Gluathione peroxidase; Mimics; Tripeptide containing selenium 2016-02-18. 日期: 2016-06-16. 国家重大科学仪器设备开发专项(批准号: 2013YQ470781)和吉林省自然科学基金(批准号: 20130101159JC)资助. 10.7503/cjcu20160101 O629; Q554+.6 A �2016-02-17. 网络出版日期: 2016-06-15. 联系人简介: 吕绍武, 男, 博士, 副教授, 主要从事模拟酶方面的研究. E-mail: lvsw@jlu.edu.cn