基于铜离子与DNA相互作用的铜离子检测
2016-12-27孔慧芳郭志慧
李 敏, 孔慧芳, 郭志慧
(陕西师范大学化学化工学院, 陕西省生命分析化学重点实验室, 西安710119)
基于铜离子与DNA相互作用的铜离子检测
李 敏, 孔慧芳, 郭志慧
(陕西师范大学化学化工学院, 陕西省生命分析化学重点实验室, 西安710119)
利用铜离子(Cu2+)可与DNA分子中的碱基相互作用形成络合物的性质, 将Cu2+富集在DNA修饰电极表面, 进而采用微分脉冲伏安法(DPV)实现了铜离子的检测. 此外, 由于乙二胺四乙酸(EDTA)对Cu2+具有更强的络合能力, 富集于DNA修饰电极表面的Cu2+很容易被洗脱液中的EDTA络合, 从而实现修饰电极的再生和重复利用. 实验结果表明, 在最佳实验条件下, Cu2+浓度在2.0×10-6~1.0×10-5mol/L和2.0×10-5~1.0×10-4mol/L范围内与其相对还原峰电流强度(I-I0)呈良好的线性关系, 且该传感器简单、 稳定, 可循环使用.
DNA修饰电极; 电化学传感器; 差分脉冲伏安法; 铜离子
铜离子是生命体中一种必需的微量元素, 广泛分布于生物组织中, 生物体内的铜离子大部分以有机复合物形式存在, 其在生命活动中扮演着重要角色. 铜离子可以作为酶辅助因子参与生命活动, 也可以参与红细胞的形成[1]. 生物系统中许多涉及氧的电子传递和氧化还原反应过程都是由含铜酶催化的, 这些酶对生命过程至关重要. 此外, 铜离子对大脑、 心脏、 造血以及抗癌等有重要作用. 然而, 过量的铜离子会导致严重的健康问题, 如会引起缺血性心脏病、 肾病、 贫血和骨骼疾病等[2], 也会给人体内的脏器造成负担, 从而影响人体健康. 美国环境保护署发布, 饮用水中的铜离子含量最大值为1.30 mg/L[3], 欧洲食品安全局规定食品中铜离子的浓度范围为1.2~4.2 mg/L[4]. 我国《生活饮用水卫生标准》中规定, 饮用水中铜离子含量不得高于1.0 mg/L. 因此, 准确检测水、 食品和环境中的铜离子污染物含量十分必要.
检测铜离子的传统方法包括原子吸收光谱法[5]、 电感耦合等离子体发射光谱法[6]、 伏安法[7~9]和荧光光谱法[10~12]等. 这些方法虽然有较高的灵敏度和较好的选择性, 但所用仪器比较昂贵、 实验成本也高, 所以, 在检测某些领域中的铜离子时, 这些方法有一定的局限性. 因此, 设计一种简单、 低成本、 灵敏度高且能在线实时检测铜离子的传感器具有重要意义.
DNA分子本身具有高度有序的自组装特性, 多形态的手性纳米结构、 独特的碱基配对方式、 稳定的理化性质以及基于结构的分子识别特性使其成为目前构建纳米自组装材料的理想元件之一[13], 这对功能化纳米材料的合成及其在手性催化剂[14]、 电化学传感[15]和金属纳米晶体[16]的应用具有重要意义. 在生物无机化学领域中, Cu2+, Zn2+, Ni2+, Co2+和Mn2+等过渡金属离子与DNA分子中的核酸碱基和序列的特殊作用已被广泛研究[17~21]. 文献[22]报道表明, 各种金属离子与 DNA 分子之间的结合方式主要有2种类型: 一种是金属离子(包括碱金属和碱土金属离子)与 DNA 分子中磷酸基团通过简单的静电作用相结合; 另一种是金属离子(包括一些过渡金属如 Ag+, Hg2+和Pt2+等)与 DNA 分子中的碱基相互作用而结合. 大部分过渡态金属离子既能与 DNA 磷酸骨架静电结合又能与DNA分子上的碱基相互作用, 而金属离子与DNA的具体结合方式和结合力大小不仅与 DNA 序列的组成、 结构相关, 还与金属离子浓度以及环境因素如离子强度、 温度、 pH值及作用时间等密切相关[22].
由于铜离子在生命体中独特的生理作用, 科研工作者对其与DNA之间作用的研究更为深入和广泛. 其中, 将铜离子对DNA序列的高识别能力用于构建DNA纳米材料受到广泛关注. 通常认为铜离子与 DNA 分子之间存在以下几种结合方式: (1) 在铜离子浓度或铜离子/碱基比例很低的情况下, 铜离子与DNA 分子磷酸基团通过静电作用非特异性结合; (2) 在铜离子浓度或铜离子/碱基比例逐渐增加的情况下, 铜离子对DNA分子上碱基的亲和力将会逐渐增大, 此时铜离子主要与鸟嘌呤(G)中的 N7 和 O6 原子以及胞嘧啶(C)中的N3和O2原子结合; (3) 当DNA链中含有连续鸟嘌呤时, 铜离子会与同一条链上2个相邻鸟嘌呤的N7和O6原子结合, 形成“G-Cu(Ⅱ)-G 的三明治结构”, 这种结合方式能够增强相邻鸟嘌呤间的碱基堆积作用以及鸟嘌呤-胞嘧啶碱基对中的氢键作用; (4) 当DNA链中富含腺嘌呤(A)或者胸腺嘧啶(T)时, 铜离子与DNA序列的作用力较弱[21,23].
本文基于铜离子与DNA之间的相互作用, 建立了一种简单、 快速测定铜离子的电化学方法. 首先将探针DNA自组装在Au电极表面, 然后通过铜离子与DNA分子中碱基的相互作用将铜离子富集到DNA修饰的Au电极上, 采用微分脉冲伏安(DPV)法实现铜离子的检测. 此外, 由于乙二胺四乙酸对铜离子具有更强的络合能力, 测试后的电极可通过在乙二胺四乙酸溶液中浸泡的方法除去表面富集的铜离子, 从而实现电极的再生和重复利用.
1 实验部分
1.1 试剂与仪器
六巯基己醇(MCH)购自Sigma公司; 乙二胺四乙酸二钠盐(EDTA)、 氯化钾(KCl)、 氯化钠(NaCl)、 铁氰化钾[K3Fe(CN)6]、 亚铁氰化钾[K4Fe(CN)6]、 浓盐酸、 氯化铜(CuCl2)、 氯化镉(CdCl2)、 硝酸铅[Pb(NO3)2]、 硝酸汞[Hg(NO3)2]、 硫酸镍(NiSO4·5H2O)、 磷酸二氢钠(NaH2PO4·2H2O)和磷酸氢二钠(NaH2PO4·12H2O)均购自国药集团化学试剂有限公司; 所用试剂均为分析纯, 使用前未经过处理; 三羟甲基氨基甲烷和DNA[序列: 5′-SH-(CH2)6-GTAAAACGACGGCCAG-3′]购自生工生物工程有限公司; Tris-HCl缓冲液(10 mmol/L, pH=9.0); Na2HPO4-NaH2PO4系列缓冲液. 实验用水均为超纯水. TG16-W型微量高速离心机(长沙湘仪离心机仪器有限公司); KH-250 DE型数控超声清洗器(昆山禾创超声仪器有限公司); CHI 620C型电化学工作站(上海辰华仪器有限公司); 三电极体系: 饱和Ag/AgCl为参比电极, 金盘电极(直径2 mm)为工作电极, 铂丝(Pt)为对电极, 参比电极和工作电极购自高仕睿联科技有限公司.
1.2 实验过程
1.2.1 DNA溶液的配制 将DNA序列在11000 r/min转速下离心10 min后, 加入适量的PBS 缓冲溶液充分振荡溶解, 得到浓度为100 μmol/L的DNA溶液. 对DNA溶液进行退火处理, 然后快速冷却到室温, 于4 ℃存储备用. 准确移取10 μL 100 μmol/L DNA 溶液置于0.5 mL离心管中, 用10 mmol/L 的PBS缓冲液(pH=7.4)稀释得到10 μmol/L DNA溶液.
1.2.2 Au电极表面的预处理 分别用0.3和0.05 μm的Al2O3粉末打磨Au电极, 置于无水乙醇和超纯水中依次超声5 min, 然后将电极浸在浓度为0.1 mol/L的H2SO4溶液中进行电化学扫描清洗, 电位窗口为0~1.5 V, 扫描至所得CV曲线稳定即可. 用超纯水冲洗电化学清洗过的Au电极, 室温下晾干备用.
1.2.3 Au电极表面的修饰 将经预处理的Au电极插入10 μmol/L 的探针DNA溶液中, 探针DNA分子通过Au—S共价键作用自组装到Au电极表面, 然后分别用10 mmol/L 的PBS缓冲液(pH=7.4)和超纯水冲洗Au电极表面, 制得Au-ssDNA 电极. 为了除去电极表面非特异性吸附的DNA并使探针DNA能有序地排列在Au电极表面, 将Au-ssDNA 电极浸在1 mmol/L的MCH溶液中保持40 min, 即得到Au-ssDNA-MCH 电极.
1.2.4 电化学检测铜离子 将Au-ssDNA-MCH 电极浸入含有铜离子的Na2HPO4-NaH2PO4缓冲液中, 吸附一定时间后, 用超纯水清洗电极表面. 将三电极体系插入5 mL含有10 mmol/L PBS(pH=7.0)和0.1 mol/L NaCl 的电解液中, 采用DPV法进行检测, 参数设置[24]如下: 初始电位为0.6 V; 高电位为0.6 V; 低电位为-0.1 V; 脉冲时间为0.2 s; 脉冲幅度为0.05 V; 静止时间为2 s; 脉冲宽度为0.05 V; 采样间隔为0.0167 s. 每次测定后, 将电极浸泡在含过量EDTA的Tris-HCl缓冲溶液(10 mmol/L, pH=9.0)中40 min以除去铜离子, 得到的电极可以重复使用[25].
2 结果与讨论
2.1 探针DNA修饰Au电极的表征
采用循环伏安法(CV)对Au电极表面的组装过程进行了表征. 图1示出了裸Au电极、 Au-ssDNA电极和Au-ssDNA-MCH电极在含有1 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]和0.1 mol/L KCl的溶液中测得的CV曲线. 曲线a为裸Au电极的CV曲线, 存在明显的氧化还原峰, 表明[Fe(CN)6]3-/4-在电极表面进行了电子传递. 当探针DNA组装到Au电极表面时, [Fe(CN)6]3-/4-在电极表面上的氧化还原峰电流降低且峰形也变得不可逆(曲线b), 这是由于探针DNA分子中的磷酸骨架带负电荷, 排斥同样带负电荷的[Fe(CN)6]3-/4-, 导致[Fe(CN)6]3-/4-远离电极表面, [Fe(CN)6]3-/4-的电子传递受到阻碍, [Fe(CN)6]3-/4-的氧化还原峰电流降低. 当在电极上修饰MCH后(曲线c), 峰电流进一步降低, 这是由于MCH在电极表面形成的单分子层影响了[Fe(CN)6]3-/4-向电极表面的扩散, 导致峰电流再次降低.
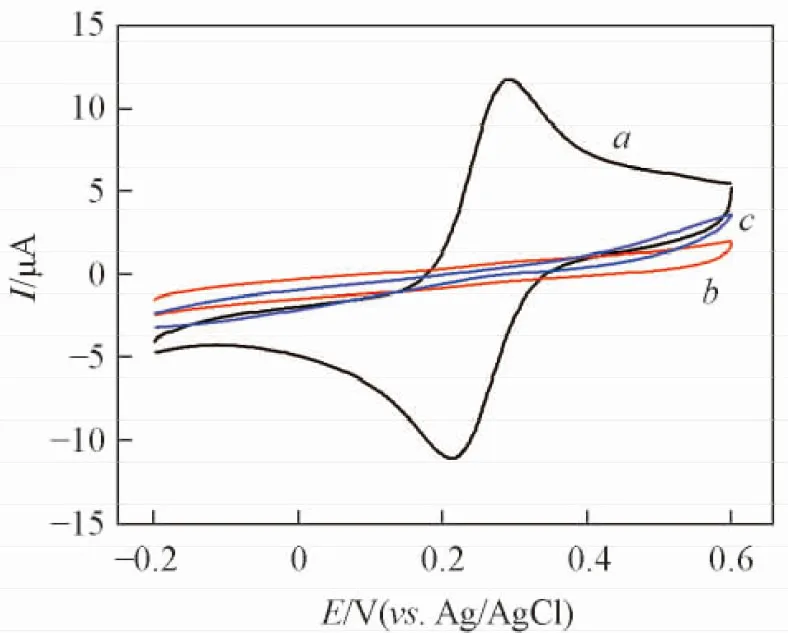
Fig.1 CV curves of 1 mmol/L K3[Fe(CN)6]/K4 [Fe(CN)6] at bare Au(a), Au-ssDNA(b) and Au-ssDNA-MCH(c) electrodes

Fig.2 Differential pulse voltammograms of DNA modified electrodes without Cu2+(a) and with Cu2+(b) in 10 mmol/L PBS containing 0.1 mol/L NaCl(pH=7.0)
2.2 探针DNA修饰Au电极对铜离子的响应
将探针DNA修饰Au电极浸在含有铜离子的溶液中吸附一段时间后, 采用DPV法进行检测. 图2示出了探针DNA修饰电极在吸附铜离子前后的DPV响应曲线. 可见, 吸附铜离子之前的修饰电极未检测到电活性物质(曲线a); 而吸附铜离子之后的修饰电极在约0.15 V处出现了明显的电化学还原峰(曲线b), 这是由于铜离子与DNA分子中的碱基相互作用形成了络合物, 络合物吸附在修饰电极表面, 扫描时Cu2+得电子被还原为Cu+所致. 根据文献[25]报道可知铜离子对DNA序列的识别能力较强, 这是因为铜离子与DNA分子中的碱基G, C, T和A有键合亲和性, 故铜离子能与DNA相互作用, 形成相应的络合物. 其中铜离子与碱基G和C的键合亲和性强于碱基T和A, 其原因是铜离子主要与G中的N7 和 O6原子以及C中的O2原子相互作用. 在中性条件下, 过渡金属离子与DNA碱基作用的稳定性顺序为N7/O6(G)>N3(C)>N7(A)>N1(A)>N3(A,G), 而且过渡金属离子与鸟嘌呤(G)中的N7相互作用的稳定性远高于其与O6或其它碱基作用的稳定性, 因此本文主要考虑Cu2+与N7(G)作用的稳定性[26~30]. 其作用原理如图3所示.

Fig.3 Schematic representation of detecting Cu2+
2.3 实验条件的优化
实验考察了铜离子吸附时间、 pH值和DNA自组装时间对响应信号的影响. 以探针DNA修饰电极有无吸附铜离子所产生的信号比值作为响应信号(I/I0,I为修饰电极吸附铜离子后产生的信号,I0为背景信号).
2.3.1 铜离子吸附时间的选择 电极表面上铜离子的吸附量会对响应信号产生影响, 因此考察了修饰电极与铜离子的作用时间. 将Au-ssDNA-MCH电极浸在含有5 μmol/L铜离子的PBS缓冲液中, 通过控制吸附时间来控制铜离子的吸附量. 当吸附时间由30 min 增至60 min时, 响应信号也随之逐渐增大; 而当吸附时间超过60 min后, 响应信号趋于稳定(见图4). 这是因为DNA中的碱基与铜离子配位是一个动力学过程, 随着作用时间增长, 修饰电极吸附的铜离子量增大, 从而电化学信号增强; 而当吸附时间大于60 min时, 由于铜离子在DNA修饰电极上已经达到吸附饱和, 所以电化学信号不再随着时间增长而增强. 因此, 实验选择铜离子的最佳吸附时间为60 min.

Fig.4 Effect of adsorption time of Cu2+ on DPV response signal(cCu2+= 5×10-6 mol/L)
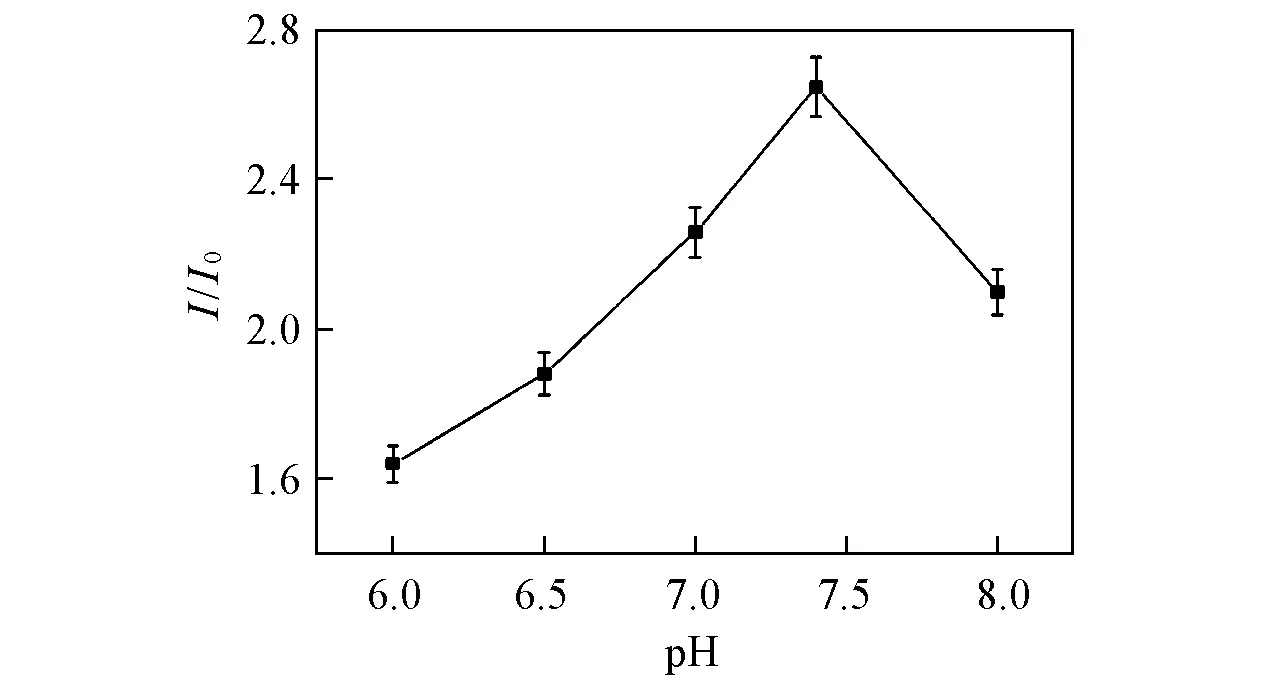
Fig.5 Effect of pH value on the DPV response signal in 10 mmol/L Na2HPO4-NaH2PO4 solution

Fig.6 Influence of the self-assembly time of DNA on the DPV response signal(cDNA=5.0×10-5 mol/L)
2.3.2 磷酸缓冲液pH的选择 将Au-ssDNA-MCH电极浸在含有铜离子的不同pH值的磷酸缓冲液中, 作用一定时间后进行测定, 结果如图5所示, 随着pH值的增大, 响应信号值先增大后减小, 当磷酸缓冲液的pH值为7.4时, 响应信号值最大. 这可能是由于在酸性介质中, 铜离子与DNA中碱基的配位能力较差, 在碱性介质中铜离子容易发生水解. 因此, 选择合适的pH值为7.4.
2.3.3 DNA自组装时间的选择 固定在电极表面上的DNA数目对铜离子的吸附量具有直接影响, 故实验考察了DNA的自组装时间. 如图6所示, 修饰电极在10 μmol/L DNA溶液中自组装120 min后, 响应信号值趋于稳定, 因此选择自组装时间为120 min.
2.4 分析特性
在最佳实验条件下, 探针DNA 修饰电极与不同浓度的铜离子作用60 min后测得的DPV曲线如图7所示. 可见, 随着铜离子浓度的增大, 铜离子的还原峰电流依次增大. 在2.0×10-6~1.0×10-5mol/L和2.0×10-5~1.0×10-4mol/L浓度范围内, 铜离子的浓度与其相对峰电流强度I-I0呈良好的线性关系, 线性回归方程分别为I-I0=-0.056+0.091cCu2+(相关系数为0.9846);I-I0=0.67+0.038cCu2+(相关系数为0.9872), 检出限为6.4×10-7mol/L(S/N=3). 表1示出了该修饰电极与其它已报道的检测铜离子的电化学方法的对比结果, 可见该修饰电极的线性范围较宽. 此外, 该修饰电极的灵敏度也满足实际水样的检测, 有望应用于实地检测.

Fig.7 DPV response of the DNA modified electrode at different concentration of Cu2+ in 10 mmol/L PBS(pH=7.0) and 0.1 mol/L NaCl

Table 1 Comparison of the electrochemical sensor in this work and other sensors
对所构建的铜离子电化学传感器的再生性和选择性进行了考察. 将吸附铜离子后的电极浸在含过量EDTA的Tris-HCl缓冲液(10 mmol/L, pH=9.0)中40 min后, 检测电极的DPV行为, 结果示于图8和图9. 由图8可见, DPV曲线上铜离子的还原峰消失, 说明铜离子已经从电极上去除. 这是由于EDTA与铜离子的络合作用强于DNA, 所以将富集有铜离子的电极在含有过量EDTA的溶液中浸泡一段时间后, EDTA可与铜离子形成更稳定的络合物(本实验条件下EDTA与Cu2+的络合常数约为1018.7, N7(G)与Cu2+的络合常数约为106.2), 使铜离子由电极表面转移到溶液中, 从而实现传感器的再生. 再生性考察结果如图9所示, RSD为1.05%.

Fig.8 Differential pulse voltammograms of the DNA modified electrodes without Cu2 +(a)and with Cu2 +(b) and after being immersed into 10 mmol/L Tris-HCl(pH=9.0) buffer solution containing excessive EDTA for 40 min(c)

Fig.9 Relative reduction current(I-I0) of Cu2+ for 4 times repetitive detections of DNA modified electrode

Fig.10 Reduction current of the DNA modified electrode after adding different metal ions orderly
向5 mL含有5 μmol/L Cu2+的电解液中依次加入常见的重金属离子Ni2+, Cd2+, Hg2+和Pb2+溶液, 使各金属离子的浓度分别为5 μmol/L. 在相同的实验条件下检测DPV响应信号, 考察该电化学传感器对铜离子检测的选择性, 结果如图10所示. 每次检测完后将修饰电极浸在含过量EDTA的Tris-HCl缓冲溶液(10 mmol/L, pH=9.0)中40 min以恢复电极活性. 在选定的电位窗口内, 依次加入干扰离子前后该电化学传感器对铜离子的响应信号变化很小, 而对加入的其它重金属离子几乎无响应, 表明该传感器在选定的电位窗口内对铜离子有良好的选择性.
采用该电化学传感器对模拟水样进行了检测. 水样采自陕西师范大学校内人工湖, 经预处理后检测. 由于人工湖水中铜离子含量很低, 未能检测到DPV响应信号, 因此向处理过的水样中加入含有铜离子的溶液, 使铜离子浓度达到5 μmol/L, 进行回收率实验, 结果如表2所示. 可见, 回收率处于合理范围(70%~120%), 说明该传感器对铜离子检测的准确性. 同时也说明采用该传感器结合DPV电化学方法检测实际样品中的铜离子是可行的.
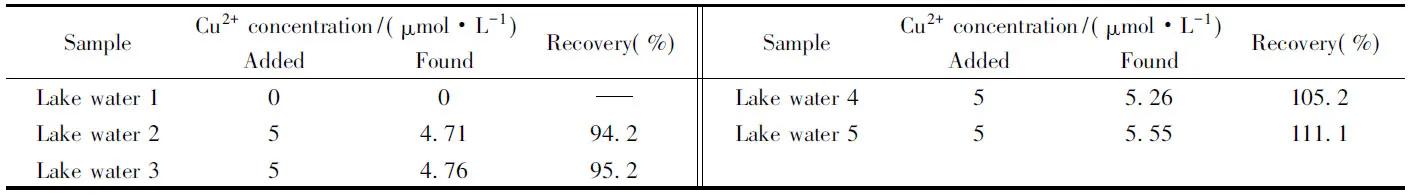
Table 2 Recovery analysis of Cu2+ in lake water samples
3 结 论
基于DNA分子中的碱基与铜离子的配位作用, 构建了一种简单、 快速测铜离子的电化学传感器. 实验结果表明, 该传感器的检测线性范围较宽, 峰电流与铜离子的浓度在2.0×10-6~1.0×10-5mol/L和2.0×10-5~1.0×10-4mol/L范围内呈良好的线性关系. 同时, 该传感器对铜离子检测的选择性较好, 且电极经处理后可循环使用, 这也为其它金属离子的检测提供了新的思路.
[1] Gholivand M. B., Sohrabi A., Abbasi S.,Electroanalysis, 2007, 19(15), 1609—1615
[2] Reddy S. A., Reddy K. J., Narayan S. L., Reddy A. V.,FoodChem., 2008, 109(3), 654—659
[3] Molinos-Senante M., Hernandez-Sancho F., Sala-Garrido R.,WaterResour.Manage., 2013, 27(6), 1797—1808
[4] Aguilar F., Charrondiere U. R., Dusemund B., Galtier P., Gilbert J., Gott D. M., Grilli S., Guertler R.,EFSAJ., 2009, 1089, 1—15
[5] Pourreza N., Hoveizavi R.,Anal.Chim.Acta, 2005, 549(1), 124—128
[6] Atanassova D., Stefanova V., Russeva E.,Talanta, 1998, 47(5), 1237—1243
[7] Zhu Y. B., Inagaki K., Chiba K.,J.Anal.At.Spectrom., 2009, 24(9), 1179—1183
[8] Tang F. X.,DetectionofHeavyMetalinWaterBasedonNanocompositeMaterial, Hunan University, Changsha, 2014(唐凤霞. 基于纳米复合材料检测水体中重金属含量. 长沙: 湖南大学, 2014)
[9] Chen C.,ResearchonElectrochemicalSensorforHeavyMetalIonsDetection,EastChinaUniversityofScienceandTechnology, Shanghai, 2013(陈晨. 用于重金属离子检测的电化学传感器研究, 上海: 华东理工大学, 2013)
[10] Chaiyo S., Chailapakul O., Sakai T., Teshima N., Siangproh W.,Talanta, 2013, 108, 1—6
[11] Zhai R. J., Liu Y. J., Zhao X., Qi Y., Yin N., Huang T.,ChemicalResearch&Application, 2015, 27(9), 1277—1282(翟荣佳, 刘娅静, 赵鑫, 戚裕, 尹妮, 黄甜. 化学研究与应用, 2015, 27(9), 1277—1282)
[12] Kong W. W., Jiang Y. L., Han Q. R., Wang B. X.,Chem.J.ChineseUniversities, 2015, 36(2), 287—292(孔伟伟, 江玉亮, 韩巧荣, 王炳祥. 高等学校化学学报, 2015, 36(2), 287—292)
[13] McLaughlin C. K., Hamblin G. D., Sleiman H. F.,Chem.Soc.Rev., 2011, 40(12), 5647—5656
[14] Wang C. H., Li Y. H., Jia G. Q., Liu Y., Lu S. M., Li C.,Chem.Commun., 2012, 48(50), 6232—6234
[15] Duprey J., Takezawa Y., Shionoya M.,Angew.Chem.Int.Ed., 2013, 52(4), 1250—1254
[16] Zhang L. Y., Guo C. X., Cui Z. M., Guo J., Dong Z. L., Li C. M.,Chem.Eur.J., 2012, 18(49), 15693—15698
[17] Zhang S., Yu T., Sun M., Yu H., Zhang Z., Wang S., Jiang H.,Talanta, 2014, 126, 185—190
[18] Izatt R. M., Christensen J. J., Rytting J. H.,Chem.Rev., 1971, 71 (5), 439—481
[19] Patil S. D. , Rhodes D. G. ,NucleicAcidsRes., 2000, 28(12), 2439—2445
[20] Berti L., Burley G. A.,Nat.Nanotechnol., 2008, 3(2), 81—87
[21] Li W., Chen X. F., Fu Y., Zhang J. L.,J.Phys.Chem.B, 2014, 118(20), 5300—5309
[22] Berti L., Burley G. A.,Nat.Nanotechnol., 2008, 3(2), 81—87
[23] Chen X. F.,EnantioselectiveRecognitionandEnantioseparationofOfloxacinEnantiomersviaDNA-Cu(Ⅱ)Self-assembly, Tianjin University, Tianjin, 2014(陈雄飞. DNA-Cu(Ⅱ)自组装体在氧氟沙星对映体手性识别和拆分中的研究, 天津: 天津大学, 2014)
[24] Liu M. C., Zhao G. H., Tang Y. Y., Yu Z. M., Lei Y. Z., Li M. F., Zhang Y. N., Li D. M.,Environ.Sci.Technol., 2010, 44, 4241—4246
[25] Babkina S. S., Ulakhovich N. A.,Anal.Chem., 2005, 77, 5678—5685
[26] Andrushchenko V., van de Sande J. H., Wieser H.,Biopolymers, 2003, 72(5), 374—390
[27] Hackl E. V., Blagoi Y. P.,J.Inorg.Biochem., 2004, 98(11), 1911—1920
[28] Kim S. H., Martin R. B.,Inorg.Chim.Acta, 1984, 91, 19—24
[29] Sigel H.,Chem.Soc.Rev., 1993, 22, 255—267
[30] Lonnberg H., Vihanto P.,Inorg.Chim.Acta, 1981, 56, 157—161
[31] Yu P.,TheResearchfortheDetectionofHeavyMetalIonsUsingElectrochemicalSensors, Central South University, Changsha, 2011(喻鹏. 用于检测重金属离子电化学传感器的研究, 长沙: 中南大学, 2011)
[32] Veerakumar P., Veeramani V., Chen S. M., Madhu R., Liu S. B.,ACSAppl.Mater.Interfaces, 2015, 8(2), 1319—1326
[33] Cui L.,ConstructionsofElectrochemicalSensorsforHeavyMetalIonsandTheirApplication, Nanjing University, Nanjing, 2015(崔琳. 重金属离子电化学传感器的构建及其应用, 南京: 南京大学, 2015)
[34] Liang Y. H., Liu Y., Guo X. Y., Ye P. P., Wen Y., Yang H. F.,SensorsandActuatorsB:Chemical, 2014, 201, 107—113
(Ed.: N, K)
Detection of Copper Ion Based on the Interaction Between DNA Molecules and Copper Ions†
† Supported by the National Natural Science Foundation of China(No.21575085).
LI Min, KONG Huifang, GUO Zhihui*
(KeyLaboratoryofAnalyticalChemistryforLifeScienceofShaanxiProvince,SchoolofChemistry&ChemicalEngineering,ShaanxiNormalUniversity,Xi’an710119,China)
Copper ion(Cu2+) is one of the essential trace elements of human, which plays an important role in life. However, excessive amounts of copper ions may cause serious damage to health. In this work, Cu2+ions were determined by differential pulse voltammetry(DPV) based on its concentration on DNA modified electrode due to the complexation of Cu2+ions with the base of DNA. Furthermore, because ethylenediaminetetraacetic acid(EDTA) shows stronger complexing ability to Cu2+ions than DNA, Cu2+concentrated on DNA modified electrode can be eluted with EDTA. Thus, the modified electrode was reusable. The results showed that under optimum conditions, the relative reduction current(I-I0) was linear with the concentration of copper ions in the range of 2.0×10-6—1.0×10-5mol/L and 2.0×10-5—1.0×10-4mol/L. The proposed electrochemical sensor for Cu2+ions was simple, stable and reusable.
DNA modified electrode; Electrochemical sensor; Differential pulse voltammetry; Copper ion
2016-02-28.
日期: 2016-06-15.
国家自然科学基金(批准号: 21575085)资助.
10.7503/cjcu20160116
O657.1
A
联系人简介: 郭志慧, 女, 博士, 副教授, 主要从事电化学研究. E-mail: zhguo@snnu.edu.cn
