镍(II)基双氮杂环卡宾配合物的合成及其晶体结构
2016-12-27崔美丽郭芳杰周明东
崔美丽,孙 京,郭芳杰,周明东
·研究论文·
镍(II)基双氮杂环卡宾配合物的合成及其晶体结构
崔美丽,孙 京,郭芳杰,周明东*
(辽宁石油化工大学 化学与材料科学学院,辽宁 抚顺 113001)
以咪唑和取代氯化苄为原料,经氮烷基化反应合成三个氮杂环卡宾(NHC)配体[L1:N,N-二苄基咪唑-2-亚基,L2:N,N-二(4-甲基苄基)咪唑-2-亚基,L3:N,N-二(4-氯苄基)咪唑-2-亚基];再以咪唑官能团化的N-杂环卡宾配体和氯化镍为原料,通过金属交换反应合成三个新型的镍基双氮杂环卡宾配合物[Ni(NHC)2]Cl2(C1~C3),其结构经1H NMR,IR,元素分析和X-单晶射线衍射表征。配合物C1和C3属于单斜晶系,分别为P21/n和P21/c空间群。配合物C2属于三斜晶系,为P1空间群。C1~C3的CCDC分别为:1433176,1433177和1433179。
氮杂环卡宾;镍配合物;合成;晶体结构
氮杂环卡宾(NHC)是至少含有一个α-氨基取代的环状卡宾化合物[1],卡宾中心富含丰富的电子,是过渡金属的良好配体[2-3]。与一般卡宾不同,氮杂环卡宾含有氮杂原子,表现出比一般卡宾更强的给电子能力,甚至优于传统的膦配体[4]。由于强的σ-给电子特性[5-7],使得氮杂环卡宾可以与中心金属配位形成强的,稳定的,空间结构不同的配合物。在金属氮杂环卡宾研究中,Ni-NHC配合物的研究远比不上Pd-,Ru-甚至是Rh-NHC化合物,众所周知,钌、铑和钯是及其昂贵的金属,性质活泼,对空气潮湿环境敏感,而金属镍与同主族金属钯相比,有相似的反应性,却价格低廉。大量文献研究工作表明含有NHC配体的金属镍配合物具有良好的催化性能,可催化Kumada-Corriu等经典偶联反应[8-13]、氢化硅烷化反应[14-15]、齐聚反应[16]等多种反应。
以咪唑和取代氯化苄为原料,经氮烷基化反应合成三个NHC配体[L1:N,N-二苄基咪唑-2-亚基,L2:N,N-二(4-甲基苄基)咪唑-2-亚基,L3:N,N-二(4-氯苄基)咪唑-2-亚基](Scheme 1);再以咪唑官能团化的N-杂环卡宾配体和氯化镍为原料,通过金属交换反应合成三个新型的镍基双氮杂环卡宾配合物[Ni(NHC)2]Cl2(C1~C3)(Scheme 2),其结构经1H NMR,IR,元素分析和X-单晶射线衍射表征。

Scheme 1

Scheme 2
1 实验部分
1.1 仪器与试剂
Bruker Ascend HD 500 MHz型核磁共振仪(CD2Cl2为溶剂,TMS为内标);Nicolet 6700 FT-IR型红外光谱仪(KBr压片);Flash EA 1112型元素分析仪;Bruker XRDR3M/ESYSTCM型单晶衍射仪。
六水合氯化镍试剂和所有溶剂经无水预处理并保存于手套箱或干燥箱中;其余所用试剂均为分析纯。
1.2 合成
(1) L1~L3的合成(以L1为例)
无水无氧条件下,在100 mL Schlenk瓶中依次加入咪唑0.34 g(5 mmol),氯化苄1.26 g(10 mmol)和无水乙腈50 mL,搅拌使其溶解;加入K2CO30.69 g(5 mmol),于75 ℃反应20 h。趁热过滤,滤液置冰箱中挥发溶剂析出白色固体L1 1.21 g,产率85%;1H NMR(DMSO-d6)δ:9.63(s,1H),7.85(s,2H),7.42~7.37(m,10H),5.43(s,4H);13C NMRδ:36.9,135.3,129.5,129.2,128.9,123.4,52.5;IRν:3 383,3 048,1 565,1 500,1 457,1 361,1 211,1 153,722 cm-1。
用类似的方法合成白色固体N,N-二(4-甲基苄基)咪唑氯化物(L2)和N,N-二(4-氯苄基)咪唑氯化物(L3)。
L2:1.37 g,产率88%;1H NMR (DMSO-d6)δ:9.66(s,1H),7.87(d,J=1.5 Hz,2H),7.36(d,J=8.0 Hz,4H),7.23(d,J=8.0 Hz,4H),5.42(s,4H),2.30(s,6H);13C NMRδ:138.7,136.6,132.4,129.9,128.9,123.2,52.2,21.2;IRν:3 364,3 070,1 625,1 554,1 493,1 399,1 150,1 096,1 021,803,756 cm-1。
L3:1.37 g,产率78%;1H NMR (DMSO-d6)δ:9.62(s,1H),7.89(d,J=1.5 Hz,2H),7.51(s,8H),5.48(s,4H);13C NMRδ:137.0,134.2,134.0,130.9,129.5,123.3,51.6;IRν:3 427,3 192,1 637,1 553,1 511,1 450,1 398,1 338,1 207,1 146,636,528,472 cm-1。
(2) C1~C3的合成(以C1为例)
无水无氧环境下,向50 mL Schlenk瓶中依次加入L1 285 mg(1.0 mmol),无水氯化镍64 mg(0.5 mmol),强碱试剂KOtBu 168 mg(1.5 mmol)和无水乙腈15 mL,于室温反应48 h。静置,过滤,滤液浓缩,加入一定量的乙醚,自然环境中挥发溶剂析出橙黄色晶体C1;1H NMRδ:7.66~7.52(m,8H),7.52~7.41(m,12H),7.26(s,4H),5.68(s,8H);IRν:2 184(Ni—C)cm-1;Anal.calcd for C34H32N4Cl2Ni:C 65.00,H 6.14,N 9.22;found C 65.23,H 6.05,N 9.37。
用类似的方法合成C2和C3。
C2:橙黄色晶体;1H NMRδ:7.38(d,J=7.5 Hz,8H),7.24(d,J=7.0 Hz,8H),7.15(s,4H),5.51(s,8H),2.36(s,12H);IRν:2 184(Ni—C) cm-1;Anal.calcd for C38H40N4Cl2Ni:C 65.69,H 6.19,N 8.19;found C 65.45,H 6.24,N 8.10。
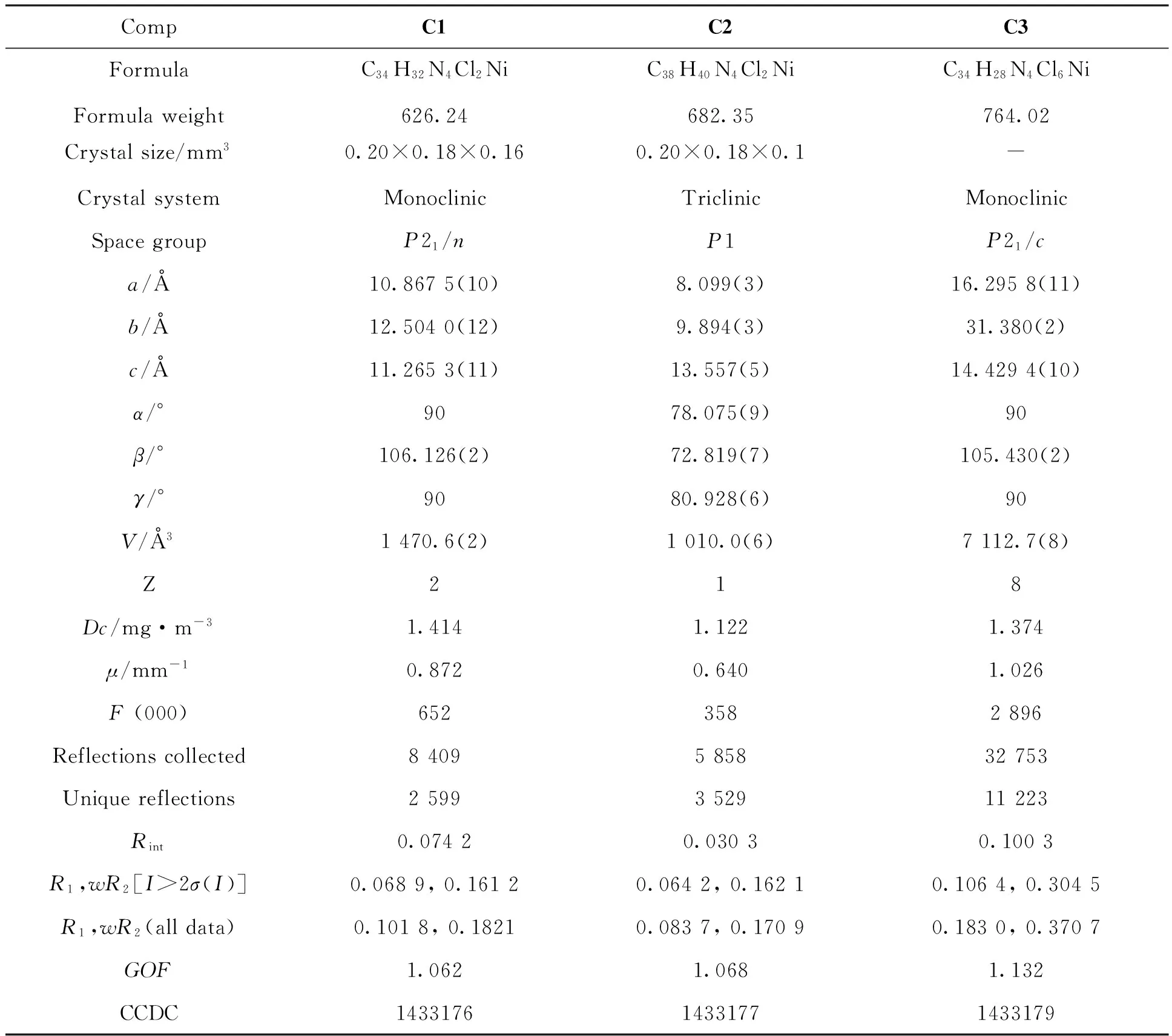
表1 配合物C1~C3的晶体结构数据
C3:橙黄色晶体;1H NMRδ:7.33(s,4H),7.30(d,J=8.5 Hz,8H),7.27(d,J=8.5 Hz,8H),5.48(s,8H);IRν:2 148(Ni—C) cm-1;Anal.calcd for C34H28N4Cl6Ni:C 53.31,H 3.95,N 7.31;found C 53.20,H 4.01,N 7.20。
1.3 晶体结构
配合物晶体结构采用Bruker XRDR3M/ESYSTCM型X-射线单晶衍射仪测试,以石墨单色化处理的MoKα射线(λ=0.710 73 Å)辐射为光源,经ω/φ扫描方式在273 K下收集衍射点,收集的数据通过SMART和SAINT程序还原。配位聚合物的结构由直接法解出,并对所有非氢原子坐标及其各项异性热参数用全矩阵最小二乘法F2修正[17]。所有的计算均使用SHELXTL晶体结构解析程序包完成[18-19]。配合物的晶体学数据及精修参数见表1。
2 结果与讨论
2.1 晶体结构
(1) C1
C1的晶体结构见图1,主要键长和键角见表2。晶体结构分析表明:C1属单斜晶系,空间群P21/n,其最小不对称单元包含1个晶体学独立的镍原子,如图1所示,中心镍离子为四配位,两个配体L1中的2个碳卡宾全部与镍原子配位,两个氯原子与镍原子相连,形成平面四边形构型。其中咪唑两个碳原子C1,C1A和两个氯原子Cl1和Cl1A构成平面的四个顶点,Ni1原子占据平面四边形的中心位置。另外,Cl1#1—Ni1—Cl1键角为180.0°,C1#1—Ni1—C1键角为180.000(1)°,C1—Ni1—Cl1键角为88.84(16)° ,C1—Ni1—Cl1#1键角为91.16(16)°,而且,C1—Ni1键长为1.953(6) Å,Cl1—Ni1键长为2.197 2(13) Å,由此可见,此构型十分接近平面正方形。经Platon程序[17]分析不存在经典的氢键以及C—H┈π或π…π作用。
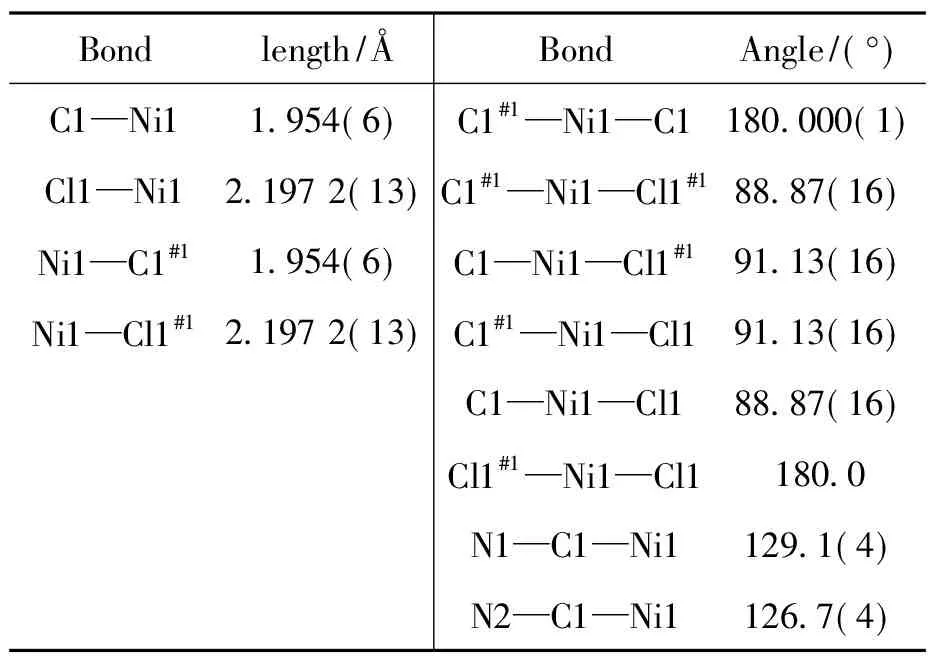
表2 C1的主要键长和键角
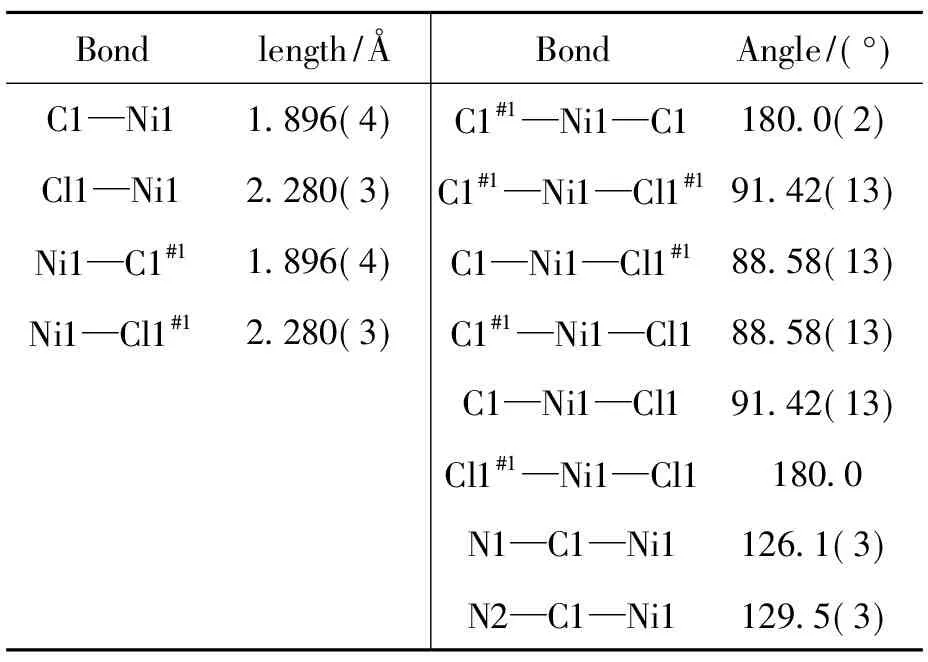
表3 C2的主要键长和键角
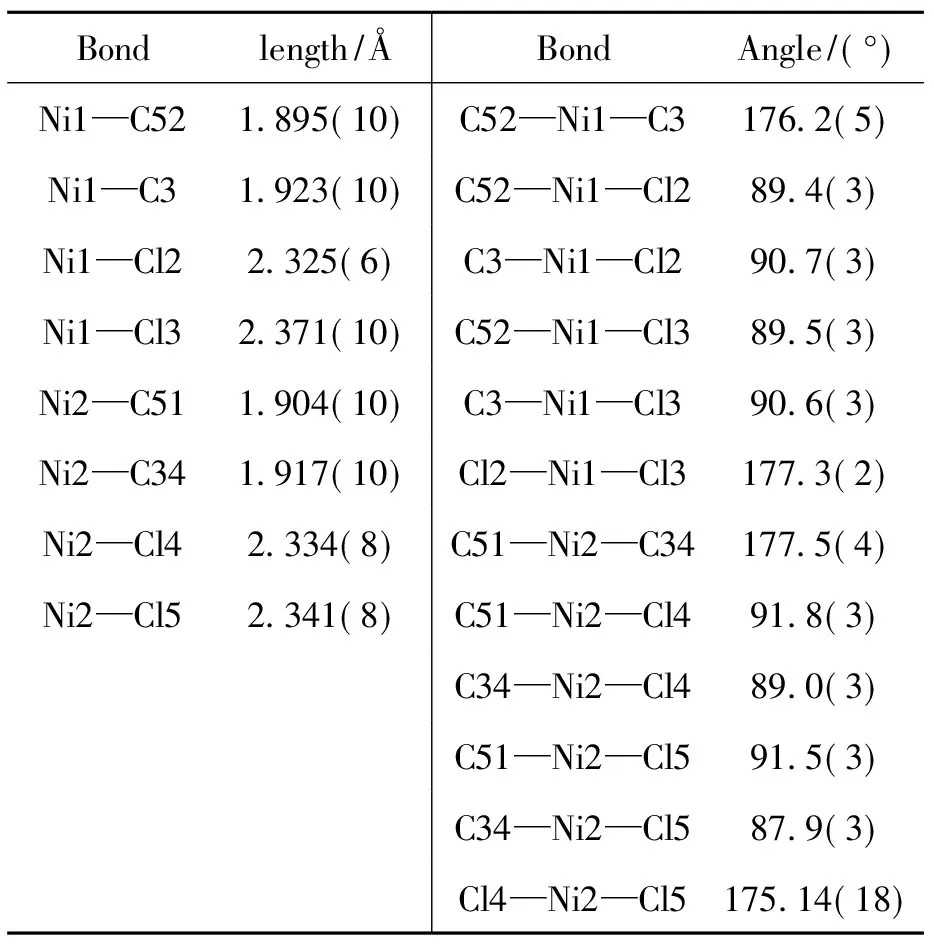
表4 C3的主要键长和键角
#1-x+1,-y+2,-z
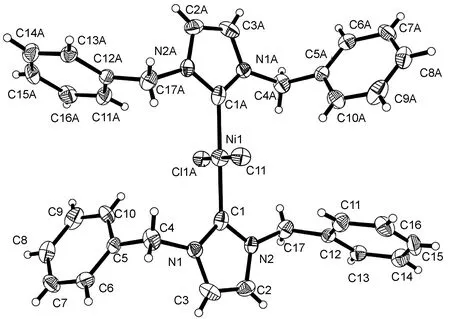
图1 C1的晶体结构(椭球率50%)

图2 C2的晶体结构(椭球率50%)
(2) C2
C2的晶体结构见图2,主要键长和键角见表3。C2结构与C1分子结构较为相似。结构分析表明,C2属三斜晶系,P1空间群,其最小不对称单元包含1个晶体学独立的镍原子,与C1晶体结构相比,C2晶体结构中配体L2苯环上多连接一个甲基基团,使得其中心构型发生扭曲,与C1相比不易接近平面正方形。所以,C2晶体结构中,C1—Ni1键长为1.896(4) Å,Cl1—Ni1键长为2.280(3) Å,对角线键长存在一定的差距。
(3) C3
C3的晶体结构见图3,主要键长和键角见表4。图3中包含两个相同的C3晶体结构。结构分析表明,C3属单斜晶系,P21/c空间群,不对称单元包含1个晶体学独立的镍原子,其余部分都是中心对称结构。如图3所示,中心镍离子为四配位,两个配体L3中的2个碳卡宾全部与镍原子配位,两个氯原子与镍原子相连,形成扭曲的平面四边形构型。由于配合物配体体积较大,空间拥挤,使得其金属中心构型发生扭曲,但这样的改变对金属的配位构型没有实质性的影响。C3晶体结构中,C3—Ni1—C52键角为176.6(5)°,Cl2—Ni1—Cl3键角为177.3(2)°,Ni1—Cl2键长为2.325(6) Å,Ni1—C3键长为1.925(10) Å,Ni2—Cl4键长为2.334(8) Å,Ni2—C51键长为1.904(10) Å。
尽管这三个配合物C1~C3都是由相似的氮杂环卡宾配体与过渡金属镍配位成对称的双卡宾配体镍金属配合物,但他们却属不同的晶系和不同的空间群。这可能是由于配体的结构,体积以及溶剂分子和结构堆积作用方式不同所导致。
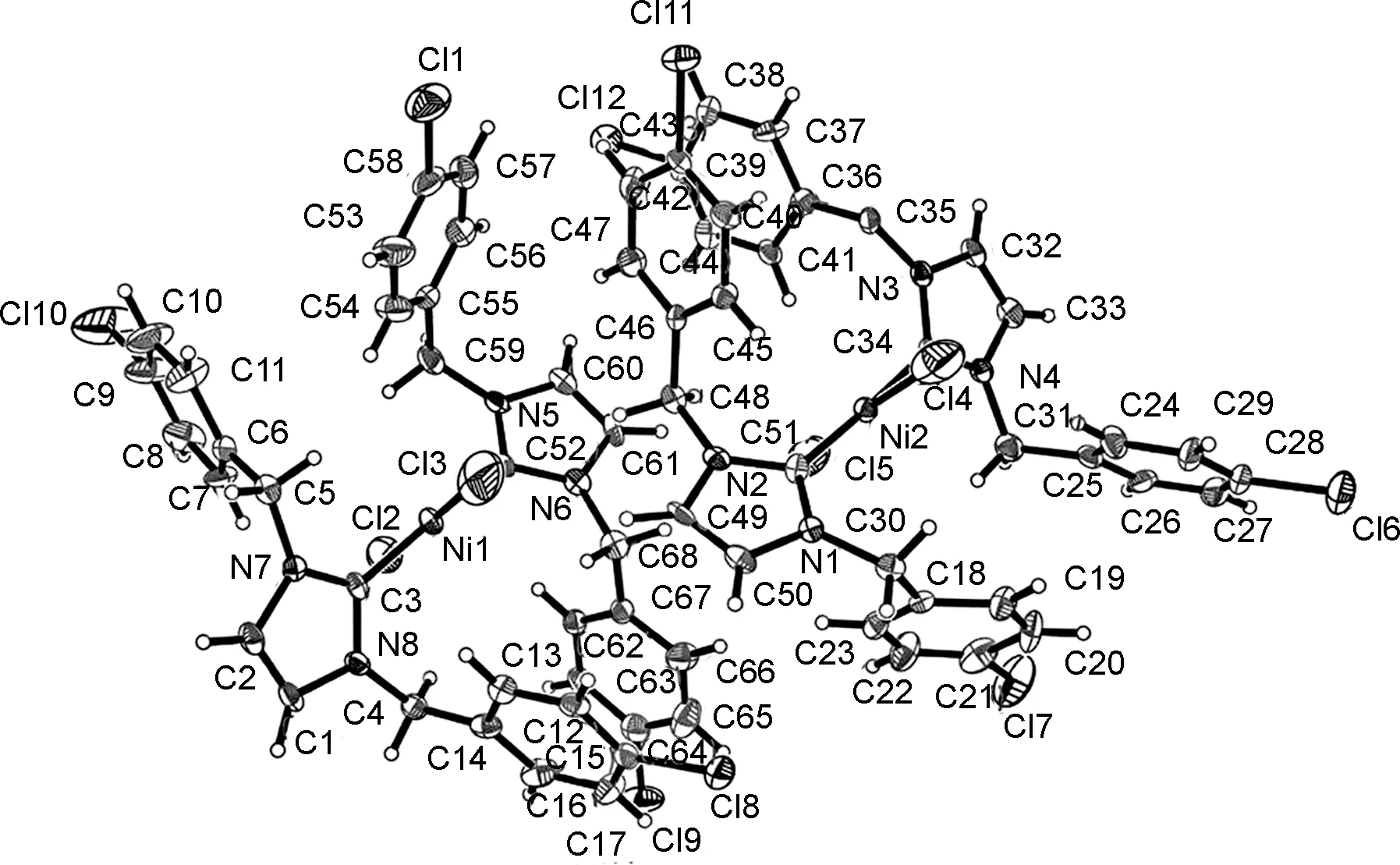
图3 C3的晶体结构(椭球率50%)
3 结论
以咪唑和取代氯化苄为原料,经氮烷基化反应合成三个氮杂环卡宾NHC配体(L1:N,N-二苄基咪唑-2-亚基,L2:N,N-二(4-甲基苄基)咪唑-2-亚基,L3:N,N-二(4-氯苄基)咪唑-2-亚基);再以咪唑官能团化的N-杂环卡宾配体和氯化镍为原料,通过金属交换反应合成三个新型的镍基双氮杂环卡宾配合物[Ni(NHC)2]Cl2(C1~C3)。结构分析表明:配合物的中心镍原子均与两个配体中的碳卡宾配位,形成四配位的平面四边形结构。这些配合物结构相似,但又由于配体取代基团不同而略有差异,分属于不同的晶系和空间群。此类镍(II)基氮杂环卡宾配合物在金属有机催化领域中的C—C偶联反应,C—S偶联反应中具有潜在的催化性能[20-21]。
[1] Frémont P D,Marion N,Nolan S P.Carbenes:Synthesis,properties,and organometallic chemistry[J].Coordin Chem Rev,2009,253(7-8):862-892.
[2] Silvia D G,Nicolas M,Nolan S P.N-heterocyclic carbenes in late transition metal catalysis[J].Chem Rev,2009,109(8):3612-3676.
[3] Enders D,Niemeier O,Henseler A.Organocatalysis byN-heterocyclic carbenes[J].Chem Rev,2007,107(12):5606-5655.
[4] Leuthauer S,Schwarz D,Plenio H.Tuning the electronic properties ofN-heterocyclic carbenes[J].Chem Eur J,2007,13(25):7195-7203.
[5] Díez González S,Nolan S P.Stereoelectronic parameters associated withN-heterocyclic carbene (NHC) ligands:A quest for understanding[J].Coordin Chem Rev,2007,251(5):874-883.
[6] Cavallo L,Correa A,Costabile C,etal.Steric and electronic effects in the bonding ofN-heterocyclic ligands to transition metals[J].Organomet Chem,2005,690(24):5407-5413.
[7] Strassner T.Electronic structure and reactivity of metal carbenes[M].Berlin:Springer,2004.
[8] Böhm V P W,Weskamp T,Gstöttmayr C W K,etal.Nickel-catalyzed cross-coupling of aryl chlorides with aryl Grignard reagents[J].Angew Chem Int Edit,2000,39(9):1602-1604.
[9] Matsubara K,Ueno K,Shibata Y.Synthesis and structures of nickel halide complexes bearing mono-and bis-coordinatedN-heterocyclic carbene ligands,catalyzing grignard cross-coupling reactions[J].Organometallics,2006,25(14):3422-3427.
[10] Huynh H V,Jothibasu R.Syntheses and catalytic activities of Pd(II) dicarbene and hetero-dicarbene complexes[J].J Organomet Chem,2011,696(21):3369-3375.
[11] Ritleng V,Oertel A M,Chetcuti M J.Half-sandwich NHC-nickel (II) complexes as pre-catalysts for the fast Suzuki coupling of aryl halides:A comparative study[J].Dalton T,2010,39(35):8153-8160.
[12] Oertel A M,Ritleng V,Chetcuti M.Synthesis and catalytic activity in Suzuki coupling of nickel complexes bearingn-butyl-and triethoxysilylpropyl-substituted NHC ligands:Toward the heterogenization of molecular catalysts[J].Organometallics,2012,31(7):2829-2840.
[13] Martin A R,Makida Y,Meiries S,etal.Enhanced activity of [Ni(NHC)CpCl] complexes in arylamination catalysis[J].Organometallics,2013,32(21):6265-6270.
[14] Junquera L B,Puerta M C,Valerga P A.R-Allyl nickel (II) complexes with chelatingN-heterocyclic carbenes:Synthesis,structural characterization,and catalytic activity[J].Organometallics,2012,31(6):2175-2183.
[15] Miller Z D,Li W,Belderrain T R,etal.Regioselective allene hydrosilylation catalyzed byN-heterocyclic carbene complexes of nickel and palladium[J].J Am Chem Soc,2013,135(41):15282-15285.
[16] Song H,Fan D,Liu Y,etal.Synthesis,structure,and catalytic activity of nickel complexes with new chiral binaphthyl-based NHC-ligands[J].J Organomet Chem,2013,729(2013):40-45.
[17] Spek A L.PLATON,Utrecht University,Utrecht,the Netherlands[S].1998.
[18] Sheldrick G M,SHELXTL97,University of Göttingen[S].Germany,1997.
[19] SMART V5.618 Software for the CCD Detector System,Bruker Analytical X-ray Systems,Inc.,Madison,WI[S].1998.
[20] Bernhammer J C,Huynh H V.Nickel(II) benzimidazolin-2-ylidene complexes with thioether-functionalized side chains as catalysts for Suzuki-Miyaura cross-coupling[J].Organometallics,2014,33(20):5845-5851.
[21] Guan P,Cao C,Liu Y,etal.Efficient nickel/N-hetero cyclic carbene catalyzed C—S cross-coupling[J].Tetrahedron Lett,2012,53(45):5987-5992.
Synthesis and Crystal Structures of NovelN-Heterocycle Carbene Nickel (II) Complexes
CUI Mei-li,SUN Jing,GUO Fang-jie,ZHOU Ming-dong*
(School of Chemistry and Materials Science,Liaoning Shihua University,Fushun 113001,China)
Three novelN-heterocycle carbine NHC ligands[L1:1,3-bisbenzyl-imidazole-2-ylidene,L2:1,3-bis(4-methylbenzyl)-imidazole-2-ylidene,L3:1,3-bis(4-chlorobenzyl)-imidazole-2-ylidene]were prepared by the nitrogen alkylation reaction of iminazole with substituted benzyl chlorides.Then three novel nickelN-heterocycle carbine complexes [Ni(NHC)2]Cl2(C1~C3),were prepared by the metal exchange reaction of the imidazole NHC ligands with nickel dichloride.The structures were characterized by1H NMR,FT-IR,elemental analysis and X-ray single crystal diffractions.C1 and C3 belong to the monoclinic crystal system with space groupP21/nandP21/crespectively,Where as C2 belongs to triclinic crystal system with space groupP1.CCDC of C1~C3 were 1433176,1433177 and 1433179 respectively.
N-heterocycle carbine;nickel complex;synthesis;crystal structure
2016-04-07;修改日期:2016-10-12
国家自然科学基金资助项目(21101085);国家科技支撑计划资助项目(2012BAF03 B00)
崔美丽(1990-),女,汉族,山西大同人,硕士研究生,主要从事氮杂环卡宾金属有机化学的研究。 E-mail:cuimeili1114@163.com
周明东,教授,E-mail:mingdong.zhou@lnpu.edu.cn
O627
A
10.15952/j.cnki.cjsc.1005-1511.2016.12.16095
