应用等温环介导扩增方法检测蜜蜂残翅病毒的研究
2016-12-27庄明亮牛庆生陈东海李志勇
庄明亮,牛庆生,陈东海,王 志,李志勇,梁 勤
(1.吉林省养蜂科学研究所,吉林 132108;2. 福建农林大学,福州 350002)
应用等温环介导扩增方法检测蜜蜂残翅病毒的研究
庄明亮1,牛庆生1,陈东海1,王 志1,李志勇1,梁 勤2*
(1.吉林省养蜂科学研究所,吉林 132108;2. 福建农林大学,福州 350002)
本文的目的在于建立用于临床检测残翅病病毒(Deformed wing virus,DWV)的等温环介导扩增技术(Loop-mediated isothermal amplification,LAMP),为该疾病的预防和控制提供理论依据。在DWV基因保守序列设计4条引物,探究LAMP扩增的最优条件,并与常规的PCR(polymerase chain reaction)检测方法进行比较。建立的LAMP方法检测下限为0.89 pg,灵敏度比PCR高100倍而且特异性好。临床检测显示建立的LAMP方法可行、准确、方便、灵敏。针对DWV的LAMP建立的检测方法为养蜂生产第一线检测和预防DWV提供了技术支持,有一定的应用价值。
残翅病毒;环介导等温扩增;检测
蜜蜂残翅病毒病是已报道的20种病毒病中最常见且具有高传染性的疾病(Ellis and Munn,2005;Neumann,2010;贾慧茹等,2014),病源为残翅病毒(Deformed wing virus, DWV),于上个世纪90年代初从日本发病西方蜜蜂Apismellifera分离获得(Allen and Ball,1996)。DWV可以侵染蜜蜂发育幼虫、蛹、成蜂的各个阶段(Chen and Siede,2007),发病的成蜂具有翅残缺卷曲、体色变暗、腹部膨胀和失去飞行能力等症状,大面积发生往往于夏秋两季(Tentchevaetal., 2004)。通常情况下DWV以隐性侵染方式存在蜂群,不表现明显症状,在特殊条件下病毒被激活(Miranda and Genersch,2010),但蜂群是如何从隐性状态转化成具有典型侵染特征直至致死状态的机制仍不得而知。有研究表明残翅病毒病的流行与爆发与蜂群内的狄斯瓦螨Varroadestructor寄生密度有密切关系,但狄斯瓦螨的寄生不是该病发生的必要条件(Martinetal.,2010)。DWV通过工蜂饲喂行为水平传播和侵染卵和精液垂直传播。DWV具有分布广泛性、高致病性等特点,已成为蜜蜂烈性传染性疾病,给蜜蜂饲养管理上带来极大地危害。
DWV属于传染性软腐病毒科,由10140个核苷酸组成正义单链RNA(GenBank登陆号:AJ489744),只有一个负责翻译和复制的开放阅读框,编码328 ku的多聚蛋白前体,含有3个主要衣壳蛋白VP1(44 ku)、VP2(32 ku)和VP3(28 ku)(Gaetanaetal., 2006;梁勤和陈大福,2009)。
环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)是日本学者Notomi于2000年发明的一种新的核酸扩增技术(Notomietal.,2000;Notomi and Nippon,2007)。LAMP是利用4条特殊设计的引物识别6个特定区域和具有链置换活性的Bst DNA聚合酶,在恒温60℃-65℃条件即可使目的DNA拷贝数扩增达到109,特异、高效的完成反应。自此技术发明以来,已经应用于病毒病源体的检测、细菌病源体的检测、真菌病原体、寄生虫病的检测、动物胚胎性别的鉴别和转基因食品的检测等领域。蜜蜂残翅病毒病在基层养蜂单位主要诊断手段为症状判断,根据症状判断具有明显的滞后性,蜂群具有明显症状时往往疾病已经大面积爆发,错过的病害防控的最佳时期。在一些有条件的单位可以用PCR技术进行检测,但它具有操作复杂、特异性差、反应时间长等弊端,而且需要特殊的PCR仪,使得无法在基层单位大面积推广。病毒早期的检测对病毒病的防控意义重大,而应用LAMP检测DWV未见报道。本研究以DWV的保守区域建立LAMP检测方法,为基层养蜂生产的快速检测提供新的技术方法。
1 材料与方法
1.1 材料
本试验用样品来自福州闽侯蜂场和福建农林大学蜂学学院,黑蜂王台病毒(Black queen bee viruses, BQCV)、蜜蜂囊状幼虫病毒(Sacbrood virus, SBV)、DWV来自蜂学学院分子生物学实验室。
1.2 主要试剂及仪器
1.2.1 试剂
TRlzol Reagent购自Ambion公司,反转录试剂盒购自Promega公司,Dream Tap Green PCR Master Mix(2×)购自Thermo公司,2000 bp DNA Marker、Trans plus Ⅱ DNA Marker 购自Takara公司,DNA聚合酶(Bst DNA Polymerase)、10×Thermopol Buffer购自NEB公司,硫酸镁(MgSO4)、甜菜碱(Betaine)购自Solarbio公司, DNA Marker、引物由上海生工生物工程有限公司合成,乙醇、异丙醇、氯仿、琼脂糖及其他常用试剂均为分析纯。
1.2.2 仪器
主要仪器有电泳仪购自北京六一仪器厂;5418离心机购自美国Eppendorf公司;凝胶成像仪购自上海培清生物技术有限公司; TU-1900紫外可见分光光度计购自北京普析通用仪器公司;DK-8D型电热恒温水槽购自上海精宏有限公司;PCR仪购自Applied Biosystems公司以及其他常用仪器。
1.3 试验方法
1.3.1 引物设计与合成
通过生物学软件Blast对GenBank中蜜蜂病毒基因进行序列分析得到保守基因序列。利用Primer Explorer V4(http://primerexplorer.jp/e/v4-manual/index.htmL)在线软件设计LAMP引物,设计4条引物包括2条外引物(F3、B3)和2条内引物(FIP、BIP)。可以用外引物常规PCR方法来鉴定引物。引物由上海生物工程公司合成,用无离子水稀释放-20℃备用(表1)。
1.3.2 蜜蜂RNA提取及cDNA的合成
对蜜蜂成年工蜂去除足和翅,50-100 mg先加400 mL Trizol在冰上用研磨棒进行充分研磨,直到看不见成块的几丁质外壳,然后转移到1.5 mL 离心管中再加600 mL Trizol,充分混匀,室温放置5 min。10000 rpm,4℃离心10 min,取上清800 mL。加0.2 mL氯仿,剧烈震荡30 s,室温放置3 min。10000 rpm,4℃离心10 min,取上清600 mL,尽量避免吸沉淀。使用加入0.5 mL的异丙醇,轻柔地混匀,室温放置10 min。10000 rpm,4℃离心10 min,去上清,形成白色点状沉淀。加-20℃冷藏的1 mL 75%乙醇,剧烈震荡。7500 rpm,4℃离心5 min。去除上清,室温晾晒5 min。沉淀溶于20-50 μL无酶水中,用枪吸吹混匀,-80℃保存备用。
使用Promega反转录试剂盒合成cDNA,建立20 μL反应体系包括:MgCl2、5×buffer、Inhibitor、随机引物、Transcriptaste、PCR Nucleotide Mix。42℃水浴延伸15 min,70℃,15 min的反转录酶灭活。所得到的cDNA产物作为LAMP反应模板。
表1 LAMP引物
Table 1 Primers used for LAMP
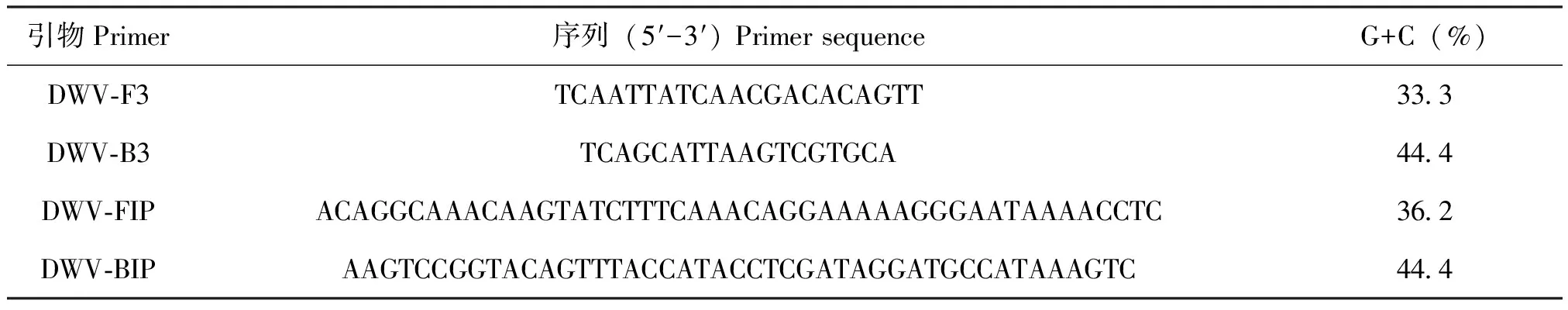
引物Primer序列(5′-3′)PrimersequenceG+C(%)DWV⁃F3TCAATTATCAACGACACAGTT333DWV⁃B3TCAGCATTAAGTCGTGCA444DWV⁃FIPACAGGCAAACAAGTATCTTTCAAACAGGAAAAAGGGAATAAAACCTC362DWV⁃BIPAAGTCCGGTACAGTTTACCATACCTCGATAGGATGCCATAAAGTC444
1.3.3 LAMP检测残翅病毒方法的建立
配制25 μLLAMP初始反应体系(表2):
表2 残翅病病毒LAMP体系建立
Table 2 The detection system of LAMP for DWV

成份Element使用量(μL)Amount10×ThermopolBufferdNTP(10mm/L)BstDNAPolymerase(8000U/mL)Betaine(10mm/L)MgSO4(100mm/L)FIP,BIP(40mm/L)B3,F3(10mm/L)模板TemplateddH2O2510102020050510补至25
1.3.4 DWV LAMP检测体系主要条件优化
1.3.4.1 LAMP体系中最佳反应时间和温度的确定
为获得LAMP扩增的最优体系和条件,依次对反应温度61℃、62℃、63℃、64℃、65℃进行梯度优化。DWV-LAMP以30 min、45 min、60 min、75 min梯度优化。反应产物1.5%琼脂糖凝胶电泳观察,根据所得条带清晰和明亮程度来确定最佳反应时间和温度。
1.3.4.2 LAMP体系中最佳外引物与内引物比例的确定
1.3.4.3 LAMP体系中最佳Betaine浓度的确定
选择之前确定最佳的内外引物比,以甜菜碱终浓度以0、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1 mmol/L、1.2 mmol/L、1.6 mmol/L、2.0 mmol/L分别进行优化固定体系其他条件,进行LAMP反应,根据扩增条带清晰及明亮程度确定最终的最佳Betaine浓度。
1.3.4.4 LAMP体系中最佳MgSO4浓度的确定
选择之前确定最佳的内外引物比和Betaine浓度,DWV LAMP调整Mg2+终浓度以0、2 mmol/L、4 mmol/L、6 mmol/L、10 mmol/L、18 mmol/L梯度优化固定体系其他条件,进行LAMP反应,根据扩增条带清晰及明亮程度确定最终的最佳MgSO4浓度。
1.3.5 LAMP方法敏感性测定
用紫外分光光度仪检测样品RNA浓度,然后依次稀释10倍,建立浓度梯度。用优化好的DWV LAMP方法和一般的PCR法同时进行检测。反应结束取扩增产物,琼脂糖电泳,成像仪观察结果。
1.3.6 可视化LAMP特异性试验
用可视化LAMP方法分别对BQCV、SBV、DWV进行扩增,即在原体系加入螯合好的1 μL钙黄绿素染料,观察颜色变化情况并用常规LAMP法电泳对比扩增反应结果,验证此LAMP方法的特异性和可视化LAMP的可行性。
1.3.7 临床样本的LAMP与PCR对比检测
对本研究室采集的20头意大利蜜蜂成蜂样本按照步骤2中方法进行提取RNA及反转录cDNA进行LAMP及PCR检测。
2 结果与分析
2.1 DWV-LAMP反应体系的优化
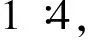
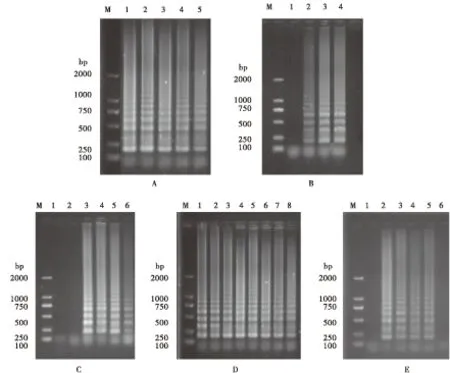
图1 残翅病毒LAMP体系优化Fig.1 The optimization of LAMP for DWV注:M,DNA分子质量标准;A,1-5泳道分别为反应温度61℃、62℃、63℃、64℃、65℃;B,1-3泳道为反应时间30 min、45 min、60 min、75 min;C,1-6泳道为DWV-LAMP外引物与内引物比例;D,1-8泳道为甜菜碱终浓度0、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1.0 mmol/L、1.2 mmol/L、1.6 mmol/L、2.0 mmol/L;E,1-6泳道为Mg2+终浓度0、2 mmol/L、4 mmol/L、6 mmol/L、10 mmol/L、18 mmol/L。Note: M, DNA marker; A, Lane 1-5 temperature 61℃, 62℃, 63℃, 64℃, 65℃L.
2.2 LAMP外引物的PCR反应与鉴定
1.5%琼脂糖凝胶电泳检测,阳性扩增可见清晰明亮的条带,大小片段与预期216 bp相吻合(图2B)。测序结果在NCBI中Blast与AJ489744对比覆盖范围86%,同源率达到96%,表明检测样本发现DWV,同时说明此LAMP引物可用于检测DWV。
2.3 LAMP 与 PCR 的敏感性对比实验
用已完成优化的DWV LAMP体系与常规PCR同等条件下进行检测,灵敏度结果显示DWV LAMP体系可达8.9 fg的RNA模板(图2A)、DWV PCR体系可达8.9 pg的RNA模板(图2B),说明DWV LAMP的灵敏度比常规PCR高100倍。
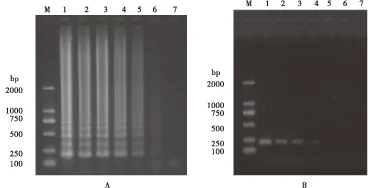
图2 LAMP(A)与PCR(B)敏感性对比图Fig. 2 The sensitivity comparison of LAMP and PCR注:M,DNA分子质量标准;A,依次稀释10倍DWV模板的LAMP琼脂糖凝胶电泳结果,1-7: 8.9 ng、0.89 ng:89 pg、8.9 pg、0.89 pg、89 fg、8.9 fg;B,依次稀释10倍DWV模板的PCR琼脂糖凝胶电泳结果,1-7,8.9 ng、0.89 ng、89 pg、8.9 pg、0.89 pg、89 fg、8.9 fg。Note: M,DNA marker; A, Agarose gel electrophoresis of LAMP products using 10-fold dilution DWV, 1-7,8.9 ng, 0.89 ng, 89 pg, 8.9 pg, 0.89 pg, 89 fg, 8.9 fg; B, Agarose gel electrophoresis of PCR products using 10-fold dilution DWV, 1-7,8.9 ng, 0.89 ng, 89 pg, 8.9 pg, 0.89 pg, 89 fg, 8.9 fg.
2.4 可视化DWV-LAMP的特异性试验
用已完成优化反应的DWV-LAMP检测,最终结果显示只有DWV的cDNA反应呈多梯形条带出现,对照的BQCV、SBV的cDNA和阴性对照没有多梯形条带(图3A)。荧光可视化结果只有DWV试管显绿色荧光,其他阴性对照和BQCV、SBV试管显橘色(图3B)。
2.5 临床样本的检测
检测意大利蜜蜂20个样品LAMP检测阳性数量分别为11;PCR检测阳性数量为7(表3)。PCR检测阳性的样品LAMP均显示阳性,说明LAMP检测准确度高。且LAMP阳性数量比PCR多检出4个,说明LAMP检测灵敏度高。且LAMP方法在在一个水浴锅反应仪器下比PCR节约2 h。
表3 LAMP和PCR对临床样本检测结果
Table 3 Results of LAMP and PCR for clinical samples
品种Variety方法Methods样品数Samples阳性检测数Positivecounts意大利蜜蜂LAMP2011ApismelliferaligusticaPCR207
3 结论与讨论
蜜蜂的残翅病毒病是由病原体DWV所引起的一种病害,感染率高严重危害蜜蜂群势健康发展。提前、快速、准确的发现病原对于早期病害的防控至关重要。

图3 DWV LAMP反应特异性扩增结果Fig. 3 LAMP specific amplified products of DWV注:M, DNA分子质量标准;A,DWV-LAMP反应特异性琼脂糖凝胶电泳图:1,残翅病毒;2,黑蜂王台病毒;3,囊状幼虫病毒;4,阴性对照;B,荧光可视化特异性试验:1, 残翅病毒;2, 黑蜂王台病毒;3, 囊状幼虫病毒;4,阴性对照。Note: M, DNA marker; A, LAMP specific amplified products of DWV:1,DWV, deformed wing virus;2,BQCV, black queen bee viruses;3,SBV, sacbrood virus; 4,Negative control; B,the visual observation of specific amplified products of BQCV:1,DWV, deformed wing virus;2,BQCV, black queen bee viruses;3,SBV, sacbrood virus;4, Negative control.
目前应用检测DWV技术主要有免疫学方法及PCR方法。免疫学方法存在操作时间长、敏感性和特异性低、有效的抗血清不易寻找等弊端。随着PCR技术发展,现已成为主流的DWV检测方法,但在生产实践中,PCR检测方法需要特定的仪器和较长的时间,在一些基层单位无法应用。而LAMP技术是一种等温核酸扩增技术,通过可视化方法,整个反应过程只需要恒温水浴锅在一个小时内即可完成检测,LAMP方法发明至今已被广泛用于多种病原体的检测,如兔出血病症病毒(原冬伟等,2013)、禽流感病毒(Dinhetal., 2011)、家蚕核型多角体病毒(唐芬芬等,2013)等。本试验经过多次验证及重复性试验优化后的LAMP体系对SBV、BQCV的检测均为阴性,表明所建立的DWV-LAMP体系特异性强;而且DWV-LAMP方法检测灵敏度比DWV用PCR灵敏度高出100倍,可用于DWV的早期诊断。建立的DWV LAMP可视化反应体系,只需在水浴锅中反应65 min即可观察结果。
LAMP的引物设计工作在整个实验中起十分关键的作用。由于LMAP设计要针对靶基因序列6个区域设计4条引物,要求靶基因序列的保守性较高。首先通过NCBI找到DWV同属其他病毒基因的全序列,通过DNAman软件进行序列对比,找到同源性高的区域,这是在长期进化变异过程中保守的部分;对照在国内的不同亚型,发现这3种亚型基因序列上差异不大,找到的大约800 bp的序列。而且可以设计2-3对引物,通过引物筛选设计成功率比较高。具体的引物设计过程需要注意如下几步:1)5′端F2区域到B2区域之间的距离控制在120-180 bp,F1、F2、F3和B1、B2、B3各个区域间距在18-20 bp;2)引物Tm值:富含AT片段55℃-60℃,富含GC片段60℃-65℃。6个区域的TM值满足:F2>F3、B3;B2 本研究建立的LAMP方法和可视化LAMP方法具有操作简便、快速、灵敏度高等特点,可用于快速准确诊断出残翅病毒,对病毒侵染初期时,为蜜蜂残翅病毒病诊断、防治提供了一种准确、简便的新方法。为提前预防有效防控该病和降低蜂产品中药物残留提供了技术保障,对日后蜜蜂病害诊断和检测必能起到促进作用。 References) Allen M,Ball B. The incidence and world distribution of honey bee viruses[J].BeeWorld, 1996,77(3):141-162. Chen YP, Siede R. Honey bee viruses[J].AdvancesinVirusResearch, 2007,70(7): 33-80. Dinh DT, Le MT, Vuong CD,etal. An updated loop-mediated isothermal amplification method for rapid diagnosis of H5N1 avian influenza viruses[J].TropicalMedicineHealth, 2011, 39(1):3-7. Ellis JD, Munn PA. The wordwide health status of honey bees[J].BeeWorld, 2005,86(4):88-101. Gaetana L, Miranda JR, MaRIA BB,etal. Molecular and biological characterization of deformed wing virus of honey bees(Apismellifera)[J].JournalofVirology, 2006, 80(10):4998-5009. Jia HR, Liu JZ, Wang X,etal. Occurrence and prevalence of six bee viruses in Beijing[J].ChineseJournalofAppliedEntomology, 2014,51(3):772-780. [贾慧茹,刘进祖,王星,等. 北京地区六种蜜蜂病毒病的流行病学研究[J]. 应用昆虫学报, 2014,51(3):772-780] Liang Q, Chen DF. Bee Protection[M]. Beijing: Chinese Agricultural Press,2009:216. [梁勤, 陈大福. 蜜蜂保护学[M]. 北京:中国农业出版社, 2009: 216] Martin SJ, Ball BV, Carreck NL,etal. Prevalence and persistence of deformed wing virus(DWV) in untreated or acaricide-treated Varroa destructor infested honey bees(Apismellifera) colonies[J].JournalofApiculturalResearch, 2010,49(1):72-79. Miranda JR, Genersch E. Deformed wing virus[J].JournalofInvertebratePathology, 2010,103(1):48-61. Neumann P, Carreck NL. Honey bee colony losses[J].JournalofApiculturalResearch,2010,49(1):1-6. Tentcheva D, Gauthier L, Jouve S,etal. Polymerase chain reaction detection of deformed wing virus(DWV) inApismelliferaandVarroadestructor[J].Apidologie,2004, 35(4):431-439. Tang FF, Yang WK, Shao YL,etal. Prompt diagnosis of theBombyxmorinucleopolyhedrosis virus by loop-mediated isothermal amplification[J].ChineseJournalofAppliedEntomology, 2013, 50(4):1013-1019. [唐芬芬,杨伟克,邵榆岚,等. 应用环介导等温扩增技术( LAMP) 快速检测家蚕核型多角体病毒的研究[J]. 应用昆虫学报, 2013, 50(4):1013-1019] Yuan DW, Liu JS, Guo DC,etal. Application of a loop-mediated isothermal amplification method in detection of RHDV[J].ChineseVeterinaryScience, 2013, 43(4):390-395.[原冬伟,刘家森,郭东春,等. 环介导等温扩增技术兔出血症病毒检测中的应用[J]. 中国兽医科学,2013, 43(4):390-395] Diagnosis of the deformed wing cell virus(DWV)by loop-mediated isothermal amplification ZHUANG Ming-Liang1,NIU Qing-Sheng1,CHEN Dong-Hai1,WANG Zhi1,LI Zhi-Yong1,LIANG Qin2* (1. Apiculture Science Institute of Jilin Province, Jilin 132108, China; 2.Fujian Agriculture and Forestry University, Fuzhou 350002, China) The objective of this study is to establish a simple, fast and accurate method to deformed wing virus(DWV) in clinical by using loop-mediated isothermal amplification(LAMP), which provides an experimental proof for controlling the disease. Four primers were designed based on six conserved regions of gene sequence on DWV, and were used for exploring the optimal LAMP amplification conditions. And the LAMP amplification result was compared conventional PCR(polymerase chain reaction) method. The established LAMP could detect as low as 0.89 pg DNA, which was 100 times sensitive than PCR method. Clinical result showed LAMP could be used to detect DWV whatever in Italian bee (Apismelliferaligustica) or in Chinese bee(A.ceranacerana), and the real positive detected ratio was 20% higher than PCR tested. The established LAMP was practical valuable for detecting and controlling the DWV in honeybee keeping. Deformed wing virus; loop-mediated isothermal amplification; detection 国家蜂产业技术体系专项资金(CARS-45-KXJ7) 庄明亮,男,1989年生,吉林辽源人,硕士研究生,E-mail: mingliang89@126.com *通讯作者Author for correspondence,E-mail: lq-fz@163.com 2015-12-21;接受日期:2016-03-16 Q963; S893.3 A 1674-0858(2016)06-1192-07
