不同变温幅度对施氏鲟幼鱼消化酶、代谢酶及抗氧化酶活性影响
2016-12-27李晋南赵志刚徐奇友罗亮王常安王连生
李晋南,赵志刚,徐奇友,罗亮,王常安,王连生
(中国水产科学研究院黑龙江水产研究所,哈尔滨 150070)
不同变温幅度对施氏鲟幼鱼消化酶、代谢酶及抗氧化酶活性影响
李晋南,赵志刚,徐奇友,罗亮,王常安,王连生
(中国水产科学研究院黑龙江水产研究所,哈尔滨 150070)
为研究不同变温条件下施氏鲟幼鱼消化酶活性和血清生化指标变化情况,试验设置一个恒温对照组(22±0)℃和四个变温组(22±1)℃、(22±2)℃、(22±3)℃及(22±4)℃,每组4个重复,每个重复15尾鱼,养殖周期42 d。结果表明,与对照组相比,(22±3)℃组十二指肠和瓣肠淀粉酶,十二指肠蛋白酶活性均显著降低(P<0.05)。各试验组与对照组相比,十二指肠脂肪酶活性无显著差异(P>0.05),但(22±3)℃组和(22±4)℃组脂肪酶活性显著低于(22±1)℃组(P<0.05)。各试验组瓣肠脂肪酶活性均显著低于对照组(P<0.05)。(22±2)℃组和(22±3)℃组瓣肠蛋白酶活性均显著高于对照组(P<0.05),其他组与对照组差异不显著(P>0.05)。各组超氧化物歧化酶(SOD)和黄嘌呤氧化酶(XOD)活性均无显著差异(P>0.05)。(22±1)℃组谷草转氨酶(AST)活性显著高于对照组(P<0.05),而(22±4)℃组AST活性显著低于对照组(P<0.05)。(22±1)℃组、(22±2)℃组和(22±4)℃组谷丙转氨酶(ALT)活性显著高于对照组(P<0.05)。(22±2)℃组总抗氧化能力(T-AOC)显著高于对照组和其他各试验组。综上,(22±2)℃变温模式可显著提高瓣肠蛋白酶活性,同时提高代谢酶活性和抗氧化能力。
变温;施氏鲟;消化酶;代谢酶;抗氧化酶
水温及其变化与鱼类生长和摄食密切相关。适宜温度对鱼类新陈代谢[1]、性别分化[2-4]和生长发育[5-6]等具有重要意义。国内外关于温度对水生动物影响研究集中在恒温条件。自然界中,水温具有时间、空间及周期性变化。Jensen研究发现,实验室得到水生动物最适生长温度与野外数据不一致,可能与实验室恒温与野外变温差异有关[7]。目前有关周期性变温对水生生物,如澳利亚罗非鱼(Oreochromis aureus)[8]、斑点叉尾鮰(Ictalurus punctatus)[9]、蟹[10]、贝类[11-12]、虾[13-14]生长发育和能量代谢等影响的研究结果表明,一定条件下变温能提高水产生物生长发育速度。
施氏鲟(Acipenser schrenckii Brandt)是重要经济鱼类,个体大、生长快、一龄后个体抗逆性强[15]。施氏鲟营养丰富,其卵制成的鱼子酱具有极高经济价值。施氏鲟自然分布于黑龙江水系,生存水温为1~30℃,人工养殖在17~26℃范围内均能正常摄食和生长[16]。近年来施氏鲟研究多集中在繁殖生物学[17-19]、营养学[20-22]、病理学[23]等方面,而环境变温对施氏鲟消化酶活性影响研究鲜有报道。本研究通过设置不同变温条件,研究施氏鲟消化酶活性和血清生化指标变化,为施氏鲟工厂化养殖温度调控提供依据。
1 材料与方法
1.1 材料
施氏鲟幼鱼取自中国水产科学研究院鲟鱼繁育中心。室内循环水族箱内暂养14 d。暂养用水为曝气自来水,暂养期间饱食投喂鲟鱼商品鱼苗种配合饲料,每天换水1/3,水温控制在(20±0.5)℃。
1.2 温度设计
试验温度设一个恒温对照组(22±0)℃和四个变温处理组(22±1)℃、(22±2)℃、(22±3)℃及(22±4)℃。通过可编程智能温度控制仪控制变温组温度,控制模式为:从6:00最低温度开始逐渐升温,13:00上升至最高温度,13:00~18:00保持最高温度;18:00后逐渐降温,次日1:00逐渐降最低温度,1:00~6:00保持最低温度,以24 h为单位循环。
1.3 养殖管理
暂养结束后,取健康且规格整齐的个体(平均体重为35.8±0.9 g)移至不同温度处理组水族箱中试验,每组4个重复,每个重复15尾鱼。试验期间每天换水1/3以上,每天3次(8:00、13:00和17:00)饱食投喂鲟鱼商品鱼苗种配合饲料,定期清除残饵和粪便。整个试验期间DO>5.5 mg·L-1,光照周期12 L∶12 D,pH(7.5±0.2)。养殖周期42 d。
1.4 血清指标检测
养殖试验结束后,停食24 h,每个试验单元中随机取鱼5尾,每处理组20尾,麻醉剂(MS-222)麻醉后,用注射器在鱼体臀鳍下方动脉抽血,血液注入离心管中后4℃冷藏,静置分层后10 000 r·min-1离心10min至完全分层后取上层血清,置于-80℃冰箱保存待测。测定指标包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、总抗氧化能力(T-AOC)、黄嘌呤氧化酶(XOD)和超氧化物歧化酶(SOD),均采用南京建成试剂盒测定,方法参照试剂盒说明书。
1.5 消化酶活性测定
将取血后试验鱼在冰盘上迅速解剖,分别取胃、十二指肠和瓣肠,用预冷(0~4℃)0.86%生理盐水洗涤,滤纸吸去表面水分,分别称重后用9倍质量比预冷0.86%生理盐水稀释,冰水浴中用高速组织匀浆机匀浆,匀浆液经离心后(4℃,3 500 r·min-1,10 min),将上清液分装保存于-20℃,作为组织粗酶液测定消化酶活性。
蛋白酶活性采用福林-酚(Folin-phenol)法测定,取匀浆粗酶液1 mL,37℃水浴预热5 min后加0.5%酪蛋白溶液2 mL作为反应底物。37℃水浴条件下准确反应15 min后加入10%三氯乙酸溶液3 mL,3 500 r·min-1离心10 min,去除沉淀,取上清液1 mL,加入0.55 mol·L-1碳酸钠溶液5 mL,再加入福林-酚试剂1 mL,于37℃水浴中显色15 min,在689 nm波长下比色测定,同时以1 mL去离子水作空白对照。淀粉酶和脂肪酶活性均采用南京建成试剂盒测定。组织蛋白含量采用考马斯亮蓝法测定。
蛋白酶活性单位定义:在37℃条件下,每分钟水解酪蛋白产生相当于1 μg酪氨酸所需酶量为1个酶活性单位。
脂肪酶活性单位定义:在37℃条件下,每克组织蛋白质在本反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活性单位。淀粉酶活性单位定义:在37℃条件下,每毫克组织蛋白质与底物作用30 min,水解10 mg淀粉为1个酶活性单位。
1.6 统计分析
应用SPSS19.0软件统计分析。分别对各温度组数据作单因素方差(One-way ANOVA)分析,并作Duncan's多重比较,结果用平均值±标准差(Mean± SD)表示,显著性水平P<0.05。
2 结果与分析
2.1 淀粉酶活性
各试验组施氏鲟幼鱼淀粉酶活性结果见表1。各试验组胃淀粉酶活性无显著差异(P>0.05)。与(22±0)℃对照组相比,(22±3)℃组十二指肠和瓣肠淀粉酶活性显著降低(P<0.05),其他组与对照组相比差异不显著(P>0.05)。
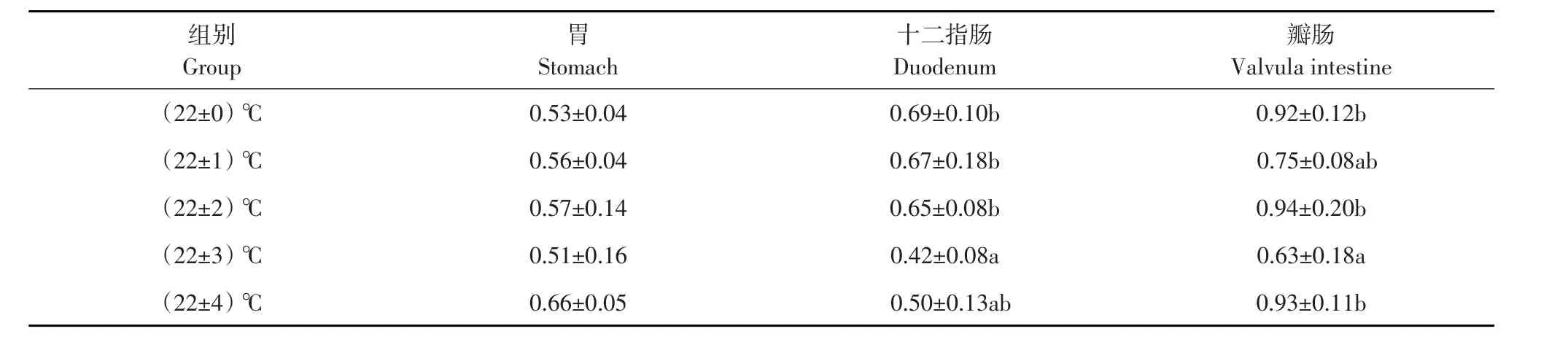
表1 不同变温幅度对施氏鲟幼鱼淀粉酶活性影响Table 1Effects of different temperature fluctuation range on amylase activities of juvenile sturgeon (U·mg-1prot)
2.2 脂肪酶活性
各试验组施氏鲟幼鱼脂肪酶活性结果见表2。各试验组胃脂肪酶活性与对照组相比差异不显著(P>0.05)。在各试验组中,(22±2)℃组胃脂肪酶活性最低,显著低于(22±3)℃组和(22±4)℃组(P<0.05)。各试验组与对照组相比,十二指肠脂肪酶活性无显著差异(P>0.05),但(22±3)℃组和(22±4)℃组十二指肠酶活性显著低于(22±1)℃组(P<0.05)。各试验组的瓣肠脂肪酶活性显著低于对照(22±0)℃组(P<0.05)。在各试验组中,(22± 3)℃组瓣肠脂肪酶活性最低,显著低于(22±0)℃对照组、(22±1)℃组和(22±2)℃组(P<0.05)。
2.3 蛋白酶活性
各试验组施氏鲟幼鱼蛋白酶活性结果见表3。各试验组与对照组相比,胃蛋白酶活性无显著差异(P>0.05),但(22±3)℃组胃蛋白酶活性显著低于(22±4)℃组(P<0.05)。(22±3)℃组十二指肠蛋白酶活性显著低于对照(22±0)℃组、(22±1)℃组和(22±2)℃组(P<0.05),其他各组与对照组相比差异不显著(P>0.05)。(22±2)℃组和(22±3)℃组瓣肠的蛋白酶活性显著高于对照(22±0)℃组(P<0.05),其他组瓣肠蛋白酶活性与对照组比差异不显著(P>0.05)。
2.4 血清代谢酶和抗氧化酶
各试验组施氏鲟幼鱼血清代谢酶和抗氧化酶结果见表4。各试验组SOD和XOD酶活性无显著差异(P>0.05)。与对照组相比,(22±1)℃组AST活性显著升高(P<0.05),而(22±4)℃组AST活性显著降低(P<0.05),其他两组AST活性与对照组相比差异不显著(P>0.05)。(22±1)℃、(22±2)℃和(22±4)℃组ALT活性显著高于对照组(P<0.05)。(22±2)℃组T-AOC显著高于对照组和其他各组(P<0.05),其他各组与对照组相比差异不显著(P>0.05)。

表2 不同变温幅度对施氏鲟幼鱼脂肪酶活性影响Table 2Effects of different temperature fluctuation range on lipase activities of juvenile sturgeon(U·g-1prot)
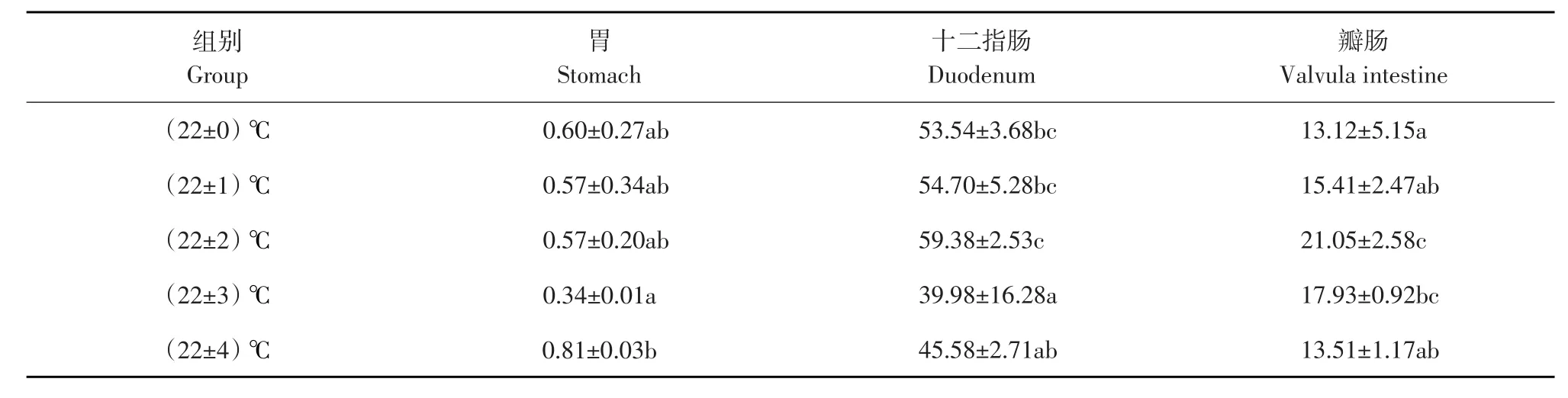
表3 不同变温幅度对施氏鲟幼鱼蛋白酶活性影响Table 3Effects of different temperature fluctuation range on protease activities of juvenile sturgeon(U·mg-1prot)
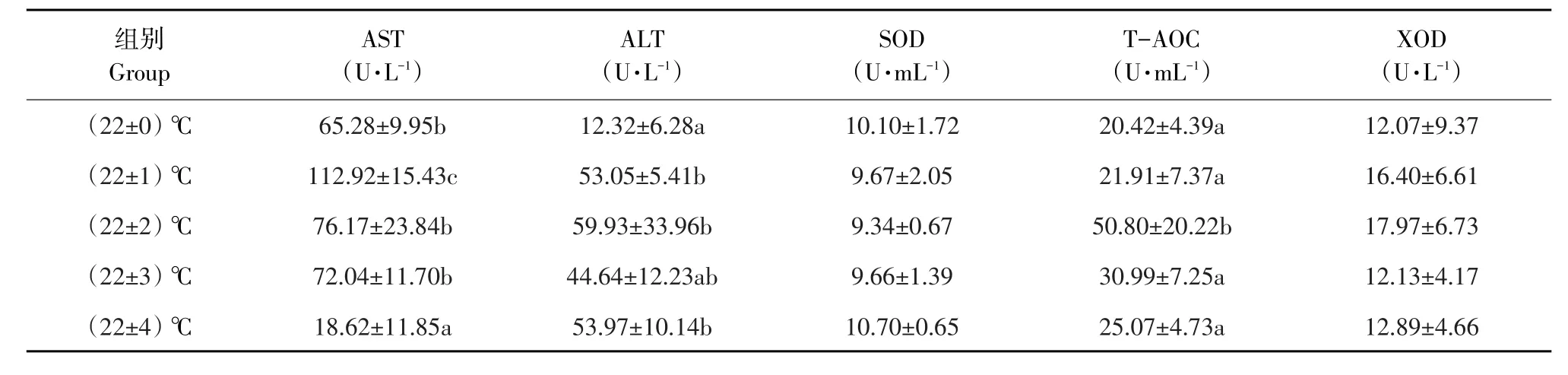
表4 不同变温幅度对施氏鲟幼鱼血清代谢酶和抗氧化酶影响Table 4Effects of different temperature fluctuation range on serum metabolic and antioxidase enzyme activities of juvenile sturgeon
3 讨论
在不同温度变化模式中,变温幅度对水生动物影响较大,适宜变温幅度促进水生动物个体生长。变温幅度过大,生长速度降低,产生消极影响[24];而变温幅度过小,即使加快温度变化频率,不足以对生长性能产生显著影响[25]。作为变温动物,鱼类消化道温度与水温变化密切相关,环境温度变化直接影响鱼体消化酶活性,其活性决定鱼体对营养物质消化吸收能力。本试验发现,与恒温模式相比,变温模式对施氏鲟十二指肠和瓣肠淀粉酶、脂肪酶和蛋白酶均产生显著影响,变温可显著影响施氏鲟机体对营养物质消化能力。随着变温幅度增加,十二指肠、瓣肠淀粉酶和脂肪酶以及胃和十二指肠蛋白酶均呈先降后升趋势,(22±3)℃达到最低值,而瓣肠蛋白酶则先升后降,(22±2)℃达到最高值。结果说明,变温对施氏鲟消化道不同部位消化酶活性影响趋势不同。可能与施氏鲟不同部位的消化酶在变温过程中适应性补偿有关。田宏杰等[26]研究施氏鲟幼鱼在不同恒温条件下消化酶活性,表明水温21℃和28℃时施氏鲟对蛋白质消化能力较强,而14℃时对脂肪消化能力较强。本研究中,与恒温相比,当变温幅度达到3℃时,施氏鲟肠道消化淀粉能力、瓣肠消化脂肪酶能力以及十二指肠消化蛋白酶能力均显著降低,而瓣肠消化蛋白酶能力显著升高。
研究表明,温度变化会影响血清指标改变[27-28]。ALT和AST是鱼类重要氨基酸转氨酶,在蛋白质合成和分解代谢中起重要作用,正常状态鱼体血清转氨酶活性较低且相对稳定。当肝脏受损时,ALT和AST大量进入血液,导致转氨酶活性升高,因此ALT和AST常被作为肝脏功能评估指标。另一方面,ALT和AST活性也与氨基酸代谢强度有关,氨基酸代谢增强时转氨酶活性升高。本试验显示,ALT和AST在适宜变温幅度中,活性均显著高于对照组,说明适宜变温幅度促进蛋白质代谢,可能对鱼体生长发育有促进作用,而并非其肝脏功能受损。总抗氧化能力(T-AOC)是反映机体抗氧化作用综合指标,可反映生物机体酶系统和非酶系统抗氧化能力水平,并与生物健康程度密切相关。生物体抗氧化防御体系包括酶促与非酶促2个部分,酶促体系以超氧化物歧化酶、谷胱甘肽酶、过氧化物酶等微量元素为中心,非酶促反应体系以维生素、氨基酸、金属蛋白质等有机物为主要成分。本试验中,超氧化物歧化酶SOD,在变温条件下,各组间无显著差异,但(22±2)℃组T-AOC值显著高于对照组和其他各组,表明该变温模式可有效提高施氏鲟机体总抗氧化能力。孙大江等发现,试验水温短时间升高或降低8~9℃时,施氏鲟仔鱼仍未出现明显不适反应[15]。田甜等研究表明,温度骤变,温差达到6℃时,施氏鲟幼鱼活动出现轻微异常;当温差达到8℃时,鱼体下沉水底,活动减缓,呼吸加快[29]。施氏鲟活动代谢变化可能与变温过程中鱼体代谢酶变化有关,仍需进一步研究。
4 结论
在本试验条件下,通过不同变温条件下鲟鱼消化酶、代谢酶和抗氧化酶活性分析,(22±2)℃变温模式显著提高瓣肠的蛋白酶活性,提高代谢酶活性和抗氧化能力,为鲟鱼养殖最适变温模式。
[1]黎军胜,李建林,吴婷婷.饲料成分与环境温度对奥尼罗非鱼消化酶活性的影响[J].中国水产科学,2004,11(6):585-588.
[2]Abucay J S,Mair G C,Skininski D O F,et al.Environment sex determination:the effect of temperature and salinity on sex ratio in Oreochromis nitoticus L[J].Aquaculture,1999,173(1):219-234.
[3]Azaza M S,Dhraief M N,Kraiem M M.Effects of water temperature on growth and sex ratio of juvenile Nile Tilapia Oreochromis niloticus(Linneaus)reared in geothermal waters in southern Tunisia[J].Journal of Thermal Biology,2008,33(2):98-105.
[4]Baras E,Jacobs B,Mélard C.Effect of water temperature on survival,growth and phenotypic sex of mixed(XX-XY)progenies of Nile tilapia Oreochromis niloticus[J].Aquaculture,2001,192(2/ 4):187-199.
[5]袁伦强,谢小军,曹振东,等.温度对瓦氏黄颡鱼仔鱼发育的影响[J].西南师范大学学报,2005,30(2):312-315.
[6]叶金聪.温、盐度对鲈鱼早期仔鱼生长及存活率的影响[J].福建水产,1997(1):14-18.
[7]Jensen A J.Growth of young migratory brown trout Salmo trutta correlated with water temperature in Norwegian rivers[J].J Anim Ecol,1990,59(2):603-614.
[8]Baras E,Pringnon C,Gohoungo G,et al.Phenotypic sex differentiation of blue tilapia under constant and fluctuating thermal regimes and its adaptive and evolutionary implication[J].J Fish Biology,2000,57(1):210-223.
[9]Sierra E,Diaz F,Espina S.Energy budget of Ictalurus punctatus exposed to constant and fluctuating temperatures[J].Riv Ita Acquacolt,1999,34(3):71-81.
[10]王勇军.周期性温度变化对幼蟹生长发育的影响[J].水产养殖, 1999(4):19-20.
[11]Pilditch C A,Grant J.Effect of temperature fluctuations and food supply on the growth and metabolism of juvenile sea scallop (Placopecten magellanicus)[J].Mar Biol,1999,134(4):235-248.
[12]Miao S,Tu S.Modeling effect of thermal amplitude on growing Chinese shrimp,Penaeus chinesis(Osbeck)[J].Ecol Model,1996, 88(1):93-100.
[13]田相利,董双林,吴立新,等.恒温和变温下中国对虾生长和能量收支的比较[J].生态学报,2005,25(11):2811-2817.
[14]董云伟,董双林,张美昭,等.变温对刺参幼参生长、呼吸代谢及生化组成的影响[J].水产学报,2005,29(5):659-665.
[15]孙大江,曲秋芝,马国军,等.史氏鲟人工繁殖及养殖技术[M].北京:海洋出版社,2000.
[16]李大鹏,庄平,严安生,等.施氏鲟幼鱼摄食和生长的最适水温[J].中国水产科学,2005,12(3):294-299.
[17]孙大江,曲秋芝,马国军,等.养殖施氏鲟的人工繁殖[J].中国水产科学,2003,10(6):485-490.
[18]Qu Q Z,Sun D J,Wang B Q,et al.The relationships between gonad development and sex steroid levels at different ages in Acipenser schrenckii[J].J Appl Ichthyol,2010,26(1):1-5.
[19]Zhang Y,Qu Q,Sun D,et al.Vitellogenin in Amur sturgeon (Acipenser schrenckii):induction,purification and changes during the reproductive cycle[J].J Appl Ichthyol,2011,27(2):660-665.
[20]赵吉伟,邱岭泉,杨雨辉,等.不同投饵率对施氏鲟幼鱼生长及体成分的影响[J].中国水产科学,2004,11(4):375-378.
[21]Wen H,Yan A S,Gao Q,et al.Dietary vitamin A requirement of juvenile Amur sturgeon(Acipenser schrenckii)[J].J Appl Ichthyol, 2008,24(5):534-538.
[22]Xu Q Y,Wang C A,Zhao Z G,et al.Effects of replacement of fish meal by soy protein isolate on the growth,digestive enzyme activity and serum biochemical parameters for juvenile amur sturgeon(Acipenser schrenckii)[J].Asian-Australasian Journal of Animal Sciences,2012,25(11):1588-1594.
[23]Meng Y,Xiao H B,Zeng L B.Isolation and identification of the hemorrhagic septicemia pathogen from Amur sturgeon Acipenser schrenckii[J].J Appl Ichthyol,2011,27(2):799-803.
[24]Ford R F,Felix J R,Johnson R L.Effects of fluctuating and constant temperatures and chemicals in thermal effluent on growth and survival of the American lobster(Ihomarus americanus)[C]. In:Proceedings of the Tenth Annual Meeting.World Mariculture Society,BatonRouge,LA(USA),1979:139-158.
[25]Konstantinov A S,Zdanovich V V,Tikhomirov D G.The effect of temperature fluctuations on metabolic rate and energetics of juvenile fish[J].J Ichthyol,1990,30:38-47.
[26]田宏杰,庄平,章龙珍,等.水温对施氏鲟幼鱼消化酶活力的影响[J].中国水产科学,2007,14(1):126-131.
[27]徐奇友,许治冲,王常安,等.不同温度下饲料脂肪水平对松浦镜鲤幼鱼肝脏游离脂肪酸、血清生化及肝脏组织结构的影响[J].东北农业大学学报,2012,43(9):118-126.
[28]黄金凤,徐奇友,王常安,等.温度和饲料蛋白质水平对松浦镜鲤幼鱼血清生化指标的影响[J].大连海洋大学学报,2013,28 (2):185-190.
Effect of different temperature fluctuation range on digestive,meta-bolic and antioxidase enzyme activities of juvenile sturgeon(Acipenser schrenckiiBrandt)/
LI Jinnan,ZHAO Zhigang,XU Qiyou,LUO Liang,WANG Chang'an,WANG Liansheng(Institute of Heilongjiang River Fisheries Research,Chinese Academy of Fishery Sciences,Harbin 150070,China)
The aim of this study to investigate the effects of different temperature fluctuation range on digestive enzymes,metabolic enzyme and antioxidase activities of juvenile sturgeon(Acipenser schrenckii Brandt).Five experiment groups were one constant temperature group(22±0)℃as control and four fluctuating groups(22±1)℃,(22±2)℃,(22±3)℃and(22±4)℃.The experiment was lasted for 42 d with 4 replicates per group and 15 fish per replicate.The results showed that the amylase activities of duodenum and valvula intestine and protease activities of duodenum in(22±3)℃group were significantly lower than that of the control group.These enzyme activities of the other groups were nosignificant difference with the control group.The lipase activities of duodenum in experimental groups were no significant difference with the control group,but the lipase activities of duodenum in the(22± 3)℃and(22±4)℃groups were significantly lower than(22±1)℃groups.The lipase activities of valvula intestine in experimental groups were significantly lower than that of the control group.The protease activities of valvula intestine in(22±3)℃and(22±4)℃groups were significantly higher than that of the control groups,and that of the other groups were no significant difference with the control group.The SOD and XOD activities had no significant difference among groups.The AST activity in (22±1)℃group was significantly higher than that of the control group.The AST activity in(22±4)℃group was significantly lower than that of the control group.The ALT activities in(22±1)℃,(22±2)℃and(22±4)℃groups were significantly higher than that of the control group.The T-AOC in(22±2)℃group was significantly higher than that of the control group and the other groups.It concluded that the (22±2)℃temperature mode could improve the protease activity of valvula intestine,and enhance the metabolic enzyme activity and the antioxidant capacity.
temperature fluctuation;Acipenser schrenckii;digestive enzyme;metabolic enzyme; antioxidase
S965.116
A
1005-9369(2016)11-0046-06
时间2016-12-1 12:02:35[URL]http://www.cnki.net/kcms/detail/23.1391.S.20161201.1202.008.html
李晋南,赵志刚,徐奇友,等.不同变温幅度对施氏鲟幼鱼消化酶、代谢酶及抗氧化酶活性影响[J].东北农业大学学报,2016,47 (11):46-51.
Li Jinnan,Zhao Zhigang,Xu Qiyou,et al.Effect of different temperature fluctuation range on digestive,metabolic and antioxidase enzyme activities of juvenile sturgeon(Acipenser schrenckiiBrandt)[J].Journal of Northeast Agricultural University, 2016,47(11):46-51.(in Chinese with English abstract)
2016-09-13
国家自然科学基金项目(31302204)
李晋南(1983-),女,助理研究员,博士,研究方向为水产动物营养与饲料。E-mail:lijinnan123@163.com
