龙葵E2泛素结合酶基因SorUBC克隆及表达特性分析
2016-12-27蔡佳文金晓霞于丽杰崔柏杨魏迅董延龙
蔡佳文,金晓霞*,于丽杰,崔柏杨,魏迅,董延龙
(1.哈尔滨师范大学生命科学与技术学院,植物生物学黑龙江省高校重点实验室,哈尔滨 150025;2.黑龙江省农业科学院园艺分院,哈尔滨 150069)
龙葵E2泛素结合酶基因SorUBC克隆及表达特性分析
蔡佳文1,金晓霞1*,于丽杰1,崔柏杨1,魏迅1,董延龙2
(1.哈尔滨师范大学生命科学与技术学院,植物生物学黑龙江省高校重点实验室,哈尔滨 150025;2.黑龙江省农业科学院园艺分院,哈尔滨 150069)
对龙葵SorUBC基因克隆并分析其在多种非生物胁迫处理下表达特性,为E2泛素结合酶在植物逆境胁迫中应用提供理论依据。试验采用电子克隆结合RT-PCR方法从龙葵中克隆得到泛素E2结合酶UBC基因编码区序列,命名为SorUBC,登陆GenBank,编号:KU233684。SorUBC基因编码区全长888 bp,编码295个氨基酸。进化树分析显示,该基因编码氨基酸序列与马铃薯、番茄同源性最高,为95%,其次是烟草,为91%。该蛋白在第266~284氨基酸位具有1个跨膜螺旋区域,泛素化位点预测表明其含有8个泛素化位点。利用荧光定量PCR技术分析SorUBC基因在龙葵各器官表达特征和不同非生物胁迫处理下(干旱、盐、碱、高温和低温)根部和叶片表达特性,同时测定龙葵叶片生理响应。结果表明,SorUBC基因表达具有组织差异性,在叶片和果实中表达量较高。非生物胁迫处理(干旱、盐、碱、高温和低温)后根部和叶片基因表达情况显示该基因存在早期(3或5h)应答上调表达,且根部与叶片基因表达量和变化趋势差异显著,根部表达量变化比叶片显著,推测SorUBC基因在龙葵早期响应干旱、盐、碱、高温和低温非生物胁迫中起调控作用。生理特征数据表明,在干旱、盐和高温胁迫中龙葵叶片MDA含量变化差异不显著,POD和SOD活性总体呈先降后升趋势,说明其在胁迫后期(9 h)对活性氧造成的损伤起缓解作用。
龙葵;SorUBC;克隆;表达分析;非生物胁迫;生理特性
龙葵(Solanum nigrum L.)为茄科一年生草本植物,在中国分布广泛,富含生物碱,全株入药,且抗性较强,是我国发现的Cd超积累植物[1-2],无论苗期或成熟期,均表现镉超积累植物具备的积累性和耐性特征[3],是一种具有重金属修复潜力的野生植物资源。龙葵干旱适应性强[4],生长期极少有虫害等[5]特性,是研究植物抗逆机制理想基因库。
植物对非生物胁迫环境作出及时有效响应对其生存至关重要。目前已确定多种调节干旱、盐等胁迫相关基因[6-10],其中,泛素/26S蛋白酶体途径是目前已知最重要,有高度选择性的蛋白质降解途径。其通过调节功能蛋白质周转或降解不正常蛋白,调节多种代谢过程。泛素是一种高度保守且有76个氨基酸组成的小分子蛋白,分子质量约8.5 ku,广泛存在于几乎所有真核生物体内[11]。泛素化是指泛素在一系列酶作用下对靶蛋白特异性修饰的过程,其中涉及E1泛素激活酶、E2泛素结合酶和E3泛素连接酶[12],底物特异性主要取决于E2泛素结合酶(UBC)和E3泛素连接酶[13]。研究表明,该途径广泛参与植物激素信号转导[14-16]、光形态建成[17-19]、自交不亲和反应[20-22]等生长发育过程,并与植物对抗各种外界环境胁迫反应相关[23-24]。
目前,对泛素E3连接酶研究较多,而对E2泛素结合酶研究相对较少,Wan等报道E2泛素结合酶(UBCs)在调节植物生长发育等多方面发挥重要作用,而在植物遭受非生物胁迫下响应情况还有待进一步研究[25]。王安邦等发现香蕉泛素结合酶MaUCE2基因表达受非生物胁迫诱导[26]。Chung等发现过表达绿豆泛素结合酶VrUBC1通过改变ABA相关基因表达增强转基因拟南芥渗透胁迫抗性[27]。小白菜BcUBCE2基因在铜胁迫响应中发挥重要作用[28]。大豆泛素E2结合酶基因GmUBC2在拟南芥中过表达,可明显提高拟南芥对干旱和高盐抗性[12];大豆GmUBC13基因在参与植物对干旱耐受作用时起正调控作用[29];甜瓜CmUBC基因响应干旱和盐胁迫[30]等,而泛素E2结合酶UBC基因在茄科植物龙葵中作用却未见报道。
本研究利用拟南芥泛素E2结合酶基因UBC32 mRNA全长序列信息,从番茄基因组数据库中钓取番茄泛素结合酶E2基因编码区序列信息,根据该序列信息设计特异引物,利用RT-PCR技术克隆得到龙葵E2泛素结合酶SorUBC基因,预测其蛋白质结构和功能。利用荧光定量PCR技术检测龙葵SorUBC基因组织器官表达特征,同时结合生理响应分析其在各种非生物胁迫处理(盐碱、干旱、高温、低温)下表达特性,旨在揭示龙葵E2泛素结合酶基因SorUBC时空表达及其参与非生物胁迫响应表达特征,为进一步开发和利用龙葵SorUBC基因提供理论依据。
1 材料与方法
1.1 试验材料及处理
本试验以野生型龙葵为试验材料,草炭土培育,取成株期叶片作SorUBC基因克隆。取5叶期植株经盐、碱、干旱、高温、低温处理,具体方法见表1,获取处理后不同时间段叶片和根部,立即液氮冷冻,存于-80℃,用于RNA提取。

表1 处理溶液浓度及温度Table 1Concentration and temperature of treatment solutions
1.2 SorUBC克隆及测序分析
根据拟南芥泛素结合酶E2基因UBC32(XM_ 002882991.1)mRNA全长序列,从番茄基因组数据库(https://solgenomics.net/)中钓取番茄泛素结合酶E2基因UBC(Solyc12g099310.1.1)基因信息,根据该基因信息设计特异引物,扩增龙葵SorUBC基因序列,特异引物序列如下:
SorUBC-F:5'ATGGCGGAAGACAAGTATAAT CT 3';
SorUBC-R:5'TACGATTCATCCATAAAGACA GC 3'。
试验使用TRlzon(康为世纪)提取龙葵成株总RNA,反转录试剂盒(TOYOBO)合成第一条cDNA,以该条链为模版,SorUBC-F/SorUBC-R为上下游引物作PCR扩增。将扩增产物凝胶电泳并回收产物与pUC-T载体(康为世纪)相连接,连接产物转化大肠杆菌感受态细胞DH5α,经蓝白斑筛选,选取白斑克隆,再次对菌液PCR和双酶切初步鉴定,测序分析。
1.3 SorUBC基因生物信息学分析
根据SorUBC氨基酸序列,利用NCBI-blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)在线分析软件比对其与其他植物序列,为进一步研究SorUBC蛋白氨基酸序列相似性及进化关系,利用软件DNAMAN对序列多重比对,再用软件MEGA 4构建系统进化树;利用TMPRED分析蛋白质跨膜区;利用UbiPred预测基因编码氨基酸存在的泛素化位点;利用SOPMA预测氨基酸二级结构[31-32]。
1.4 SorUBC基因在不同组织器官中的表达分析
根据龙葵SorUBC的cDNA序列设计UBC片段上下游引物C-Y2(见表2)。取成株期植株不同部位:根、茎、叶、花、果实,用于基因组织器官表达分析。提取各组织器官RNA,反转录成cDNA,以龙葵β-actin基因为内参基因,使用上下游引物C-Y2各0.5 μL,cDNA 1 μL,40个循环荧光定量PCR。

表2 引物名称及序列Table 2Names and sequences of the primers
1.5 SorUBC基因在不同非生物胁迫处理下的表达分析
对5叶期龙葵作干旱、盐、碱、高温及低温处理,分别在处理后0、1、3、5、9、12 h取植株根部和叶片,提取RNA,反转录成cDNA,使用上下游引物C-Y2荧光定量PCR表达分析。
1.6 干旱、盐、高温胁迫下龙葵生理指标测定
对成株期龙葵经干旱、盐及高温处理(浓度同1.5),分别在0、1、3、5、9 h取植株叶片,测定部分生理活性物质(MDA、POD、SOD)含量。丙二醛(MDA)含量采用硫代巴比妥酸法测定[33];过氧化物酶(POD)活性采用愈创木酚显色法测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑光还原法测定[34]。以上试验每组重复3次。
2 结果与分析
2.1 龙葵SorUBC基因编码区全长克隆及测序分析
提取龙葵叶片RNA(见图1),反转录后以cDNA为模板,利用SorUBC-F/R为引物PCR扩增,使用0.8%琼脂糖凝胶电泳检测预期大小条带(见图2)。将PCR产物回收,连接pUC-T载体并转化大肠杆菌感受态细胞DH5α,经蓝白斑筛选后,挑取白斑培养,菌液PCR,双酶切鉴定(见图3),表明目的基因已连接到克隆载体上,将获得阳性克隆送往上海生工测序,获得编码区序列,全长888 bp,登陆GenBank,编号为:KU233684。
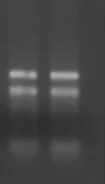
图1 龙葵RNA提取Fig.1Extraction of Solanum nigrum L.RNA
2.2 龙葵SorUBC氨基酸同源性分析及系统进化树构建
将克隆得到的cDNA序列作生物信息学分析,通过NCBI的ORF Finder程序分析,结果显示开放读码区为888 bp,编码295个氨基酸(见图4),蛋白分子质量为25 ku,理论等电点pI=5.23。

图2 SorUBC基因全长cDNA序列电泳结果Fig.2Agarose gel electrophoresis of the cDNA sequence of SorUBC gene

图3 pUCT-SorUBC双酶切鉴定Fig.3Identification of pUCT-SorUBC double digested
根据已克隆龙葵SorUBC基因氨基酸序列在NCBI上与其他植物同源氨基酸序列比对分析,结果表明(见图5),龙葵SorUBC氨基酸序列与马铃薯、番茄一致性为95%,与烟草一致性为91%,与葡萄、芝麻、麻风树、梅、红景天等植物为80%以上,说明SorUBC基因在这些植物中高度保守。
将上述氨基酸序列比对,构建植物生成进化树,分析龙葵SorUBC蛋白与其他物种相关蛋白进化关系,结果表明(见图6),龙葵SorUBC与马铃薯、番茄同属1个分支;麻风树和梅UBC属同1个分支;葡萄、芝麻、红景天UBC属同1个分支,其中芝麻和红景天进化关系较近。
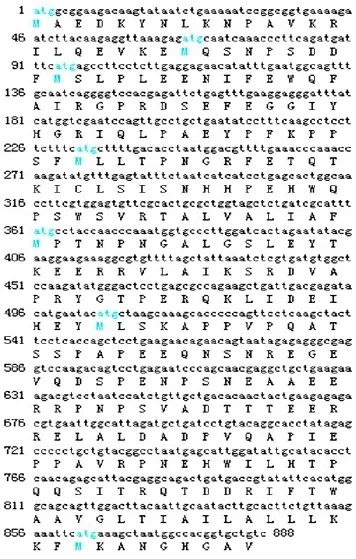
图4 SorUBC编码区核苷酸序列及氨基酸序列Fig.4Nucleotide and amino acid sequences of SorUBC coding regions
2.3 龙葵SorUBC蛋白结构分析结果
2.3.1 SorUBC蛋白跨膜螺旋结构预测
利用TMPRED预测SorUBC蛋白跨膜螺旋(见图7、8),结果表明该蛋白具有1个跨膜螺旋区域,其相应氨基酸位置是第266~284位。
2.3.2 SorUBC蛋白泛素化位点预测
利用UbiPred在线预测分析SorUBC中泛素化位点,发现SorUBC有8个泛素化位点,位置分别为第5、9、14、21、73、91、160、172位氨基酸。说明SorUBC蛋白可能通过相应位点泛素化发挥作用(见表3)。
2.3.3 SorUBC蛋白二级结构预测
利用SOPMA预测SorUBC蛋白二级结构,结果见图9。结果表明SorUBC蛋白二级结构中,h占25.91%,e占18.60%,t占5.32%,c占50.17%。由此推测,SorUBC蛋白含有大量α-螺旋和无规则卷曲。
2.4 龙葵SorUBC基因组织特异性表达分析
利用实时荧光定量PCR技术检测SorUBC基因在龙葵不同组织器官表达量,结果发现该基因在龙葵根、茎、叶、花和果实中均有表达,且差异较大,SorUBC基因在叶片与果实中表达量最高,茎中表达量为5倍,花中表达量为3倍,根中表达最弱,是叶片和果实中的1/10。说明SorUBC基因在龙葵中的表达具有组织特异性(见图10)。
2.5 不同非生物胁迫处理下,龙葵SorUBC基因表达分析
采用实时荧光定量PCR技术,对成株期龙葵经盐、碱、干旱、高温及低温处理,检测不同非生物胁迫处理下SorUBC基因在龙葵根部和叶片表达特性。结果表明,不同胁迫处理下SorUBC基因表达受不同程度影响(见图11)。低温处理下,从1 h起,SorUBC基因叶片表达量逐渐下降,仅12 h有一次上升,但总体含量低于对照组;而根中表达量呈先增后降趋势,5 h时达最大值,是对照组的6.7倍(见图11A)。高温处理下,叶基因表达量明显低于对照组;而根中表达量在处理5 h后已显著上调表达,处理12 h时SorUBC表达量达最大,为对照组的30倍(见图11B)。

图5 龙葵SorUBC与其他物种UBC氨基酸序列保守区域多重比对Fig.5Alignment of conserved domains of SorUBC between Solanum nigrum L.and other plants
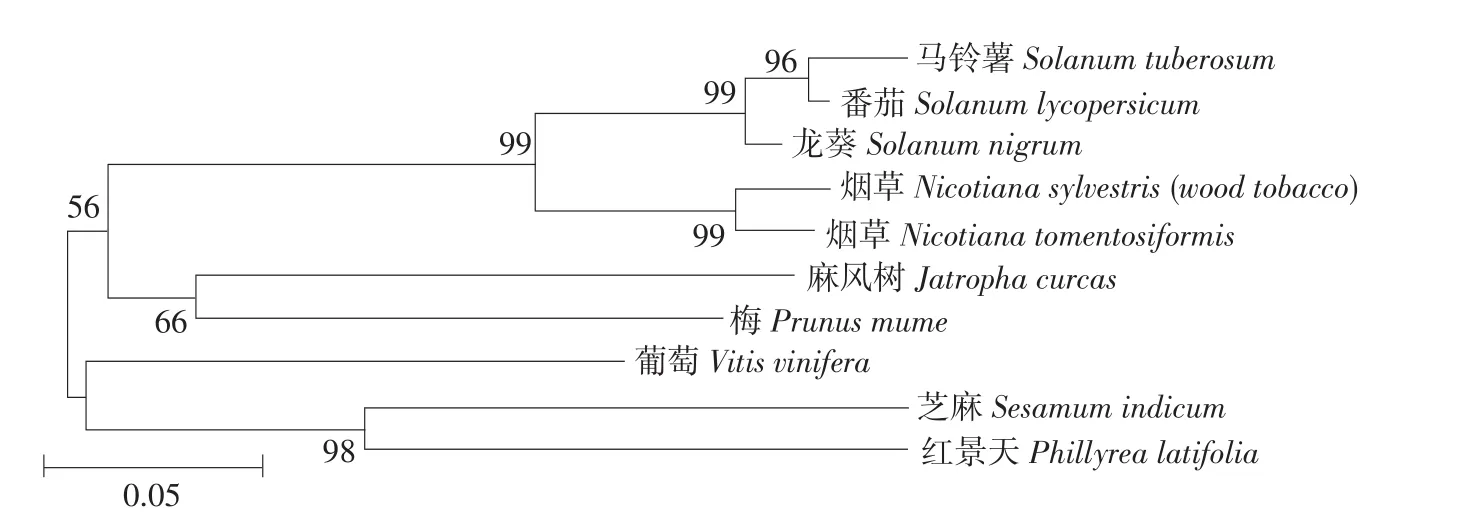
图6 UBC氨基酸序列系统进化树Fig.6Phylogenetic tree of UBC amino acid sequences

图7 SorUBC蛋白跨膜区域预测Fig.7Predicted transmembrane domains of SorUBC protein
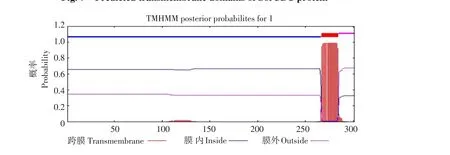
图8 TMHMM预测SorUBC蛋白跨膜结构Fig.8SorUBC transmembrane regional prediction by TMHMM

表3 SorUBC泛素化位点预测Table 3Ubiquitinated site analysis on SorUBC
干旱胁迫下,SorUBC基因处理组叶片表达量一直低于对照组;而根部表达量在处理3 h时达到最大,为对照的9倍,随后显著下调后又上升,在12 h上调为3 h表达量的1/17(见图11C)。盐胁迫下,1 h时叶片中SorUBC表达量下降,处理3 h达到最低后又显著上调,9 h叶表达量达到最大,是对照2倍;在根部该基因分别在3和9 h时达最大值,为对照的1.8倍和2倍,而在12 h表达量最低(见图11D)。碱处理下,叶片中SorUBC表达量除9 h与对照基本持平外,表达量均下调;在根部,该基因表达量除在3 h有一次下调外,总体呈先升后降趋势,9 h达到最大值,为对照组的2.5倍(见图11E)。以上结果表明SorUBC基因在以上非生物胁迫处理下均存在不同早期应答反应,分别在3或5 h表达上调,且根部与叶片基因表达量和变化趋势差异显著,根部SorUBC基因表达变化比叶中更明显,从基因表达量变化看SorUBC基因参与龙葵在非生物胁迫中的应答反应过程。

图9 SorUBC蛋白二级结构预测Fig.9Secondary structure prediction of SorUBC protein

图10 龙葵SorUBC基因在不同器官中的表达Fig.10Expression of SorUBC in different organs of Solanum nigrum L.

图11 非生物胁迫下龙葵SorUBC基因在根部和叶片的表达Fig.11Expression of SorUBC gene in roots and leaves of Solanum nigrum under abiotic stress
2.6 不同非生物胁迫对龙葵叶片生理特性影响
图12A显示干旱、高温和盐胁迫后龙葵MDA变化情况。干旱胁迫中,MDA含量总体呈先降后升再降趋势,5 h时达到最大值,受损伤程度加剧。高温胁迫中,MDA含量在1 h时含量较高,之后略有下降,且变化不显著。盐胁迫处理中,MDA含量呈先升后降趋势,处理1 h时,MDA含量略微增加,膜脂过氧化程度增加。

图12 非生物胁迫下龙葵叶片生理指标测定结果Fig.12Determination results of physiological index of leaves of Solanum nigrum under abiotic stress
过氧化物酶POD和超氧化物歧化酶SOD在植物中广泛存在,是防御系统保护酶。图12B显示,干旱胁迫中,POD活性呈下降趋势,5 h时叶中表达量最低,为对照组的1/5,之后活性增强,9 h时为5 h时的5倍,说明胁迫初期植株适应性较差,后期POD活性增强,缓解干旱对植株活性氧的伤害。高温胁迫中,POD活性呈先降后升趋势,9 h达到最大值,为对照的1.3倍。POD活性在盐胁迫处理中变化不明显。从图12C可知,龙葵叶片SOD活性总体呈先降后升趋势。干旱、高温胁迫中,SOD活性较对照组显著下降,干旱胁迫5 h时与对照组相比下降5倍,之后活性略有上升,且均未高于对照组。盐胁迫中,3 h时达最小值,为对照的1/2,之后SOD活性显著上升,9 h时达到最大值,为对照组的1.32倍。三种处理中,SOD活性均显著低于对照。以上说明非生物胁迫初期,龙葵过氧化物酶POD和超氧化物歧化酶SOD活性不高,植株适应调节能力较差,对植株造成一定伤害;胁迫后期(9 h),两种酶活性增加,对活性氧造成的损伤起缓解作用。
3 讨论
研究发现植物体内多种泛素结合酶基因在各器官中均有表达,例如E2泛素结合酶TaE2基因在小麦根、茎、叶和种子中均有表达[35];SUMO E3连接酶SIZ1和E3泛素连接酶AtSAP5,在拟南芥根、茎、叶、花中均有表达[36-37]。Suzuki等研究也表明,E2泛素结合酶基因在调节植物光形态建成[38]、胚胎及器官形成[39]、维管束发育[40]等方面起一定作用。本研究在克隆获得龙葵E2泛素结合酶SorUBC基因编码区全长基础上,通过荧光定量PCR技术测定龙葵不同组织器官SorUBC基因表达量,结果表明各组织中均有表达且差异显著,SorUBC编码的蛋白在龙葵各组织中普遍存在,且在叶片和果实中表达量显著高于其他器官。
植物在生长发育过程中,受各种自然条件因素影响,当这些因素超过一定范围时即对植物构成胁迫,以往研究表明泛素蛋白酶体途径在植物受到非生物胁迫时发挥重要作用[41-43]。而E2泛素结合酶在泛素化过程中扮演重要角色,提高植物应对不良环境能力。如大豆GmUBC2基因在拟南芥中过表达,明显提高拟南芥对干旱和高盐抗性[12];甜瓜CmUBC基因响应干旱和盐胁迫[29]。本研究中,叶片在低温、高温和干旱处理后SorUBC基因处于下调状态,在盐、碱处理后呈下调后上调又下降趋势。而根部在这些胁迫中SorUBC表达量大致呈两次上升过程(除低温、碱胁迫为一次上升过程)。徐东北等研究表明,GmUBC13基因在参与植物对干旱耐受作用时起正调控作用[30];而本研究中,干旱处理下(见图11C),根部SorUBC基因表达量在胁迫初期(3 h)呈一次明显上升,表达量总体上与对照组相比呈上升趋势。盐碱胁迫下(见图11D、E),基因表达量与低温、高温和干旱相比较低,盐胁迫下根部SorUBC基因表达量在3、9 h与对照组相比处于上调状态,碱胁迫在5、9、12 h处于基因上调表达状态,说明SorUBC基因不同程度响应干旱、盐碱与高、低温胁迫处理。Wan等研究表明,花生在受到由干旱、高盐、低温、施用外源ABA等引起的生理水胁迫时AhUBC2表达量增加[25];而本研究中,低温下(见图11A)龙葵根部SorUBC基因表达量在5 h胁迫处理下呈最高值;高温下(见图11B),SorUBC基因随处理时间变化表达量有所变化,且与对照组比较明显呈上调趋势。推测SorUBC基因可能在以上非生物胁迫中发挥作用,该基因是否具有以上功能需深入研究。
本试验还选取高温、干旱和盐三种非生物胁迫处理龙葵检测其生理响应。MDA是膜脂过氧化最终分解产物,其细胞内浓度表示脂质过氧化强度和膜系统伤害程度,是逆境生理中重要指标[44]。POD和SOD是植物防御胁迫过程中重要保护酶。三种胁迫处理中,MDA含量变化差异不显著,植物在高温、干旱和盐胁迫处理中未受明显伤害。POD和SOD活性总体呈先降后升趋势,说明其参与龙葵自身修复过程,胁迫后期(9 h)对活性氧造成损伤起缓解作用。
4 结论
本研究从龙葵中克隆到一个泛素结合酶E2基因SorUBC,SorUBC基因在马铃薯、番茄、烟草等植物中保守性较高。生物信息学预测表明该蛋白具有1个跨膜螺旋区域,其相应氨基酸位置是第266~284位,且该蛋白存在8个泛素化位点,可能通过相应位点泛素化来发挥泛素结合酶E2功能。
泛素结合酶E2基因SorUBC在龙葵各组织中均有表达,在叶片和果实中表达量显著高于其他组织。盐、碱、高温、低温及干旱非生物胁迫处理下,龙葵SorUBC基因表达量均存在早期应答上调表达趋势,分别在3或5 h上调表达,且SorUBC基因在根部与叶片表达量和变化趋势差异显著,根部表达量明显高于叶片表达量。三种胁迫处理(高温、干旱和盐)中,MDA含量变化差异不显著;POD和SOD活性总体呈先降后升趋势。
[1]Wei S H,Zhou Q X,Wang X.Characteristics of 18 species of weed hyperaccumulating heavy metal in contaminated soils[J]. Journal of Basic Science and Engineering,2003,11(2):152-159.
[2]Wei S H,Zhou Q X,Wang X.Cadmium-hyperaccumulator Solanum nigrum L.and its accumulating characteristics[J].Environmental Science,2005,26(3):167-171.
[3]孙瑞莲,周启星,王新.镉超积累植物龙葵叶片中镉的积累与有机酸含量的关系[J].环境科学,2006,27(4):765-769.
[4]裘梅.干旱胁迫对龙葵解剖结构和生理特性的影响[D].南京:南京农业大学,2010.
[5]肖湘黔,曾东强,李德伟.龙葵上三种主要害虫及防治[J].广西热带农业,2005(6):37-38.
[6]Bray E A.Plant responses to water deficit[J].Trends in Plant Science,1997(2):48-54.
[7]Zhang Y Y,Yang C W,Li Y,et al.SDIR1is a RING finger E3 ligase that positively regulates stress-responsive abscisic acid signaling in Arabidopsis[J].The Plant Cell,2007,19(6):1912-1929.
[8]Li H G,Jiang H L,Bu Q Y,et al.The Arabidopsis RING finger E3 ligase RHA2b acts additively with RHA2a in regulating abscisic acid signaling and drought response[J].Plant Physiology Preview, 2011,156(2):550-563.
[9]Cheng M C,Hsieh E J,Chen J H,et al.Arabidopsis RGLG2, functioning as a RING E3 ligase,interacts with AtERF53 and negatively tegulates the plant drought stress response[J].Plant Physiology Preview,2012,158(1):363-375.
[10]Zhu J K.Salt and drought stress signal transduction in plants[J].Annual Review of Plant Biology,2002,53:247-273.
[11]Hershko A,Ciechanover A.The ubiquitin system[J].Annual Review of Biochemistiy,1998,67:425-479.
[12]Zhou G A,Chang R Z,Qiu L J.Overexpression of soybean ubiquitinconjugating enzyme gene GmUBC2 confers enhanced drought and salt tolerance through modulating abiotic stress-responsive gene expression in Arabidopsis[J].Plant Molecular Biology,2010,72: 357-367.
[13]Cui F,Liu L J,Zhao Q Z,et al.Arabidopsis ubiquitin conjugase UBC32 is an ERAD component that functions in brassinosteroidmediated salt stress tolerance[J].The Plant Cell,2012,24:233-244.
[14]Dharmasiri N,Dharmasiri S,Estelle M.The F-box protein TIR1 is an auxin receptor[J].Nature,2005,435(7041):441-445.
[15]Ariizumi T,Lawrence P K,Steber C M.The role of two F-box proteins,SLEEPY1 and SNEEZY,in Arabidopsis gibberellin signaling[J].Plant Physiology,2011,155(2):765-775.
[16]Chini A,Fonseca S,Fernandez G,et al.The JAZ family of repressors is the missing link in jasmonate signaling[J].Nature, 2007,448(7154):666-671.
[17]Marrocco K,Zhou Y C,Bury E,et al.Functional analysis of EID1, an F-box protein involved In phytochrome A2 dependent light signal transduction[J].The Plant Journal,2006,45(3):423-438.
[18]Holm M,Ma L G,Qu L J,et al.Two Interacting bZIP proteins are direct targets of COP1-Mediated control of light-dependent gene expression in Arabidopsis[J].Genes&Development,2002,16 (10):1247-1259.
[19]OsterlundMT,HardtkeCS,WeiN,etal.Targeted destabilization of HY5 during light-regulated development of Arabidopsis[J].Nature,2000,405(6785):462-466.
[20]Wang Y,Wang X,Skirpan A L,et al.S-RNase-mediated self-Incompatibility[J].Journal of Experimental Botany,2003,54(380): 115-122.
[21]Lai Z,Ma W,Han B,et al.An F-box gene linked to the selfincompatibility(S)locus of antirrhinum is expressed Specifically in pollen and tapetum[J].Plant Molecular Biology,2002,50 (1):29-42.
[22]于晓敏,蓝兴国,李玉花.泛素/26S蛋白酶体途径与显花植物自交不亲和反应[J].植物学通报,2006,23(2):197-206.
[23]刘方方,姜颖,曹言勇,等.玉米中RING型E3泛素连接酶基因ZmGW2的表达分析[J].玉米科学,2013,21(2):47-51.
[24]Lee H K,Cho S K,Son O,et al.Drought stress-induced Rma1H1, a RING membrane-anchor E3 ubiquitin ligase homolog,regulates aquaporin levels via ubiquitination transgenic Arabidopsis plants [J].Plant Cell,2009,21(2):622-641.
[25]Wan X R,Mo A Q,Liu S,et al.Constitutive expression of a peanut ubiquitin-conjugating enzyme gene in Arabidopsis confers improved water-stress tolerance through regulation of stressresponsive gene expression[J].Journal of Bioscience and Bioengineering,2011,111:478-484.
[26]王安邦,金志强,刘菊华,等.香蕉泛素结合酶基因MaUCE2在非生物胁迫下的表达分析[J].生物技术通报,2013(5):77-80.
[27]Chung E,Cho C W,So H A,et al.Overexpression of VrUBC1,a Mung Bean E2 ubiquitin conjugating enzyme,enhances osmotic stress tolerance in Arabidopsis[J].PLOS ONE,2013(8):1-15.
[28]赵瑞丽,钟凤林,林义章,等.小白菜BcUBCE2基因的克隆及表达分析[J].西北植物学报,2014,34(1):60-65.
[29]Baloglu M C,Patir M G.Molecular characterization,3D model analysis,and expression pattern of the CmUBC gene encoding the melon ubiquitin-conjugating enzyme under drought and salt stress conditions[J].Biochemical Genetics,2014,52:90-105.
[30]徐东北,于月华,韩巧玲,等.大豆(Glycine max)GmDREB5互作蛋白GmUBC13的特性及功能[J].中国农业科学,2014,47(18): 3534-3544.
[31]赖先军,古英洪,王海燕,等.甘薯Sporamin家族基因克隆与表达分析[J].应用与环境生物学报,2013(4):215-223.
[32]戴凌燕,唐呈瑞,殷奎德,等.甜高粱SUTI基因克隆、表达及生物信息学分析[J].核农学报,2015,29(12):2276-2286.
[33]Dhindsa R S,Dhindsa P P,Thorpe T A.Leaf senescence: Correlated with increased leaves of membrane permeability and lipid peroxidation,and decreased levels of superoxide dismutase and catalase[J].J Exp Bot,1981,32:93-101.
[34]孙群.植物生理学研究技术[M].杨凌:西北农林科技大学出版社,2007.
[35]尹丽娟,陈阳,刘沛,等.小麦泛素结合酶TaE2的表达分析及蛋白互作[J].植物遗传资源学报,2014,15(1):144-149.
[36]Catala R,Jian O,Abreu I A,et al.The Arabidopsis E3 SUMO ligase SIZ1 regulates plant growth and drought responses[J].The Plant Cell,2007,19(9):2952-2966.
[37]Kang M,Fokar M,Haggag A,et al.Arabidopsis SAP5 functions as a positive regulator of stress responses and exhibits E3 ubiquitin ligase activity[J].Plant Molecular Biology,2011,75:451-466.
[38]Suzuki G,Yanagawa Y,Kwok S F,et al.Arabidopsis COP10 is aubiquitin-conjugating enzyme variant that acts together with COP1 and the COP9 signalosome in repressing photomorphogenesis[J]. Genes&Development,2002,16(5):554-559.
[39]Hanjo H,Mark E.Plant development:regulation by protein degradation[J].Science,2002,297(5582):793-797.
[40]Criqui M C,Engler J D A,Camassees A,et al.Molecular characterization of plant ubiquitin-conjugating enzymes belonging to the UbcP4/E2-C/UBCx/UbcH10 gene family[J].Plant Physiology, 2002,130:1230-1240.
[41]Lee H,Xiong L,Gong Z,et al.The Arabidopsis HOS1 gene negatively regulates cold signal transduction and encodes a RING
[14]黄绍敏,宝德俊,黄甫湘荣,等.长期施用有机和无机肥对潮土氮素平衡与去向的影响[J].植物营养与肥料学报,2006,12(4): 479-484.
[15]李宗新,董树亭,胡昌浩,等.有机无机肥互作对玉米产量及耕层土壤特性的影响[J].玉米科学,2004,12(3):100-102.
[16]朱平,彭畅,高洪军,等.长期培肥对土壤肥力及玉米产量的影响[J].玉米科学,2009,17(6):105-108.
[17]Brookes P C,Landman A,Pruden G,et al.Chloroform fumigation and the release of soil N:A rapid direct extraction method to measure microbial biomass nitrogen in soil[J].Soil Biology and Biochemistry,1985,17:837-842.
[18]Inubushi K,Brookes P C,Jenkinson D C.Soil microbial biomass C,N and ninhydrin-N in aerobic and anaerobic soils measured by the fumigation-extraction method[J].Soil Biology and Biochemistry,1991,23:737-741.
[19]吴金水,林启美,黄巧云,等.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006.
[20]中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985.
[21]许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[22]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1998.
[23]刘艳丽.长期施肥下水稻土土壤性质变化及其与生产力的关finger protein that displays cold-regulated nucleo-cytoplasmic partitioning[J].Genes Development,2001,15:912-924.
[42]Yan J,Wang J,Li Q,et al.AtCHIP,a U-box-containing E3 ubiquitin ligase,plays a critical role in temperature stress tolerance in Arabidopsis[J].Plant Physiolgy,2003,132:861-869.
[43]Seo Y S,Choi J Y,Kim S J,et al.Constitutive expression of CaRma1H1,a hot pepper ER-localized RING E3 ubiquitin ligase, increases tolerance to drought and salt stresses in transgenic tomato plants[J].Plant Cell Reports,2012,31:1659-1665.
[44]成广雷,张海娇,赵久然,等.临界胁迫贮藏条件下不同基因型玉米种子活力及生理变化[J].中国农业科学,2015,48(1):32-42.
Clone and expression pattern analysis of E2 ubiquitin-binding enzymegeneSorUBCinSolanum nigrumL./
CAI Jiawen1,JIN Xiaoxia1,YU Lijie1,CUI Baiyang1,WEI Xun1,DONG Yanlong2(1.School of Life Science and Technology,Harbin Normal University,Key Laboratory of Plant Biology,College of Heilongjiang Province,Harbin 150025, China;2.Horticulture Branch,Heilongjiang Academy of Agricultural Sciences,Harbin 150069, China)
In this researchSorUBCgene fromSolanum nigrumL.was cloned and the expression pattern under different abiotic stresses were detected.This would help us to predict the characteristics of E2 ubiquitin binding enzyme and provide theoretical basis for the application of E2 ubiquitin binding enzyme in plant stress.The research cloned E2 ubiquitin binding enzymeUBCgene full-length coding region sequence by electronic cloning and RT-PCR method fromSolanum nigrumL.,namedSorUBC,GenBank accession number:KU233684.The coding region sequence was 888 bp,encoded 295 amino acids.Phylogenetic tree analysis showed thatSorUBCamino acid sequence was homologous highest with potato and tomato,was 95%,followed by tobacco which was 91%.The protein was predicted to have one transmembrane helical regions in the 266-284 amino acid site,and the ubiquitin-based site prediction showed that it contained eight ubiquitin-based sites.The expression characteristics of SorUBCin various organs and in roots and leaves with abiotic stress treatments(drought,salt,alkali, high temperature and low temperature)ofSolanum nigrumL.were detected using quantitative PCR analysis,meanwhile physiological response of leaves inSolanum nigrumL.were determined.The results showed that the expression ofSorUBCgene were different in tissues,higher in leaves and fruits.Detection of gene expression in roots and leaves after abiotic stress treatments(drought,salt, alkali,high temperature and low temperature)showed that there was an early(3 or 5 h)response up regulation expression ofSorUBCgene,the expression levels and the trends of the gene in roots and leaves had significant difference,the expression in roots were more obvious than in leaves,suggesting thatSorUBCgene might play a regulatory role in early stage response to different abiotic stress such as drought,salt,alkali,high temperature and low temperature stress inSolanum nigrumL. Physiological characteristic data showed that no significant change of the MDA content in leaves of Solanum nigrumin drought,salt and high temperature stress,the activity of POD and SOD increased first and decreased afterward,indicated that they played a certain role in alleviating the damage caused by reactive oxygen species in the later stage of stress(9 h).
Solanum nigrumL.;SorUBC;clone;expression analysis;abiotic stress;physiological characteristics
Q785
A
1005-9369(2016)11-0026-11
时间2016-12-1 11:35:17[URL]http://www.cnki.net/kcms/detail/23.1391.S.20161201.1135.006.html
蔡佳文,金晓霞,于丽杰,等.龙葵E2泛素结合酶基因SorUBC克隆及表达特性分析[J].东北农业大学学报,2016,47(11):26-36.
Cai Jiawen,Jin Xiaoxia,Yu Lijie,et al.Clone and expression pattern analysis of E2 ubiquitin-binding enzyme geneSorUBC inSolanum nigrumL.[J].Journal of Northeast Agricultural University,2016,47(11):26-36.(in Chinese with English abstract)
2016-09-29
黑龙江省教育厅面上项目(12531204,12531178);“植物生物学”黑龙江省高校重点实验室开放课题(ZK201205);哈尔滨师范大学青年学术骨干资助计划项目(KGB201218)
蔡佳文(1991-),女,硕士研究生,研究方向为植物分子生物学。E-mail:caimylove1991@126.com
*通讯作者:金晓霞,副教授,硕士生导师,研究方向为植物分子生物学。E-mail:xiaoxia6195@163.com
