RP-HPLC测定油用牡丹籽饼粕和籽壳中单萜苷的含量
2016-12-26李小方刘一琼董俊青邓瑞雪
刘 普 李小方 张 恒 刘一琼 董俊青 邓瑞雪
(河南省伏牛山野生药材基源工程技术研究中心 河南科技大学化工与制药学院,洛阳 471023)
RP-HPLC测定油用牡丹籽饼粕和籽壳中单萜苷的含量
刘 普 李小方 张 恒 刘一琼 董俊青 邓瑞雪
(河南省伏牛山野生药材基源工程技术研究中心 河南科技大学化工与制药学院,洛阳 471023)
建立RP-HPLC同时测定油用牡丹籽饼粕和籽壳中6种单萜苷类化合物含量的方法。采用乙腈(A)和磷酸二氢钾缓冲盐(B)(pH=3)为流动相梯度洗脱,梯度为0 min(A, 15%)→10 min(A, 15%)→22 min(A, 25%);检测波长:4″-羟基白芍苷和氧化芍药苷为260 nm,白芍苷、芍药苷、6-O-β-D-吡喃葡萄糖-8-O-苯甲酰基-9α-甲氧基-牡丹酮和白芍苷R1为232 nm,柱温30 ℃。结果表明,单萜苷类物质在油用牡丹籽饼粕中的含量远远大于在其籽壳中的含量,牡丹籽饼粕可以作为单萜苷类物质的一个重要来源。该方法准确,实用性好,可用于牡丹籽饼粕中单萜苷类成分的定性与定量分析。
油用牡丹 高效液相色谱法 单萜苷 含量测定
牡丹为芍药科落叶灌木,是原产中国著名的观赏花卉。牡丹籽可以用于榨油,牡丹籽油中含有丰富的不饱和脂肪酸,具有较好营养价值和保健功效[1-4]。在压榨法制备牡丹籽油的过程中会产生大量的牡丹籽壳和牡丹籽饼粕等副产物,充分开发利用这些副产物对于提高油用牡丹的研究开发价值具有重要作用。
研究发现,牡丹籽中含有大量的单萜苷类化学成分[5-8]。单萜苷类成分为芍药属中一个特征性成分,具有广泛的生物活性[9-10]。本课题组深入分析发现单萜苷类物质在油用牡丹籽壳和籽饼粕的含量有较大的差异。确定油用牡丹籽壳和籽饼粕中单萜苷类物质含量差异对于它们的深入开发利用具有重要意义。关于单萜苷类成分在油用牡丹籽壳和籽饼粕中的含量测定鲜见文献报道。
本试验采用波长切换法研究能同时分离4″-羟基白芍苷、氧化芍药苷、白芍苷、芍药苷、6-O-β-D-吡喃葡萄糖-8-O-苯甲酰基-9α-甲氧基-牡丹酮(paeonidanin,PD)和白芍苷R1等6种单萜苷类成分的分析色谱条件,对油用牡丹籽壳和籽饼粕中6种单萜苷类物质的含量进行了分析,为牡丹籽榨油副产物的进一步开发利用提供参考。
1 材料与方法
1.1 仪器、试剂及药材
Agilent1100高效液相色谱仪:四元泵和二极管阵列检测器(G1313A);在线脱气,柱温箱,自动进样器,Agilent1100色谱工作站;FA2004型电子分析天平: 上海越平科学仪器有限公司。
4″-羟基白芍苷、氧化芍药苷、白芍苷、芍药苷、PD、白芍苷R1等对照品:自制,经NMR和 ESI-MS鉴定了化合物的结构,经HPLC测定纯度大于98%。紫斑牡丹(P.rockii)籽和凤丹牡丹(PaeoniaostiiT.Hong et J.X.Zhang)籽:河南省孟津县土桥村花木公司基地。
乙腈为色谱纯,水为高纯水,磷酸二氢钾为色谱纯,其余试剂均为分析纯。
1.2 试验方法
1.2.1 色谱条件
Agilent1100高效液相色谱仪;色谱柱:Zorbax SB-Aq C18色谱柱(4.6 mm×250 mm,5 μm);流动相:乙腈-磷酸(0.05),或乙腈-磷酸二氢钾缓冲盐(pH=3.0);体积流量为1.0 mL/min;柱温:30 ℃;进样量:10 μL。
1.2.2 对照品溶液的制备
精密称取对照品4″-羟基白芍苷10.3 mg,氧化芍药苷10.4 mg,白芍苷10.8 mg,芍药苷18.6 mg,PD14.9 mg,白芍苷R1 8.1 mg,用甲醇定容于50 mL容量瓶中,配成206、208、216、372、298、161 μg/mL的混合溶液,即为对照品储备溶液。
1.2.3 供试品溶液的制备
取采自洛阳市孟津县土桥村花木公司牡丹种植基地的紫斑牡丹和凤丹牡丹种子,脱壳机脱壳,收集牡丹籽仁和牡丹籽壳,牡丹籽仁经压榨法榨油后得牡丹籽饼粕,将油用牡丹籽壳和牡丹籽饼粕置于100 ℃的烘箱中烘3 h。将经过烘干的油用牡丹籽壳和牡丹籽饼粕粉碎,过60目筛,分别精密称取10.00 g样品,用滤纸包好,加入100 mL甲醇为提取溶剂,采用索氏提取器回流提取4 h。回收提取液,冷却后,滤液用0.45 μm的微孔滤膜过滤,定容于100 mL容量瓶中,即为供试品溶液。
2 结果与讨论
2.1 吸收波长的选择
取1.2.2中配置的对照品样品溶液,采用紫外可见分光光度计在波长200~400 nm间进行全波长扫描,以确定各单萜苷的最大吸收波长,从而确定合适的检测波长。光谱扫描结果显示4″-羟基白芍苷和氧化芍药苷在260 nm处有明显的吸收峰,白芍苷、芍药苷、PD和白芍苷R1在232 nm处有最大吸收峰。因此,吸收波长采用变波长法测定,选择260 nm作为4″-羟基白芍苷和氧化芍药苷的检测波长,232 nm作为白芍苷、芍药苷、PD和白芍苷R1的检测波长。
2.2 流动相的选择
由于单萜苷类化合物含有较多的羟基,这些羟基与固定相作用较强,会导致拖尾。所以文献报道分离芍药苷等单萜苷类的流动相多为乙腈-磷酸水体系[11-13]。本研究优化了乙腈-磷酸水体系作为流动相的分离效果,发现采用乙腈-磷酸水体系时4″-羟基白芍苷和氧化芍药苷2种单萜苷的分离效果较差。参考苷类分析方法的文献报道[14],对乙腈-磷酸二氢钾缓冲盐体系分离单萜苷类的条件进行了优化,最终选择乙腈-磷酸二氢钾缓冲盐(pH=3.0)为分离流动相。分离洗脱为梯度洗脱,条件为:0 min(A, 15%)→10 min(A, 15%)→22 min(A, 25%)。在此条件下,6个单萜苷都得到很好的分离,并且分析时间较短。
2.3 供试品的制备方法的建立
比较了甲醇、乙醇和乙腈等溶剂提取单萜苷的效率,同时对不同的提取方法(超声、索氏回流、冷浸和回流)、提取时间、料液比及溶剂浓度进行了优化,以其中主要成分芍药苷的含量作为衡量标准。结果发现采用10倍量的甲醇和乙腈用索氏提取器回流4 h时芍药苷的得率比较接近,大于用其他提取方法的得率。由于乙腈毒性较大,综合评价得率和安全性等因素,最后选择甲醇作为提取溶剂。
2.4 线性关系的考察
精密吸取混合对照品储备液1 mL加入到10 mL容量瓶中,用甲醇定容。然后吸取0.75、1.5、3、6、12 μL注入色谱仪,按照1.2中的色谱条件进行测定,记录峰面积。以对照品的峰面积(y)为纵坐标,进样量(x)为横坐标进行线性回归,得4″-羟基白芍苷、氧化芍药苷、白芍苷、芍药苷、PD和白芍苷R1的线性回归方程见表1。
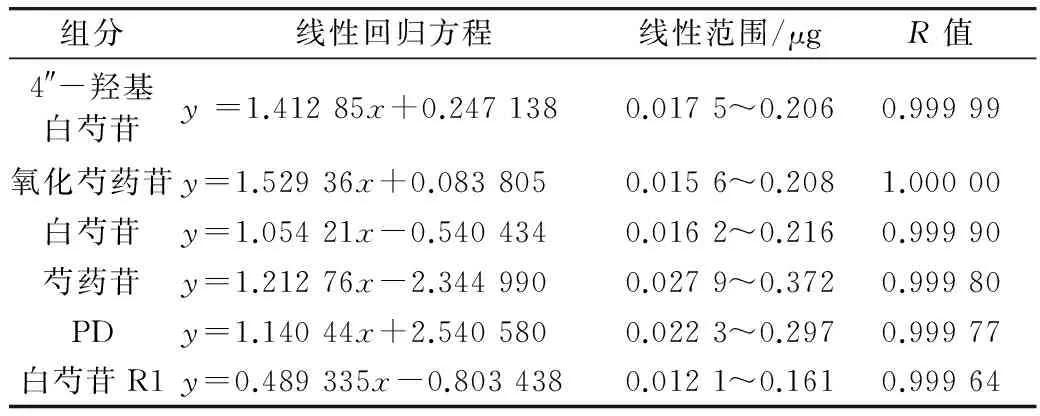
表1 6种对照品的线性关系
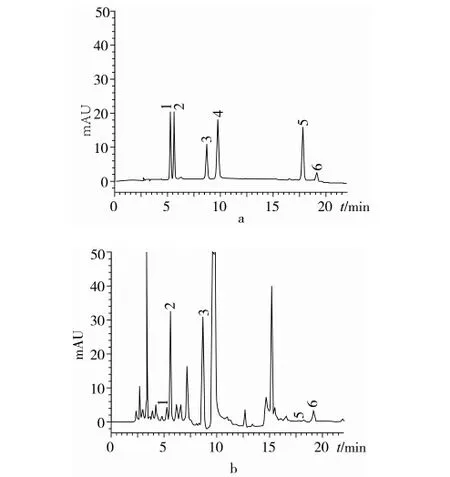
注:1对羟基白芍苷,2氧化芍药苷,3 白芍苷,4 芍药苷,5 PD,6 白芍苷R1。
图1 对照品(a)和样品的色谱图(b)
2.5 精密度试验
取对照品混合物溶液,按色谱条件,连续进样6次,记录峰面积,计算4″-羟基白芍苷、氧化芍药苷、白芍苷、芍药苷、PD、白芍苷R1峰面积的RSD分别为0.32%、0.87%、0.65%、0.57%、0.89%、0.68%,表明本方法的精密度良好。
2.6 稳定性试验
取同一供试品溶液,分别于配制后的0、2、4、8、12、24、48 h进样,记录峰面积。结果显示4″-羟基白芍苷、氧化芍药苷、白芍苷、芍药苷、PD、白芍苷R1的峰面积的RSD值分别为0.87%、1.14%、1.54%、1.08%、0.85%、0.97%。表明供试品溶液在48 h内稳定性良好。
2.7 重复性试验
精密称取紫斑牡丹籽饼粕粉末5份,每份10 g,按照1.2.3中的方法操作,制备所需供试品溶液,测定4″-羟基白芍苷、氧化芍药苷、白芍苷、芍药苷、PD和白芍苷R1的含量,计算各组分含量平均值分别为0.110、5.702、1.078 3、12.381 4、0.063 2、0.558 7 mg/g;RSD分别为0.89%、1.02%、1.31%、0.76%、0.87%,0.95%。
2.8 加样回收率试验
精密称取已经测得含量的紫斑牡丹籽饼粕粉末9份,每份10.00 g,3份为一组,分别精密加入一定量的4″-羟基白芍苷、氧化芍药苷、白芍苷、芍药苷、PD、白芍苷R1对照品(约相当于样品中各对照品含量的80%、100%、120%),加入10 mL乙醇,按照“1.2.3”中的方法操作,制备所需溶液,进样10 mL,测定提取液中5种组分的含量并计算加样回收率。4″-羟基白芍苷、氧化芍药苷、白芍苷、芍药苷、PD和白芍苷R1平均加样回收率和RSD见表2。

表2 回收率测定结果(n=3)
2.9 样品含量的测定
将经过烘干的油用牡丹籽壳和牡丹籽饼粕用高速粉碎机粉碎,过60目筛,按照1.2.3中的方法制备供试品溶液。精密吸取对照品混合物和供试品溶液各10 μL,注入高效液相色谱仪,照色谱条件分别测定,外标法计算不同部位中各个单萜苷的含量,结果见表3。

表3 样品含量测定结果/mg/g (n=5, x±s)
3 结论
本试验建立了波长切换同时测定2种油用牡丹籽壳和榨油后的籽饼粕中6种单萜苷类化合物含量的测定方法。结果表明,6种单萜苷在油用牡丹籽壳和籽饼粕中含量不同,在油用牡丹籽饼粕中的含量远远大于其在牡丹籽壳中的含量,最多可以相差400多倍。在油用牡丹籽饼粕中,这6种单萜苷类物质的含量也有非常大的差异,其中含量最多的单萜苷为芍药苷,其在紫斑牡丹籽饼粕中的含量为12.339 5 mg/g;含量最低的单萜苷为PD,其在凤丹牡丹籽饼粕中的含量仅为0.003 2 mg/g。油用牡丹籽饼粕作为压榨法制备牡丹籽油的最主要的副产物,含有丰富的单萜苷类成分,可以通过从中提取单萜苷类物质进一步提高其应用价值。
[1]戚军超,周海梅,马锦琦,等. 牡丹籽油化学成分GC-MS分析[J]. 粮食与油脂, 2005, 19 (11):22-23
Qi J C, Zhou H M, Ma J Q, et al. Analysis of the chemical constituents in peony seed oil by GC-MS[J]. Cereals & Oils, 2005,19 (11):22-23
[2]邓瑞雪,刘振,秦琳琳,等. 超临界CO2流体提取洛阳牡丹籽油工艺研究[J],食品科学,2010,31(10):142-145
Deng R X, Liu Z, Qin L L, et al. Optimization of supercritical CO2extraction and analysis of chemical composition of peony seed oil[J].Food Science, 2010, 31(10): 142-145
[3]史国安,郭香凤,金宝磊,等. 牡丹籽油超临界CO2萃取工艺优化及抗氧化活性的研究[J],中国粮油学报,2013,28(4):47-50
Shi G A, Guo X F, Jin B L, et al. Optimization of supercritical CO2extraction and analysis of antioxidation activity of peony seed oil[J]. Journal of the Chinese Cereals and Oils Association, 2013, 28(4): 47-50
[4]王昌涛,张萍,董银卯. 超临界CO2提取牡丹籽油的工艺以及成分分析[J]. 中国粮油学报,2009,24(8):96-99
Wang C T, Zhang P, Dong Y M. The technique of the extraction of oil from peony seed with supercritical CO2extraction method and the analysis of the composition[J]. Journal of the Chinese Cereals and Oils Association, 2009,24(8):96-99
[5]S. H. Wu, D. G. Wu, Y. W. Chen.Chemical constituents and bioactivities of plants from the genusPaeonia[J].Chemistry & Biodiversity, 2010, 7(7):90-104
[6]C. N. He, Y. Peng, Y. C. Zhang,et al. Xiao.Phytochemical and biological studies of paeoniaceae[J].Chemistry & Biodiversity,2010, 7(7):805-838
[7]何春年,肖伟,李敏,等. 牡丹种子化学成分研究[J]. 中国中药杂志, 2010,35 (11):1428-1431
He C N, Xiao W, Li M, et al. Chemical constituents from seeds of Paeonia suffruticosa[J]. China Journal of Chinese Materia Medica, 2010, 35(11):1428-1431
[8]He C N, Zhang Y C, Xiao P G,etal. Monoterpene glycosides from the seeds of Paeonia suffruticosa protect HEK 293 cells from irradiation-induced DNA damage[J]. Phytochemistry Letters, 2012, 5(1): 128-133
[9]刘普,李亮,邓瑞雪,等. 凤丹籽饼粕单萜苷类成分的研究[J],中国药学杂志,2013,48(17):1445-1448
Liu P, Li L, Deng R X, et al. Monoterpene glucosides from seed cake ofPaeoniaostii[J]. Chinese Pharmaceutical Journal, 2013,48(17):1445-1448
[10]刘普,卢宗元,邓瑞雪,等. 凤丹籽饼粕中一个新单萜苷[J],中国药学杂志,2014,49(5):360-362
Liu P, Lu Z Y, Deng R X, et al. A new Monoterpene glycosides isolated from seed cake ofPaeoniaostii[J]. Chinese Pharmaceutical Journal, 2014,49(5):360-362
[11]李伟铭,赵月然,杨燕云,等. HPLC波长切换法同时测定白芍饮品中9种成分的含量[J],药物分析杂志,2011,31(12):2208-2212
Li W M, Zhao Y R, Yang Y Y, et al. RP-HPLC with UV switch determination of 9 components in white peony roots species[J]. Chinese Journal of pharmaceutical Analysis, 2011,31(12):2208-2212
[12]葛志伟,贺庆,林云径,等. RP-HPLC法测定杭白芍及其饮片中芍药内酯苷、芍药苷和苯甲酰芍药苷[J],中草药,2008,39(3):378-380
Ge Z W, He Q, Lin Y J, et al. RP-HPLC determination of the Albiflorin, Paeoniflorin and benzoylpaeoniflorin inPaeonialactifloraPall[J].Chinese Traditional and Herbal Drugs, 2008,39(3):378-380
[13]何秀菊,张振秋,王婧宁,等. HPLC波长切换法同时测定桂枝、白芍药对提取物中8个成分的含量[J].药物分析杂志,2013,33(11):1899-1903
He X J, Zhang Z Q, Wang J N, et al. HPLC with UV switch determination of 8 indicative components in combination extracts ofPersicaeRamulus andPaeoniaeRadix Alba[J]. Chinese Journal of pharmaceutical Analysis, 2013,33(11):1899-1903
[14]刘普,张创峰,邓瑞雪,等. 高效液相色谱法同时测定小叶丁香不同部位中5种活性成分的含量[J].中国药学杂志,2011,46(24):1935-1938
Liu P, Zhang C F, Deng R X, et al. Simultaneous determination of five Glycosides in Syringa pubenscens Turcz by HPLC[J].Chinese Pharmaceutical Journal, 2011,46(24):1935-1938.
Determination of Monoterpene Glycosides in Seed Cake and Seed Shell of Peony for Oil
Liu Pu Li Xiaofang Zhang Heng Liu Yiqiong Dong Junqing Deng Ruixue
(Henan Engineering Technology Research Center for Funiu Mountain Wild Medicinal Source Chemical Engineering & pharmaceutical College, Henan University of Science and Technology, Luoyang 471023)
To establish an HPLC method for simultaneous determination of 6 monoterpene glycosides in seed cake and seed shell of peony for oil, the separation was performed on an Agilent Zorbax SB C18column, using acetonitrile (A) and potassium dihydrogen phosphate solution (B) (pH=3) as the mobile phase by a gradient elution 0 min(A, 15%)→10 min(A, 15%)→22 min(A, 25%). Detection wavelength was set at 260 nm for the detection of 4″-hydroxyl-abiflofin, oxypaeoniflorin, and 232 nm for the detection of abiflofin, paeoniflorin, Paeonidanin, abiflofin R1. Column temperature was set at 30 ℃.The results indicated that the content of monoterpene glycosides in seed cake was higer than that in seed shell, and the seed cake would become the natural resource of monoterpene glycosides. The method was simple, accurate and could be used for quality control of the seed cake of peony for oil.
peony for oil, HPLC, monoterpene glycosides, assay
TS229
A
1003-0174(2016)10-0142-04
洛阳市科技攻关项目(1301052A,1401074A),河南科技大学大学生训练计划(HG201501),河南省重点科技攻关(162102310202)
2015-02-15
刘普,男,1978年出生,副教授,牡丹深加工
邓瑞雪,女,1978年出生,副教授,功能活性天然产物及其全合成
