响应面法优化板栗抗性淀粉制备工艺
2016-12-26欧阳杰王建中王丰俊
姚 慧 吕 佼 欧阳杰 王建中 王丰俊
(北京林业大学生物科学与技术学院;林业食品加工与安全北京市重点实验室,北京 100083)
响应面法优化板栗抗性淀粉制备工艺
姚 慧 吕 佼 欧阳杰 王建中 王丰俊
(北京林业大学生物科学与技术学院;林业食品加工与安全北京市重点实验室,北京 100083)
为了提高板栗抗性淀粉含量,并获得抗性淀粉制备方法的最适工艺参数,本研究优化了压热—普鲁兰酶法制备板栗抗性淀粉的工艺,在单因素试验基础上,采用响应面法研究淀粉悬浮液质量分数、普鲁兰酶添加量、酶解时间和冷凝时间对抗性淀粉得率的影响,建立各因素与抗性淀粉得率关系的数学回归模型。最终根据实际工艺操作确定最佳的制备工艺条件为淀粉悬浮液质量分数11.00%,酶添加量9 PUN/g、酶解时间10 h、冷凝时间15 h。在该制备条件下,测得抗性淀粉得率为64.90%,基本符合理论预测值(65.70%)。试验证明,响应面法能够提高板栗抗性淀粉的制备率。
抗性淀粉 普鲁兰酶 板栗淀粉 响应面
抗性淀粉(resistant starch,RS),即不被健康人体小肠吸收的淀粉及其水解物的总称[1]。根据抗性淀粉形态及物理化学性质,可将其分为4 类:物理包埋淀粉(RS1)、抗性淀粉颗粒(RS2)、回生淀粉(RS3)和化学改性淀粉(RS4)。RS3类似于膳食纤维,但RS3具有更优良的加工特性,最具研究价值。一般认为其形成机理是:淀粉糊化后在冷却过程中,短直链淀粉形成双螺旋结构,双螺旋之间聚合形成螺旋聚集体,在此基础上形成抗酶晶体[2]。RS3的制备通常采用压热处理法和脱支法,或者二者相结合的方法[3]。压热处理过程中淀粉颗粒完全破裂,其中的直链淀粉完全游离出来,促进直链分子之间相互结合形成氢键;酶水解淀粉分子中的α-1.6糖苷键,生成更多的游离直链淀粉,在淀粉冷却回生过程中,促使直链淀粉双螺旋的缔合,形成抗性晶体[4-5]。所以选择压热-酶法相结合来探究制备抗性淀粉的可能性。
关于抗性淀粉的研究,蹇华丽等[6]以玉米为原料,研究了抗性淀粉的结晶性质;陈恋[7]以蕨根为原料,研究了抗性淀粉的糊化性质;邵秀芝[8]以小麦为原料,研究了抗性淀粉的流变学特性及表观结构特性。然而,对板栗抗性淀粉的研究鲜见报道。本研究以板栗为原料,分离提取淀粉,通过淀粉悬浮液质量分数、酶添加量、酶解时间和冷凝时间控制制备工艺,探究制备规律,进而采用响应面法优化工艺条件,提高抗性淀粉得率,为后续研究提供参考。
1 材料和方法
1.1材料与试剂
新鲜板栗:河北栗源食品有限公司;普鲁兰酶(3 000 PUN/g)、耐高温α-淀粉酶:丹麦诺维信公司;胃蛋白酶(3 000 U/g)、葡萄糖淀粉酶(10 000 U/g):北京科百奥试剂公司。
1.2 主要仪器
SCIENTZ-12N冷冻干燥机:宁波新芝生物科技股份有限公司;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 淀粉的提取
鲜板栗去壳切片,按料液比1:4与0.2%NaOH溶液混合后打浆,过80目和200目筛并挤压残渣,将滤液静置12 h后,3 500 r/min离心10 min,沉淀物即为板栗淀粉,冷冻干燥后备用。
1.3.2 板栗抗性淀粉制备
取5.0 g板栗淀粉于150 mL三角瓶中,加一定量水,配制成不同质量分数的淀粉悬浮液于80 ℃电热恒温水浴锅中进行糊化处理15 min。迅速移至高压灭菌锅中进行121℃、15 min压热处理并自然冷却降至55 ℃,用1 mol/L HCl溶液调整pH值到5.7,添加不同质量的普鲁兰酶进行脱支处理一定时间,之后向充分酶解后的样品液中加入体积比为1倍样品液体积:3倍80%的乙醇稀释液,并放入4 ℃冰箱保存不同时间以使其充分老化,离心,弃去上清液,洗涤沉淀3次,并在冷冻干燥机中冻干,粉碎过200目筛,干燥保存备用。
1.3.3 板栗抗性淀粉含量的测定
参照文献[9]并作适当的改进进行板栗抗性淀粉的测定,称取0.10 g样品于150 mL锥形瓶中,加入10 mL HCl-KCl缓冲液,调pH至2.0,加入胃蛋白酶0.1 mL(1 g/100 mL),40 ℃恒温震荡60 min,3 000 r/min离心15 min后弃上清液;向沉淀中加入10 mL磷酸缓冲液,调pH至6.0,加入耐高温α-淀粉酶2 mL(1%),95 ℃恒温震荡60 min,3 000 r/min离心后弃上清液;加入10 mL乙酸钠缓冲液,调pH至4.5,加入葡萄糖淀粉酶1 mL(0.01%),50 ℃恒温震荡60 min,3 000 r/min离心后弃上清液;反复3次,彻底洗掉葡萄糖;将沉淀完全溶于2 mol/L KOH,用6 mol/L HCl中和,加入过量的葡萄糖淀粉酶,50 ℃恒温振荡60 min,冷却,离心,收集上清液,反复3次,合并上清液,用蒸馏水定容至50 mL。用3,5-二硝基水杨酸法(DNS)[10]测还原糖的含量,并根据公式计算出抗性淀粉的质量分数:
抗性淀粉质量分数=还原糖含量×0.9/样品重×100%
2 结果与分析
2.1 生板栗中抗性淀粉的含量
取1.3.1的方法提取的淀粉5.0 g加一定体积蒸馏水配制为11.00%悬浮液,在1.3.3的方法下进行测定,试验处理重复3次,得到板栗原含有抗性淀粉为11.65%。
2.2 高压-酶解复合法制备抗性淀粉的单因素试验
2.2.1 淀粉悬浮液质量分数对抗性淀粉得率的影响
取5.0 g板栗淀粉加以不同体积蒸馏水配制为7.00%、9.00%、11.00%、13.00%、15.00%的悬浮液,预糊化后进行高压处理,添加普鲁兰酶(9 PUN/g),脱支处理10 h,按操作1.3.3测定抗性淀粉得率,每组处理重复3 次,由图1可知,抗性淀粉得率随淀粉悬浮液质量分数先增高后降低,当抗性淀粉悬浮液质量分数达到11.00%时,抗性淀粉得率最大(57.52%),随着淀粉悬浮液质量分数进一步升高,抗性淀粉得率先下降迅速,接着下降速率逐渐减小。说明淀粉悬浮液质量分数过高或过低都不利于抗性淀粉的形成,淀粉悬浮液质量分数过低,大量水分子以氢键与淀粉分子结合,减少了直链淀粉分子间的接触,影响了抗性淀粉的形成;淀粉悬浮液质量分数过高,水分含量不能满足淀粉粒的完全溶胀和糊化,导致淀粉糊的黏度变大,不利于直链淀粉分子相互靠近连接,影响抗性淀粉的形成[11]。

图1 不同因素对板栗抗性淀粉得率的影响
2.2.2 普鲁兰酶添加量对抗性淀粉得率的影响
取5.0 g板栗淀粉加适当体积蒸馏水配制为11.00%的悬浮液,预糊化后进行高压处理,添加普鲁兰酶7、8、9、10、11 PUN/g脱支处理10 h,4 ℃冷凝老化处理12 h,按操作1.3.3测定抗性淀粉得率,每组处理重复3 次,由图1可知,普鲁兰酶添加量过多过少都不利于抗性淀粉的形成,当普鲁兰酶加入量为9 PUN/g时,抗性淀粉质量分数最高,达到44.20%。当普鲁兰酶添加量较少时,分子被切断程度不够,游离的直链淀粉分子较少,且淀粉糊的黏度仍然很大,不利于直链淀粉分子相互接近而形成结晶;添加量太大,直链淀粉分子太短,黏度过低,直链淀粉分子相互接近的概率较低,也不利于抗性淀粉的形成。抗性淀粉的形成需要直链淀粉分子,因为直链淀粉可提供一定的三维结构空间,若直链分子太短则无法提供三维结构,RS无法形成[12-13]。同时加酶量多少也会影响被切断后分子链长短比例以至于影响晶体形成的难易程度。
2.2.3 酶解时间对板栗抗性淀粉得率的影响
取5.0 g板栗淀粉加适当体积蒸馏水配制为11.00%的悬浮液,预糊化后进行高压处理,添加普鲁兰酶(9 PUN/g)脱支处理6、8、10、12、14 h,4 ℃冷凝老化处理12 h,按操作1.3.3测定抗性淀粉得率,每组处理重复3次,由图1可知,普鲁兰酶作用时间过长过短都不利于抗性淀粉的形成。普鲁兰酶作用时间从6 h到10 h,曲线有上升,当普鲁兰酶作用时间为10 h时,曲线上升到最高点(59.5%),抗性淀粉含量最高,继续延长酶解时间,曲线下降,抗性淀粉含量下降。普鲁兰酶作用时间过长,直链分子过短,而分子量小的直链分子则运动较快,分子运动比较剧烈,因为运动快的链碰撞在一起的几率及稳定的几率相对小,因此较难聚集,所以直链分子过短(即分子量过小)反而不利于晶体的形成。当普鲁兰酶作用时间过短,释放的直链淀粉分子太少,不利于重新结晶,而且淀粉糊中直链分子的链过长,分子间斥力增大,也难聚集。所以只有中等长度的链才最有利于聚集,RS的聚合度大约为50~60[14-16]。
2.2.4 冷凝时间对抗性淀粉得率的影响
取5.0 g板栗淀粉加适当体积蒸馏水配制为11.00%的悬浮液,预糊化后进行高压处理,添加普鲁兰酶(9 PUN/g)脱支处理10 h,4 ℃冷凝老化处理2、6、12、18、24 h按操作1.3.3测定抗性淀粉得率,每组处理重复3次,由图1可知,抗性淀粉的质量分数随着冷凝时间的延长增加,在12 h时达到最大值(56.00%),继续增加冷凝时间,抗性淀粉得率没有明显上升。RS的形成是直链淀粉分子的重新结晶过程,根据结晶理论,淀粉结晶分2个阶段,即晶核形成和晶体生长阶段。晶核的形成是在较高的温度范围内进行的,当冷却到一定温度时,晶体开始生长,甚至在贮藏阶段也在缓慢进行。按结晶体成长理论,随着静置时间的延长,RS的含量应该增加,但淀粉乳在长时间的低温环境下,由于水分的析出和分子运动的减慢,这就使晶体的生长受到了阻碍[17-18],所以,过长时间的静置并没有使得RS含量无限增加。
2.3 响应面优化试验
2.3.1 响应面试验设计及结果
根据单因素试验结果,采用Design Expert 7.0中的响应面试验设计法(response surface method,RSM),对影响抗性淀粉得率的淀粉悬浮液质量分数、酶添加量、酶解时间、冷凝时间进行4因素3水平的响应面试验,优化压热普鲁兰酶法生产抗性淀粉的工艺条件。因素水平编码值见表1,结果见表2 。
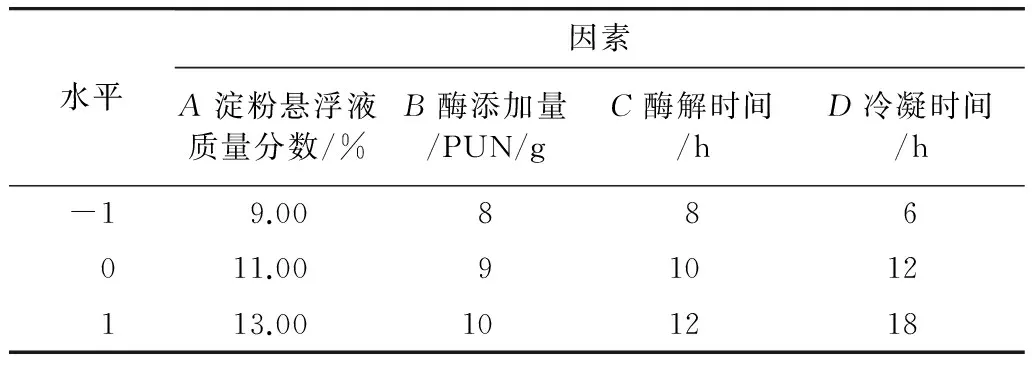
表1 响应面试验因素水平表

表2 试验设计及结果
2.3.2 建立模型方程与显著性检验
应用Design Expert 7.0 统计分析软件对29个试验点的响应值进行回归分析拟合,分别得到回归方程模型方差分析(表3)及回归方程系数估计值(表4)。

表3 回归方程模型的方差分析
注:*差异显著P<0.05,** 差异极显著P<0.01,下同。
由表3可看出,模型P<0.000 1,说明该模型建立为高度显著,具有合理性;失拟项(P=0.650 0)>0.05,说明模型失拟项不显著;因此二次模型成立。应用此模型可以预测抗性淀粉得率及优化压热酶解生产抗性淀粉的工艺,并获得四元二次多项回归方程。
Y/%=58.33+2.74A+7.71B+6.40C-1.83D+0.52AB-1.62AC-6.84AD-3.28BC-0.87BD+2.21CD-8.91A2-4.98B2+2.21C2-6.67D2
方程的决定系数R2=0.983 7,说明该模型能解释98.37%响应值的变化,即该模型与实际试验拟合良好,试验误差小。
由表4可知,影响抗性淀粉得率的因素主次为B>C>A>D,即普鲁兰酶加酶量>酶解时间>淀粉悬浮液质量分数>冷凝时间。其中普鲁兰酶加酶量、酶解时间、淀粉悬浮液质量分数、冷凝时间对反应的影响达到极显著程度,四因素交互作用皆显著,且淀粉悬浮液质量分数与冷凝时间、普鲁兰酶添加量与酶解时间极显著,淀粉悬浮液质量分数与普鲁兰酶添加量、淀粉悬浮液质量分数与酶解时间、普鲁兰酶添加量与冷凝时间、酶解时间与冷凝时间显著。

表4 回归模型系数显著性检验结果
2.3.3 抗性淀粉得率响应面分析与最优工艺条件的确定
响应面图形是响应值Y对应于试验因素A、B、C、D所构成的三维空间的曲面图及其在二维平面上的等高线图。响应面图形可以直观地反映各因素及它们之间的交互作用对响应值的影响。将2个因素固定在零水平,可作出另外2因素交互作用的响应曲面图及等高线图,结果见图2。
由图2a可知,随着淀粉悬浮液质量分数的增加与普鲁兰酶加酶量增大,抗性淀粉得率先升高后降低,等高线形状椭圆形,淀粉悬浮液质量分数与酶添加量的交互作用对反应有显著影响,由此可见,选择合适的淀粉悬浮液质量分数与普鲁兰酶添加量,可以一定程度提高抗性淀粉得率。由图2b可知,随着淀粉悬浮液质量分数升高与酶解时间延长,抗性淀粉得率匀速升高然后缓慢下降,等高线形状呈三角状,说明淀粉悬浮液质量分数与酶解时间的交互作用对反应也有显著影响。由图2c可知,随着淀粉悬浮液质量分数的增加与冷凝时间的延长,抗性淀粉的得率先匀速上升后迅速下降,等高线形状为椭圆形,说明淀粉悬浮液质量分数和冷凝时间的交互作用对反应的影响极显著。由图2d可知,随着加酶量的增加和酶解时间的延长,抗性淀粉的得率先增加后趋于平稳,等高线的形状为线,说明加酶量和酶解时间的交互作用对抗性淀粉的得率的影响极显著。由图2e可知,随着加酶量的增加和冷凝时间的延长,抗性淀粉的得率先增加后趋于平稳,等高线的形状为椭圆形,说明加酶量和冷凝时间的交互作用对抗性淀粉的得率有显著的影响。由图2f可知,随着酶解时间和冷凝时间的延长,抗性淀粉的得率先增加后下降,等高线的形状为椭圆形,说明酶解时间和冷凝时间的交互作用对抗性淀粉的得率有显著影响。因此,在实际生产中,可以通过控制淀粉悬浮液质量分数、酶添加量、酶解时间和冷凝时间以获得较高的抗性淀粉得率。


图2 各因素交互影响抗性淀粉得率的响应面及等高线图
压热复合普鲁兰酶法生产抗性淀粉的最优条件为淀粉悬浮液质量分数11.07%、酶添加量9.06 PUN/g、酶解时间9.99 h、冷凝时间14.80 h。在此条件下,抗性淀粉得率预测值为65.7%。而根据实际工艺条件,确定为淀粉悬浮液质量分数11.00%、酶添加量9 PUN/g、酶解时间10 h、冷凝时间15 h,做3组验证试验,测得抗性淀粉得率分别为64.6%、65.2%、64.9%,平均得率64.9%,与该条件下的理论预测值65.7%相比,相对误差小于1%,说明采用RSM 法优化得到的生产工艺参数准确可靠。
3 结论
影响普鲁兰酶法制备抗性淀粉的主要因素为淀粉悬浮液质量分数、普鲁兰酶加酶量、酶解时间和冷凝时间,各因素对板栗抗性淀粉得率的影响大小不同,各因素的显著性为普鲁兰酶加酶量>酶解时间>淀粉悬浮液质量分数>冷凝时间。这4个因素对反应的影响都达到极显著程度,且淀粉悬浮液质量分数与普鲁兰酶添加量、淀粉悬浮液质量分数与酶解时间、淀粉悬浮液质量分数与冷凝时间、普鲁兰酶添加量与酶解时间、普鲁兰酶添加量与冷凝时间、酶解时间与冷凝时间有交互作用。
通过响应面试验,确定了压热复合普鲁兰酶法生产抗性淀粉的最优制备条件:淀粉悬浮液质量分数11.00%、酶添加量9 PUN/g、酶解时间10 h、冷凝时间15 h。在该条件下,板栗抗性淀粉得率为64.9%,响应面法的最优工艺可以有效提高板栗抗性淀粉得率,说明响应面法能更好反映各因素之间的相互作用。
[1]Englyst H N, Anderson V, Cummings J. Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition, 1988, 45: 533-550
[2]Abdorreza M N, Robal M C, Tajul A Y, et al. Physicochemical,thermal,and rheological properties of acid-hydrolyzed sago(Metroxylonsagu) starch[J].Food Science and Technology, 2012, 23(46): 135-141
[3]Rong H, Can P L, De Y C, et al. Preparation of phosphorylated starch by dry-heating in the presence of pyrophosphate and its calcium-phosphate solubilizing ability[J].Journal of Food Science Technology, 2011(10): 356-364
[4]周世成.抗性淀粉的制备与应用研究进展[J].中国粮油学报,2009,2(17):51-56
Zhou Shicheng. Research review of chestnut resistant starch’s preparation and application[J].Journal of Chinese Cereals and Oils Association, 2009, 2(17): 51-56
[5]Paula R C, Maria C N, Maria L B. The effect of starch isolation method on physical and functional properties of Portuguese nuts starches. I. chestnuts (CastaneasativaMill) fruits[J].Food Hydrocolloids, 2012, 12(27): 256-263
[6]蹇华丽,高群玉.抗性淀粉结晶性质的研究[J].食品科学,2003,24(7):44-47
Jian Huali, Gao Qunyu.The study of resistant starch’s crystallization properties[J].Journal of Food Science, 2003, 24(7): 44-47
[7]陈恋.蕨根淀粉理化性质及抗性淀粉制备工艺的研究[D].重庆:西南大学,2008
Chen Lian. Stuidies on the physicochemical properties and preparation technology of fern root resistant starch[D].Chongqing: Southwest University, 2008
[8]邵秀芝.小麦抗性淀粉物理性质研究[J].粮食与油脂,2009,9:11-13
Shao Xiuzhi.Physical properties of wheat resistant starch[J].Journal of Cereals & Oils, 2009: 11-13
[9]Perera A, Meda V, Tyler R T. Resistant starch: A review of analytical protocols for determining resistant starch and of factors affecting the resistant starch content of foods [J].Food Research International, 2010, 43(8): 1959-1974
[10]丁文平,李清,夏文水.淀粉酶对大米淀粉回生影响机理的研究[J].粮食与饲料工业,2005,15(10):16-17
Ding Wenping,Li Qing, Xia Wenshui. Mechanism research of amylase to rice starch retrogradation[J].Cereal and Feed Industry, 2005, 15(10): 16-17
[11]陈光,高俊鹏,王刚,等.抗性淀粉的功能特性及应用研究现状[J].吉林农业大学学报,2005,27(5):578-581
Chen Guang, Gao Junpeng,Wang Gang, et al. Study status of function characteristics and application on resistant starch[J]. Journal of Jilin Agricultural University, 2005, 27(5): 578-581
[12]孙建全,王剑非,邵秀芝,等.不同热处理方式对小麦抗性淀粉形成的影响[J].江苏农业科学,2010,3(6):421-423
Sun Jianquan, Wang Jianfei, Shao Xiuzhi, et al. The influence of different heat treatment methods on wheat resistant starch formation[J]. Jiangsu Agricultural Sciences, 2010, 3(6): 421-423
[13]韩晓芳,李新华.压热法制备荞麦抗性淀粉的研究[J].粮食与饲料工业,2008,12:25-27
Han Xiaofang, Li Xinhua. The research of preparing buckwheat resistant starch by pressure-heating treatment[J].Cereal and Feed Industry, 2008, 12: 25-27
[14]史苗苗,高群玉,郑琳,等.普鲁兰酶加酶量对蜡质玉米抗性淀粉影响及性质研究[J]. 粮食与油脂,2012,25(4):16-19
Shi Miaomiao, Gao Qunyu, Zheng Lin, et al. The influence of pullulanase adding amount on waxy corn resistant starch and its properties research [J]. Journal of Cereals & Oils, 2012, 25(4): 16-19
[15]张守文,孟庆虹,杨春华,等.玉米抗消化淀粉的结构和性质研究[J].食品工业科技,2009,10(12):65-67
Zhang Shouwen, Meng Qinghong, Yang Chunhua, et al. Structure and property research of corn resistant starch[J]. Science and Technology, 2009, 10(12): 65-67
[16]Gonzalez S R A, Mora E R, Hernández S H, et al. The influence of time and storage temperature on resistant starch formation from autoclaved debranched banana starch[J].Food Research International, 2007, 40(2): 304-310
[17]Park O J, Kang N E, Chang M J, et al. Resistant starch supplementation influences blood lipid concentrations and glucose control in overweight subjects[J].Journal of Nutritional Science and Vitaminology, 2004, 50: 93-99
[18]Robertson M D, Bickerton A S, Dennis A L, et al. Insulin-sensitizing effects of dietary resistant starch and effects on skeletal muscle and adipose tissue metabolism[J]. American Journal of Clinical Nutrition, 2005, 82: 559-567.
Response Surface Methodology for Optimization of Chestnut Resistant Starch PreparationTechnology
Yao Hui Lü Jiao Ouyang Jie Wang Jianzhong Wang Fengjun
(College of Biological Science and Technology, Beijing Forestry University Beijing Key Laboratory of Forest Food Processing and Safety, Beijing 100083)
The present study aimed to improve the yield of chestnut resistant starch and optimize the processing parameters of resistant starch preparation method. The methods of autoclaving treatment and pullulanase hydrolysis were used. Based on the result of single factor experiment, response surface method was used to investigate the effect of starch suspension mass fraction, pullulanase adding amount, enzymatic hydrolysis time and cooling time on the yield of resistant starch. A mathematical regression model of the relationship between resistant starch yield and 4 factors was established. According to the actual processing conditions, the optimum preparation conditions were achieved as follows: starch suspension mass fraction of 11.00%, pullulanase adding amount of 9 PUN/g, enzymatic hydrolysis time of 10 h and cooling time of 15 h. Under above conditions, the yield of the chestnut resistant starch reached 64.90%, which was close to the predicted value (65.70%). Therefore, RSM could be used to design the experiments and increase the yield of chestnut resistant starch.
resistant starch, pullulanase, chestnut starch, response surface methodology (RSM)
TS201.2
A
1003-0174(2016)12-0132-07
林业公益性行业科研专项重大项目(201204401)
2015-05-17
姚慧,女,1990年出生,硕士,天然产物与功能性食品
王丰俊,男,1975年出生,副教授,油脂与植物蛋白开发
