β-葡聚糖对大豆分离蛋白酸致混合凝胶流变性的影响
2016-12-26赵城彬刘金阳林海晶
赵城彬 刘 畅 张 瑶 刘金阳 陈 旸 林海晶 吴 非
(东北农业大学食品学院1,哈尔滨 150030)(哈尔滨市农产品质量安全检验检测中心2,哈尔滨 150070)
β-葡聚糖对大豆分离蛋白酸致混合凝胶流变性的影响
赵城彬1刘 畅2张 瑶1刘金阳1陈 旸1林海晶1吴 非1
(东北农业大学食品学院1,哈尔滨 150030)(哈尔滨市农产品质量安全检验检测中心2,哈尔滨 150070)
采用乳酸菌对大豆分离蛋白(SPI)/β-葡聚糖混合体系进行发酵制备酸致凝胶,研究β-葡聚糖浓度(0.4~1.6 mg/100 mL)和分子质量(OGL80~OGL360)对SPI(4、6、8 mg/100 mL)酸致混合凝胶流变性的影响。结果表明:在SPI中添加β-葡聚糖不会改变大豆蛋白的变性温度,但会使表面疏水性由81.97降低至71.83。一定浓度β-葡聚糖会使SPI酸致凝胶的起点由1 Pa降至0.01~0.1 Pa,甚至降低凝胶终点G′至10 Pa以下不能形成凝胶。而高分子质量β-葡聚糖通过增加体系黏度而减少分层现象并保持体系稳定,从而降低或消除β-葡聚糖对SPI酸致混合凝胶的弱化作用,甚至会改善混合体系凝胶强度。
β-葡聚糖 大豆分离蛋白 混合凝胶 流变性
大豆分离蛋白(SPI)作为食品配方中的功能性成分,由于其具有高营养价值和多种功能特性被广泛应用于食品工业中[1]。凝胶性是大豆蛋白一个重要的功能特性,是蛋白质形成三维空间网状结构的性质,对食品质构特性的改善有很大影响[2]。大豆蛋白的凝胶性可以通过添加其他凝胶剂的方法而得到改善,例如多糖。β-葡聚糖是一种非淀粉多糖,燕麦和大麦中含量较高,主要存在于谷物胚乳和糊粉层中,基本结构是由D-葡萄糖以β-(1→4)和β-(1→3)糖苷键连接而成的线性多糖[3]。β-葡聚糖可在水溶液中呈现不规则的形状,导致其溶解性和吸水溶胀能力较强,形成高黏度溶液,并发挥多种生理功能的作用,如调节免疫、降血脂、降血糖等[4],而这些生理功能与其溶液流变性有密切关系。此外,β-葡聚糖还具有一定的凝胶性,不但与其黏性有关,还受其浓度和分子质量的影响。蛋白质与β-葡聚糖可以相互作用形成混合凝胶,其分子结构、理化特性和加工条件等因素会影响混合凝胶体系的流变特性、微观结构和质构特性等[5]。近年来,国内外已有学者对蛋白质与β-葡聚糖混合凝胶体系进行研究,Lazaridou等[6]对燕麦β-葡聚糖/酪蛋白酸钠混合体系的凝胶性进行研究,探究β-葡聚糖浓度和分子质量对凝胶体系流变性和相分离行为的影响,进而评价多糖对发酵乳制品质地的影响。赵城彬等[7]将不同分子质量燕麦β-葡聚糖添加到大豆分离蛋白中,采用乳酸菌对其进行发酵制备酸致混合凝胶,探讨燕麦β-葡聚糖浓度和分子质量对SPI凝胶的脱水收缩作用、质构特性和持水性的影响。但关于β-葡聚糖对SPI酸致混合凝胶流变性影响的研究却鲜有报道。本试验采用乳酸菌对SPI/β-葡聚糖混合体系进行发酵制备酸致凝胶,采用流变仪研究β-葡聚糖浓度和分子质量对SPI酸致混合凝胶流变性的影响,进而探讨蛋白质与多糖间的相互作用关系,为提高SPI的功能性质和拓展其应用范围提供参考。
1 材料与方法
1.1 材料、试剂与仪器
燕麦:市售;SPI:哈高科食品有限责任公司;保加利亚乳杆菌L12:东北农业大学乳品重点实验室。
α-淀粉酶:上海生工AMRESCO产品;胰酶:美国Amresco公司;Sepharaose CL-4B柱子:美国GE公司;Dextran系列标准样品:美国Sigma公司;乙酸锌、亚铁氰化钾:北京新光化工试剂厂;葡萄糖、无水乙醇、磷酸、盐酸均为分析纯。
F2102型植物试样粉碎机:天津泰斯特仪器有限公司;JY98-IIID型超声波细胞破碎仪:宁波新芝生物科技有限公司;旋转蒸发仪:上海博讯实业有限公司医疗设备厂;LGJ-1冷冻干燥机:上海医用离心机厂;电热恒温水浴锅:余姚市东方电工仪器厂;恒温培养箱:北京市永光明医疗仪器厂;pHS-3C型酸度计:上海鹏顺科学仪器有限公司;PE Pyris 6差示扫描量热仪:美国PULUS TA.XT公司;F-4500荧光分光光度计:日本HITACHI公司;马尔文流变仪:英国马尔文仪器有限公司。
1.2 试验方法
1.2.1 β-葡聚糖的制备
燕麦粉碎过筛后与水混合,碱性条件下超声提取[8]后离心取上清液。加入中温α-淀粉酶酶解除淀粉,离心取上清液。将上清液冷却后采用胰酶酶解结合蛋白沉淀剂的方法除蛋白,离心取上清液。将上清液减压浓缩后加入无水乙醇静置过夜,离心收集沉淀。沉淀加水复溶,冷冻干燥得β-葡聚糖提取物。用磷酸调节β-葡聚糖溶液pH为2,80 ℃下水解不同的时间[9],冷却至室温,调pH为7,冷冻干燥得到不同分子质量β-葡聚糖。β-葡聚糖的分子质量采用凝胶过滤色谱法测定[10],分别为360、300、250、190、80 ku,分别用OGL360、OGL300、OGL250、OGL190和OGL80来表示。
1.2.2 SPI/β-葡聚糖酸致凝胶的制备
将不同分子质量(360、300、250、190和80 ku)的β-葡聚糖分散到一定量的蒸馏水中,80 ℃下搅拌使其完全溶解,配成0.4、0.8、1.2、1.6 mg/100 mL的多糖溶液。将多糖溶液冷却后,分别加入4、6、8 mg/100 mL的SPI,室温下磁力搅拌2 h充分混匀,形成SPI/β-葡聚糖混合溶液,然后于95 ℃加热15 min,冷却后添加4%葡萄糖,然后接种3%的保加利亚乳杆菌,42 ℃发酵5 h,然后4 ℃冷藏12 h得到凝胶。对照组为不含β-葡聚糖的SPI凝胶。
1.2.3 热性质(DSC)的测定
根据Arntfield等[11]的方法对样品的热性质进行分析。将样品溶液冻干后,取3.0 mg放入铝盒中,加入10 μL的0.01 mol/L的磷酸缓冲溶液(pH 7)密封,以5 ℃/min的升温速率由20 ℃加热到120 ℃,采用空铝盒作为对照。记录此过程的吸热峰温度(Tp)和热焓值(ΔH)。
1.2.4 表面疏水性(H0)的测定
参照Kato等[12]的ANS荧光探针法对样品的表面疏水性进行测定。将样品溶液用0.05 mol/L、pH 7的磷酸盐缓冲溶液稀释至1 mg/mL,在10 000 g下离心20 min,采用Lowry法检测上清液中蛋白质含量。将上清液用同样的缓冲液稀释至蛋白质量浓度为0.05~1 mg/mL,将20 mL浓度为8 mmol/L的ANS溶液分别与1 mL不同浓度的样品溶液混合,摇匀后测定样品的荧光强度。激发波长λex为390 nm,发射波长λem为470 nm,以荧光强度对蛋白质浓度作图,初始斜率即为表面疏水性(H0)。
1.2.5 pH的测定
在不同的发酵时间下,采用pHS-3C型酸度计对样品溶液的pH进行测定。
1.2.6 凝胶流变性的测定
参照Lazaridou的方法[13]对酸致凝胶流变性进行测定。将接种后的样品溶液置于流变仪平板上,设定平板间距1 000 μm,使平板间完全充满溶液,在溶液裸露部位滴1~2滴矿物油覆盖防止水分蒸发,加上保温套准备测定。调整频率为1 Hz、应变为0.005,42 ℃下连续测定5 h,记录此过程的弹性模量(G′)及黏性模量值(G″)随时间的变化。初始的应变扫描试验显示应变在凝胶线性黏弹区域内。
1.2.7 统计分析
每个试验重复3次,结果表示为平均数x±s。采用统计学软件SPSS17.0对试验数据进行统计分析,采用Origin8.5软件作图。
2 结果与分析
2.1 SPI/β-葡聚糖混合物热性质(DSC)及表面疏水性(H0)分析
表1显示SPI/β-葡聚糖混合物和对照组SPI的吸热峰温度(Tp)、热焓值(ΔH)和表面疏水性(H0)。与对照组相比,无论是β-伴大豆球蛋白(7S组分)还是大豆球蛋白(11S组分),SPI/β-葡聚糖混合物的吸热峰温度(Tp)和热焓值(ΔH)没有明显改变,这表明在SPI中加入β-葡聚糖对蛋白质的变性温度几乎没有影响,这与Zhu等[14]的研究结果一致。此外,所有样品的Tp最大值约为93~94 ℃左右,在接菌前采用95 ℃热处理可使蛋白质完全变性。
蛋白质变性过程中疏水残基的暴露会使表面疏水性(H0)增加。与对照组相比,在SPI中添加β-葡聚糖不会影响SPI(无论7S组分还是11S组分)的热变性,但会使蛋白质的H0由81.97降低至71.83(表1)。这很可能是由于β-葡聚糖与蛋白质间的相分离引起蛋白质通过疏水相互作用发生聚集,这会导致H0的降低[15]。此外,SPI/β-葡聚糖混合物H0的降低也可能是由于多糖屏蔽了蛋白质表面的疏水区造成的。
2.2 SPI/β-葡聚糖酸致混合凝胶的形成过程及凝胶时间
图1为SPI/β-葡聚糖酸致混合凝胶曲线。由图1可以看出,乳酸菌发酵产酸使pH下降,最终达到蛋白质的等电点4.5左右。SPI/β-葡聚糖和对照组SPI(数据未给出)酸化过程中pH下降趋势是相似的,发酵过程中pH的变化不受β-葡聚糖的影响,只与乳酸菌种类和发酵条件有关[7]。酸化过程中,G′和G″增加,tanδ降低,最终到达一个恒定值。这表明随着体系pH值逐渐下降至蛋白质等电点,蛋白分子间和分子内结构发生重排,结合逐渐加剧,最终形成一个稳定的凝胶结构[16]。
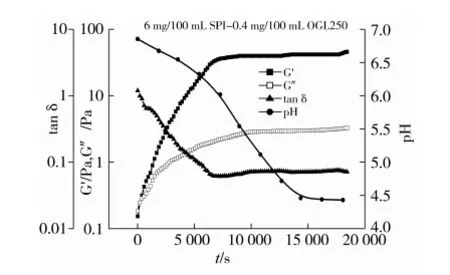
图1 SPI/β-葡聚糖酸致混合凝胶曲线
表2 SPI/β-葡聚糖酸致混合凝胶的凝胶时间tgel/h
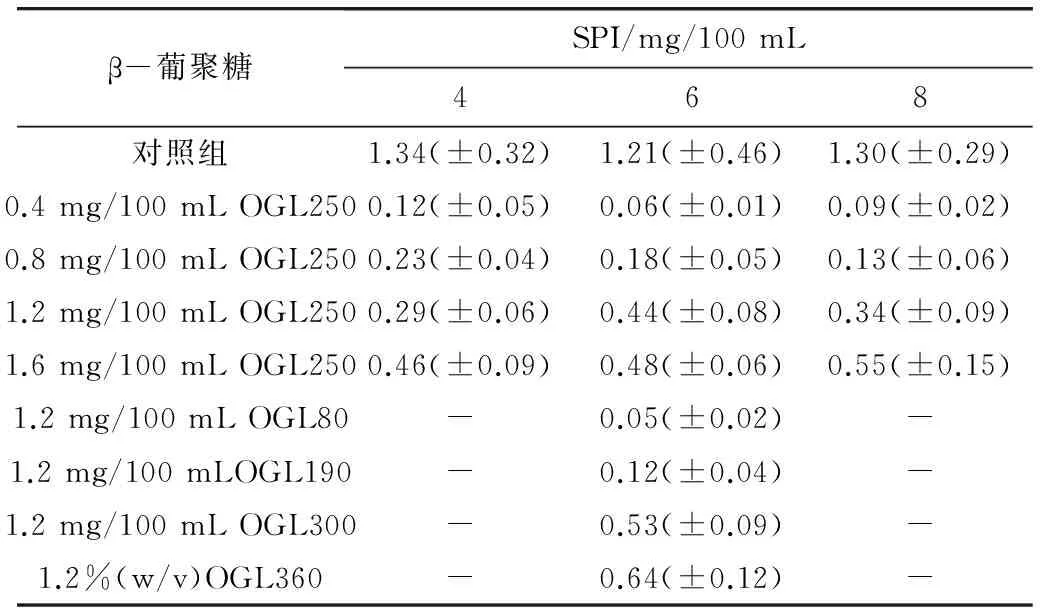
β-葡聚糖SPI/mg/100mL468对照组1.34(±0.32)1.21(±0.46)1.30(±0.29)0.4mg/100mLOGL2500.12(±0.05)0.06(±0.01)0.09(±0.02)0.8mg/100mLOGL2500.23(±0.04)0.18(±0.05)0.13(±0.06)1.2mg/100mLOGL2500.29(±0.06)0.44(±0.08)0.34(±0.09)1.6mg/100mLOGL2500.46(±0.09)0.48(±0.06)0.55(±0.15)1.2mg/100mLOGL80-0.05(±0.02)-1.2mg/100mLOGL190-0.12(±0.04)-1.2mg/100mLOGL300-0.53(±0.09)-1.2%(w/v)OGL360-0.64(±0.12)-
“-”表示未测定
表2为SPI/β-葡聚糖酸致混合凝胶的凝胶时间tgel。由表2可以看出,在SPI酸致凝胶中加入β-葡聚糖会明显缩短凝胶时间,而凝胶时间会随着β-葡聚糖浓度和分子质量的增加而延长,但都低于对照组。β-葡聚糖与大豆蛋白的不相容性可能会影响胶凝之前的聚合[17],研究表明通过增加β-葡聚糖的量来增加胶凝时间(表2),从而使蛋白聚合物在凝胶点后发生重排。
2.3 β-葡聚糖浓度对SPI酸致凝胶流变性的影响
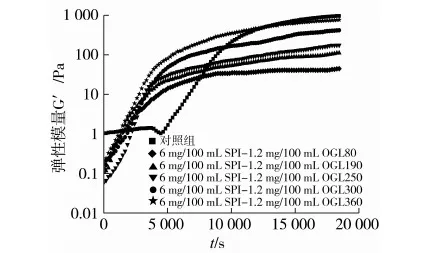
图2为6 mg/100 mL SPI与不同浓度β-葡聚糖(OGL190)酸致混合凝胶弹性模量G′随时间的变化。由图2可以看出,对照组SPI体系的起始G′为1 Pa左右,而混合体系的起始G′为0.01~0.1 Pa之间,均低于对照组,且G′ 图2 SPI与不同浓度β-葡聚糖酸致混合凝胶弹性模量G′随时间的变化 图3为SPI与不同浓度β-葡聚糖(OGL190)酸致混合凝胶发酵终点的弹性模量G′。由图3可以看出,在SPI酸致凝胶中添加一定浓度的β-葡聚糖主要降低了混合体系的凝胶强度(G′),甚至降到10 Pa以下不能形成凝胶。随着β-葡聚糖浓度的增加(0.4~1.6 mg/100 mL),混合凝胶的强度(G′)呈先降低后增加的趋势(4 mg/100 mL SPI)或稍有起伏(6、8 mg/100 mL SPI)。β-葡聚糖虽然会削弱SPI的凝胶强度,但随着β-葡聚糖浓度的增加,多糖分子填充到网络结构中,增加了大豆蛋白的有效浓度,使凝胶的弹性和强度又稍有回升[19]。此外,低浓度SPI不如高浓度SPI酸致凝胶网络结构紧密,更易受到β-葡聚糖的影响。 注:横坐标1~3分别表示4、6、8 mg/100 mL SPI。下同。 图3 SPI与不同浓度β-葡聚糖酸致混合凝胶发酵终点的弹性模量G′ 图4为6 mg/100 mL SPI与不同分子质量β-葡聚糖酸致混合凝胶弹性模量G′随时间的变化。与图2的结果相似,在SPI酸致凝胶中加入不同分子质量的β-葡聚糖会降低混合体系的凝胶起点(图4),同时也会缩短凝胶时间(表2)。结合图2可知,无论多糖浓度高低、分子质量大小,β-葡聚糖都会降低SPI酸致凝胶的起点,并缩短凝胶时间。 图4 SPI与不同分子质量β-葡聚糖酸致混合凝胶弹性模量G′随时间的变化 图5为SPI与不同分子质量β-葡聚糖酸致混合凝胶发酵终点的弹性模量G′。由图5可以看出,在SPI(4、6、8 mg/100 mL)中加入β-葡聚糖会降低凝胶强度,随着β-葡聚糖分子质量的增加(OGL80~OGL360),混合体系的凝胶强度(G′)呈增加趋势,但都低于各自的对照组,只有4 mg/100 mL SPI-OGL360混合凝胶的强度(G′)高于对照组。这表明高分子质量的β-葡聚糖能够降低或者消除其对SPI酸致混合凝胶的弱化作用,甚至会改善SPI酸致混合凝胶网络结构,提高凝胶强度。高分子质量β-葡聚糖能够增加体系黏度,从而固定住蛋白胶粒,减少由于排斥絮凝引起的体系分层现象,保持体系稳定[20]。虽然提高β-葡聚糖分子质量能够改善凝胶强度,但在一定程度上仍然会影响大豆蛋白凝胶的形成,即延长凝胶时间(表2)。这表明黏性多糖对蛋白胶粒的固定作用,阻碍了排斥絮凝现象的发生,却延缓了大豆蛋白凝胶的形成。 图5 SPI与不同分子质量β-葡聚糖酸致混合凝胶发酵终点的弹性模量G′ 将不同分子质量(OGL80~OGL360)的燕麦β-葡聚糖以0.4~1.6 mg/100 mL加入到SPI酸致凝胶中(蛋白浓度4、6、8 mg/100 mL),探讨β-葡聚糖浓度和分子质量对SPI酸致混合凝胶流变性的影响。结果表明:在SPI中添加β-葡聚糖不会改变大豆蛋白的变性温度,但会降低蛋白质的表面疏水性。一定浓度β-葡聚糖会降低SPI酸致凝胶的起点,同时会产生排斥絮凝作用,并且吸附大豆蛋白微粒,使蛋白网络结构的连续性被打破,从而削弱凝胶强度,但却能使蛋白更快的形成凝胶。而高分子质量β-葡聚糖能增加体系黏度,固定住蛋白胶粒,减少由于排斥絮凝引起的体系分层现象并保持体系稳定,从而降低或消除β-葡聚糖对SPI酸致混合凝胶的弱化作用,甚至会改善混合体系凝胶强度,但在一定程度上会延长凝胶形成时间。 [1]Scilingo A A, Anon M C. Characterization of soybean protein isolates. The effect of calcium presence[J]. Journal of the American Oil Chemists Society, 2004, 81: 63-69 [2]Renkema J M S, van Vliet T. Heat-induced gel formation by soy proteins at neutral pH[J]. Journal of Agricultural and Food Chemistry, 2002, 50: 1569-1573 [3]汪海波, 徐群英, 刘大川,等. 燕麦β-葡聚糖的流变学特性研究[J]. 农业工程学报, 2008, 24(5): 31-36 Wang Haibo, Xu Qunying, Liu Dachuan, et al. Rheological properties of β-glucans from oats[J]. Transactions of the CSAE, 2008, 24(5): 31-36 [4]Lawlor Susan. Beta-glucans: Discovering one of nature's healthiest assets[J]. Food Science and Technology, 2006, 20(3): 40-42 [5]Tolstoguzov V B. Phase behaviour in mixed polysaccharide systems[J]. Food Polysaccharides, 2006, 17: 587-625 [6]Lazaridou A, Biliaderis C G. Concurrent phase separation and gelation in mixed oat β-glucans/sodium caseinate and oat β-glucans/pullulan aqueous dispersions[J]. Food Hydrocolloids, 2009, 23: 886-895 [7]赵城彬, 吴非. 燕麦β-葡聚糖对大豆分离蛋白酸致凝胶物理性质影响的研究[J]. 食品工业科技, 2012, 33(18): 162-166 Zhao Chengbin, Wu Fei. Effect of oat β-glucan on physical properties of soy protein isolates acid-set gels[J]. Science and Technology of Food Industry, 2012, 33(18): 162-166 [8]马国刚, 王建中. 超声波辅助提取青稞β-葡聚糖的工艺条件优化[J]. 食品科技, 2009, 34(11): 168-174 Ma Guogang, Wang Jianzhong. Optimization of ultrasonic-assisted extraction technology of β-Glucan from barleys[J]. Food Science and Technology,2009, 34(11): 168-174 [9]Vaikousi H, Biliaderis C G, Izydorczyk M S. Solution flow behavior and gelling properties of water-soluble barley (1-3, 1-4)-β-glucans varying in molecular size[J]. Journal of Cereal Science, 2004, 39: 119-137 [10]Lazaridou A, Biliaderis C G, Izydorczyk M S. Molecular size effects on rheological properties of oat β-glucans in solutions and gels[J]. Food Hydrocolloids, 2003, 17:693-712 [11]Arntfield S D, Murray E D. The influence of processing parameters on food protein functionality I. Differential scanning calorimetry as an indicator of protein denaturation[J].Canadian Institute of Food Science and Technology Journal, 1981, 14: 289-294 [12]Kato A, Nakai S. Hydrophobicity determined by a fluorescence probe methods and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta, 1980, 624: 13-20 [13]Vassilis K, Christos R, Costas G B, Stefan K. Effect of barley β-glucan concentration on the microstructural and mechanical behaviour of acid-set sodium caseinate gels[J]. Food Hydrocolloids, 2006, 20: 749-756 [14]Zhu Jianhua, Yang Xiaoquan, Ijaz Ahmad, et al. Rheological properties of κ-carrageenan and soybean glycinin mixed gels[J]. Food Research International, 2008, 41: 219-228 [15]Molina O S E, Puppo M C, Wagner J R. Relationship between structural changes and functional properties of soy protein isolates-carrageenan systems[J]. Food Hydrocolloids, 2004, 18: 1045-1053 [16]Roefs S P F M, de Groot-Mostert A E A, van Vliet T. Structure of acid casein gels. 1. Formation and model of gel network[J]. Colloids and Surfaces, 1990, 50: 161-175 [17]Lazaridou A, Vaikousi H, Biliaderis C G. Impact of mixed-linkage (1-3, 1-4) β-glucans on physical properties of acid-set skim milk gels[J]. International Dairy Journal, 2008, 18: 312-322 [18]Hemar Y, Tamehana M, Munro P A, Singh H. Viscosity, microstructure and phase behavior of aqueous mixtures of commercial milk protein products and xanthan gum[J]. Food Hydrocolloids, 2001, 15: 565-574 [19]Saskia de Jong, et al.Charge density of polysaccharide controls microstructure and large deformation properties of mixed gels [J]. Food Hydrocolloids, 2007, 21: 1172-1187 [20]Syrbe A, Bauer W J, Klostermeyer H. Polymer science concepts in dairy systems-An overview of milk protein and food hydrocolloid interaction. International Dairy Journal, 1998, 8: 179-193. Effect of β-Glucans on Rheology of Soybean Protein Isolate Acid-Set Mixed Gels Zhao Chengbin1Liu Chang2Zhang Yao1Liu Jinyang1Chen Yang1Lin Haijing1Wu Fei1 (College of Food Science, Northeast Agricultural University1, Harbin 150030)(Harbin Examing and Inspection Center for Agricultural Products Safety and Quality2, Harbin 150070) Soybean protein isolate (SPI)/β-glucans acid-set mixed gels were prepared by fermentation using lactobacillus. The effect of concentration (0.4~1.6 mg/100 mL) and molecular weight (OGL80~OGL360) of β-glucans on rheology and microstructure of SPI (4、6、8 mg/100 mL) acid-set mixed gels were researched. Results showed that additions of β-glucan into SPI have no affect on the denaturation temperatures of soybean protein, while it reduced surface hydrophobicity from 81.97 to 71.83. A certain concentration of β-glucans could reduce the starting point of SPI acid-set gel from 1 Pa to 0.01~0.1 Pa. And it even reduced the end point G′ of gel below 10 Pa, which could not form gels. However, high molecular weight β-glucans reduced stratification and keeped the system stable by increasing the viscosity of system, which reduced or eliminated the weakening effect of the β-glucans on SPI acid-set mixed gels, and even improved gel strength of mixed system. β-glucans,soybean protein isolate, mixed gels, rheology TS201.7 A 1003-0174(2016)12-0045-06 东北农业大学研究生科技创新项目(yjscx14059) 2015-05-14 赵城彬,男,1987年出生,博士,粮食油脂及植物蛋白工程 吴非,女,1968年出生,教授,大豆产品精深加工

2.4 β-葡聚糖分子质量对SPI酸致混合凝胶流变性的影响

3 结论
