miRNA-29c在大鼠脑缺血再灌注神经损伤中的保护作用与机制
2016-12-26陈建珍张立光
叶 蓓,李 曼,程 翔,陈建珍,贺 芳,张立光
(1.苏州卫生职业技术学院,江苏 苏州 215009;2.山东大学齐鲁医院,济南 250012)
研究报告
miRNA-29c在大鼠脑缺血再灌注神经损伤中的保护作用与机制
叶 蓓1,李 曼2,程 翔1,陈建珍1,贺 芳1,张立光1
(1.苏州卫生职业技术学院,江苏 苏州 215009;2.山东大学齐鲁医院,济南 250012)
目的探讨miRNA-29c在大鼠脑缺血再灌注神经损伤中的保护作用与机制研究。方法48只雄性SD大鼠随机分为假手术组,模型组,miR-29c NC组,miR-29c inhibitor组,除假手术组外,其余三组均采用拴线法建立大鼠大脑中动脉局灶缺血再灌注损伤模型,并于术后24 h评价大鼠神经行为变化,检测大鼠脑梗死体积,缺血侧脑组织细胞凋亡情况,脑组织中miR-29c表达量,超氧化物岐化酶(SOD)活性,丙二醛(MDA)含量,含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase 3),Caspase 8及Caspase 9活性,及Bcl-2,Bax,Bak1,cleaved caspase 3,cleaved caspase 8与cleaved caspase 9蛋白表达。结果与假手术组比较,模型组,miR-29c NC组中miR-29c表达量显著提高,大鼠神经行为评分提高,脑梗死体积增加,细胞凋亡率提高,SOD活性降低,MDA含量,Caspase 3,Caspase 8及Caspase 9活性上升,Bcl-2表达量下调,Bax,Bak1,cleaved caspase 3,cleaved caspase 8及cleaved caspase 9表达量上调,差异均具有统计学意义(P<0.01)。与模型组及miR-29c NC组比较,miR-29c inhibitor组miR-29c表达量显著降低,大鼠神经行为评分降低,脑梗死体积百分比减少,细胞凋亡率降低,SOD活性上升,MDA含量,Caspase 3,Caspase 8及Caspase 9活性降低,Bcl-2表达量上调,Bax,Bak1,cleaved caspase 3,cleaved caspase 8及cleaved caspase 9表达量下调,差异均具有统计学意义(P<0.01)。结论miR-29c对大鼠脑缺血再灌注神经损伤具有保护作用,与提高抗氧化能力及调控细胞凋亡相关蛋白表达有关。
miR-29c;脑缺血再灌注;细胞凋亡
缺血性脑血管病的发病率,致残率及死亡率皆相当之高,且发病机制复杂。其可分为局灶性脑缺血及全脑缺血,前者指脑血管局部区域血流减少或被阻断,后者是指在临床上肺栓塞,休克,窒息所导致的。在缺血过程中,当血液恢复灌流后,会启动一系列内源性的损伤,加重脑缺血的损伤,而这一过程称之为脑缺血再灌注损伤[1-2]。这一损伤过程涉及脑血管微环境及神经细胞释放大量氧自由基等有害因子,损害细胞生物膜结构,损伤细胞线粒体功能,最终导致细胞凋亡。因此,通过清除氧自由基产物,抑制细胞凋亡将对于脑缺血再灌注损伤后神经细胞的保护具有重要作用[2-3]。
miRNAs是一类长度约为18-25 nt高度保守的小RNA,能结合于其靶基因3’-UTR区域,进而抑制靶基因的翻译,从而参与细胞生长,增值,分化与凋亡的调控。以往对于miRNA的研究主要集中于肿瘤的发生及免疫疾病中,近些年也陆续有研究发现miRNA与缺血性脑血管病关系密切。如Jeyaseelan等[4]研究显示在大鼠局灶性大脑中动脉栓塞(MCAO)模型中,发现有106个miRNA异常表达。另外Dharap等[5]研究也表明MCAO大鼠中miRNA在各个检测点中异常表达。上述研究报道均说明miRNA与脑缺血再灌注损伤密切相关,但涉及的具体调控机制尚不明确。此外miR-29c是一个与胚胎神经系统的发育生长密切相关的miRNA[6]。Huang等[7]研究发现降低miR-29c的表达,能显著的抑制MCAO大鼠的脑梗死体积及细胞凋亡,但是其具体作用机制未知。所以本研究将以miR-29c为研究对象,探讨miR-29c在大鼠MCAO中的神经保护作用及相关机制。
1 材料和方法
1.1 动物
48只雄性SD大鼠实验动物由山东大学实验动物中心提供【SCXK(鲁)2009-0001】,清洁级,(200±20)g,室内温度控制在(23±2)℃,大鼠自由饮食和摄水。实验所在实验室:山东大学齐鲁医院临床基础研究所【SYXK(鲁)2010-0038】。
1.2 主要试剂及仪器
BCA法蛋白定量试剂盒,Annexin V-FITC细胞凋亡检测试剂盒,小鼠抗GAPDH单克隆抗体购自碧云天生物技术研究所;兔抗Bcl-2,Bax,Bak1,多克隆抗体购自美国Abcam公司;Caspase 3,Caspase 8,Caspase 9活性检测试剂盒购自南京凯基生物技科技发展有限公司;SOD活力,MDA含量试剂盒购自南京建成生物技术有限公司;miR-29c inhibitor(UAACCGATTTCAAAUGGUGCUA)及miR-29c NC(CAGTACUUUUGUGUAGUACAAA),购自上海吉玛生物技术有限公司。电泳仪,转印电泳仪,凝胶成像系统购自美国Bio-Rad公司;酶标仪购自瑞士瑞士TECAN集团公司;流式细胞仪购自美国BD公司。
1.3 分组及给药[7]
将48只大鼠分为假手术组,模型组,miR-29c NC组,miR-21 inhibitor组。将miR-29c inhibitor及miR-29c NC溶解于人工脑脊液中,浓度为20 μmol/L,进行侧脑室注射,注射速度为1 μL/min,总共5 μL。而假手术组及模型组用同样方式给予人工脑脊液,给药24 h后除假手术组外其余三组皆进行造模。1.4 造模[8-9]
参相关文献将制成大脑中动脉阻塞(MCAO)模型,10%水合氯醛麻醉大鼠,使大鼠处于仰卧位,并正中切开大鼠颈部的皮肤,钝性的将两侧肌肉分离,并进一步分离出右颈总动脉(CCA),右颈内动脉(ICA)及右颈外动脉(ECA),备线并结扎ECA及CCA,并用动脉夹夹住ICA远端,同时在ECA近CCA处作一小切口,松开ICA的动脉夹,并将钝性的尼龙线缓慢插入ECA,插入深度约为18 mm,实现大脑中动脉阻塞导致脑缺血,最后消毒并缝合皮肤,另外外留尼龙线线头约1 cm。缺血2 h后,将尼龙线轻提,使线头略有阻力,血流再通,以实现再灌注22 h。假手术组仅仅分离ECA,CCA及ICA,但不结扎CCA。
1.5 神经行为学评分[1]
于术后24 h,参考Zea Longa的5分制评分标准对各组大鼠进行神经功能评分。0分:没有出现神经损伤症状;1分:左侧前爪不能完全伸展;2分:向左侧转圈行走;3分:行走时向左侧倾倒;4分:不能够自发行走,同时意识丧失。
1.6 梗死体积测定
于术后24,将各组大鼠麻醉,并迅速断头取脑,将脑组织周围小脑,嗅球等去除。对全脑进行切片,厚度约2 mm,立即浸入2%氯化三苯基四氮唑(TCC),置于37℃温箱中避光染色30 min,染成红色的是正常的脑组织,染成白色的梗死的脑组织。最后在10%甲醛中固定,并拍照。用Image-Pro Plus 6.0软件进行分析计算脑梗死体积,并乘以脑片厚度2 mm,累计每只大鼠所有脑切片的脑梗死容积即得全脑梗死容积,并计算脑梗死体积百分比(brain infarct volume percentage,BIVP)。
1.7 RT-PCR检测miR-29c表达
采用Trizol法抽提细胞总RNA,接着一步法RT-PCR逆转录,逆转录产物用于琼脂糖凝胶电泳。引物由上海生工生物工程有限公司合成,如下:miR-29c 5’-UAGCACCAUUUGAAAUGGUUA-3’。反转录体系为:总RNA模板2 μL(1 μg)、dNTP混合物2 μL、MgCl22 μL、加EDPC补充蒸馏水至25 μL。反应参数为:95℃预变性 5 min, 95℃变性30 s,58℃退火30 s,72℃延伸30 s,循环次数为40。
1.8 SOD活性及MDA含量的检测
取缺血侧大脑组织进行匀浆,按照SOD活力,MDA含量试剂盒说明书进行检测。
1.9 流式细胞术检测缺血侧脑细胞凋亡情况
取缺血侧大脑组织进行匀浆,并用胰酶和胶原酶进行消化,获得细胞悬液后,按照Annexin V-FITC流式细胞检测试剂盒进行检测,在1 h内进行流式细胞仪检测。
1.10 Caspase 3,Caspase 8,Caspase 9活性的检测
取缺血侧大脑组织进行匀浆,按照Caspase 3,Caspase 8,Caspase 9活性试剂盒说明书进行检测。
1.11 caspase 3, cleaved caspase 8,cleaved caspase 9,Bak1,Bax及Bcl-2蛋白的检测
采用Western blot技术进行检测。取缺血侧大脑组织进行匀浆,并加入RIPA强裂解液,裂解,离心,收获蛋白。采用BCA试剂盒检测蛋白浓度。蛋白变性,上样,进行十二烷基磺酸钠凝胶电泳,湿法转膜。一抗孵育,4℃过夜;二抗室温孵育1-2 h。在凝胶成像系统中曝光。用“Quantity one”软件分析各抗体条带灰度值。
1.12 数据分析
2 结果
2.1 miR-29c inhibitor对MCAO大鼠脑组织中miR-29c表达量的影响
如图1所示,与假手术组比较,模型组及miR-29c NC组大鼠脑组织中miR-29c表达量显著提高,差异具有统计学意义(P<0.01);与模型组及miR-29c NC组比较,miR-29c inhibitor组大鼠脑组织中miR-29c表达量显著降低,差异具有统计学意义(P<0.01)。
2.2 miR-29c inhibitor对MCAO大鼠神经行为评分的影响
如表1所示,与假手术组比较,模型组及miR-29c NC组大鼠神经行为评分均显著提高,差异具有统计学意义(P<0.01);与模型组及miR-29c NC组比较,miR-29c inhibitor组大鼠神经行为评分显著降低,差异具有统计学意义(P<0.01)。
2.3 miR-29c inhibitor对MCAO大鼠脑梗死体积的影响
如表1所示,与假手术组比较,模型组及miR-29c NC组大鼠脑梗死体积百分比均显著增加,差异具有统计学意义(P<0.01);与模型组及miR-29c NC组比较,miR-29c inhibitor组大鼠脑梗死体积百分比显著减少,差异具有统计学意义(P<0.01)。

注:A:假手术组;B:模型组;C:miR-29c NC组;D:miR-29c inhibitor组。与假手术组比较,**P<0.01;与模型组及miR-29c NC组比较,##P<0.01。
2.4 miR-29c inhibitor对MCAO大鼠脑组织中SOD活性,MDA含量的影响
如表2所示,与假手术组比较,模型组及miR-29c NC组脑组织中SOD活力降低,MDA含量提高,差异具有统计学意义(P<0.01);与模型组及miR-29c NC组比较,miR-29c inhibitor组脑组织中SOD活性提高,MDA含量降低,差异具有统计学意义(P<0.01)。
2.5 miR-29c inhibitor对MCAO大鼠脑缺血侧细胞凋亡的影响
流式细胞仪结果显示(见图2),假手术组细胞凋亡率为1.95±1.12,模型组及miR-29c NC组细胞凋亡率显著提高,分别为9.25±0.83、8.95±0.72,与假手术组相比,差异具有统计学意义(P<0.01);miR-29c inhibitor组细胞凋亡率为5.42±0.49,与模型组及miR-29c NC组比较,显著降低,差异具有统计学意义(P<0.01)。
2.6 miR-29c inhibitor对MCAO大鼠脑组织中Caspase 3,Caspase 8及Caspase 9活性的影响
如表3所示,与假手术组比较,模型组及miR-29c NC组脑组织中Caspase 3,Caspase 8及Caspase 9活性提高,差异具有统计学意义(P<0.01);与模型组及miR-29c NC组比较,miR-29c inhibitor组脑组织中Caspase 3,Caspase 8及Caspase 9活性降低,差异具有统计学意义(P<0.01)。

注:A:假手术组;B:模型组;C:miR-29c NC组;D:miR-29c inhibitor组。
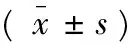
表1 miR-29c inhibitor对MCAO大鼠神经行为评分及脑梗死体积的影响Tab.1 Effect of miR-29c inhibitor on neurological behavior score and brain infarct volume percentage in MCAO rats
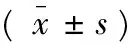
表2 miR-29c inhibitor对MCAO大鼠脑组织中SOD活性,MDA含量的影响Tab.2 Effect of miR-29c inhibitor on activity of SOD and level of MDA in MCAO rasts
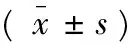
表3 miR-29c inhibitor对MCAO大鼠脑组织中Caspase 3,Caspase 8及Caspase 9活性的影响Tab.3 Effect of miR-29c inhibitor on activity of Caspase 3, Caspase 8 and Caspase 9 in MCAO rats brain tissue
2.7 miR-29c inhibitor对MCAO大鼠脑组织中cleaved caspase 3,cleaved caspase 8及cleaved caspase 9蛋白表达的影响
如图3所示,与假手术组比较,模型组及miR-29c NC组脑组织中cleaved caspase 3,cleaved caspase 8及cleaved caspase 9蛋白表达量显著提高,差异具有统计学意义(P<0.01);与模型组及miR-29c NC组比较,miR-29c inhibitor组脑组织中cleaved caspase 3,cleaved caspase 8及cleaved caspase 9蛋白表达量降低,差异具有统计学意义(P<0.01)。

注:A:假手术组;B:模型组;C:miR-29c NC组;D:miR-29c inhibitor组。与假手术组比较,**P<0.01;与模型组及miR-29c NC组比较,##P<0.01
2.8 miR-29c inhibitor对MCAO大鼠脑组织中Bak1,Bax及Bcl-2蛋白表达的影响
如图4所示,与假手术组比较,模型组及miR-29c NC组脑组织中Bak1,Bax表达量显著提高,Bcl-2表达量显著降低,差异具有统计学意义(P<0.01);与模型组及miR-29c NC组比较,miR-29c inhibitor组脑组织中Bak1,Bax表达量显著降低,Bcl-2表达量显著提高,差异具有统计学意义(P<0.01)。
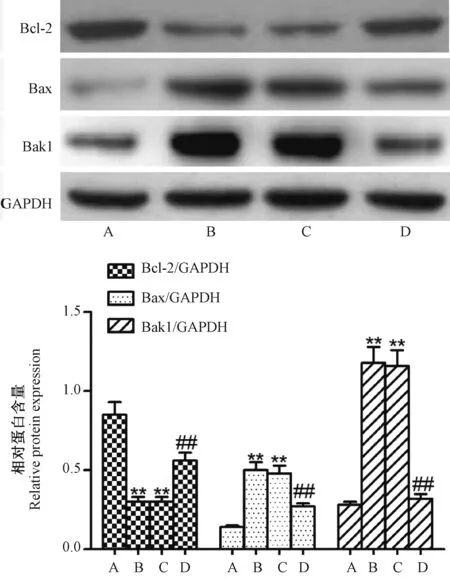
注:A:假手术组;B:模型组;C:miR-29c NC组;D:miR-29c inhibitor组。与假手术组比较,**P<0.01;与模型组及miR-29c NC组比较,##P<0.01。
3 讨论
脑缺血后再恢复血供的过程中,脑血管微环境中会产生大量的损害因子,如氧自由基,这些氧自由基会损伤脑组织细胞生物膜结构,损伤线粒体DNA,损害细胞核DNA,使细胞内蛋白质及DNA大分子断裂,从而诱发神经细胞启动凋亡程序。所以发现一种有效的清除清除氧自由基,进而抵抗细胞损伤的物质将对脑缺血再灌注损伤后的神经保护具有重要作用[2-3]。
miR-29c是miR-29家族的一员,是Lagos-Quintina等在2003年研究神经细胞核糖核蛋白中发现的,并克隆获得的miRNA。miR-29c位于人类1号染色体,在大鼠胚胎及出生时尚未见表达,在出生2周后表达增高,说明该miRNA在神经细胞中的特异性存在与表达, 并与胚胎神经的发育,生长,分化密切相关[6]。另外Shen等[10]研究显示miR-29a,miR-29b及miR-29c在缺血再灌注损伤中异常表达,表达量差异最大的miRNA是miR-29c。Huang等[7]研究进一步表明往MCAO大鼠脑侧左室注射miR-29c inhibitor或者miR-29c mimics,前者能够降低脑梗死体积及细胞凋亡率,后者加重了脑缺血再灌注损伤。从而说明miR-29c与脑缺血再灌注损伤的关系密切。
本研究首先建立大鼠MCAO模型,并侧脑室注射miR-29c inhibitor进行干预,接着于术后24 h检测各组大鼠神经学行为评分,脑梗死体积及缺血侧脑组织细胞凋亡情况,结果表明miR-29c inhibitor能显著降低大鼠神经学行为评分,减小脑梗死体积,并抑制细胞凋亡,与Huang等[7]研究结果一致。同时MDA是细胞膜脂质被活性氧氧化后的副产物,是细胞遭受氧化应激损伤的生物标志物。SOD是细胞内主要的抗氧化酶,是清除氧自由基的主要物质,能抵抗氧自由基对细胞的损伤。所以本研究继续探讨miR-29c对MCAO大鼠脑组织中MDA含量及SOD活性的影响,结果表明miR-29c inhibitor能显著的提高SOD活性,降低MDA含量,从而说明miR-29c inhibitor能清除脑缺血再灌注损伤所产生的氧化应激产物,并提高抗氧化酶活性。
脑神经细胞的凋亡是细胞主动有序的自然死亡形式,其发生可能与组织中抗凋亡和促凋亡基因的表达失衡有关。其中Bcl-2家族是目前研究最为广泛的凋亡调控基因家族,Bcl-2是最常见的抑制凋亡基因,能与促凋亡基因Bax形成异源二聚体,或者Bax自身能形成二聚体,从而调控细胞的凋亡。而Bak1也是Bcl-2家族促凋亡蛋白的一员,能与Bax形成复合物,从而维持线粒体膜的稳定性,当上游凋亡信号传递下来后,Bak1能够介导线粒体膜孔开放,使得线粒体中的细胞色素C释放,并诱导Caspase信号级联反应,最终使得细胞凋亡。Caspase正常情况下以无活性酶原形式存在于细胞内,激活主要通过以下2条信号通路[11-13]:(1)内源性途径:细胞色素C从线粒体释放到胞质后与dATP、凋亡蛋白酶激活因子(Apaf-1)结合成复合物,激活caspase 9,从而激活caspase 3;(2)外源性途径:Fas膜受体系统激活caspase 8,从而直接激活caspase 3,这条途径绕过了线粒体。当受到上游凋亡信号刺激时,Caspase的起始因子caspase 8及caspase 9被其它激酶所剪切或者自身发生切割作用后被激活,从而传递凋亡级联信号,最终传递到caspase家族的执行因子caspase 3,最终导致细胞凋亡[11-13]。此外Huang等[7]研究证实Bak1是miR-29c的下游靶蛋白之一。Tiao等[14]研究表明miR-29c能通过下调Bax表达,上调Bcl-2表达,从而抑制阻塞性黄恒导致的肝细胞凋亡。Wang等[15]研究表明miR-29 inhibitor通过抑制Caspase 3表达,从而减轻长时间低温循环导致的脑神经损伤。所以本研究继续探讨miR-29c对MCAO大鼠脑组织中caspase 3,caspase 8,caspase 9活性,cleaved caspase 3,cleaved caspase 8、cleaved caspase 9及Bax,Bcl-2、Bak1蛋白的表达,结果表明miR-29c inhibitor能显著的上调Bcl-2表达,并降低cleaved caspase 3,cleaved caspase 8及cleaved caspase 9蛋白的表达,说明miR-29c inhibitor能通过调控细胞凋亡相关蛋白表达,同时抑制细胞内源和外源促凋亡通路共同抑制caspase 3的激活,从而抑制脑缺血再灌注损伤所导致的脑细胞凋亡。
[1] 闵昱源,冯彩华,高子军,等.梓醇对大鼠脑缺血再灌注损伤的保护作用研究[J].现代生物医学进展,2012,12(20):3805-3808.
[2] 王富明,徐虹,孙华.脑缺血再灌注损伤治疗的实验研究进展[J].医学研究杂志,2015(02):12-15.
[3] 王光胜,耿德勤.脑缺血/再灌注损伤机制研究进展[J].医学综述,2011(24):3753-3756.
[4] Jeyaseelan K, Lim KY, Armugam A. MicroRNA expression in the blood and brain of rats subjected to transient focal ischemia by middle cerebral artery occlusion [J]. Stroke, 2008, 39(3): 959-966.
[5] Dharap A, Bowen K, Place R,etal. Transient focal ischemia induces extensive temporal changes in rat cerebral microRNAome [J]. J Cereb Blood Flow Metab, 2009, 29(4): 675-687.
[6] 黄昌发,刘小珊.微RNA miR-29与人类疾病[J].生命的化学,2010,30(2):250-255.
[7] Huang LG, Li JP, Pang XM,etal. MicroRNA-29c Correlates with Neuroprotection Induced by FNS by Targeting Both Birc2 and Bak1 in Rat Brain after Stroke [J]. CNS Neurosci Ther, 2015, 21(6): 496-503.
[8] 王荣亮,赵海苹,罗玫,等.远程缺血后适应对大鼠脑缺血再灌注损伤后MIP-1α表达的影响[J].中国比较医学杂志,2013,23(8):24-29.
[9] 曾兆禄,韩继超,薛云,等.针刺结合丹红注射液对大鼠脑缺血再灌注损伤的保护作用[J].中国比较医学杂志,2016,26(2):62-66.
[10] Shen B, Zhou S, He Y,etal. Revealing the underlying mechanism of ischemia reperfusion injury using bioinformatics approach [J]. Kidney Blood Press Res, 2013, 38(1): 99-108.
[11] 刘晓婷,王延让,张明.线粒体介导细胞凋亡的研究进展[J].环境与健康杂志,2013,30(2):182-185.
[12] 王力俭,田可川,吴伟伟,等.细胞凋亡信号传导通路的研究进展[J].中国畜牧兽医,2011,38(10):132-135.
[13] 梁凯,曹秉振.线粒体调控的细胞凋亡研究进展[J].生物医学工程与临床,2014,18(5):501-505.
[14] Tiao MM, Wang FS, Huang LT,etal. MicroRNA-29a protects against acute liver injury in a mouse model of obstructive jaundice via inhibition of the extrinsic apoptosis pathway [J]. Apoptosis, 2014, 19(1): 30-41.
[15] Wang Y, Gu T, Shi E,etal. Inhibition of microRNA-29c protects the brain in a rat model of prolonged hypothermic circulatory arrest [J]. J Thorac Cardiovasc Surg, 2015, 150(3): 675-684.
The mechanism and protective effect of miR-29c on cerebral ischemia-reperfusion injury in rats
YE Bei1,LI Man2,CHEN Jian-zhen1,HE Fang1,ZHANG Liguang1
(1.Suzhou Health College of Jiangsu, Jiangsu Soochow 215009, China;2.Qilu Hospital of Shandong University, Jinan 250012, China)
Obejective To explore protective effect of miR-29c on cerebral ischemia-reperfusion injury in rats. Methods Forty eight SD rats were randomly divided into sham group, model group, miR-29c NC group and miR-29c inhibitor group. Except the sham operation group, the other three groups were established by using ligation of middle cerebral artery. Twenty four hours after the operation, neurological behavior score, cerebral infarction volume, cell apoptosis, the activity of superoxide dismutase (SOD), the content of malondialdehyde (MDA), cysteine aspartic acid protease 3 (caspase 3), caspase 8, caspase 9, and the expression of miR-29c, Bcl-2, Bax, Bak1, cleaved caspase 3, cleaved caspase 8 and cleaved caspase 9. Results Compared with sham group, neurological behavior score, cerebral infarction volume, cell apoptosis rate was increased, SOD th the expression of miR-29c, activity was decreased, the level of MDA, caspase 3, caspase 8 and caspase 9 activity was increased. The expression of Bcl-2 was down-regulated, the expression of Bax, Bak1, cleaved caspase 3, cleaved caspase 8 and cleaved caspase 9 expression was up-regulated in model group, miR-29c NC group. The differences were also statistically significant (P<0.01). Compared with model group, miR-29c NC group, the expression of miR-29c, neurological behavior score, cerebral infarction volume percentage, cell apoptosis rate was decreased, SOD activity was increased, the level of MDA, caspase 3, caspase 8 and caspase 9 activity was decreased. The expression of Bcl-2 was up-regulated, the expression of Bax, Bak1, cleaved caspase 3, cleaved caspase 8 and cleaved caspase 9 expression was down-regulated in miR-29c inhibitor group. The differences were also statistically significant (P<0.01).Conclusion miR-29c had a protective effect on cerebral ischemia-reperfusion injury in rats, which was related to improve the antioxidant capacity and regulation of apoptosis related protein expression.
miR-29c; cerebral ischemia-reperfusion; cell apoptosis
叶蓓(1979-),女,生理学硕士,讲师。研究方向:哺乳动物中枢神经系统损伤的分子机制及保护作用。E-mail: 150795306@qq.com。
R-332
A
1671-7856(2016)11-0031-07
10.3969.j.issn.1671-7856. 2016.11.006
2016-07-12
