MR对颅内血管外皮细胞瘤的诊断价值
2016-12-26吴海陈延帆许加峻何晓华张淑平池新乐
吴海 陈延帆 许加峻 何晓华 张淑平 池新乐
MR对颅内血管外皮细胞瘤的诊断价值
吴海 陈延帆 许加峻 何晓华 张淑平 池新乐
颅内血管外皮细胞瘤(hemangiopericytoma,HPC)是一种少见的颅内脑外肿瘤,2007年WHO中枢神经系统肿瘤分类中划分为间叶起源的脑膜肿瘤,WHO分级为Ⅱ~Ⅲ级[1]。颅内HPC发病率较低,占颅内原发肿瘤的1%[2]。临床医师对颅内HPC认识不足,易误诊为脑膜瘤;但是颅内HPC血管丰富,术中出血较多,术后易复发或向颅外转移[3],这些特点与脑膜瘤不同。笔者认为术前MR能较好显示肿瘤的特征性表现及范围,帮助临床医师作出正确诊断,以评估手术风险、制定手术方案以及术后综合治疗方法。现将MR对颅内HPC的诊断价值报道如下。
1 资料和方法
1.1 一般资料 收集2009年8月至2015年9月经手术病理证实的6例颅内HPC患者的临床资料,其中男、女各3例,年龄21~62岁,平均(38.3±15.1)岁。主要临床症状有头痛、肢体乏力、颅内高压症状、恶心呕吐、耳鸣、视力下降等,病程3个月~4年。术前MR诊断发现4例,原被误诊为胶质瘤、脑膜瘤或神经源性肿瘤;常规体检发现1例。
1.2 MR检查 采用Symphony 1.5T超导磁共振扫描仪(德国西门子公司生产)对6例患者进行常规平扫及增强后扫描,采用头颅相控阵线圈采集信号,检查序列主要包括:(1)快速自选回波(turbo spin echo,TSE)T2WI序列:TR 3 030ms,TE 92ms;(2)自选回波(spin echo,SE)T1WI序列:TR 310ms,TE 8.7ms;(3)液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列:TR 7 000ms,TE 89ms,TI 2 500ms;(4)弥散加权序列(diffusion weighted imaging,DWI):TR 3 000ms,TE 105ms,b值为0、500和1 000。各序列的层厚7mm,层间距2.1mm,FOV 240mm×180mm,激励2次。增强采用SE T1WI序列:轴位TR 310ms,TE 8.7ms,层厚7mm,间距2.1mm;冠状位及矢状位TR 550ms,TE 11ms,层厚5.5mm,层间距1.6mm,FOV 240mm×192mm。使用双筒高压注射器(德国Ulrich公司生产),经肘静脉团注对比剂马根维显(拜尔医疗保健有限公司生产),规格为469.01mg/ml×15ml,剂量0.2ml/kg,速率2ml/s。所有MR图像由2位高年资医师分别阅片,最后统一诊断意见。
2 结果
2.1 HPC位置 6例颅内HPC患者均是位于颅内脑外的单个病灶,其中4例位于天幕上(前颅窝底跨大脑镰生长1例,左侧额顶部大脑镰旁1例,右侧颞部大脑凸面1例,左侧枕部紧贴天幕1例),1例位于天幕下右侧小脑凸面,1例自右侧桥小脑角区骑跨天幕向外侧裂区呈哑铃状生长。
2.2 MR诊断特征 6例颅内HPC病变均有明显占位效应,其中5例病灶周围有轻度水肿;5例肿瘤边缘呈分叶状或结节状改变,内部或边缘可见粗大流空血管,见图1a。最大病灶67mm×65mm×57mm,位于右侧小脑凸面,占位效应明显,右侧小脑及第四脑室受压,伴有严重的脑积水和小脑扁桃体下疝,见图1b-g;最小病灶25mm×23mm×21mm,位于右侧颞部大脑凸面,呈类圆形改变,病灶内部或边缘无流空血管。
所有病灶T2WI均呈等或稍高信号。T1WI序列中5例呈等、稍高信号,1例呈稍低信号;DWI序列中3例呈高信号或稍高信号,2例呈等信号,1例呈低信号。增强后T1WI序列中6例病灶实性部分明显强化,见图1h-j。本组中3例病灶内可见T2WI高信号、T1WI低信号囊变区,增强后无强化,见图2;其中2例病灶中央及边缘均有囊变区,1例囊变区仅位于病灶中央。4例肿瘤以窄基底与硬脑膜相邻,2例以宽基底与硬脑膜相邻;2例可见脑膜尾征,见图3。
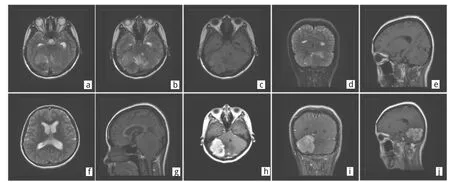
图1 1例21岁女性右侧小脑凸面HPC患者的MR表现(a:肿瘤中央及边缘可见低信号流空血管;b-e:横轴位、冠状位及矢状位,T2WI、T1WI均为稍高信号,肿瘤周围可见片状水肿;f-g:肿瘤占位效应明显,压迫小脑半球及四脑室,导致两侧脑室积水及小脑扁桃体下疝;h-j:增强后肿瘤明显强化,边缘呈结节状、分叶状改变,与天幕呈宽基底相邻)
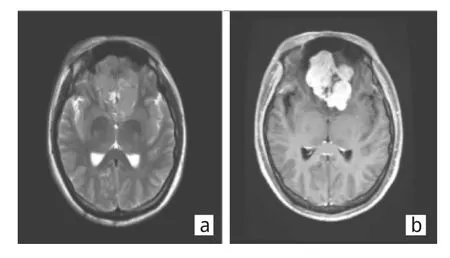
图2 1例28岁男性前颅窝底HPC患者的MR表现(a:肿瘤跨大脑镰生长,肿瘤中心可见囊变区;b:增强后肿瘤明显强化,囊变区无强化)

图3 1例62岁女性右侧大脑凸面HPC患者的MR表现(a:肿瘤明显强化与硬脑膜窄基底相邻;b:冠状位可见脑膜尾征)
3 讨论
颅内HPC以前认为是脑膜瘤的一个亚型,即血管母细胞型脑膜瘤;但后来证明并不是起源于脑膜的蛛网膜粒细胞,而是起源于脑膜间质的毛细血管外皮细胞[2],是紧贴毛细血管网状纤维断续排列的梭形细胞,具有多分化潜能。
相关文献认为HPC绝大多数位于脑外,而脑内病变较为罕见;边缘有分叶,多以窄基底与脑膜相邻,为富血供肿瘤,增强后明显强化;磁共振T2WI序列可见流空血管影;增强T1WI序列可见低信号的流空血管,硬膜尾征少见,多数囊变区位于肿瘤周边[4-10]。本组6例颅内HPC患者具有相似的MR特征:6例肿瘤均位于颅内脑实质外,边缘均呈分叶状或结节状,增强后明显强化,4例窄基底、2例宽基底与硬脑膜相邻,5例可见流空血管影,脑膜尾征2例。但是2例颅内HPC患者的肿瘤中央与边缘均有囊变区,1例囊变区仅位于中央;这与上述文献报道不完全一致,可能与颅内HPC较为罕见,研究样本较少有关。本组病例中的囊变区均远离流空血管,因此笔者认为颅内HPC虽有较多的肿瘤血供,但因其具有恶性生物学特性,肿瘤生长迅速,故在局部血供较少的区域易发生坏死、囊变。此外,本组有囊变区组患者平均年龄为(33.7±12.2)岁,无囊变组平均年龄为(43.0± 17.0)岁;笔者推测囊变、年龄可能与HPC恶性程度有关,但需要扩大样本并作相关统计分析来证实。DWI序列3例病灶呈高或稍高信号,2例呈等信号,1例呈低信号;这可能与肿瘤细胞疏密程度有关,即致密区信号相对较高[11]。颅内HPC的生长极具浸润性,因此肿瘤占位效应非常明显,易导致严重的脑疝。本组中有1例肿瘤压迫小脑半球、第四脑室,产生严重的脑积水和小脑扁桃体下疝。与脑膜瘤比较,颅内HPC出现脑膜尾征较少,可能与两者起源细胞不同、脑膜瘤的良性生长方式对硬脑膜的刺激等有关。
临床上,颅内HPC与其他颅内肿瘤的鉴别诊断十分重要。因颅内HPC与脑膜瘤的生长部位、临床病史相似,两者的鉴别诊断是一难点,具体如下:(1)颅内HPC肿瘤边缘呈结节状或分叶状;脑膜瘤通常生长缓慢,呈圆形或椭圆形。(2)颅内HPC的生长速度明显快于脑膜瘤,内部血供满足不了肿瘤生长的需要,易出现坏死、囊变;而脑膜瘤内部信号一般较为均匀。(3)颅内HPC有大量流空血管,血供较脑膜瘤丰富,增强后强化程度明显强于脑膜瘤;而脑膜瘤很少见到流空血管影。(4)颅内HPC以窄基底与硬脑膜相邻较多,出现脑膜尾征较少;脑膜瘤则反之。此外,位于脑实质边缘的转移瘤、胶质瘤亦需与颅内HPC相鉴别:前者一般位于脑内,且肿瘤周围有明显水肿;而本组5例颅内HPC的肿瘤周围轻度水肿。位于桥小脑角区的颅内HPC需与听神经鞘瘤相鉴别:前者内听道无扩大、边缘呈结节状或分叶状、内部有流空血管,均与听神经鞘瘤不同;临床症状亦有助于两者鉴别。
目前手术切除是颅内HPC的主要治疗方法。有学者报道颅内HPC全切除术后无复发率为84%,部分切除术后无复发率为38%[12]。但由于颅内HPC的侵袭性本质,对硬脑膜窦等周围重要结构的包绕,颅内HPC具有颈内外动脉双重供血、血供异常丰富,术中易发生剧烈出血等原因,常常导致肿瘤无法完全切除,故需辅以放化疗[13]。必要时,术前可以利用数字减影血管造影术对肿瘤供血血管进行栓塞,以减少术中出血量。
因此,术前作出明确的影像学诊断、揭示肿瘤与周围组织结构的关系显得尤为重要。MR能很好地显示颅内HPC的流空血管、囊变、分叶、血管丰富、窄基底与硬脑膜相邻等特征性征象,以及肿瘤与周围重要解剖结构的关系,在一定程度上提示肿瘤的恶性程度,可作为诊断颅内HPC、指导临床制定治疗方案的首选检查方法。
[1] Fuller G N,Scheithauer B W.Symposium:the 2007 revised world health organization(WHO)classification of tumors of the central nervous system:newly codified entities[J].Brain Pathol,2007,17 (3):304-307.
[2] Louis D N,Ohgaki H,Wiestler O D,et al.The 2007 WHO classification of tumors of the central nervous system[J].Acta Neuropathol,2007,114(2):97-109.
[3] 张颉,杜固宏.中枢神经系统血管外皮细胞瘤106例临床分析[J].中华神经外科杂志,2010,26(10):935-937.
[4] Wang A M,Akbar F S,Wang H C,et al.Extra-axial primary CNS neoplasms mimicking meningiomas[J].The Radiologist,2002,9 (2):91-99.
[5] 陈谦,戴建平,高培义.颅内血管外皮细胞瘤与脑膜瘤的MR影像对照研究[J].中华放射学杂志,2003,37(6):519-524.
[6] 万业达,张云亭,刘松龄.颅内血管外皮瘤的影像学诊断:9例回顾性总结[J].中国神经肿瘤杂志,2004,2(2):130-133.
[7] Wei W,Shi J X,Cheng H L,et al.Hemangiopericytomas of the centralnervous system[J].J Clin Neurosci,2009,16(4):519-523.
[8] Zhou J L,Liu J L,Zhang J,et al.Thirty-nine cases of intracranial hemangiopericytoma and anaplastic hemangiopericytoma:a retrospective review ofMRIfeatures and pathologicalfindings[J].Eur J Radiol,2012,81(11):3504-3510.
[9] Ma C,Xu F,Xiao Y D,et al.Magnetic resonance imaging of intracranial hemangiopericytoma and correlation with pathological findings[J].Oncology Lett,2014,8(5):2140-2144.
[10] 胡玉娜,李丽,杨琴,等.12例颅内血管外皮细胞瘤的影像及病理表现[J].放射学实践,2015,30(11):1094-1098.
[11] 刘梅丽,韩彤,刘力,等.中枢神经系统血管外皮细胞瘤的MRI表现与病理分析[J].中国医学计算机成像杂志,2007,13(6):389-396.
[12] Soyuer S,Chang E L,Selek U,et al.Intracranial meningeal hemangiopericytoma:the role of radiotherapy:report of 29 cases and review ofthe literature[J].Cancer,2004,100(7):1491-1497.
[13] Melone A G,Elia A D,Francesca Santoro,et al.Intracranial hemangiopericytoma-our experience in 30 years:a series of 43 cases and review of the literature[J].World Neurosurg,2014,81 (3-4):556-562.
2016-04-19)
(本文编辑:陈丹)
325000 温州市人民医院影像科
吴海,E-mail:whzxl@139.com
