双特异性磷酸酶1在涎腺腺样囊性癌组织中的表达及意义
2016-12-26曹君凌志强葛明华郑传铭
曹君 凌志强 葛明华 郑传铭
●论 著
双特异性磷酸酶1在涎腺腺样囊性癌组织中的表达及意义
曹君 凌志强 葛明华 郑传铭
目的 探讨双特异性磷酸酶1(DUSP1)在涎腺腺样囊性癌(SACC)组织中的表达及其意义。方法 采用免疫组化、qRT-PCR和Western blot检测48例SACC患者的癌组织和20例癌旁正常组织中DUSP1的蛋白和基因表达水平,并收集相关临床资料,分析DUSP1蛋白表达与SACC患者临床病理特征间的关系。结果 48例SACC患者标本中18例(37.5%)DUSP1阳性表达,30例(62.5%)阴性表达。qRT-PCR结果显示,SACC癌组织中DUSP1的基因表达阳性率显著低于癌旁正常组织(P<0.05),Western blot结果与其一致。不同T分期、淋巴结转移、神经侵犯、局部侵犯的患者间比较,DUSP1蛋白表达阳性率均有统计学差异(均P<0.05),而不同性别、年龄、肿瘤部位、组织学类型、远处转移的患者间比较,DUSP1蛋白表达阳性率均无统计学差异(均P>0.05)。结论 DUSP1在SACC中表达下降,与T分期、淋巴结转移、神经侵犯、局部侵犯有关,有望成为SACC预后的潜在标志物之一。
双特异性磷酸酶1 涎腺腺样囊性癌 预后
涎腺腺样囊性癌(SACC)是较常见的涎腺恶性肿瘤之一,具有嗜神经侵袭并顺其逐渐扩散转移的生物学特性,进而导致患者术后的转移率、复发率均较高,预后不佳,但该肿瘤生长相对缓慢,带瘤生存时间较长,因此多数患者可获得长期生存,然而目前临床上对SACC高侵袭性及远处转移的相关机制仍缺乏认识。双特异性磷酸酶1(DUSP1),又名丝裂素活化蛋白激酶磷酸酶(MKP-1),是Alessi等[1]发现的第1个MKP磷酸酶家族成员,作为一种双向特异性苏/酪氨酸磷酸酯酶,DUSP1可通过脱磷酸来调节促有丝分裂原蛋白激酶(MAPK)信号通路的活性,进而在细胞生长周期及细胞增殖等方面起到重要的调控作用。本研究采用免疫组化Envision法、qRTPCR和Western blot检测了SACC患者癌组织及癌旁正常组织中DUSP1蛋白和基因表达情况,并探讨其与患者临床病理特征之间的关系,现报道如下。
1 对象和方法
1.1 对象 选取1993年10月至2011年10月在浙江
省肿瘤医院头颈外科住院治疗的原发性SACC患者共48例,所有患者均进行了手术切除,其中9例予术后辅助放射治疗,3例予术后辅助化学药物治疗。其中男19例,女29例;年龄26~74岁,中位年龄49.5岁。同时选取SACC标本中的20例癌旁正常组织(与肿瘤边缘距离超过3~5cm的组织)标本作为对照。48例癌组织及20例癌旁正常组织在手术切除后立即放入液氮罐中快速冷冻,随后在-80℃冰箱中冻存备用。所有标本均经病理组织学检查证实为SACC癌组织和癌旁正常组织,并按照2005年WHO涎腺肿瘤组织学分类标准,由3位副主任医师以上职称的病理医师共同诊断分类,其中筛孔型27例、腺管型11例、实体型(实体成分≥30%)10例。根据2010年美国癌症联合会(AJCC)分期,T1~3期26例、T4期22例;累及神经的39例、未累及神经的9例;发生远处转移的7例、未发生远处转移的41例,见表1。本研究得到浙江省肿瘤医院伦理委员会批准。
1.2 方法
1.2.1 免疫组化染色 采用免疫组化Envision两步法检测DUSP1蛋白在SACC癌组织和癌旁正常组织中的表达,山羊抗人DUSP1多克隆抗体购自美国abcam公司,二抗及DAB试剂盒购自北京中杉金桥公司。在SACC标本癌灶组织和远端组织取材,经4%甲醛固定,石蜡包埋切片,分别进行HE染色与免疫组化染色。具体操作严格按照试剂盒说明进行,结果评定标准详见相关文献报道[2]。所有结果均由至少3位病理医师进行双盲评定。
1.2.2 qRT-PCR 将配对组织样本从-80℃冰箱取出,每例样本取0.3~0.5g,放入超声波细胞粉碎仪中粉碎,然后严格按照Trizol(美国Invitrogen公司产品)试剂盒说明书操作提取总RNA。取100ng总RNA,采用PrimeSciptTM逆转录试剂盒(日本Takara公司产品)进行逆转录,反应条件为37℃60min,85℃5s,逆转录完成后进行qRT-PCR,反应条件为50℃2min,预变性95℃30s,PCR反应95℃5s,60℃30s,40个循环,熔解反应条件为95℃15s,60℃60s,95℃15s。引物序列如下:DUSP1上游5′-TGTGGGCAACATTCCTGTAA-3′,下游5′-CAAAGGAT-GGCACAGGATTT-3′;GAPDH上游5′-GAAGGTGAAGGTCGGAGTC-3′,下游5′-GAAGATGGTGATGGGATTT-C-3′。反应结束后导出数据,采用2-ΔΔCt法分析DUSP1基因的相对表达量。对于28例没有癌旁正常组织对照的癌组织标本,将已有的20例癌旁正常组织的DUSP1逆转录产物各取等量混合作为对照。
1.2.3 Western blot 选取配对的SACC癌组织和癌旁正常组织标本各4例用于Western blot。取SACC癌组织和癌旁正常组织标本各200mg剪成糊状,加入组织裂解液进行超声匀浆,随后提取总蛋白,蛋白定量后上样检测,内参选用GAPDH。化学发光试剂显色,胶片贴近曝光,显影、定影后用Epson彩色图像扫描仪获取蛋白信号条带图像,经Image-Pro Plus软件处理,目的蛋白条带与内参蛋白条带的比值代表目的蛋白的表达水平。
1.3 统计学处理 应用SPSS 18.0统计软件。计量资料以表示,组间比较采用t检验。计数资料组间比较采用Pearson χ2检验。
2 结果
2.1 DUSP1蛋白在SACC癌组织和癌旁正常组织中的表达情况 免疫组化结果显示,DUSP1蛋白在20例癌旁正常组织中均呈阳性表达,表达阳性率100.0%;48例SACC癌组织中18例阳性表达,表达阳性率为37.5%,两者间比较有统计学差异(P<0.05),见图1。
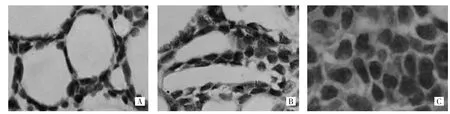
图1 DUSP1蛋白在SACC癌组织中的表达(A:筛孔型;B:腺管型;C:实体型;免疫组化Envision法染色,×400)
2.2 DUSP1基因在SACC癌组织及癌旁正常组织中的表达比较 qRT-PCR结果显示,SACC癌组织和癌旁正常组织中DUSP1基因相对表达量分别为0.9±0.3和5.8±3.1,两者间比较具有统计学差异(P<0.05),见图2。
2.3 DUSP1蛋白在SACC癌组织及癌旁正常组织中的表达比较 Western blot结果显示,癌旁正常组织中DUSP1蛋白相对表达量为1.16±0.25,明显高于SACC癌组织的0.33±0.18,具有统计学差异(P<0.05),见图3。
2.4 DUSP1蛋白表达阳性率与SACC患者临床病理特征的关系 不同T分期、不同淋巴结转移情况,以及不同神经侵犯和局部侵犯情况的患者间比较,DUSP1蛋白表达阳性率均有统计学差异(均P<0.05),见表1。
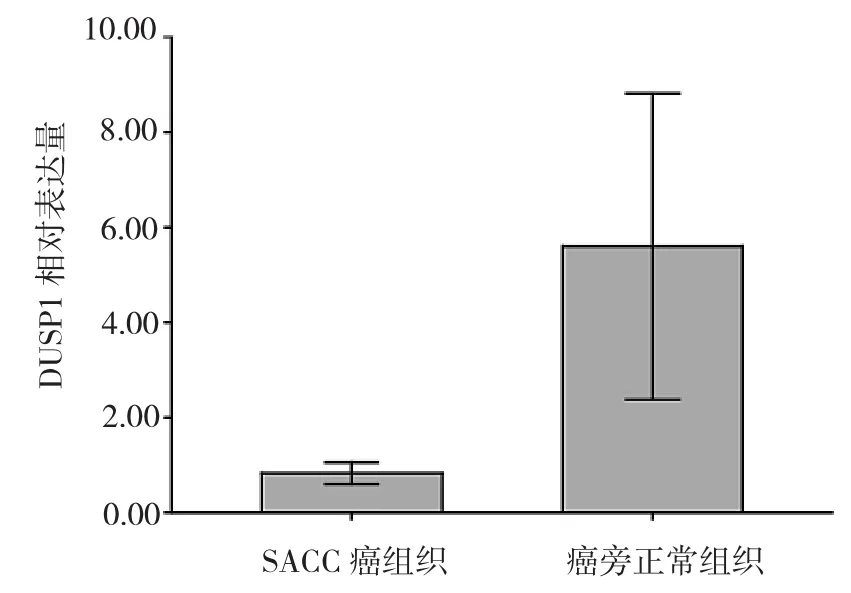
图2 SACC癌组织及癌旁正常组织中DUSP1基因表达

图3 SACC癌组织及癌旁正常组织中DUSP1蛋白表达

表1 DUSP1蛋白表达与SACC患者临床病理特征的关系[例(%)]
3 讨论
SACC临床进展较慢,近期治疗效果较好,但患者远期生存率低,部分患者起病时肿瘤即表现为广泛侵袭性生长,生存时间较短,且具有较高的复发率和远处转移率。因此,准确判断SACC患者预后并采取合适的治疗方式,是延长患者生存时间的前提。在笔者的前期研究中已发现,SACC的预后与患者的临床病理学分期、淋巴结转移情况和神经侵犯与否等密切相关[3]。但目前尚缺乏有效的分子标志物来预测SACC的预后,故探讨SACC肿瘤分子生物学改变,将为判断预后和分子靶向治疗提供新的思路。
双特异性磷酸酶蛋白家族由25名成员组成[4],它是一类酪氨酸特异性磷酸酶,既能使磷酸化的苏氨酸/丝氨酸去磷酸化,又能使磷酸化酪氨酸去磷酸化[5],且这类双特异性磷酸酶的亚细胞定位、组织分布、作用底物特异性及对诱导因子的刺激等具有差异性[6]。双特异性磷酸酶通过使其作用底物上的苏氨酸/丝氨酸和酪氨酸残基去磷酸化,来调节MAPK信号途径[4]。DUSP1的cDNA片段全长1 101bp,可编码367个氨基酸[1],是一种核MAPK磷酸酶,可在氧化应激、缺氧和其他压力如营养剥夺和化疗药物的影响作用下,作为p53[7]、细胞周期转录因子(E2F-1)[8]、原癌基因c-Jun[9]和激活转录因子-2(ATF-2)[10]等的直接转录作用靶点。大量研究证明,DUSP1与非小细胞肺癌、乳腺癌、卵巢癌、胃癌和早期前列腺癌等恶性肿瘤发病相关,这提示DUSP1在肿瘤的发生过程中可能扮演重要的角色。Moncho-Amor等[10]发现DUSP1蛋白在非小细胞肺癌中呈过表达状态,且其表达上调可促进一些血管生成因子,如血管内皮生长因子受体相关蛋白(SH2D2A)、血管内皮生长因子-C(VEGF-C)等的表达增加,进而促进肿瘤的血管生成、侵袭和转移。Liu等[11]发现在胰腺癌中,DUSP1蛋白过表达可通过下调氨基末端激酶(JNK)和p38 MAPK等促凋亡蛋白的活性来发挥抗凋亡作用,进而促进体内瘤体的生成。以上研究结果提示,DUSP1在肺癌、胰腺癌中起到促癌基因的作用。然而,Calvisi等[12]在肝癌(HCC)的研究中发现DUSP1蛋白表达水平越高,患者预后反而越好,且在HCC细胞中,DUSP1可负性调节ERK信号通路,从而抑制其细胞增殖潜力,提示在HCC中DUSP1可能发挥了抑癌基因的功能。Hao等[13]也发现DUSP1蛋白表达下调与HCC分化程度及临床分期密切相关,过表达DUSP1蛋白的肝癌小鼠肿瘤进展慢,且存活时间更长。此外,野生型而非突变型的p53通过DNA结合域上调DUSP1蛋白的表达,而DUSP1又通过p38 MAPK/HSP27途径激活p53。因此,DUSP1和p53可能是通过一个正向调节环路来协同抑制HCC的发生、发展。Khor等[14]在口腔鳞状细胞癌的研究中也发现,DUSP1蛋白在口腔鳞状细胞癌呈低表达,且其表达下调与甲基化有关。以上研究显示,DUSP1在肿瘤形成过程中有一定器官异质性。本研究主要通过免疫组化、qRT-PCR和Western blot分析了SACC癌组织与癌旁正常组织中DUSP1蛋白和基因的相对表达量,并进一步分析了DUSP1蛋白表达阳性率与患者临床病理特征的关系。结果显示癌组织中DUSP1蛋白表达明显低于癌旁正常组织,且随着肿瘤进展,DUSP1蛋白表达阳性率逐渐下降,说明DUSP1蛋白表达阳性率下降代表了肿瘤从局部到进展期的演变过程。这与DUSP1蛋白在肝癌、口腔鳞状细胞癌中的表达相似,提示DUSP1在SACC中可能是一个潜在的抑癌基因,且在不同T分期、淋巴结转移、神经侵犯、局部侵犯患者间比较,DUSP1蛋白表达阳性率有统计学差异,然而不同性别、年龄、肿瘤部位、组织学类型、远处转移患者的DUSP1蛋白表达阳性率则无统计学差异。考虑到本研究样本量较少,SACC癌组织中的DUSP1蛋白表达量是否受性别、年龄、肿瘤部位、组织学类型、远处转移等影响尚需进一步研究证实。
综上所述,DUSP1在SACC中呈低表达,可能是潜在的抑癌基因,DUSP1的低表达与SACC的发生、发展及侵袭转移存在密切联系。笔者预测,DUSP1蛋白将在临床上SACC早期病变的筛查、靶向治疗、患者病情进展的预测及预后评价中发挥积极的指导作用。
[1] Alessi D R,Smythe C,Keyse S M.The human CL100 gene encodes a Tyr/Thr-protein phosphatase which potently and specifically inactivates MAP kinase and suppresses its activation by oncogenic ras in Xenopus oocyte extracts[J].Oncogene,1993,8 (7):2015-2020.
[2] Ling Z Q,Guo W,Lu XX,et al.A Golgi-specific protein PAQR3 is closely associated with the progression,metastasis and prognosis of human gastric cancers[J].Ann Oncol,2014,25(7):1363-1372.
[3] 王佳峰,葛明华,王可敬,等.小涎腺腺样囊性癌52例临床分析[J].中华口腔医学杂志,2012,47(12):705-710.
[4] Bermudez O,Pags G,Gimond C.The dual-specificity MAP kinase phosphatases:critical roles in development and cancer[J]. Am J PhysiolCellPhysiol,2010,299(2):C189-202.
[5] Liu C,Shi Y,Du Y,et al.Dual-specificity phosphatase DUSP1 protects overactivation of hypoxia-inducible factor 1 through inactivating ERKMAPK[J].Exp CellRes,2005,309(2):410-418.
[6] Owens D M,Keyse S M.Differentialregulation of MAP kinase signalling by dual-specificity protein phosphatases[J].Oncogene, 2007,26(22):3203-3213.
[7] Liu YX,Wang J,Guo J,et al.DUSP1 is controlled by p53 during the cellular response to oxidative stress[J].MolCancer Res,2008, 6(4):624-633.
[8] Wang J,Yin D P,Liu Y X,et al.Dual specificity phosphatase 1/CL100 is a direct transcriptionaltarget of E2F-1 in the apoptotic response to oxidative stress[J].Cancer Res,2007,67(14):6737-6744.
[9] Laderoute K R,Mendonca H L,Calaoagan J M,et al.Mitogenactivated protein kinase phosphatase-1 (MKP-1)expression is induced by low oxygen conditions found in solid tumor microenvironments.A candidate MKP for the inactivation of hypoxia-inducible stress-activated protein kinase/c-Jun N-terminal protein kinase activity[J].J BiolChem,1999,274(18):12890-12897.
[10] Moncho-Amor V,Ibanez de Cceres I,Bandres E,et al.DUSP1/ MKP1 promotes angiogenesis,invasion and metastasis in nonsmall-celllung cancer[J].Oncogene,2011,30(6):668-678.
[11] Liu F,Gore A J,Wilson J L,et al.DUSP1 is a novel target for enhancing pancreatic cancer cell sensitivity to gemcitabine[J]. PLoS One,2014,9(1):e84982.
[12] CalvisiD F,Pinna F,MeloniF,et al.Dual-specificity phosphatase 1 ubiquitination in extracellular signal-regulated kinase-mediated control of growth in human hepatocellular carcinoma[J]. Cancer Res,2008,68(11):4192-4200.
[13] Hao P P,Li H,Lee M J,et al.Disruption of a regulatory loop between DUSP1 and p53 contributes to hepatocellular carcinoma development and progression[J].J Hepatol,2015,62(6):1278-1286.
[14] Khor G H,Froemming G R,Zain R B,et al.DNAmethylation profiling revealed promoter hypermethylation-induced silencing of p16,DDAH2 and DUSP1 in primary oralsquamous cellcarcinoma[J].Int J Med Sci,2013,10(12):1727-1739.
Expression of DUSP1 in salivary adenoid cystic carcinoma and its clinicopathological significance
CAO Jun,LING Zhiqiang,GE Minghua,et al.The Second Clinical Medical College,Zhejiang Chinese Medical University,Hangzhou 310053,China
Objective To investigate the expression of dual specificity phosphatase1(DUSP1)in salivary adenoid cystic carcinoma (SACC)and its clinicopathological significance. Methods Immunohistochemisty,real-time fluorescence quantitative PCR(RT-qPCR)and Western blot method were used to determine the expression of DUSP1 in 48 samples of SACC tissue and 20 samples of pericancerous tissue.The relationship between DUSP1 expression and clinicopathological features was analyzed. Results Immunohistochemistry showed that in 48 salivary gland ACC samples,18 cases(37.5%)were DUSP1-positive,while 30 (62.5%)were DUSP1-negative.qRT-PCR result revealed that the expression of DUSP1 was significantly lower in SACC tissues compared to pericancerous tissues(P<0.05),Western blot result was in accordance with qRT-PCR.There were significant differences in expression of DUSP1 among patients with different T stages,lymph node metastasis,nerve invasion and local invasion (P<0.05),but no significant differences among patients with different gender,age,tumor location,histological types and distant metastasis(P>0.05). Conclusion The expression of DUSP1 is correlated with T stage,lymph node metastasis,nerve invasion and localinvasion in SACC,indicating that it may be used as a potentialnegative prognostic indicator for SACC.
Dualspecificity phosphatase 1 Salivary adenoid cystic carcinoma Prognosis
2015-08-12)
(本文编辑:田云鹏)
浙江省自然科学基金(Y14H160065);浙江省医药卫生科技项目平台计划学科带头人项目(2015100148)
310053 杭州,浙江中医药大学第二临床医学院(曹君);浙江省肿瘤医院头颈外科(曹君、葛明华、郑传铭,曹君系浙江中医药大学第二临床医学院硕士研究生,葛明华系浙江中医药大学研究生导师),浙江省肿瘤研究所(凌志强)
郑传铭,E-mail:mingdoc@163.com
