新生大鼠耳蜗Kölliker器在体凋亡的研究△
2016-12-24杨军何圆圆
杨军何圆圆,2
新生大鼠耳蜗Kölliker器在体凋亡的研究△
杨军1何圆圆1,2
目的 了解不同天龄新生大鼠耳蜗Kölliker器的形态变化,研究凋亡相关因子的mRNA及蛋白的表达水平,探讨Kölliker器在听觉功能发育过程中凋亡的机制。方法 选取出生后不同天龄的Sprague-Dawley大鼠共192只,其中出生后1天(P1)、5天(P5)、12天(P12)各6只大鼠耳蜗冰冻切片后,通过苏木精-伊红染色及免疫荧光染色等方法,观察耳蜗Kölliker器的形态结构变化;取P1大鼠6只行耳蜗基底膜免疫荧光观察;提取出生后1、3、5、7、10、12及14天(P1、P3、P5、P7、P10、P12和P14)大鼠耳蜗基底膜mRNA(各6只)及蛋白(各18只),运用real-time PCR及蛋白质印迹的方法,观察出生后各天龄组大鼠耳蜗基底膜Kölliker器凋亡过程中bcl-2、caspase-3、caspase-8及caspase-9的表达规律。结果 出生后大鼠听力出现之前其耳蜗Kölliker器支持细胞的形态自顶回向底回从高柱状向矮柱状变化,同时支持细胞的数量逐渐减少。出生后不同天龄大鼠耳蜗基底膜的caspase-3、caspase-8、caspase-9及bcl-2的mRNA和蛋白的表达水平均呈明显的时间依赖性。结论 在大鼠出生后、听力出现前耳蜗发育的整个阶段,Kölliker器自底回向顶回逐渐发生退化;caspase-3、caspase-8、caspase-9及bcl-2的m RNA和蛋白的表达表现为时间依赖性。
大鼠; 耳蜗; Kölliker器; 支持细胞; 凋亡
鼠类动物出生时其听觉器官并未发育成熟,其出生后至12~14天没有听觉。Kölliker器(亦称大上皮嵴)是耳蜗发育过程中的一种暂态结构,位于耳蜗内毛细胞(IHCs)内侧的柱状支持细胞团[1],存在于胚胎中晚期和出生后早期,是耳蜗未成熟的标志之一;出生后,Kölliker器细胞发生凋亡,数目减少,在有听觉之后,当耳蜗成熟时,Kölliker器消失[2]。
以往有研究观察到Kölliker器在出生后12~14天消失[3],但目前对出生后听力发育过程中Kölliker器的形态结构变化及生物化学变化知之甚少,且对Kölliker器支持细胞的凋亡及其机制也少有研究。本实验拟通过研究不同天龄新生大鼠耳蜗Kölliker器的形态变化及凋亡相关因子的m RNA及蛋白的表达变化,探讨Kölliker器在新生大鼠听觉功能发育过程中凋亡的机制。
1 材料与方法
1.1 实验动物及分组 选取健康清洁级Sprague-Dawley大鼠192只,雌雄不拘,所有大鼠父辈耳廓反射灵敏,耳部外形正常,由中国科学院上海实验动物中心提供。取出生后1天(P1)、5天(P5)以及12天(P12)各6只,用于制备耳蜗切片;另选取P1大鼠6只,用于行耳蜗基底膜免疫荧光观察;选取生后1、3、5、7、10、12及14天(P1、P3、P5、P7、P10、P12、P14)大鼠各6只,提取基底膜RNA;选取P1、P3、P5、P7、P10、P12及P14大鼠各18只,提取基底膜蛋白。
1.2 试剂 Tissue-Tek冷冻组织包埋剂由日本Sakura公司提供;L-多聚赖氨酸及10%山羊血清由美国Sigma公司提供;兔抗大鼠Myosin-VIIa购自美国Proteus BioSciences公司;山羊抗大鼠Sox2抗体购自美国Santa Cruz公司;逆转录试剂盒(PrimeScript RT reagent Kit)及Realtime试剂盒(SYBR Premix Ex TaqTM,Perfect Real Time)由Takara公司提供;小鼠抗大鼠β-actin抗体购自美国Protein Tech公司;兔抗大鼠caspase-3抗体、caspase-8抗体、caspase-9抗体、bcl-2及cleaved caspase-3抗体购自美国CST公司。
1.3 实验方法
1.3.1 耳蜗冰冻切片 取P1、P5及P12大鼠各6只快速断头,取下颞骨后,放入新鲜4%多聚甲醛溶液中。在解剖显微镜下打开颞骨壁,打开听泡,分离耳蜗,挑去镫骨底板,开放圆窗及卵圆窗,并在蜗顶打一小孔,置于4%多聚甲醛溶液内,4℃固定24 h。P5及P12大鼠耳蜗放入10%EDTA溶液中于4℃冰箱脱钙,P5组脱钙2 d,P12组脱钙5 d,每天更换新鲜脱钙液,用0.01 M PBS漂洗3次,在4℃耳蜗通过10.0%、12.5%、15%和20%的系列蔗糖磷酸缓冲液梯度,每一梯度至耳蜗沉底。将耳蜗浸入Tissue-Tek冷冻组织包埋剂中,耳蜗快速冷冻在-20℃用冷冻切片机沿蜗轴作冰冻切片,片厚6~8 μm,切片置于涂L-多聚赖氨酸的载玻片上融解,并在空气中干燥,冰冻切片可储存在-20℃冰箱或立即用于实验。
1.3.2 HE染色 取出耳蜗切片,置室温晾干。蒸馏水漂洗,苏木精染液染色5 min。蒸馏水洗去多余苏木精染液后,滴加1%盐酸酒精分化5~10 s,细流水冲洗,至细胞核呈蓝色。滴加0.1%伊红染液染色1 min,依次经70%、85%、95%、100%梯度酒精脱水,其中95%、100%酒精各2次,每次各为5 min,二甲苯透明2次,每次5 min;滴加适量中性树胶,加盖玻片封闭,封片过程避免出现气泡。过夜晾干,显微镜下观察P1、P5、P12大鼠耳蜗Kölliker器形态并摄片。
1.3.3 基底膜免疫荧光染色 取6只P1大鼠,快速断头,在体视解剖显微镜下自顶回至基底回仔细分离出血管纹和螺旋韧带,自基底膜底回完整撕下基底膜,将基底膜置于4%多聚甲醛溶液室温4 h,PBS漂洗3次,每次5 min。滴加0.1%Triton X-100溶液通透40 min,PBS漂洗;加10%山羊血清封闭30 min,滴加1:300兔抗大鼠Myosin-VIIa抗体及1:200山羊抗大鼠Sox2抗体,置于4℃冰箱过夜,复温1 h,PBS漂洗。滴加Dy Light 594山羊抗兔IgG及Dy Light 488兔抗山羊IgG,避光室温孵育2 h,PBS漂洗,避光滴加50%甘油磷酸缓冲液,加盖玻片封闭。荧光显微镜下观察耳蜗基底膜顶、中、底回Kölliker器细胞的数量并摄片。Myosin-VIIa标记毛细胞,显示为绿色;Sox2标记所有的支持细胞,包括Kölliker器支持细胞,显示为红色。
1.3.4 Real time PCR检测不同天龄大鼠耳蜗感觉上皮bcl-2、caspase-3、caspase-8及caspase-9 m RNA的表达 常规提取P1、P3、P5、P7、P10及P12大鼠(各6只)耳蜗基底膜mRNA,反转录为cDNA后,SYBR Green嵌合荧光定量real-time PCR检测bcl-2、caspase-3、caspase-8及 caspase-9 m RNA的表达。PCR引物设计见表1。反应条件:95℃预变性30 s;95℃变性5 s,60℃退火34 s,40个循环;以β-actin为内参,根据2-ΔΔCt法分析bcl-2、caspase-3、caspase-8及caspase-9 m RNA表达量。设对照组的表达量为1,计算实验组中各个因子的相对表达量。
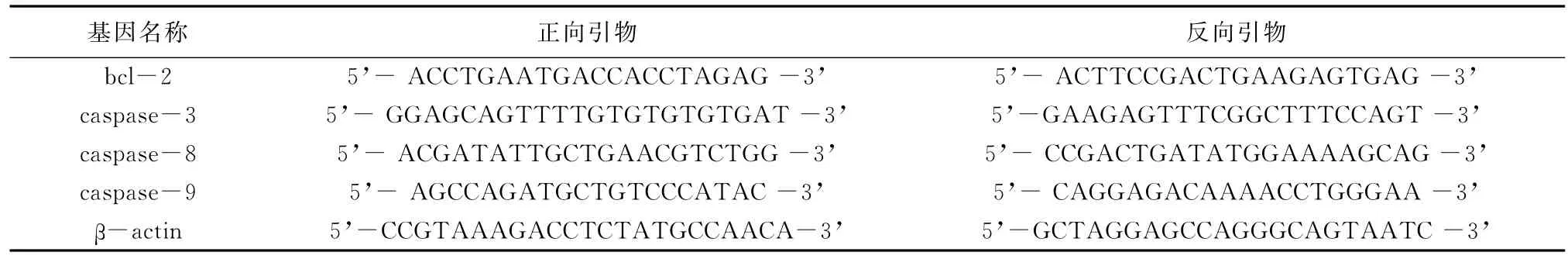
表1 引物序列和PCR扩增产物
1.3.5 凋亡相关蛋白的蛋白质印迹检测(Western blot) 新鲜抽提的P1、P3、P5、P7、P10及P12大鼠耳蜗基底膜组织,配置含蛋白酶抑制剂PMSF(苯甲基磺酰氟)的蛋白质抽提试剂RIPA,提取同鼠龄耳蜗感觉上皮的总蛋白,经蛋白含量测定及蛋白变性后,SDS-PAGE(十二烷硫酸钠聚丙烯酰胺)凝胶电泳,转膜,封闭1 h,分别用兔克隆bcl-2、caspase-3、caspase-8、caspase-9及cleaved caspase-3一抗及小鼠克隆β-actin抗体4℃孵育24 h,洗膜3次,每次5 min,加1:1 000辣根过氧化物标记的二抗(由美国Protein Tech公司提供)孵育60 min,洗膜3次,每次10 min,凝胶成像分析系统分析各不同天龄组大鼠耳蜗感觉上皮的bcl-2、caspase-3、caspase-8及caspase-9及cleaved caspase-3蛋白的表达。
1.4 统计学方法 采用SPSS13.0(SPSS Inc,美国)同步统计软件处理数据,组间比较采用方差分析(F检验),以P<0.05为差异有统计学意义。
2 结果
2.1 不同天龄大鼠耳蜗Kölliker器形态比较 大鼠出生后,其耳蜗形态发育尚不成熟,Kölliker器仍存在(图1)。可见P1和P5组大鼠耳蜗底回、中回及顶回Kölliker器均还未退化,从底回到顶回,Kölliker器内支持细胞的形态从矮柱状向高柱状变化,支持细胞的数量逐渐减少,从8~14排减少至3~4排;P12组耳蜗底回和中回的Kölliker器基本消失,而顶回的Kölliker器还未退化;说明新生大鼠耳蜗的发育及Kölliker器的退化是从底回开始逐渐向顶回进展。
2.2 耳蜗基底膜免疫荧光染色显示Kölliker器支持细胞数量变化 P1大鼠耳蜗的基底膜Myosin-VIIa和Sox2的免疫荧光染色结果表明,其耳蜗底回、中回和顶回中Kölliker器支持细胞均存在,且自底回向顶回Kölliker器支持细胞数量依次明显减少(图2)。说明在出生后大鼠的耳蜗仍处在发育过程中,Kölliker器的支持细胞存在凋亡使细胞数目减少。
2.3 不同天龄大鼠耳蜗感觉上皮bcl-2、caspase-3、caspase-8和caspase-9的m RNA表达P1、P3、P5、P7、P10、P12及P14大鼠耳蜗感觉上皮bcl-2、caspase-3、caspase-8和caspase-9的m RNA表达呈一定的时间依赖性;bcl-2的m RNA表达水平在P3、P5和P7组均显著增高,约为P1组的2~2.5倍(P<0.05)(图3a);P3组caspase-3的mRNA表达水平约为P1组的1.8倍(P<0.05)(图3b);且caspase-8 mRNA的表达水平在P3组最高,约为P1组的2.5倍(P<0.05),而P14组caspase-8 m RNA的表达水平明显降低,约为P1组的1/2(P<0.05)(图3c);各组caspase-9 m RNA表达规律与caspase-3 m RNA和caspase-8 mRNA不同(图3d);P5、P10组和P12组的caspase-9 m RNA表达水平分别约为P1组的0.6~0.7倍(P<0.05)。
2.4 不同天龄大鼠耳蜗感觉上皮的bcl-2、caspase-3、caspase-8和caspase-9及cleaved caspase-3蛋白的表达 Western blot检测P1、P3、P5、P7、P10、P12及P14大鼠耳蜗感觉上皮bcl-2、caspase-3、caspase-8和caspase-9蛋白的表达呈一定的时间依赖性(图4);与P1组相比,P3组的caspase-3的水平明显较高,而P12组和P14组相对较低;caspase-8蛋白表达在P3组最高,而在P10组降至与P1相当;与P1组相比,caspase-9的蛋白水平在P12组和P14组明显降低,但其余各组与P1组相比无明显变化;bcl-2蛋白表达在P3、P5及P7组有明显增高。
Western blot检测P1、P3组大鼠耳蜗感觉上皮cleaved caspase-3蛋白的表达显示,与caspase-3蛋白表达水平相似,cleaved caspase-3蛋白的表达也呈一定的时间依赖性(图5),与P1组相比,P3组的cleaved caspase-3蛋白的表达水平明显较高。
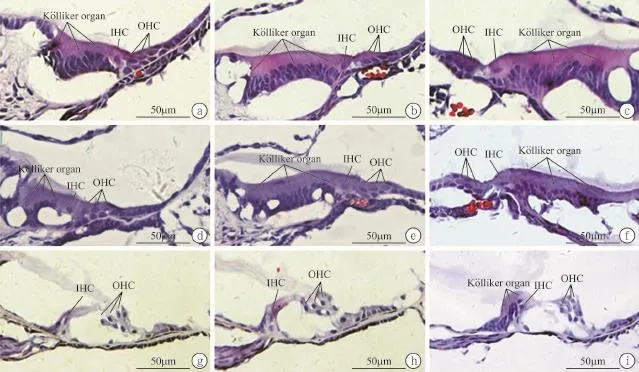
图1 P1、P5、P12新生大鼠耳蜗Kölliker器的HE染色

图2 P1新生大鼠耳蜗基底膜免疫荧光染色
3 讨论
众所周知,在发育成熟的耳蜗中,声波振动导致内毛细胞(IHCs)去极化,之后电压门控的钙离子通道开放,钙离子内流触发传入性神经递质谷氨酸释放,通过如此机械-电信号转导、神经递质传递,最终产生听觉。在大鼠出生后、听觉产生前,发育中的螺旋神经元产生的动作电位依赖于非声音介导的自发性活动[4],这种非声音介导的自发性活动起源于耳蜗[5],且有促进听觉神经元的存活及成熟[5~7]、突触的发育[8,9]及音频定位的建立[10]等作用。Tritsch等[1]研究表明Kölliker器的支持细胞可以自发性节律性释放ATP,与IHCs上的嘌呤受体结合导致钙离子内流,之后IHCs去极化并释放谷氨酸;谷氨酸激活螺旋神经元产生动作电位,以此模拟外界声输入的效应,在不成熟的耳蜗中产生不依赖声音的自发性活动。前期研究发现,新生大鼠耳蜗Kölliker器的支持细胞在体外能够释放ATP[11]。在出生后12~14天的鼠类动物,外耳道开放,Kölliker器不复存在,支持细胞终止释放ATP,自发性活动停止,耳蜗功能成熟,耳蜗中出现声音介导的电活动。因此,Kölliker器在出生后大鼠耳蜗发育过程中发挥着重要的作用。作为耳蜗未成熟的标识之一,Kölliker器细胞的胞体细长,顶部有双极或单极突起,其末端可见微绒毛,胞核小,位于胞体中部,部分细胞在胚胎晚期和出生后早期可能存在有丝分裂活动。在耳蜗的发育阶段,大鼠耳蜗Kölliker器自内侧向外侧自底回向顶回发生退化,其退化的机制可能是细胞凋亡[12,13]。细胞凋亡的信号可以通过细胞内或细胞外的多个独立的途径启动从而诱导凋亡,而半胱天冬酶(caspase)是许多器官凋亡级联反应的关键酶。当线粒体膜电位损失后,细胞色素C自线粒体释放,而细胞色素C可以激活caspase-3,目前caspase-3是研究最多的凋亡途径启动的下游的酶。caspase-8通过与位于细胞膜上的死亡受体结合并形成三聚体而启动外源性凋亡通路,caspase-8一旦被激活,便可以激活下游的半胱天冬酶,如直接裂解caspase-3或间接造成线粒体膜的破裂释放细胞色素C。caspase-9参与线粒体介导的活化和随后释放到细胞质的细胞色素C的激活,从而激活caspase-3[14]。半胱天冬酶的激活受多种因素的调节,如B-细胞淋巴瘤2(bcl-2)蛋白家族。抗凋亡蛋白bcl-2是众所周知的bcl-2家族成员,可以对抗细胞凋亡。

图3 各组耳蜗Kölliker器bcl-2、caspase-3、caspase-8及caspase-9 mRNA的表达

图4 Western blot分析各组耳蜗Kölliker器bcl-2、caspase-3、caspase-8和caspase-9蛋白的表达
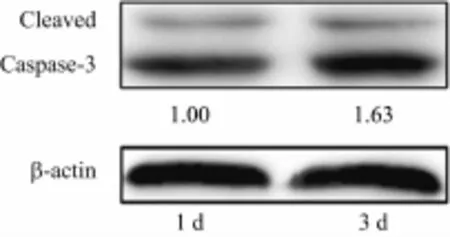
图5 Western blot分析P1及P3组耳蜗Kölliker器cleaved caspase-3蛋白的表达
目前少有研究集中在耳蜗Kölliker器的形态发育,对Kölliker器的认识仅限于其在出生后的短时间内会消失[15]。本研究结果显示,新生的P1、P3、P5、P7、P10、P12及P14大鼠耳蜗底回、中回及顶回的Kölliker器的支持细胞的形态从底回向顶回逐渐从矮柱状向高柱状变化,支持细胞的数量逐渐减少,因此可以推测在新生大鼠耳蜗发育的过程中,存在Kölliker器支持细胞的凋亡。
在内耳中,参与凋亡途径的分子在耳蜗发育中发挥了重要的作用[15],半胱天冬酶在细胞程序性死亡/凋亡中作用显著[16],caspase-3在凋亡裂解过程中是不可缺少的[17]。以往的研究表明,在胚胎期和出生后早期的发育过程中,caspase-3影响听觉系统的形成和维持[13];在2周龄的caspase-3(-/-)小鼠耳蜗,Kölliker器在底回、中回和顶回中均存在,没有退化,推测caspase-3依赖的凋亡途径对哺乳动物听觉系统发育和功能成熟是必需的。在野生型鼠类动物,Kölliker器凋亡的这些信号途径亟待深入研究[18]。
本研究结果显示,在Kölliker器中,caspase-3在大鼠出生后第一天即有高表达,在P5~P7组大鼠,Kölliker器支持细胞的凋亡达高峰,而自P10起凋亡减弱。bcl-2的表达趋势和上述趋势一致,即在体Kölliker器支持细胞中凋亡和抗凋亡同时存在。而在Kölliker器支持细胞离体实验中,证实Kölliker器支持细胞离体培养时不凋亡,而具有明显的增殖能力[19]。结合在体和离体实验结果,推测在体Kölliker器支持细胞不仅只存在凋亡,也存在增殖。当凋亡和抗凋亡失衡时,在体Kölliker器支持细胞才表现为凋亡或增殖。细胞增殖的数量远少于细胞凋亡的数量时,在组织结构上表现为Kölliker器的消失。本研究首次揭示了在耳蜗发育过程中,caspase-3和bcl-2在在体Kölliker器中表达的时间趋势,初步了解这两种蛋白在耳蜗发育过程中的作用。
在细胞凋亡的途径中,caspase-8和caspase-9是处于上游的半胱天冬酶。从本研究结果看,P3组大鼠Kölliker器caspase-8显著高表达;在P1~P10大鼠,caspase-9均有明显的表达。推测在体Kölliker器的凋亡经细胞外凋亡途径启动进而通过细胞外和细胞内两条途径共同参与,但是具体机制需要进一步的研究证明。
综上所述,在出生之后听觉产生之前,大鼠耳蜗Kölliker器从底回向顶回逐渐发生退化,从底回至顶回,Kölliker器内的支持细胞的形态从矮柱状向高柱状变化,支持细胞的数量逐渐减少;在出生后耳蜗发育的整个阶段,Kölliker器的退化表现为时间依赖性。本研究首次揭示了在大鼠出生后耳蜗发育过程中,caspase-3和bcl-2在在体Kölliker器中表达的时间趋势。
1 Tritsch NX,Yi E,Gale JE,et al.The origin of spontaneous activity in the developing auditory system[J].Nature,2007,450:50.
2 何圆圆,邓杰,杨军.耳蜗发育与三磷酸腺苷的关系[J].中华临床医师杂志,2012,6:112.
3 Liang Y,Huang L,Yang J.Differential expression of ryanodine receptor in the developing rat cochlea[J].Euro J Histochem,2009,52:249.
4 Tritsch NX,Bergles DE.Developmental regulation of spontaneous activity in the Mammalian cochlea[J].J Neurosci,2010,30:1539.
5 Jones TA,Leake PA,Snyder RL,et al.Spontaneous discharge patterns in cochlear spiral ganglion cells before the onset of hearing in cats[J].J Neurophysiol,2007,98:1898.
6 Glueckert R,Wietzorrek G,Kammen-Jolly K,et al.Role of class D L-type Ca2+channels for cochlear morphology[J].Hear Res,2003,178:95.
7 Seal RP,Akil O,Yi E,et al.Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3[J].Neuron,2008,57:263.
8 Erazo-Fischer E,Striessnig J,Taschenberger H.The role of physiological afferent nerve activity during in vivo maturation of the calyx of Held synapse[J].J Neurosci,2007,27:1725.
9 Mc Kay SM,Oleskevich S.The role of spontaneous activity in development of the endbulb of Held synapse[J].Hear Res,2007,230:53.
10 Kandler K,Clause A,Noh J.Tonotopic reorganization of developing auditory brainstem circuits[J].Nat Neurosci,2009,12:711.
11 何圆圆,杨军.新生大鼠耳蜗Kölliker器支持细胞ATP释放的机制[J].中华耳鼻咽喉头颈外科杂志,2015,50:43.
12 Kamiya K,Takahashi K,Kitamura K,et al.Mitosis and apoptosis in postnatal auditory system of the C3H/He strain[J].Brain Res,2001,901:296.
13 Nicholson DW.Caspase structure,proteolytic substrates,and function during apoptotic cell death[J].Cell Death Differ,1999,6:1028.
14 Adrain C,Martin SJ.The mitochondrial apoptosome:a killer unleashed by the cytochrome seas[J].Trends Biochem Sci,2001,26:390.
15 Maher P,Schubert D.Signaling by reactive oxygen species in the nervous system[J].Cell Mol Life Sci,2000,57:1287.
16 Chen YR,Tan TH.The c-Jun N-terminal kinase pathway and apoptotic signaling(review)[J].Int J Oncol,2000,16:651.
17 Li H,Steyger PS.Systemic aminoglycosides are trafficked via endolymph into cochlear hair cells[J].Sci Rep,2011,1:159.
18 Giorgi C,Romagnoli A,Pinton P,et al.Ca2+signaling,mitochondria and cell death[J].Curr Mol Med,2008,8:119.
19 何圆圆,杨军.新生大鼠Kölliker器支持细胞体外凋亡及增殖的研究[J].临床耳鼻咽喉头颈外科杂志,2015,29:152.
(2015-09-04收稿)
(本文编辑 周涛)
The Apoptosis of the Kölliker Organ in the Cochlea of Newborn Rat in Vivo
Yang Jun*,He Yuanyuan
(*Department of Otorhinolaryngology-Head&Neck Surgery,Xinhua Hospital,Shanghai Jiaotong University School of Medicine,Shanghai Jiaotong University School of Medicine Ear lnstitute,Shanghai Key Laboratory of Translational Medicine on Ear and Nose Diseases,Shanghai,200092,China)
Objective To explore the apoptosis mechanisms of the Kölliker organ during the development of the auditory function,through the obser vation of the morphological changes,the expression of the apoptosis-related mRNA or protein of the Kölliker organ in the cochlea of newborn rats.Methods A total of 192 Sprague-Dawley rats at different days after parturition(P)were used.There were P1,P5,and P12 rats(6 rats in each group)for hematoxylin-eosin staining and immunohistochemistry to investigate the morphological changes using frozen sections of the cochlea.Six rats at P1 were used for the immunofluorescence of the cochlear basal membrane.The sensory epitheliums in P1,P3,P5,P7,P10,P12 and P14 rats(6 rats each)were separated to extract mRNA(6 rats each)and protein(18 rats each),respectively.The differential expressions of the bcl-2,caspase-3,caspase-8 and caspase-9 through the real-time PCR and western blot during the apoptotic process of the Kölliker organ were studied.Results After birth,the supporting cells in the Kölliker organ showed the morphological change from the high columnar to short columnar and the disappearance with a base-to-apex gradient.The resultsof real-time PCR and western blot showed the expression pattern of bcl-2,caspase-3,caspase-8 and caspase-9 mRNA and protein in the cochlear sensory epithelium at 1st,3rd,5th,7th,10th,12thand 14thday.This indicates a significant time-dependent along the course of development.Conclusion After birth,but prior to the onset of hearing,the Kölliker organ in the cochlea of newborn rats degraded with a base-to-apex gradient throughout the developmental period of the cochlea.The expression of the caspase-3,caspase-8,caspase-9 and bcl-2 in the Kölliker organ during this period also showed in a time-dependence pattern.
Rat; Cochlea; Kölliker organ; Supporting cells; Apoptosis
10.3969/j.issn.1006-7299.2016.04.012
时间:2016-6-29 16:11
R339.16
A
1006-7299(2016)04-0371-06
△ 国家自然科学基金(81170919,81470689)、国家科技部973课题(2014CB541705)、上海市科委重大项目(14DJ1400201,14DZ2260300)资助
1 上海交通大学医学院附属新华医院耳鼻咽喉-头颈外科 上海市耳鼻疾病转化医学重点实验室 上海交通大学医学院耳科学研究所(上海 200092); 2 南京医科大学附属无锡人民医院耳鼻咽喉科
杨军,男,湖北人,主任医师,博士,主要研究方向为耳蜗发育及耳蜗信息转导。
杨军(Email:yangjun67@hotmail.com)
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20160629.1611.024.html
