2012年至2014年医院免疫增强剂的药物利用分析
2016-12-24王楠
王楠
(中国人民解放军南京军区南京总医院,江苏 南京 210002)
2012年至2014年医院免疫增强剂的药物利用分析
王楠
(中国人民解放军南京军区南京总医院,江苏 南京 210002)
目的 探讨医院2012年至2014年免疫增强剂的使用情况及用药趋势,为临床管理和合理用药提供参考。方法 利用医院“军卫一号”信息系统数据库,检索2012年至2014年免疫增强剂的使用数据,采用金额排序法、用药频度分析法统计和分析药物利用情况。结果 2012年至2014年免疫增强剂销售金额呈逐年递增趋势,年增长率分别为7.39%和48.61%。其中生物制剂类免疫增强剂在总体销售金额中占比最大,核糖核酸Ⅱ用药金额连续3年排名第1,中草药类免疫增强剂用药金额逐年增大。结论 免疫增强剂的使用日益广泛,且存在一些不合理用药情况,应加强对此类药物的监管。
免疫增强剂;销售金额;用药频度;合理用药
免疫缺陷病包括原发性免疫缺陷病和继发性免疫缺陷病。原发性免疫缺陷病较少见,通常与遗传相关,可分为体液免疫缺陷、细胞免疫缺陷及体液免疫缺陷和细胞免疫缺陷联合性免疫缺陷病。继发性免疫缺陷病一般是由后天因素引起的免疫障碍,常继发于感染、恶性肿瘤、营养不良、脾切除等[1]。免疫缺陷病导致患者罹患感染性疾病的概率增大,恶性肿瘤的发病率或癌细胞转移/复发率大大增加等[2]。免疫增强剂作为提高机体免疫力的药物,按其来源和结构一般分为化学合成小分子、微生物制剂、生物制剂及中草药制剂。近年,临床对免疫增强剂的应用日益增加,但存在不合理使用现象,故应严格把握免疫增强剂的适用范围和使用剂量,使其使用更经济、合理。为此,笔者分析了我院2012年至2014年免疫增强剂的使用情况,供临床合理用药参考。
1 资料与方法
利用医院“军卫一号”信息系统,提取 2012年至2014年使用免疫增强剂的住院患者病历,详细记录使用免疫增强剂的药品名称、规格、用量、用药金额等数据。限定日剂量(DDD值)是指用于成人主要治疗目的的平均每日维持剂量,依据第17版《新编药物学》[3]、2010年版《中国药典·临床用药须知》[4]、药品说明书推荐剂量及临床应用实际情况综合确定。用药频度(DDDs)=总用药量/该药的DDD值,其值越大,表明该药的使用频度越大,反之则越小。药物利用指数(DUI)是判定药物使用合理性的指标,DUI=DDDs/用药天数。日均费用(DDC)=某药的总用药金额/总DDDs,可作为用药费用方面的参考指标,反映了患者使用该药的平均日费用。序号比为用药金额排序序号与DDDs排序序号的比值,可反映药品用药金额与DDDs的同步性,比值接近1,表明同步性好;比值小于1,表明药品价位较高,DDDs相对较低;比值大于 1,表明价位较低,DDDs相对较高。年增长率=(截止年份总用药金额-起始年份总用药金额)/起始年份总用药金额×100%。
2 结果
2.1 金额构成及动态变化
按来源和结构,该院的免疫增强剂主要涉及以下4个类别:生物制剂,包括重组人白细胞介素-2、重组白细胞介素-11、干扰素α-1b、胸腺五肽、胸腺法新、核糖核酸Ⅱ、静注人免疫球蛋白、小牛脾提取物、脾多肽);中草药制剂,包括香菇多糖、参芪扶正、百令、施保利通;微生物制剂,包括乌苯美司、甘露聚糖肽;化学合成小分子,包括匹多莫德。
2012年至2014年,生物制剂类因品种最多,用药金额比例最大,中草药制剂其次,微生物制剂及化学合成小分子制剂用药金额较少,生物制剂类用药金额构成比从68.89%增至76.18%。中草药制剂从26.89%下降至19.70%。详见表1。

表1 2012年至2014年不同类别免疫增强剂的用药金额构成及动态变化
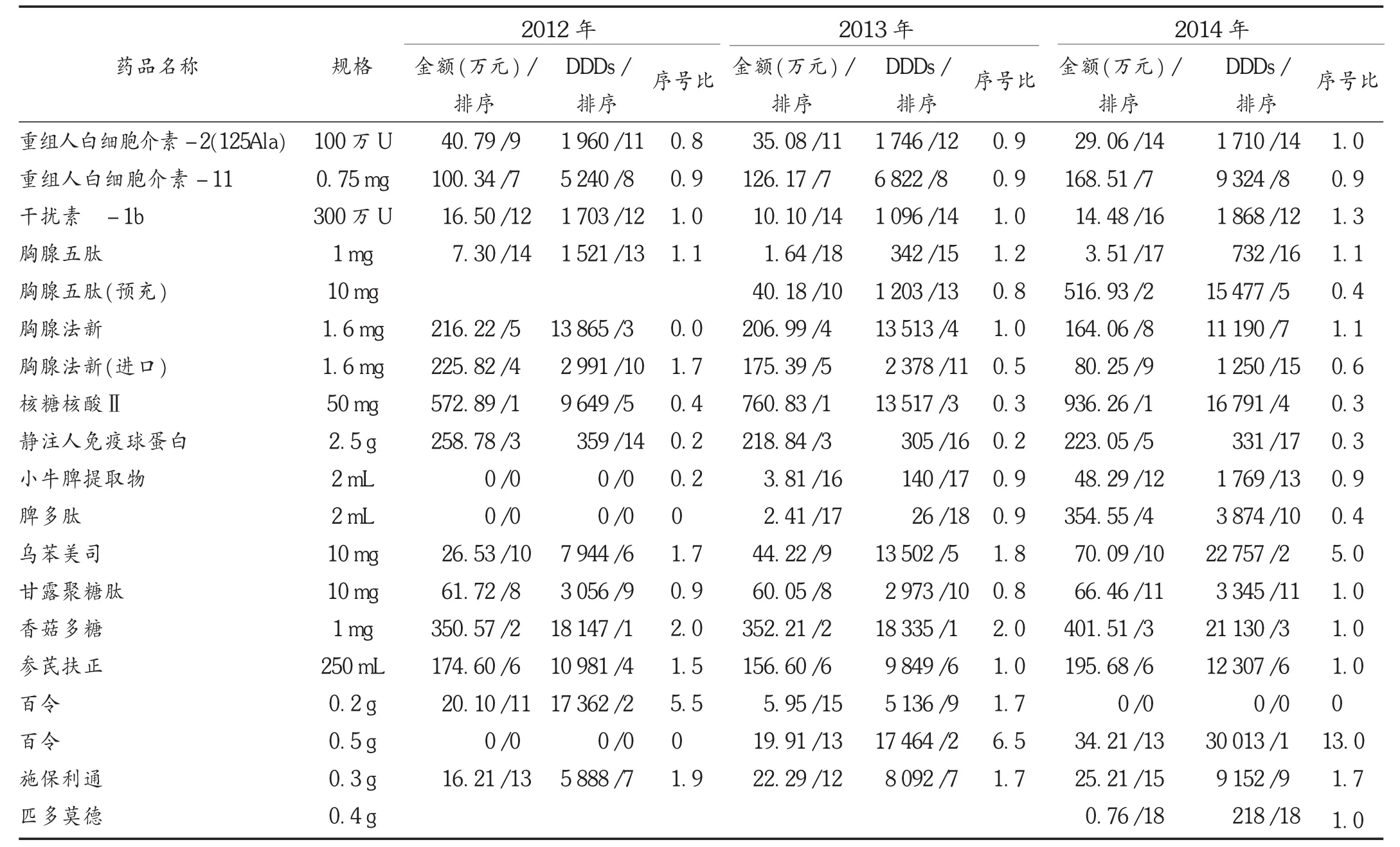
表2 2012年至2014年免疫增强剂的用药金额、DDDs及排序
2.2 用药金额、DDDs及排序
对2012年至2014年免疫增强剂使用金额进行排序,可见核糖核酸Ⅱ用药金额连续3年排名第1,香菇多糖连续3年排名前3名。DDDs排序,香菇多糖、百令连续3年排名前3名。百令、乌苯美司、施保利通的序号比显著大于1,使用频率较高。详见表2。
2.3 日均费用及DUI
按世界卫生组织(WHO)规定的DUI≤1判断,2012年至2014年各年度均有超过8个品种DUI>1,存在不合理使用。静注人免疫球蛋白、脾多肽、胸腺法新(进口)、核糖核酸Ⅱ的日均费用远高于其他免疫增强剂。详见表3。
3 讨论
3.1 用药金额及DDDs
调查结果显示,2012年至2014年,我院免疫增强剂的用药金额呈上升趋势,年增长率分别为7.39%和48.61%。这一方面是由于住院患者逐年增多,药物消耗量也随之不断增加;另一方面反映了临床医生对其疗效的认可及临床对其需求的增大。我院免疫增强剂单品种的DDDs和DUI值排序并不存在一致趋势,即用药频度高的药物其使用不一定合理。如DDDs高的香菇多糖、胸腺法新、胸腺法新(进口)、胸腺五肽(预充),其DUI>1,均超过了合理使用范围,不合理的用药形式可能包括非适应证用药、疗程过长、用药剂量过大、给药频率过短、重复用药等,临床需提高应用这类药品的警惕性。
3.2 各类免疫增强药物
生物制剂来源:我院生物制剂来源的免疫增强药物有重组人白细胞介素-2、重组白细胞介素-11、干扰素α-1b、胸腺五肽、胸腺法新、核糖核酸Ⅱ、静注人免疫球蛋白、小牛脾提取物、脾多肽,其中核糖核酸Ⅱ连续3年用药金额排名第1。核糖核酸Ⅱ是具有生理活性的高纯度物质,能激活T淋巴细胞产生大量淋巴因子和杀伤细胞,以增强人体免疫功能,还能激活B淋巴细胞,以增强人体体液免疫功能,可直接进入细胞核内,抑制癌细胞DNA,导致癌细胞死亡。核糖核酸Ⅱ可促进癌组织空泡样变化和液化性坏死,并增加癌组织周围的巨噬细胞和淋巴细胞;通过辅助Th1和Th2淋巴细胞分泌细胞因子,并平衡其细胞因子网络来增加细胞和体液免疫,从而缓解癌细胞分裂、增殖;可明显抑制血管内皮因子的表达,抑制肿瘤新生血管的生成;同时阻断肿瘤细胞中多胺类物质的生长途径来抑制肿瘤的复发、转移和扩散。在临床,核糖核酸Ⅱ不仅能作为肿瘤免疫治疗的一种手段,且在治疗某些免疫缺陷方面疾病上也取得了较好效果,对于某些难以防治的顽固传染病,免疫核糖核酸也表现出巨大的潜在临床价值。
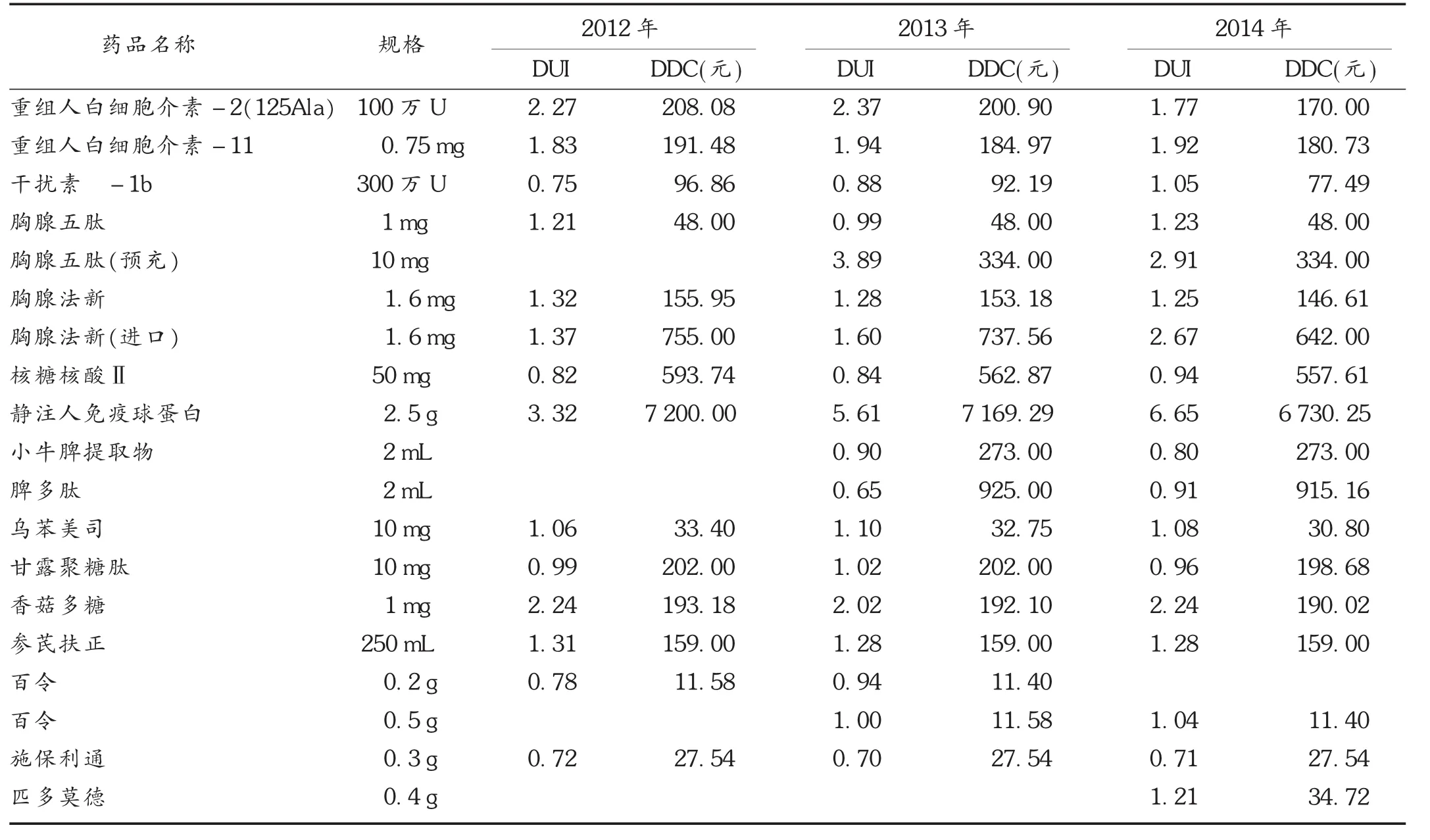
表3 2012年至2014年免疫增强剂的DUI及DDC变化
中草药类:我院中草药类免疫增强药物有香菇多糖、参芪扶正、百令、施保利通。百令胶囊连续3年用药频度排名前2位。百令胶囊为人工虫草制剂,是人工发酵培养得到的菌丝,其主要成分为虫草素、虫草酸、超氧化物歧化酶、腺苷、多种氨基酸等。虫草可使糖尿病大鼠肾脏质量有降低趋势,肾质量/体质量比值显著降低,延缓肾小球基底膜厚度及足突融合[5]。腺苷可使超氧化物歧化酶升高,清除自由基,降低脂质过氧化物,保护患者肾脏免受损害,改善肾血流,抑制血小板聚集,稳定溶酶体膜,并促进肾细胞的修复,对抑制糖尿病肾病的发生发展,改善微循环,阻断和减轻肾微细血管病变,减少尿蛋白的排泄,改善肾功能能起到非常重要的作用[6]。
香菇多糖类:香菇多糖的用药金额和DDDs连续3年都是前3位,香菇多糖是以天然香菇子实体中提取的多糖,能显著提高肿瘤患者CD3,CD4,CD4/CD8、自然杀伤(NK)细胞、淋巴因子激活的杀伤(LAK)细胞等水平。CD8细胞有提高免疫功能的作用;在动物试验中,能活化T淋巴细胞,包括辅助性T细胞和细胞毒性T细胞,同时对自然杀伤细胞和杀伤性淋巴细胞也有活化作用;此外,可通过激活补体系统的经典和替代途径,从而增强白细胞、巨噬细胞等的抗病原体反应,保护机体免遭进一步损伤,并能促使机体免疫功能维持平衡状态[7-9]。
微生物类:我院微生物类免疫增强药有乌苯美司、甘露聚糖肽。乌苯美司是一种氨肽酶抑制剂,CD13是其主要靶点[10]。乌苯美司通过抑制CD13的活性,从而影响肿瘤细胞的正常代谢与功能,可直接导致肿瘤细胞的增殖和侵袭受到极大抑制,诱导肿瘤细胞凋亡[11]。曹华等[12]的研究表明,乌苯美司在多种恶性肿瘤的辅助治疗中,还可有增加宿主免疫应答反应、抑制肿瘤细胞生长作用。
化学合成小分子类:我院2014年才开始使用匹多莫德,且用量有上升趋势。匹多莫德是人工合成的口服高纯度二肽,在机体内既能促进非特异性免疫,又能促进特异性免疫。研究发现,匹多莫德可增加和增强巨噬细胞及中性粒细胞的效应,同时激活NK细胞,通过刺激白细胞介素-2和干扰素-γ细胞因子的产生,促进细胞免疫反应[13],亦可促进和增强吞噬细胞的吞噬效应,从而达到免疫增强效应。其免疫调节机制较复杂,亦有报道匹多莫德可作用于下丘脑-垂体-肾上腺轴与细胞因子间缺失反馈的作用[14],从而影响和加强机体自身的免疫调节能力。匹多莫德通过对机体的免疫调节作用。在临床,其用于辅助治疗局部或全身免疫功能低下的患者,主要是由于疾病导致的机体免疫功能低下,如恶性肿瘤、病毒感染及一些慢性疾病等。
3.3 合理用药评价
2012年至2014年,我院使用免疫增强剂的结构相对合理,但也存在不合理用药现象,且由于免疫增强剂的用药指南及用药方案尚无国家标准和规范。因此,需加强对医师的培训,掌握免疫增强剂的使用指征及药物的特性;应积极倡导临床医生在选择免疫增强剂时,要同时考虑药物经济学及患者个人情况,做到个体化给药;临床药师应加强临床用药监督,尤其重点监控用药频率较高的药物,建立超常预警制度,积极与临床医生沟通,以规范免疫增强剂的合理应用。
[1]陈同辛.原发性免疫缺陷病早期诊断和临床干预[J].中国实用儿科杂志,2011,26(11):808-811.
[2]陈 丽,焦顺昌.化疗对肿瘤免疫功能影响的研究进展[J].临床肿瘤学杂志,2011,16(9):853-856.
[3]陈新谦,金有豫,汤 光.新编药物学[M].第17版.北京:人民卫生出版社,2011:704.
[4]国家药典委员会.中华人民共和国药典·临床用药须知[M].北京:中国医药科技出版社,2011:1 135.
[5]孙建红,何戎华,任传路.虫草制剂和开博通对糖尿病大鼠肾脏功能和形态影响的对比研究[J].徐州医学院学报,2000,20(6):450-453
[6]黎磊石,郑 丰,储小曼,等.(人工虫草)对大鼠庆大霉素急性肾毒性损害的影响[J].中医药管理杂志,1995,5(增刊):36.
[7]刘玉华,高天丽.香菇多糖的药理作用和临床应用[J].中国药业,1998,7(6):32.
[8]申 杰,苏秀兰,徐桂华,等.香菇多糖对晚期胃癌患者免疫功能的影响及临床疗效与安全性评估[J].中国循证医学杂志,2007,7(1):18-26.
[9]王海燕,郑盛杰.香菇多糖对慢性阻塞性肺疾病患者免疫功能的影响[J].临床和实验医学杂志,2012,11(1):40-41.
[10]Ino K,Goto S,Okamoto T,et al.Expression of aminopeptidase N on human choriocarcinoma cells and cell growth suppression by the inhibition of aminopeptidase N activity[J].Jpn J Cancer Res,1994(85):927-933.
[11]Huang DM,Cui JQ,Tao YG.Inhibitory effect of ubenimex on human choriocarcinoma cell JAR and ovarian cancer cell SKOV3,3AO in vitro[J].J Zhengzhou Univ(Med Sci),2005(40):642-643.
[12]曹 华,郑 涛,许瑞莲,等.乌苯美司对恶性肿瘤患者免疫功能的影响研究[J].中国肿瘤临床与康复,2012,19(3):196-200.
[13]王金陵,臧建英,李 明.芙露饮[J].中国新药杂志,2003,12(9):768.
[14]杨莉萍,傅得兴.新型免疫调节剂匹多莫德[J].中国新药杂志,2004,13(4):300-304.
Drug Utilization Analysis of Imm une Enhancer in the Hospital from 2012 to 2014
Wang Nan
(Nanjing General Hospital of Nanjing Military Area Command,Nanjing,Jiangsu,China 210002)
Objective To investigate the medication usage trends of immune enhancer in the hospital from 2012-2014 to provide reference for clinical management and rational drug use.M ethods By JunweiⅠHIS,immune enhancer usage data from 2012-2014 were retrieved,then got statistical analysis of drug utilization using the amount of sort and DDDs analysis method.Resu lts From 2012 to 2014,the amount of sales of immune enhancer increased year by year.The annual growth rates were 7.39% and 48.61%.Immune enhancer of biologics showed the largest proportion of the overall sales amount.The amount of RNA Ⅱ medication ranked first for 3 consecutive years,and immune enhancer amount of herbal medication increased every year.Conclusion The use of immune enhancer is increasingly widespread,and there are some irrational drug use and we should strengthen the supervision of these drugs.
immunoenhancer;consumption sum;DDDs;rational drug use
R969.3;R979.5;F407.7
A
1006-4931(2016)06-0069-04
2015-10-14)
