黄芪甲苷对3,4苯并芘介导内皮祖细胞损伤的保护作用及机制
2016-12-24陈军夏武杰薛杨静胡建坚
陈军 夏武杰 薛杨静 胡建坚
●论 著
黄芪甲苷对3,4苯并芘介导内皮祖细胞损伤的保护作用及机制
陈军 夏武杰 薛杨静 胡建坚
目的 观察黄芪甲苷对3,4苯并芘(BaP)介导内皮祖细胞(EPCs)损伤的保护作用并探讨其机制。方法 采用密度梯度离心法收集人脐血单个核细胞,贴壁培养法培养EPCs,消化收集第4代细胞,随机分为5组,正常对照组:不作任何处理;Bap组:予BaP,浓度为20μmol/L;3种浓度黄芪甲苷各组(先加入浓度分别为2、10、50μg/ml的黄芪甲苷,2h后再加入浓度为20μmol/L的Bap)。分别采用细胞计数试剂盒(CCK-8)检测细胞增殖能力,黏附能力测定实验检测细胞黏附能力,transwell小室检测细胞迁移能力。取各组细胞培养上清液检测其超氧化物歧化酶(SOD)及丙二醛(MDA)含量,免疫荧光染色检测各组细胞活性氧(ROS)的表达。结果 与正常对照组相比,BaP组细胞的增殖、黏附以及迁移能力均明显降低(均P<0.01),黄芪甲苷预保护可呈浓度依赖性地提高EPCs增殖、黏附及迁移能力(均P<0.05);BaP组培养上清液中MDA含量与正常对照组相比明显升高(P<0.01),SOD含量明显下降(P<0.01),ROS表达明显上升(P<0.01),不同浓度的黄芪甲苷可降低培养上清液中MDA含量(P<0.05),提高SOD含量(P<0.05),并且呈浓度依赖性地降低细胞ROS表达(P<0.01)。结论 黄芪甲苷对BaP介导的EPCs损伤具有保护作用,其机制可能与抑制氧化应激有关。
3,4苯并芘 内皮祖细胞 黄芪甲苷 氧化应激
动脉粥样硬化是一种慢性病变,它的主要特点是脂质和纤维成分在大血管长期堆积,最终导致冠心病的发生[1]。而冠心病已经成为全球发病率、病死率最高的疾病[2]。目前,人们广泛认为血管内皮细胞在动脉粥样化的启动和进程中起着至关重要的作用[3]。动脉血管内皮损伤可以导致血管屏障功能的丧失,进而促进炎症细胞浸润以及脂质推积。1997年,Asahara第1次分离培养到内皮祖细胞(EPCs),它是一群能分化成内皮细胞的干/祖细胞[4]。大量研究表明,它参与内皮损伤后的修复过程,其数量和功能与动脉粥样硬化的危险性呈负相关。吸烟是动脉粥样硬化的重要危险因素,与脑卒中和冠状动脉疾病发病率的增加相关。香烟烟雾中含有大量的有害物质,3,4苯并芘(BaP)就是其中的一种[5]。有研究发现,BaP对EPCs的多项生物学功能有损伤作用[6]。因此,寻找一种能降低烟草对心血管损伤,并且改善BaP对EPCs损伤的药物,已引起医学科研人员的高度重视。黄芪甲苷作为黄芪的一种活性成分,已被发现有很强的心血管保护作用[7-8],但其对BaP介导的EPCs是否有保护作用以及潜在机制尚未清楚,对此笔者进行了研究,现将结果报道如下。
1 材料和方法
1.1 材料 BaP(美国Sigma-Aldrichg公司),黄芪甲苷(上海融禾公司),EGM-2培养基(瑞士Lonza公司),人淋巴细胞分离液(北京索莱宝科技有限公司),胰酶、Hank's液(美国Gibco公司),FBS、FITC-UEA-I(美国Sigma-Aldrichg公司),Dil-ac-LDL(美国 Molecular Probe公司),Ⅷ因子相关抗原细胞化学试剂盒(武汉博士德生物工程有限公司),细胞计数试剂盒(CCK-8,日本同仁化学研究所),超氧化物歧化酶(SOD)测试盒、丙二醛(MDA)测试盒、细胞活性氧(ROS)测试盒(南京建成生物工程研究所)。
1.2 方法
1.2.1 EPCs的培养及鉴定 采用贴壁培养法培养EPCs。脐带血来自温州医科大学附属第一医院健康的顺产产妇,经产妇知情同意,每次采血50ml,采用密度梯度离心法从脐血中分离获取单个核细胞,以5×106个/ml密度接种于培养瓶中,每瓶中加入4ml含有10%的FBS、血管内皮生长因子(VEGF)(10ng/ml)的EGM-2培养基,置于37℃、5%CO2、饱和湿度培养箱中培养。每隔48h更换培养基,待细胞集落长成80%汇集度即可用0.05%含EDTA的胰酶消化贴壁细胞,用培养基重悬细胞,并放置培养箱中继续培养。采用Ⅷ因子相关抗原检测、Dil-ac-LDL/FITC-UEA-I lectin双荧光染色鉴定培养细胞;采用免疫组化法检测培养细胞的Ⅷ因子相关抗原,步骤参照说明书进行。空白对照不加一抗,阴性对照采用胃癌细胞株GSC7901。为鉴定培养细胞摄取Dil-ac-LDL及FITC-UEA-I lectin,将细胞制成5×106个/ml细胞悬液,加入终浓度2.4μg/ml的Dil-ac-LDL,在培养箱中避光孵育2h。吸弃上清液,4%多聚甲醛固定15min,加入FITC-UEA-I lectin(10mg/ml),继续孵化1h,取出盖玻片,用PBS轻轻冲洗2次,荧光显微镜下拍照。
1.2.2 实验分组 EPCs生长至70%~90%汇合度时,吸弃培养基,以低FBS(含2%FBS)的EGM-2培养基继续培养24h,使细胞同步化,然后以0.05%含EDTA的胰酶消化、收集细胞,并以含10%FBS的EGM-2培养基重悬细胞,制成5×106个/ml密度的单个细胞悬液。制成细胞悬液,以同等数量细胞接种,随机分为5组,正常对照组:不作任何处理;BaP组:加入浓度为20μmol/L的BaP;3种浓度黄芪甲苷各组(先加入浓度分别为2、10、50μg/ml的黄芪甲苷,2h后再加入浓度为20μmol/L的BaP),各组细胞继续培养24h后进行细胞功能检测。
1.3 细胞功能检测
1.3.1 增殖能力测定 消化收集第4代EPCs并以含2%FBS的培养基重悬,制成单个细胞悬液,各组均以每孔5 000个细胞的密度接种至预先包被hFN的96孔板中,每组设6个复孔,另设调零孔,同样设6个复孔,每孔只添加含2%FBS的EGM-2培养液;然后将96孔板置于37℃、5%CO2、饱和湿度培养箱中培养。24h后,吸弃培养基,重新添加含10%CCK-8溶液的培养基,继续培养4h后,置酶标仪450nm处测OD值。
1.3.2 黏附能力测定 各组细胞均按5 000个/孔的密度接种至预先包被hFN的96孔板中,每组设10个复孔;置37℃、5%CO2、饱和湿度培养箱中培养30min,洗去未贴壁细胞,随机选取10个视野(×200),倒置显微镜下计数黏附细胞数。
1.3.3 迁移能力测定 按上述方法收集并重悬细胞,在24孔板中放入transwell小室,下室加入含10%FBS的培养基,上室加入用含2%FBS培养基重悬的细胞悬液,培养24h后,取出transwell小室,用多聚甲醛固定微孔膜下层的细胞,并用结晶紫染色,显微镜计数迁移至小室底部的细胞。
1.4 测定细胞培养上清液中SOD及MDA含量 收集各组细胞培养上清液,SOD测试盒检测细胞培养上清液中SOD含量;MDA测试盒检测细胞培养上清液中MDA含量。上述操作严格依据说明书进行,然后置于可见光分光光度仪测各组吸光度,最后按说明书中换算公式得出测量数据。
1.5 测定各组EPCs细胞内ROS含量 按实验分组干预处理后,吸弃细胞培养上清液,用PBS洗细胞2次,然后在6孔板中加入用EGM-2稀释的浓度为10μmol/ ml的DCFH-DA,置于37℃、5%CO2、饱和湿度培养箱中培养3h。最后吸弃上清液,用PBS轻洗细胞,取出盖玻片置于荧光显微镜下观察,激发波波长为484nm,发射波波长为525nm。用Image-Pro Plus 6.0图像软件分析各组细胞荧光强度,用平均灰度值表示。
1.6 统计学处理 应用SPSS16.0统计软件。计量资料以表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。
2 结果
2.1 EPCs的培养与鉴定 细胞培养7~8d后,置于显微镜下观察,可见细胞呈梭行,呈现典型的铺路石样的集落(图1a)。Dil-ac-LDL摄取和FITC-UEA-1 lectin结合双荧光染色试验阳性,细胞膜摄取FITC-UEA-1 lectin发绿色荧光,细胞质吞噬Dil-ac-LDL发红色荧光(图1b,此图为双染图片融合后的复合图像)。Ⅷ因子细胞化学试验阳性,细胞呈现棕色(图1c),作为对照的胃癌细胞不显色。

图1 EPCs的形态与鉴定
2.2 黄芪甲苷对EPCs增殖能力的影响 与正常对照组比较,BaP明显抑制了EPCs的增殖能力(P<0.01);经过24h干预后,黄芪甲苷能恢复EPCs受损的增殖能力,且随着浓度的增高而增高(均P<0.01),详见图2。
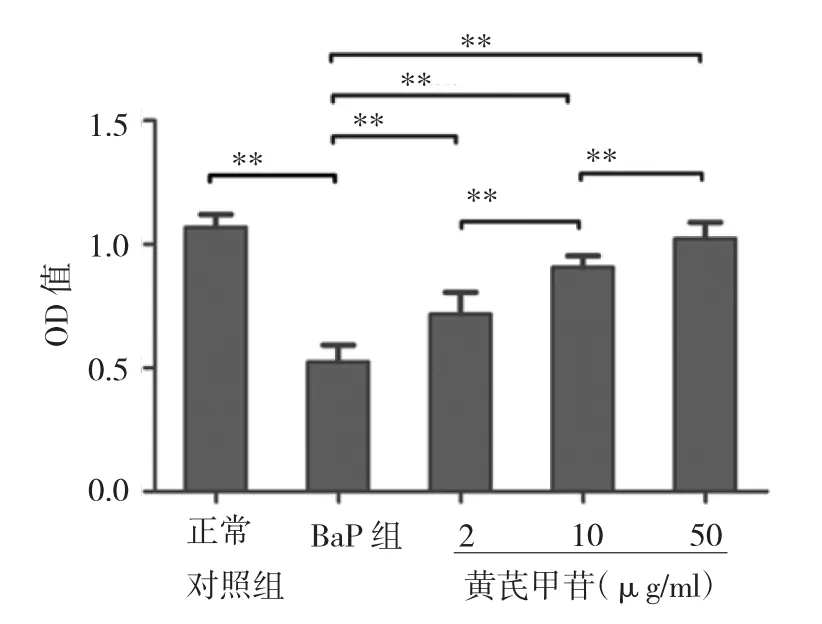
图2 黄芪甲苷对EPCs增殖能力的影响(*P<0.05,**P<0.01)
2.3 黄芪甲苷对EPCs黏附能力的影响 与正常对照组比较,BaP对EPCs的黏附能力有损害作用(P<0.01),经过不同浓度黄芪甲苷干预后,黄芪甲苷能恢复EPCs受损的黏附能力,且随着浓度的增高而增高(均P<0.05),详见图3。

图3 黄芪甲苷对EPCs黏附能力的影响(*P<0.05,**P<0.01)
2.4 黄芪甲苷对EPCs迁移能力的影响 与正常对照组比较,BaP明显损害EPCs的迁移能力(P<0.01),经过24h干预后,黄芪甲苷能恢复EPCs受损的迁移能力,且随着浓度的增高而增高(均P<0.01),详见图4(见插页)。
2.5 黄芪甲苷对EPCs中SOD及MDA含量的影响与正常对照组比较,BaP组的SOD含量明显降低(P<0.01),MDA含量明显上升(P<0.01);与BaP组相比,不同浓度黄芪甲苷组的SOD含量明显上升(P<0.05),MDA含量下降(P<0.05),并且在一定浓度范围内,随着黄芪甲苷浓度的增加,效果越明显,详见图5。
2.6 黄芪甲苷对EPCs中ROS的影响 与正常对照组比较,BaP组的ROS表达显著上升(P<0.01);与BaP组相比,不同浓度黄芪甲苷组的ROS表达明显下降(P<0.01),且呈浓度依赖性,详见图6(见插页)。
3 讨论
EPCs是出生后机体中存在的、能特异性归巢于血管损伤、血管新生部位并分化成内皮细胞的一群干/祖细胞[4]。近年来,EPCs在心血管疾病发生、发展乃至治疗中的作用越来越受关注[9]。研究证实,其数量及功能受损可导致血管内皮细胞修复功能减弱,从而促使动脉粥样硬化的发生[10]。吸烟是动脉粥样硬化的危险因素,而BaP是香烟烟雾的重要组成部分。本研究发现,与正常对照组相比,BaP显著损害EPCs的增殖、黏附、迁移能力,并且明显减低细胞上清液中SOD含量,提高MDA含量及ROS的表达,笔者推测BaP对EPCs生物学功能的损害可能与氧化应激相关。
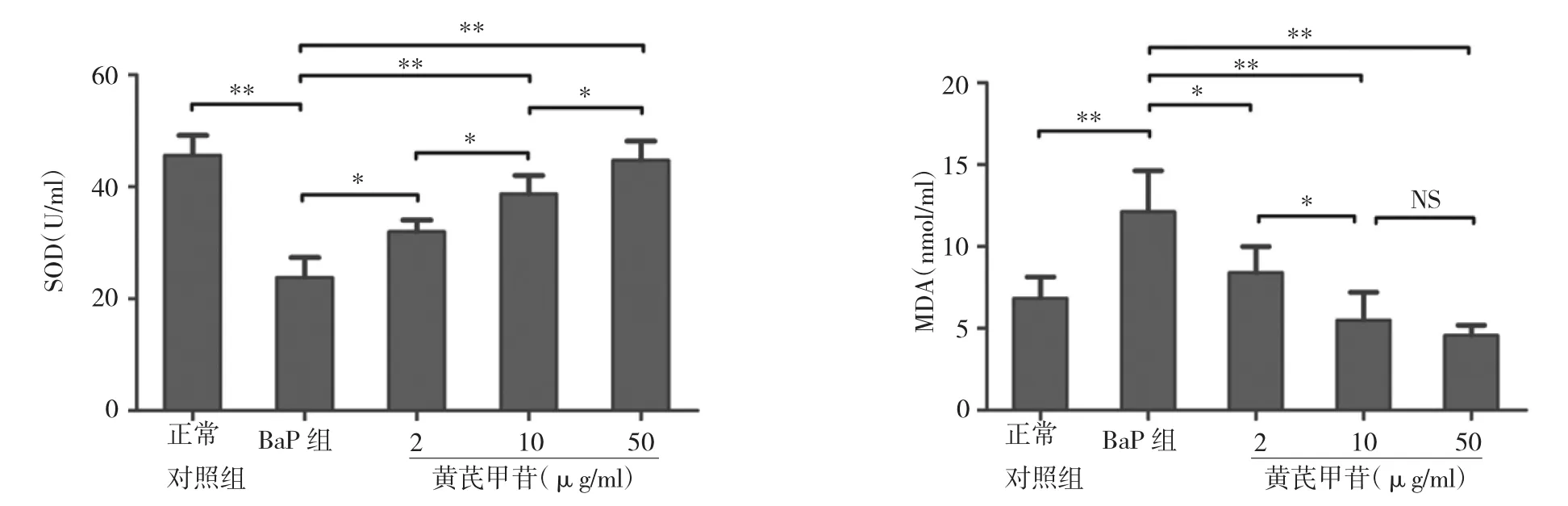
图5 黄芪甲苷对EPCs中SOD及MDA的影响(*P<0.05,**P<0.01)
有研究显示,适当水平的ROS,例如超氧离子、二氧化二氢,可以作为细胞活动中的一种信号因子,对于细胞的正常生长、迁移、分化、凋亡和衰老有着重要的作用[11]。但是,过量的ROS对于各种细胞,如EPCs或其它干细胞、祖细胞则是有害的[12]。SOD是一种生物酶,他通过岐化方式清除体内的氧自由基,保护细胞和基质免受氧自由基的损害[13]。研究表明,人EPCs之所以可以耐受适当的氧化应激,是因为其细胞内含有较多可以清除超氧负离子的酶-锰SOD(MnSOD)[14],而过强的氧化应激会使得EPCs的功能活性受损[15]。MDA作为氧自由基,与生物膜不饱和脂肪酸发生脂质过氧化物的程度,间接反应细胞受自由基的损伤程度相关[16]。
黄芪,作为一种中药,曾长期被广泛用于治疗多种心血管疾病[7]。从黄芪中可以分离纯化得到许多具有药用价值的化合物,包括黄芪皂苷、多糖和黄酮,而黄芪甲苷是其中重要活性部分之一。目前体内和体外研究表明黄芪甲苷可能通过抗氧化效应对心肌起保护作用[17-18]。本研究发现黄芪甲苷能改善BaP介导的EPCs多种生物学功能,包括增殖能力、黏附能力、迁移能力,并且伴随着EPCs多种生物学功能的改善,黄芪甲苷能够显著升高上清液中SOD含量,降低MDA含量及ROS的表达。这提示着黄芪甲苷可能通过减少氧化应激从而对BaP介导的EPCs起到保护作用。
本研究为黄芪甲苷治疗心血管疾病提供了新的证据,也间接说明其在心血管疾病治疗领域上有着广阔的前景。
[1] Libby P.Inflammation in atherosclerosis[J].Nature,2002,420 (6917):868-874.
[2] Isaacs A,Willems S M,Bos D,et al.Risk scores of common genetic variants for lipid levels influence atherosclerosis and incident coronary heart disease[J].Arterioscler Thromb Vasc Biol,2013, 33(9):2233-2239.
[3] Liu Z,Ren X,Yang Z,et al.Effects and mechanisms of indol-2, 3-dione on atherosclerosis[J].Int J Clin Exp Med,2014,7(8): 2087-2091.
[4] Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1977,275 (5302):964-967.
[5] Rodgman A,Smith C J,Perfetti T A.The composition of cigarette smoke:a retrospective,with emphasis on polycyclic components [J].Hum Exp Toxicol,2000,19(10):573-595.
[6] Ji K,Xing C,Jiang F,et al.Benzo[a]pyrene induces oxidative stress and endothelial progenitor cell dysfunction via the activation of the NF-kappaB pathway[J].Int J Mol Med,2013,31(4): 922-930.
[7] Lei Z Y.Effect of Astragalus membranaceus on cardiovascular system[J].Zhongguo Zhong XiYiJie He Za Zhi,1993,13(7):443-446.
[8] Han L,Chen K.Progress of experimentalpharmacologic study on the effect ofAstragaus on the cardiac vascular system[J].Zhongguo Zhong XiYiJie He Za Zhi,2000,20(3):234-237.
[9] Sen S,McDonald S P,Coates P T,et al.Endothelial progenitor cells:novel biomarker and promising cell therapy for cardiovascular disease[J].Clin Sci(Lond),2011,120(7):263-283.
[10] GiannottiG,Doerries C,Mocharla P S,et al.Impaired endothelial repair capacity of early endothelialprogenitor cells in prehypertension:relation to endothelial dysfunction[J].Hypertension, 2010,55(6):1389-1397.
[11] Griendling K K,Sorescu D,Ushio-Fukai M.Nad(p)h oxidase: Role in cardiovascular biology and disease[J].Circ Res,2000, 86(5):494-501.
[12] Yao E H,Yu Y,Fukuda N.Oxidative stress on progenitor and stem cells in cardiovascular diseases[J].Curr Pharm Biotechnol, 2006,7(2):101-108.
[13] Afonso V,Champy R,Mitrovic D,et al.Reactive oxygen species and superoxide dismutases:role in joint diseases[J].Joint Bone Spine,2007,74(4):324-329.
[14] Dernbach E,Urbich C,Brandes R P,et al.Antioxidative stressassociated genes in circulating progenitor cells:Evidence forenhanced resistance against oxidative stress[J].Blood,2004, 104(12):3591-3597.
[15] Thum T,Fraccarollo D,Thum S,et al.Differential effects of organic nitrates on endothelial progenitor cells are determined by oxidative stress[J].Arterioscler Thromb Vasc Biol,2007,27(4): 748-754.
[16] Fattman C L,Schaefer L M,Oury T D.Extracellular superoxide dismutase in biology and medicine[J].Free Radic Biol Med, 2003,35(3):236-256.
[17] Lai P K,Chan J Y,Cheng L,et al.Isolation of anti-inflammatory fractions and compounds from the root of Astragalus membranaceus[J].Phytother Res,2013,27(4):581-587.
[18] Zhao M,Zhao J,He G,et al.Effects of astragaloside IVon action potentials and ionic currents in guinea-pig ventricular myocytes [J].BiolPharm Bull,2013,36(4):515-521.
Protective effect of astragaloside IV on benzo[a]pyrene-mediated endothelial progenitor cell dysfunction and its mechanism
CHEN Jun,XIA Wujie,XUE Yangjing,et al.Department of Intensive Care Unit,the First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000,China
Objective To investigate the protective effect ofAstragaloside IV(As IV)on benzo[a]pyrene(BaP)-mediated endothelial progenitor cell(EPC)dysfunction and to explore the underlying mechanism. Methods Human umbilical cord blood mononuclear cells were seeded in adherent culture to obtain EPCs.The EPCs were divided into 3 groups:control group,BaP group,and As IV group.BaP and Ac IV groups were treated with 20μmol/L BaP for 24h,and before exposure to BaP the As IV groups were pre-treated with different concentrations of Astragaloside IV(2,10 and 50μg/ml)for 24h.The proliferation,adhesion and migration of EPCs were evaluated by CCK-8 method,adhesion assay and Transwell assay,respectively.The superoxide dismutase(SOD)and malondialdehyde(MDA)levels in culture supernatants were measured,and the expression of ROS was detected by immunofluorescence staining. Results Compared to the control group,BaP-treated EPCs showed a decline in proliferation,adhesion and migration (P<0.01);while As IV treatment significantly attenuated BaP-induced decline of cell proliferation,adhesion and migration(P<0.05)in EPCs.Furthermore,BaP-treated EPCs presented an increasing expression of ROS and MDA,but a decline ofSOD secretion(P<0.01);while various concentrations of Astragaloside IVreduced the production of MDA(P<0.05)and ROS(P<0.01),and increased the SOD activity(P<0.05)of EPCs in a concentration-dependent manner. Conclusion Astragaloside IVis able to prevent BaP-mediated EPCs dysfunction,probably by inhibiting oxidative stress.
Benzo[a]pyrene(Bap)Endothelialprogenitor cells(EPCs)Astragaloside IV Oxidative stress
2015-08-18)
(本文编辑:严玮雯)
325000 温州医科大学附属第一医院心脏监护室(陈军);温州医科大学附属第二医院ICU(胡建坚),心血管内科(夏武杰、薛杨静)
陈军,E-mail:531818260@qq.com
