5种肿瘤干细胞标志物在非小细胞肺癌组织中的表达及临床意义
2016-12-23蔡传书王培荣吕文龙
蔡传书 王培荣 黄 雄 吕文龙
(福建医科大学附属第一医院放疗科,福建 福州 350005)
5种肿瘤干细胞标志物在非小细胞肺癌组织中的表达及临床意义
蔡传书 王培荣 黄 雄 吕文龙
(福建医科大学附属第一医院放疗科,福建 福州 350005)
目的 探讨CD133、滋养层细胞表面抗原-2(TROP-2)、CD44、三磷酸腺苷结合转运蛋白G超家族成员2(ABCG2)及神经营养因子受体p75(p75NTR)五种肿瘤干细胞(CSC)标志物在非小细胞肺癌(NSCIC)组织中的表达及其与临床病理参数间的关系。方法 选取80例NSCLC组织、33例癌旁组织、28例正常组织为研究对象,采用免疫组化法检测各组织中CD133、CD44、TROP-2、ABCG2及p75NTR蛋白表达的差异,分析其与NSCLC患者病理参数的相关性。结果 (1)CD133、CD44、TROP-2、ABCG2及p75NTR在NSCLC组织中的阳性率分别为80.00%、87.50%、50.00%、62.50%、68.75%;在癌旁组织中的阳性率分别为6.06%、30.30%、15.15%、21.21%、12.12%;在正常组织中的阳性率分别为46.43%、10.71%、21.43%、21.43%、21.43%,各指标在不同组织间的阳性率比较差异均有统计学意义(P<0.05)。(2)随着细胞分化程度的降低,NSCLC组织中的CD133、CD44、TROP-2、ABCG2及p75NTR的阳性率均呈上升趋势(P<0.05),CD133、TROP-2阳性率与NSCIC患者年龄、淋巴结转移、TNM分期有关(P<0.05),ABCG2及p75NTR阳性率与NSCIC患者年龄及远处转移有关(P<0.05)。结论 NSCLC组织中CD133、CD44、TROP-2、ABCG2及p75NTR的表达水平异常,且均与NSCLC肿瘤细胞分化密切相关。
非小细胞肺癌;肿瘤干细胞
肿瘤干细胞(CSC)是肿瘤组织中具有自我更新、增殖以及多向分化的肿瘤细胞,也是肿瘤不断生长、转移与复发根源〔1〕。CD133是一种经典的CSC标志物〔2,3〕,众多研究表明,滋养层细胞表面抗原-2(TROP-2)、CD44、三磷酸腺苷结合转运蛋白G超家族成员2(ABCG2)及神经营养因子受体p75(p75NTR)等也具有CSC特性,可以作为CSC筛选标志物,与肿瘤生长、转移、侵袭息息相关〔4,5〕。本研究采用免疫组化法检测CSC标记物CD133、CD44、TROP-2、ABCG2及p75NTR在非小细胞肺癌(NSCLC)、癌旁及正常组织中的表达情况,分析其与临床病理参数的相关性。
1 资料和方法
1.1 临床资料 抽选2010年3月至2015年7月在我院行手术切除术的80例NSCLC患者,留取手术组织标本存档。纳入标准:①临床上均经组织学检查,确诊为NSCLC;②患者术前均未予以放、化疗治疗或者其他抑制肿瘤治疗,排除其他类型肺癌患者。男30例,女50例,年龄44~73岁,平均(62.8±8.6)岁。取33例癌旁组织、28例正常组织进行检测,其中癌旁组织男12例,女21例,年龄48~77岁,平均(63.8±9.1)岁。正常组织:其中男10例,女18例,年龄45~75岁,平均(62.9±8.9)岁。三组性别、年龄资料比较均无统计学差异(P>0.05),具有可比性。
1.2 方法
1.2.1 试剂 CD133多克隆抗体购自英国Abcam公司。ABCG2、p75NTR、EnVisionTM检测试剂盒购自Gene Tech公司,CD44兔抗人抗体购自武汉博士德公司,羊抗人TROP-2多抗购自美国R&D公司,DAB显色剂(DAB003)购自福州迈新生物技术开发有限公司。
1.2.2 免疫组织化学染色法 所有组织标本经10%甲醛固定,石蜡包埋组织,连续切片,厚度4 μm,利用二甲苯和乙醇脱蜡水化等处理。切片入pH6.0柠檬酸缓冲液进行冲洗,高温、高压抗原修复。自来水冲洗冷却至室温后,采用PBS进行液洗3次,5 min/次。用3% H2O2滴加至切片上,室温孵育30 min,继而PBS洗涤3次,5 min/次。甩去PBS液,每张切片上滴加50 μl稀释后的CD133多克隆抗体、ABCG2、p75NTR、CD44兔抗人抗体、羊抗人TROP-2多抗;湿盒内孵育1 h,PBS洗涤3次,5 min/次。甩去PBS液,滴加EnVisionTM试剂盒试剂1,室温孵20 min,继而PBS洗涤3次,5 min/次。甩去PBS液,滴加EnVisionTM试剂盒试剂2,室温孵育30 min,继而PBS 洗涤3次,5 min/次。甩去PBS液,滴加DAB 显色液,封片,显微镜下观察,用PBS磷酸缓冲液代替一抗作阴性对照。
1.3 阳性结果判断标准 由2名病理医生在对标本资料不知情的情况下独立完成。标准:DAB阳性染色为棕色或黄色,计数4个不重叠的高倍视野下大约200个癌细胞,阳性细胞数>10%为阳性,≤10%为阴性。
1.4 统计学方法 采用SPSS17.0软件,计量资料组间采用t检验,计数资料采用χ2检验。
2 结 果
2.1 5种CSC标志物在NSCIC、癌旁组织、正常组织中的表达 CD133、CD44、TROP-2、ABCG2及p75NTR在NSCLC组织中的阳性率分别为80.00%、87.50%、50.00%、62.50%、68.75%;在癌旁组织中的阳性率分别为6.06%、30.30%、15.15%、21.21%、12.12%;在正常组织中的阳性率分别为46.43%、10.71%、21.43%、21.43%、21.43%,各指标在不同组织间的阳性率比较均有统计学差异(P<0.05)。
2.2 5种CSC标志物表达与NSCIC病理参数的关系 见表1。随着细胞分化程度的降低,NSCLC组织中的CD133、CD44、TROP-2、ABCG2及p75NTR的阳性率均呈上升趋势(P<0.05);此外,CD133、TROP-2阳性率与NSCIC患者年龄、淋巴结转移、TNM分期有关(P<0.05),ABCG2及p75NTR阳性率与NSCIC患者年龄及远处转移有关(P<0.05)。
表1 5种CSC标志物表达与NSCIC病理参数的关系〔n(%)〕
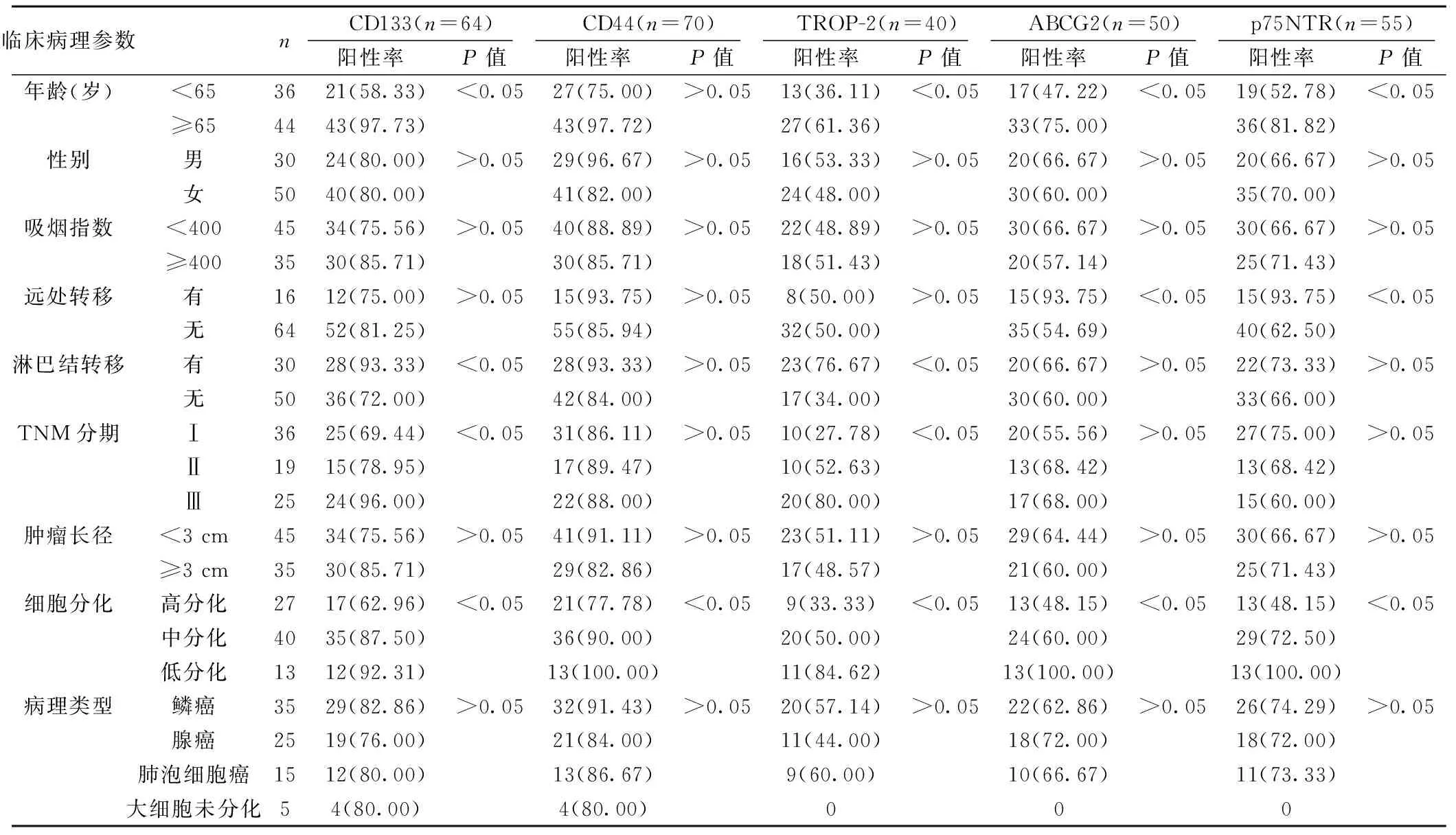
临床病理参数nCD133(n=64)阳性率 P值CD44(n=70)阳性率 P值TROP-2(n=40)阳性率 P值ABCG2(n=50)阳性率 P值p75NTR(n=55)阳性率 P值年龄(岁)<653621(58.33)<0.0527(75.00)>0.0513(36.11)<0.0517(47.22)<0.0519(52.78)<0.05≥654443(97.73)43(97.72)27(61.36)33(75.00)36(81.82)性别男3024(80.00)>0.0529(96.67)>0.0516(53.33)>0.0520(66.67)>0.0520(66.67)>0.05女5040(80.00)41(82.00)24(48.00)30(60.00)35(70.00)吸烟指数<4004534(75.56)>0.0540(88.89)>0.0522(48.89)>0.0530(66.67)>0.0530(66.67)>0.05≥4003530(85.71)30(85.71)18(51.43)20(57.14)25(71.43)远处转移有1612(75.00)>0.0515(93.75)>0.058(50.00)>0.0515(93.75)<0.0515(93.75)<0.05无6452(81.25)55(85.94)32(50.00)35(54.69)40(62.50)淋巴结转移有3028(93.33)<0.0528(93.33)>0.0523(76.67)<0.0520(66.67)>0.0522(73.33)>0.05无5036(72.00)42(84.00)17(34.00)30(60.00)33(66.00)TNM分期Ⅰ3625(69.44)<0.0531(86.11)>0.0510(27.78)<0.0520(55.56)>0.0527(75.00)>0.05Ⅱ1915(78.95)17(89.47)10(52.63)13(68.42)13(68.42)Ⅲ2524(96.00)22(88.00)20(80.00)17(68.00)15(60.00)肿瘤长径<3cm4534(75.56)>0.0541(91.11)>0.0523(51.11)>0.0529(64.44)>0.0530(66.67)>0.05≥3cm3530(85.71)29(82.86)17(48.57)21(60.00)25(71.43)细胞分化高分化2717(62.96)<0.0521(77.78)<0.059(33.33)<0.0513(48.15)<0.0513(48.15)<0.05中分化4035(87.50)36(90.00)20(50.00)24(60.00)29(72.50)低分化1312(92.31)13(100.00)11(84.62)13(100.00)13(100.00)病理类型鳞癌3529(82.86)>0.0532(91.43)>0.0520(57.14)>0.0522(62.86)>0.0526(74.29)>0.05腺癌2519(76.00)21(84.00)11(44.00)18(72.00)18(72.00)肺泡细胞癌1512(80.00)13(86.67)9(60.00)10(66.67)11(73.33)大细胞未分化54(80.00)4(80.00)000
3 讨 论
现代肿瘤手术、放化疗、生物治疗技术均在不断进步,但随着放化疗抵抗的发生,NSCLC等肿瘤患者的术后复发率、临床死亡率仍居高不下〔6,7〕,故寻找NSCLC治疗的新靶点,对患者个体化治疗及预后具有重要临床价值。近年研究发现,靶向CSC是根治肿瘤的一个临床新方向〔8〕,CSC是肿瘤细胞中的特殊细胞,具有极强的自我更新、分化能力,发挥多种功能;此外,CSC具有较强迁徙以及运动能力,可促进细胞转移,引发肿瘤浸润和转移等〔9,10〕,另外,CSC还可长期维持正常机体的相对稳定休眠状态,有较强的耐药性。有研究认为〔11〕,CSC是肿瘤发生、发展及复发的源泉,肿瘤生长以及分化最终取决于其组织中CSC表达,同时肿瘤本身具有转移潜力,当机体CSC表达达到一定程度时,肿瘤的转移将不可避免。研究人员近年来相继在胶质瘤、结肠癌、乳腺癌、肝癌等中发现CSC表达〔12〕,而NSCLC组织中的CSC表达及作用机制一直存在较大争议。研究发现,肺组织中存在细支气管肺泡干细胞(BASCs),这为CSC对肺癌的发病作用提供了实验依据〔13〕。
CD133是Prominin 家族成员,存在于外周血、骨髓、脐带血及其他组织中〔14〕,CD133+对肿瘤增殖、分化、复发有着关键作用〔15,16〕。有研究发现,CD133+表达与肿瘤预后相关,高水平的CD133结直肠癌病人预后较差〔17〕。本研究提示CD133在NSCLC组织中异常高表达,同时肿瘤细胞分化程度越低、TNM分期越高,存在淋巴结转移患者中的阳性表达率越高,这说明CD133阳性表达参与了NSCLC肿瘤干细胞的增殖、分化及转移等过程。
CD44是一种广泛存在于表皮细胞与间皮细胞中的黏附分子,主要参与异质性黏附,即肿瘤细胞与宿主细胞和宿主基质的黏附,异质性黏附在肿瘤细胞侵袭转移中起促进作用,与恶性肿瘤发生发展密切相关〔18〕。国外文献报道,CD44在前列腺癌组织中表达升高,与癌细胞生长存在相关性〔19〕。国内有研究〔20〕报道,CD44在NSCLC组织中的阳性率为65.33%,明显高于正常肺组织的20.00%且CD44过量表达患者的生存率低于正常水平者。本研究与上述研究结果一致,进一步证实CD44的异常表达与NSCLC的发病有关。此外,本研究中CD44阳性表达率随着肿瘤细胞分化程度的降低而呈上升趋势,提示CD44阳性表达影响着NSCLC的发生、发展。
TROP-2是一种跨膜糖蛋白,在正常人体合包体滋养层、细胞滋养层及复层上皮细胞均存在表达,具有调节肿瘤细胞生长、侵袭以及转移的作用。近年来,已证实TROP-2在鼻咽癌、乳腺癌、前列腺癌、卵巢癌等许多实体瘤中表达水平增高〔21〕。本文结果也说明TROP-2与NSCLC的发生、发展有关。
ABCG2是一种转运蛋白,在维持细胞自身稳定及机体正常生理功能等方面起着重要作用,主要定位于细胞膜上,正常生理下可保护机体,而对肿瘤而后则可导致其耐药。研究发现,三磷酸腺苷结合盒转运体(ABC)仅在干细胞上表达,具有分化调节干细胞作用〔22〕。p75NTR是肿瘤坏死因子受体成员,主要在神经细胞的早期发育过程中大量表达,通过不同的信号转导通路诱导以神经细胞为主的细胞增殖、迁移、分化、生存、凋亡、突触的建立和神经的形成,发挥多重生物学效应。早期认为p75NTR仅参与神经细胞发育早期的增殖、迁移、凋亡,近年来研究发现,p75NTR阳性细胞自我更新、增殖及多向分化能力较强,证实为食管上皮CSC〔23〕。本研究结果显示,ABCG2及p75NTR的表达在肿瘤发生、发展过程中可能发挥作用,但其相关性仍需加大样本量分析。
1 吴兆利,李华栋,杨 光,等.肿瘤干细胞及其模型的研究现状及临床治疗最新进展〔J〕.现代生物医学进展,2015;15(1):178-80,194.
2 Qiu ZX,Zhao S,Mo XM,etal.Overexpression of PROM1(CD133)confers poor prognosis in non-small cell lung cancer〔J〕.Int J Clin Exp Pathol,2015;8(6):6589-95.
3 Mohamadnejad M,Vosough M,Moossavi S,etal.Intraportal infusion of bone marrow mononuclear or CD133+ cells in patients with decompensated cirrhosis:a double-blind randomized controlled trial〔J〕.Stem Cells Transl Med,2016;5(1):87-94.
4 Yamaguchi T,Okumura T,Hirano K,etal.Detection of circulating tumor cells by p75NTR expression in patients with esophageal cancer〔J〕.World J Surg Oncol,2016;14(1):40.
5 Zhang R,Zhang P,Wang H,etal.Inhibitory effects of metformin at low concentration on epithelial-mesenchymal transition of CD44(+)CD117(+)ovarian cancer stem cells〔J〕.Stem Cell Res Ther,2015;6(1):262.
6 Valizadeh A,Ahmadzadeh A,Saki G,etal.Role of tumor necrosis factor-producing mesenchymal stem cells on apoptosis of chronic B-lymphocytic tumor cells resistant to fludarabine-based chemotherapy〔J〕.Asian Pac J Cancer Prev,2015;16(18):8533-9.
7 Murayama T,Nakaoku T,Enari M,etal.Oncogenic fusion gene CD74-NRG1 confers cancer stem cell-like properties in lung cancer through a IGF2 autocrine/paracrine circuit〔J〕.Cancer Res,2016;76(4):974-83.
8 岳冬丽,韩交玲,关方霞,等.肿瘤干细胞的研究进展及临床意义〔J〕.郑州大学学报(医学版),2013;48(1):1-8.
9 Tomellini E,Touil Y,Lagadec C,etal.Nerve growth factor and proNGF simultaneously promote symmetric self-renewal,quiescence,and epithelial to mesenchymal transition to enlarge the breast cancer stem cell compartment〔J〕.Stem Cells,2015;33(2):342-53.
10 Park HJ,Oh JS,Chang JW,etal.Proton irradiation sensitizes radioresistant non-small cell lung cancer cells by modulating epidermal growth factor receptor-mediated DNA repair〔J〕.Anticancer Re,2016;36(1):205-12.
11 马 远,冯 军,吴灵芝,等.CD133+肺癌干细胞中基质金属蛋白酶9和缺氧诱导因子2α的表达及其病理学机制〔J〕.中华医学杂志,2015;95(32):2607-11.
12 何 敬.肺癌干细胞研究进展综述〔D〕.石家庄:河北医科大学,2015.
13 洪 暄,陈国涵,刘中民,等.肺癌干细胞研究进展〔J〕.中华胸心血管外科杂志,2011;27(6):380-2.
14 Kazama S,Kishikawa J,Yasuda K,etal.CD133 Expression in lymph node metastases is associated with tumor aggressiveness during lymph node metastasis in colorectal cancer〔J〕.Anticancer Res,2015;35(12):6599-605.
15 周 蕾,武世伍,俞岚,等.非小细胞肺癌中CD133和Notch1的表达及其临床病理意义〔J〕.南方医科大学学报,2015;35(2):196-201.
16 Poon MW,Zhuang JT,Wong ST,etal.Co-expression of cytoskeletal protein adducin 3 and CD133 in neurospheres and a temozolomide-resistant subclone of glioblastoma〔J〕.Anticancer Res,2015;35(12):6487-95.
17 Aravantinos G,Isaakidou A,Karantanos T,etal.Association of CD133 polymorphisms and response to bevacizumab in patients with metastatic colorectal cancer〔J〕.Cancer Biomark,2015;15(6):843-50.
18 Leung EL,Fiscus RR,Tung JW,etal.Non-small cell lung cancer cells expressing CD44 are enriched for stem cell-like properties〔J〕.PLoS One,2010;5(11):e14062.
19 Doherty RE,Haywood-Small SL,Sisley K,etal.Aldehyde dehydrogenase activity selects for the holoclone phenotype in prostate cancer cells〔J〕.Biochem Biophys Res Commun,2011;414(4):801-7.
20 李士亭,陶文成.肿瘤干细胞表面标记物CD44在胃癌浸润和淋巴结转移中的作用〔J〕.中国组织工程研究,2015;19(23):3669-73.
21 刘观成,何晓松,宣广旭,等.肿瘤干细胞标志物在鼻咽癌细胞株中的表达〔J〕.现代医药卫生,2015;31(6):801-3.
22 曹 娟,白淑玮.microRNA对人视网膜母细胞瘤肿瘤干细胞多药耐药性的影响〔J〕.中国医药导报,2014;11(27):4-8,20.
23 黄燕燕,裴学莲,刘 洋,等.多种肿瘤干细胞标志物在食管鳞癌Eca109细胞球细胞中的表达〔J〕.解剖学报,2014;45(3):350-3.
〔2016-07-15修回〕
(编辑 郭 菁)
蔡传书(1965-),男,主任医师,主要从事肿瘤诊断与放射治疗方面的研究。
R73
A
1005-9202(2016)23-5905-03;
10.3969/j.issn.1005-9202.2016.23.058
