EZH2抑制剂联合顺铂对非小细胞肺癌A549细胞增殖、凋亡的影响
2016-12-23张艳华
张艳华 陆 颖 陈 霞
(南通市第一人民医院药剂科,江苏 南通 226001)
EZH2抑制剂联合顺铂对非小细胞肺癌A549细胞增殖、凋亡的影响
张艳华 陆 颖 陈 霞
(南通市第一人民医院药剂科,江苏 南通 226001)
目的 探讨EZH2抑制剂UNC1999 联合顺铂对肺癌A549细胞增殖、凋亡的影响。方法 传代培养人肺癌A549细胞系,取生长良好的传代细胞分为对照组、联合用药组、顺铂组和UNC1999 组。所有组均给予RPMI 1640培养液及10%的胎牛血清培养,对照组不加药液,联合用药组分别加入10、20、40、80、160 nmol /L UNC1999 药液及2.5、5、10、20、40 μg/ml顺铂药液;顺铂组分别加入2.5、5、10、20、40 μg/ml顺铂药液;UNC1999 组分别加入10、20、40、80、160 nmol/L 的UNC1999 药液;采用MTT比色法检测各组细胞增殖抑制率中IC50及联合指数(CI)。Western印迹法检测各组相关凋亡蛋白及细胞外调节蛋白激酶(ERK)及p-ERK的表达水平。流式细胞术检测各组细胞凋亡情况。结果 与对照组相比,UNC1999组、顺铂组、联合用药组细胞增殖均受到不同程度抑制(P<0.05)。各组细胞增殖抑制作用存在剂量-时间依赖关系,且UNC1999与顺铂存在协同作用。UNC1999组、顺铂组、联合用药组与对照组比较细胞凋亡差异显著(P<0.05)。UNC1999组、顺铂组、联合用药组中凋亡蛋白Bax、Caspase-3表达明显升高,p-ERK蛋白表达明显降低,联合用药组Bcl-2表达低于对照组(P<0.05)。结论 EZH2特异性抑制剂UNC199可能通过抑制MAPK-ERK细胞通路起到抑制肺癌A549细胞增殖,促进其凋亡,与顺铂单药或联合均具有协同效应。
EZH2抑制剂;顺铂;ERK信号通路;非小细胞肺癌
化疗在非小细胞肺癌(NSCLC)的治疗中占有重要的地位,而以顺铂为基础的化疗方案是NSCLC的主要治疗手段〔1,2〕。但目前顺铂的耐药已经普遍存在〔3,4〕。胞外信号调控激酶(ERK)是真核生物中广泛存在的一类丝氨酸/苏氨酸蛋白激酶(MAPK)中的一种,通过整合素进入细胞核内,促进多种转录因子磷酸化,增强转录活性,与细胞增殖、凋亡等多种生物学行为有关〔5〕。果蝇zeste基因增强子同源物2(EZH2)基因属于PeG基因家族,具有抑制基因和沉默起始基因的作用,在多种肿瘤中都有高表达,与肿瘤的侵袭增殖、转移等具有密切的关系〔6,7〕。本研究主要观察EZH2抑制剂联合顺铂对肺癌A549细胞增殖及凋亡的影响,并探讨其作用机制。
1 材料与方法
1.1 材料 肺癌A549细胞系,RPMI 1640培养液,鼠抗人ERK及磷酸化ERK(p-ERK)、Caspase-3、Bcl-2、Bax和β-actin 单克隆抗体,核糖核酸酶、甲基偶氮唑蓝(MTT)、顺铂、EZH2抑制剂UNC1999。
1.2 细胞培养与分组 取出存有肺癌A549细胞的冻存管,放于37℃温水中,用镊子夹住轻轻摇动使其迅速融化。1 000~2 000 r/min,3~5 min离心,无菌条件下打开冻存管,移去上清液,加入1 ml预热的细胞培养液将细胞吹散开,然后转移至25 cm2培养瓶中。加入4 ml的RPMI 1640培养液及10%的胎牛血清。置于37℃、5%CO2培养24 h后,更换培养液。后加入1 ml消化液,在37℃培养箱中孵育5~8 min后把培养瓶放置在倒置显微镜下观察,发现细胞的胞质回缩、胞间质增大后,终止消化。加入5 ml预热至37℃的培养液,反复吹打后,吸取一半的细胞悬液,以1∶2传代接种到新的25 cm2培养瓶中,补足培养液至5~10 ml,加10%~20%的胎牛血清。倒置显微镜下观察,37℃、5%CO2培养。用含10%胎牛血清的培养液配成单个细胞悬液,以每孔103~105个细胞接种到96孔板,每孔体积100~200 μl。同一培养条件,培养1~2 d。吸去原培养基,每孔加入以无血清培养基配制的不同浓度药物,分为对照组、联合用药组、顺铂组和UNC1999 组。对照组不加药液,联合用药组分别加入10、20、40、80、160 nmol /L UNC1999 药液及2.5、5、10、20、40 μg/ml顺铂药液;顺铂组分别加入2.5、5、10、20、40 μg/ml顺铂药液;UNC1999 组分别加入10、20、40、80、160 nmol/L的UNC1999 药液。
1.3 MTT法检测细胞增殖抑制率 培养24或48 h后,每孔加MTT溶液(5 mg/ml,用pH7.4的PBS配制,避光保存)10~20 μl(如每孔培养基为100 μl,加10 μl;如每孔培养基为200 μl,加20 μl)。37℃继续孵育4 h,终止培养,小心吸弃孔内培养上清液(对于悬浮细胞需要离心后再吸弃孔内培养上清液)。每孔加150 μl DMSO,振荡10 min,使结晶物充分融解。选择490 nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,各组取平均值,以时间为横坐标,吸光值为纵坐标绘制曲线。细胞增殖抑制率(%)=1-(实验组OD值/对照组OD值)×100%。采用Origin7.5软件计算抑制细胞增殖50%的药物浓度(IC50)及联合指数(CI)。
1.4 细胞凋亡率检测 根据MTT计算的IC50结果,分别选取三个用药组相应浓度亚组,即UNC1999 40 nmol/L组,顺铂10 μg/ml组,UNC1999 40 nmol/L+顺铂10 μg/ml组(联合用药组)。胰酶消化,1 ml PBS清洗后移入15 ml BD管中。800 r/min离心5 min,去上清,PBS吹洗,再次离心弃上清,重复两次,用0.1 ml冰PBS重悬,移到1.5 ml EP管中。加入浓度为20 μg/ml 的RNase A,37℃孵育30 min,加入PI(10 g/L),避光30 min,上机流式细胞仪检测。采用CellQuest软件计算细胞凋亡率。
1.5 Western印迹法检测相关凋亡蛋白 分别收集各亚组细胞1×107个,制备蛋白,制作标准曲线,加入5×SDS 上样缓冲液至终浓度为1×。沸水中煮5 min使蛋白变性。上样,电泳4 h,电压为40 V,转膜,脱色后晾干备用。上摇床5%脱脂牛奶封闭1 h,按预染Marker标记剪裁转印膜,分别加入p-ERK抗体(1∶1 000)、ERK(1∶500)、Bcl-2(1∶300)、Caspase-3(1∶250)、β-actin(1∶1 000)及Bax(1∶300)孵育过夜。用TBST脱色洗2次,每次10 min;再用TBS洗1次,10 min。加入辣根过氧化物酶标记的二抗(1∶800),室温反应30 min,ECL法化学发光,显影,定影。
1.6 统计学方法 采用SPSS16.0软件,两个样本间的比较采用t检验,多个样本组间比较采用单因素方差分析。
2 结 果
2.1 MTT法检测各组细胞增殖抑制率 与对照组相比,UNC1999组、顺铂组、联合用药组细胞增殖均受到不同程度抑制,且联合用药组细胞增殖抑制率均明显高于UNC1999组与顺铂组(P<0.05)。各组细胞增殖抑制作用存在剂量-时间依赖关系,见表1。根据结果计算IC50值:UNC1999组24、48、72 h的IC50分别为(72.48± 4.38)、(48.89± 3.86)、(23.62±2.16)nmol/L,顺铂组为(25.69±3.49)、(14.95±2.48)、(2.21±1.31)μg/ml。联合用药组24、48、72 h CI值分别为0.825、0.558、0.438,均<1,提示UNC1999与顺铂存在协同作用。

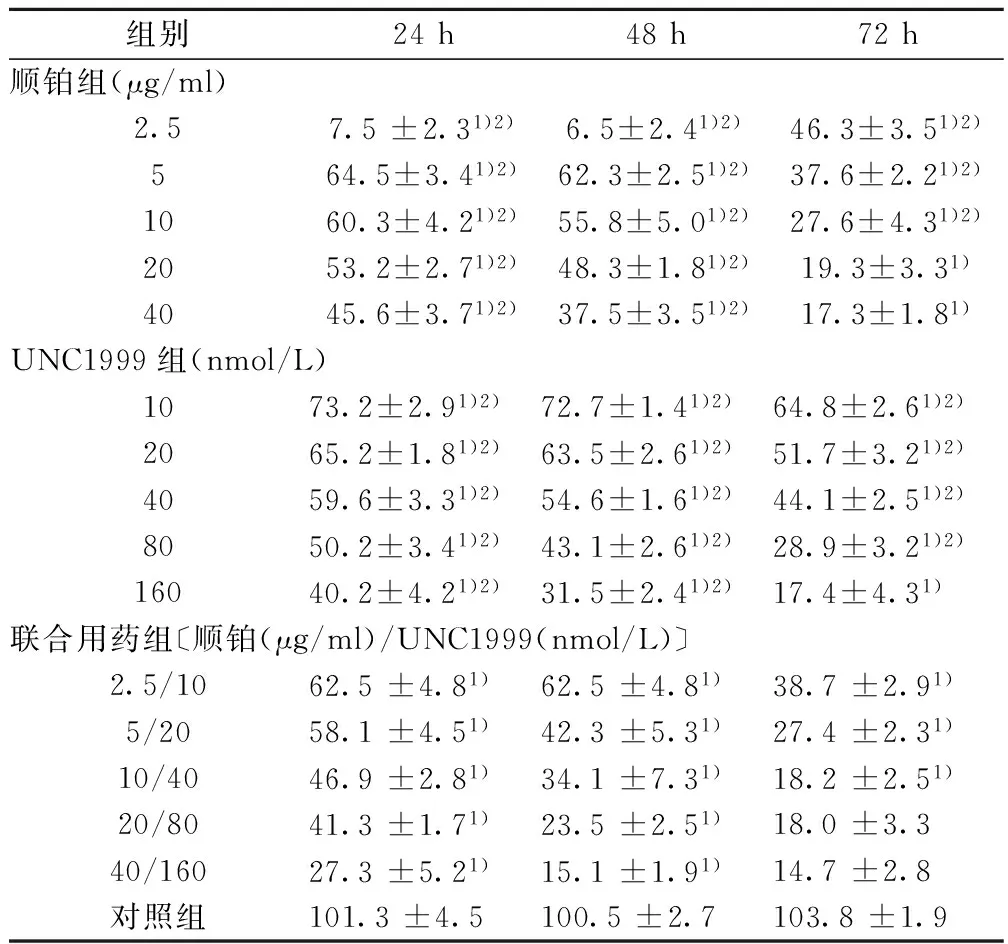
组别24h48h72h顺铂组(μg/ml)2.57.5±2.31)2)6.5±2.41)2)46.3±3.51)2)564.5±3.41)2)62.3±2.51)2)37.6±2.21)2)1060.3±4.21)2)55.8±5.01)2)27.6±4.31)2)2053.2±2.71)2)48.3±1.81)2)19.3±3.31)4045.6±3.71)2)37.5±3.51)2)17.3±1.81)UNC1999组(nmol/L)1073.2±2.91)2)72.7±1.41)2)64.8±2.61)2)2065.2±1.81)2)63.5±2.61)2)51.7±3.21)2)4059.6±3.31)2)54.6±1.61)2)44.1±2.51)2)8050.2±3.41)2)43.1±2.61)2)28.9±3.21)2)16040.2±4.21)2)31.5±2.41)2)17.4±4.31)联合用药组〔顺铂(μg/ml)/UNC1999(nmol/L)〕2.5/1062.5±4.81)62.5±4.81)38.7±2.91)5/2058.1±4.51)42.3±5.31)27.4±2.31)10/4046.9±2.81)34.1±7.31)18.2±2.51)20/8041.3±1.71)23.5±2.51)18.0±3.340/16027.3±5.21)15.1±1.91)14.7±2.8对照组101.3±4.5100.5±2.7103.8±1.9
与对照组比较:1)P<0.05;与联合用药组比较:2)P<0.05;下表同
2.2 各组细胞凋亡情况 UNC1999组、顺铂组、联合用药组及对照组细胞凋亡率分别为6.5%±1.4%、7.2%±2.2%、28.3%±2.5%、1.6%±0.3%。各组与对照组比较均有统计学差异(P<0.05)。
2.3 各组细胞相关凋亡蛋白检测 UNC1999组、顺铂组、联合用药组中凋亡蛋白Bax、Caspase-3表达均高于对照组(P<0.05)。联合用药组中Bax、Caspase-3表达也高于UNC1999组和顺铂组;但三组p-ERK蛋白表达均低于对照组,且联合用药组低于UNC1999组和顺铂组(P<0.05);联合用药组Bcl-2表达低于对照组(P<0.05)。见表2。
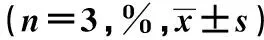

组别BaxCaspase-3Bcl-2p-ERKUNC1999组247.5±4.91)2)163.6±9.41)2)95.4±2.62)41.2±3.41)2)顺铂组371.5±6.61)2)190.2±5.71)2)80.7±4.12)22.4±2.11)2)联合用药组702.9±7.31)837.6±8.51)50.2±3.21)7.2±4.11)对照组103.2±3.7102.8±2.1103.6±2.9100.3±3.5
3 讨 论
PcG基因家族是一类与细胞周期和增殖相关的转录抑制子基因,主要包括PRC1和PRC2,PRC1具有抑制基因的作用,PRC2具有沉默起始基因的作用〔8〕。EZH2是PRC2的催化亚基,可抑制H3K27m3和H3K9m3的转录,从而在染色体水平调节基因活性,并干扰细胞DNA修复〔9,10〕。UNC1999一种有效的EZH1、EZH2特异性抑制剂,对EZH2 Y641和EZH2 Y641F突变体有很强的抑制活性,对细胞增殖有浓度依赖性的抑制〔11〕。顺铂具有广谱抗癌活性,是NSCLC基础化疗药物之一,能够与DNA链上的G共价结合,从而阻断DNA的复制及转录〔12,13〕。
本研究发现,UNC1999可以通过抑制EZH2抑制细胞增殖,且具有浓度依赖性。MTT证实UNC1999与顺铂联用可抑制肺癌A549细胞增殖,促进凋亡,且两药有明显的协同作用。
既往研究发现,MEK-ERK抑制剂可以不同程度抑制肿瘤细胞中EZH1和EZH2基因的表达,促进H3K27me3去甲基化酶的表达,因此,MEK-ERK信号通路参与了EZH2基因的调控,抑制ERK通路可以抑制EZH2基因的表达〔14,15〕。为阐明机制,本研究检测了相关凋亡蛋白的表达,结果发现IC50的UNC1999组、顺铂组及联合用药组中Bax、Caspase-3凋亡相关蛋白表达水平均高于对照组,而p-ERK蛋白表达均低于对照组。表明UNC1999及顺铂均可以抑制p-ERK蛋白表达,而且二者联合作用更为明显。二者可能通过抑制ERK信号通路的激活来促进A549细胞的凋亡。
1 梁 璇,丁新民,霍艳英,等.ERK1/2-Sp1信号通路对肺癌细胞VEGF的调控作用〔J〕.癌变·畸变·突变,2007;19(4):280-4.
2 张慧君.肺癌细胞上皮-间质转化及其PI3K/Akt和MEK/Erk信号通路的研究〔D〕.苏州:苏州大学,2010.
3 沈 杰.eIF3a和p27/Kip1表达变异对非小细胞肺癌化疗预后的影响及eIF3a抑制剂的筛选〔D〕.长沙:中南大学,2014.
4 万 军,车 云,康宁宁.信号通路蛋白Akt1、ERK1/2与HIF-1α在肺癌组织中的表达及其临床意义〔J〕.实用癌症杂志,2014;29(12):1515-7,1521.
5 明拂晓,靳彩玲,赵树鹏,等.红景天苷通过下调ERK1/2信号通路抑制肺癌A549细胞的增殖作用〔J〕.中药新药与临床药理,2016;2:225-30.
6 陈小霞,谢 娟,黄 成,等.EZH2对HSC-T6细胞增殖活化的影响及其部分机制研究〔J〕.中国药理学通报,2015;31(8):1061-5.
7 骆广涛.EZH2蛋白在他莫昔芬耐药乳腺癌MCF-7细胞系的表达及对其细胞增殖的影响〔D〕.合肥:安徽医科大学,2015.
8 刘萃萃.乳腺癌细胞中miR-15b靶向调控EZH2基因表达的研究〔D〕.广州:南方医科大学,2014.
9 刘乙齐.组蛋白赖氨酸甲基转移酶Ezh1促进TLR触发天然免疫应答及其机制研究〔D〕.杭州:浙江大学,2014.
10 陈薪宇,张红胜,吴同超.组蛋白甲基酶EZH2的研究进展〔J〕.生物技术通讯,2014;25(5):723-6.
11 韩利军,呼 群.EZH2在非小细胞肺癌中的研究进展〔J〕.内蒙古中医药,2014;33(15):128-9.
12 饶进军,何关生,毛 楠,等.沉默EZH2表达逆转人非小细胞肺癌顺铂耐药性〔J〕.中国药理学通报,2014;30(8):1084-90.
13 唐 甜,陕 光.Bmi-1和EZH2基因在小细胞肺癌中的表达及其意义〔J〕.中国组织化学与细胞化学杂志,2012;21(1):48-52.
14 张嘉玲,苏秀兰,闫美荣,等.shRNA沉默EZH2表达对人肺癌细胞增殖和侵袭能力的影响〔J〕.中华临床医师杂志(电子版),2011;5(20):5871-4.
15 赵红叶,陈 波,吴剑卿.EZH2组蛋白甲基转移酶在肺癌中的作用〔J〕.中华临床医师杂志(电子版),2013;7(2):773-5.
〔2015-12-15修回〕
(编辑 徐 杰)
张艳华 (1971-),男,副主任药师,主要从事药物临床应用研究。
R73
A
1005-9202(2016)23-5839-03;
10.3969/j.issn.1005-9202.2016.23.029
