前列腺小细胞神经内分泌癌1例并文献复习
2016-12-23夏中友李云祥
夏中友 李云祥 张 萌 范 俊 伍 季
南充市中心医院泌尿外科(四川南充 637000)
·短篇报道·
前列腺小细胞神经内分泌癌1例并文献复习
夏中友 李云祥 张 萌 范 俊 伍 季*
南充市中心医院泌尿外科(四川南充 637000)
前列腺小细胞癌(small cell carcinoma of prostate, SCPCa)又叫神经内分泌前列腺癌,其为罕见恶性肿瘤,进展快,早期易转移,预后极差。检索Pubmed、万方及中国知网等数据库,全世界近20年关于前列腺小细胞癌报到不足400例,而国内报到不足40例,且大部分前列腺小细胞癌常与前列腺腺癌混合存在,完全性前列腺小细胞癌不足2%[1]。2015年我院收治1例完全性前列腺小细胞癌,现报到如下,并复习相关文献,了解该病的临床、病理特征,以及目前的治疗方式,从而提高对该病的全面认识。
病例报告
患者男性,73岁,因排尿困难4月,加重1月于2015年2月1日入院。既往患者在我院普外科诊断为左侧腹股沟小细胞神经内分泌癌,未进一步治疗。查体:一般情况可,生命特征平稳。直肠指检前列腺左侧叶可触及大小约3cm×4cm包块,质地较硬,固定,表面不光滑,指套退出无染血。左侧腹股沟区可见一长约15cm手术瘢痕。血清前列腺特异性抗原(PSA)3.1 ng/mL,游离前列腺特异性抗原(fPSA) 0.39 ng/mL。B超示前列腺回声不均质,CT示前列腺癌盆腔、盆壁多发淋巴结转移、腰5椎体转移,ECT示腰5椎体处骨骼异常放射性浓聚改变,转移性骨肿瘤可能。遂经直肠穿刺活检。穿刺病检示:完全性前列腺小细胞癌。免疫组织化学染色示:神经特异性希醇酶(neuron-specifi c enlolase, NSE)(+)、突触素(synptophysin, Syn)(+)、CD56(+)、嗜铬蛋白A(CgA)(+)。结合患者上述辅助检查,目前患者存在盆腔多处淋巴结转移及骨转移。复习相关类似病例,建议同时行放化疗。但患者拒绝行放射治疗,遂给予EP方案(依托泊苷+顺铂)化疗:依托泊苷100mg静滴,连续3d,顺铂80mg静滴,化疗第1天给药,21~28d为1个周期,连续3个周期。2015年6月因咳嗽咳痰就诊于我院,复查CT见肺部转移,于2015年8月随访因多器官转移死亡,病理切片见图1。
讨 论
小细胞癌常发生于肺部,前列腺为肺外小细胞癌好发部位,约占全部肺外小细胞癌的3%,而前列腺小细胞癌在前列腺癌总数中不足1%[2]。作为特殊类型前列腺癌,不能用常规的Gleason分级法。前列腺小细胞癌形态结构类似于同名的肺小细胞癌,主要分为单纯性和混合型两类,混合型前列腺小细胞癌发病率约50%[3]。Wenk等[4]在1977年首次报道了前列腺小细胞癌,大多数在诊断时已经处于晚期。关于前列腺小细胞癌起源存在争议,目前存在三种假说:(1)前列腺腺癌接受大剂量激素阻断治疗后,传统的腺泡细胞沿神经内分泌细胞系分化所致;(2)正常前列腺细胞或多能上皮细胞恶变;(3)直接起源于多能干细胞。后两者假说解释了在前列腺小细胞癌中PSA水平并未升高[3]。而对于其发病机制尚不明确,国内外相关学者认为可能与ERG基因的重排;AURK4及MYCN基因的过度表达及扩增;Rb基因缺失;P13K、Akt、β-catentin基因灭活;EZH2基因上调及P53信号途径失活等众多因素相关,但发病主要原因仍处于研究阶段[5]。
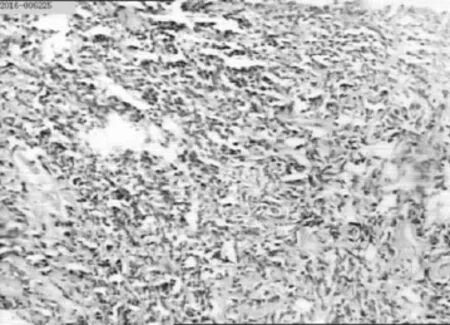
图1 前列腺穿刺病理切片(×100)注:癌细胞呈小圆形,胞质少,几近裸核,核深染
前列腺小细胞癌发病年龄在61~70岁[6],早期缺乏特异性临床症状,国内外相关报道大部分患者初次就诊主要以下尿路梗阻症状为主,或伴有血尿、会阴部不适,以及肺、肝脏、骨等转移病灶所致症状。极少数患者出现副癌综合征及Cushing综合征。B超及CT检查提示前列腺局部回声不均质。由于SCPCa症状类似良性前列腺增生症,因此,临床上易出现误诊或漏诊。有研究发现活检组织中前列腺小细胞癌占前列腺癌的1%,而尸检报告中这一比例达到10%~20%[7]。PSA 由前列腺腺泡及导管上皮细胞分泌产生,当前列腺腺泡被破坏后, 上皮细胞分泌的PSA就释放入血,导致血清PSA升高。而前列腺SCPCa无腺泡结构破坏,所以血清PSA水平通常处于正常水平,即使广泛转移PSA也很少升高[8]。因此,使用PSA予以鉴别SCPCa可能性较小。对于非泌尿外科医师对该病认识不足,也是导致漏诊的一个原因,如本例患者最初因左侧腹股沟包块就诊于我院普外科,且术后病检提示小细胞神经内分泌癌,但未考虑前列腺癌区域淋巴结转移。结合目前国内外相关文献,SCPCa主要靠组织病理学确诊。
SCPCa在病理结构上主要表现:细胞呈片状、巢状分布,细胞小圆形,胞质少,几乎为裸核,核深染,核仁不清楚,核分裂象存在,伴凝固性坏死。免疫组织化学是用于诊断前列腺小细胞癌最主要的方法,最典型的染色标记物示NSE、ChrA、TTF-1、CD56和Syn,文献报道SCPCa中以上五种指标阳性表达率分别为85%,80%,83%,92%和85%[9],少数患者可出现PSA、PSAP、PSMA阳性。本例患者免疫组化染色结较典型。伴有副癌综合征的患者可出现ACTH、降钙素及甲状旁腺激素升高。也有文献报道,将VEGF及TGF-A纳入了诊断指标[10]。但未分化小细胞癌缺乏神经内分泌特征。
治疗上,由于前列腺小细胞癌恶性程度极高,进展快,转移早,且目前报道病例有限,缺乏标准的治疗方案,临床上多参照小细胞肺癌治疗方案,采用手术、化疗及放疗为主的多学科综合治疗。文献报道,对于局限及早期病灶,根治性手术为标准治疗方案,考虑到小细胞癌易局部复发及转移,术后可结合化疗,对于术后病检切缘阳性或pT3a的患者,应予以放射治疗[11]。Tamas等[12]对16例局限混合型小细胞癌行前列腺根治性切除术,术后结合放化疗,患者无瘤生存时间达到了46个月。但大部分患者就诊时已处于晚期,存在肺、肝、骨及淋巴结等转移,失去了根治性治疗机会,放化疗成为该部分病人主要治疗方式。目前化疗主要采用顺铂联合依托泊苷,但现有文献报道卡铂分别与托泊苷或紫杉醇可以替代以顺铂为基础的化疗方案[13]。经过化疗后部分患者出现临床症状缓解,尤其是下尿路梗阻症状,但大多数患者对化疗不敏感,临床症状改善不佳,必要时可行TURP术解除尿路梗阻。放射治疗常规计量为45~55Gy(1.8Gy/d),需根据前列腺体积调整,文献报道的最高治疗量达到73Gy[14]。晚期患者也可以行粒子植入术,但效果不佳,平均生存期为5~17个月[15]。蒋银锋等[16]诊断的1例晚期混合型前列腺小细胞癌行粒子植入治疗,虽然术后生活质量较治疗前明显改善,但患者术后7个月后因多器官转移死亡。前列腺腺癌由于与SCPCa组织学上存在较大差异,故治疗上同样存在较大差异。对于混合型SCPCa需联合雄激素去势治疗,但由于在激素阻断治疗时易出现前列腺细胞向神经内分泌分化,故国内外研究者建议去势治疗前予以化疗[13]。
预期寿命往往是评价治疗效果的重要因素,由于SCPCa疾病特点,患者中位生存时间仍较短,平均在8~15个月。长期生存的案例罕见,沈志远等[17]使用高强度聚焦超声+激素去势治疗混合型SCPCa 1例,其生存期达到了7年。临床治疗中高强度聚焦超声治疗可作为选择,而对于疾病早期诊断及采取多学科的综合治疗仍然是目前治疗SCPCa主要的也是最为有效的方法。而且随着精准医学的发展,相信在以后前列腺小细胞癌在基因治疗上将会有更多突破。
前列腺肿瘤; 癌, 小细胞; 预后
1 Sargos P, Ferretti L, Gross-Goupi M, et al. Characterization of prostate neuroendocrine cancers and therapeutic management: a literature review. Prostate Cancer Prostatic Dis 2014; 17(3): 220-226
2 Hingorani R, Young J, Alweis R. Mixed adenocarcinoma and neuroendocrine prostatecancer: a case report. J Community Hosp Intern Med Perspect 2014; 4(5): 25176
3 Demirtaş A, Sahin N, Oztürk F, et al. Small cell prostate carcinoma: a case report and review of the literature. Case Rep Urol 2013; 2013: 387931
4 Wenk RE, Bhagavan BS, Levy R, et al. Ectopic ACTH, prostatic oat cell carcinoma, and marked hypernatremia. Cancer 1977; 40(2): 773-778
5 Rahul Aggarwal, Tian Zhang, EricJ Smal, et al. Neuroendocrine prostate cancer:subtypes, biology, and clinical outcomes. J Natl Compr Canc Netw 2014; 12(5): 719-726
6 Palmgren JS, Karavadia SS, Wakefi eld MR. Unusual andunderappreciatedl small cell carcinoma of the prostate. Semin Oncol 2007; 34(1): 22-29
7 Furtado P, Linma MV, Nogueira C, et al. Review of small cell carcinomas of the prostate. Prostate Cancer 2011; 2011: 543272
8 温爽, 郭爱桃, 爱军, 等. 前列腺小细胞性神经内分泌癌3例临床病理学特征分析. 诊断病理学杂志 2013; 20(1): 25-29
9 张虎, 陈万钵, 史本涛, 等. 前列腺小细胞癌的诊断与治疗: 附4例报告. 临床泌尿外科杂志 2013; 28(9): 709-711
10 Muders MH, Zhang H, Wang E, et al. Vascular endothelial growth factor-C protects prostate cancer cells from oxidative stress by the activation of mammalian target of rapamycin complex-2 and AKT-1. Cancer Res 2009; 69(15): 6042-6048
11 Stein ME, Bernstein Z, Abacioglu U, et al. Small cell (neuroendocrine) carcinoma of the prostate: etiology, diagnosis,prognosis,and therapeutic implications-a retrospective study of 30 patients from the rare cancer network. Am J Med Sci 2008; 336(6): 478-488
12 Tamas EF, Epstein JI. Prognostic significance of paneth cell-like neuroendocrine differentiation in adenocarcinoma of the prostate. Am J Surg Pathol 2006; 30(8): 980-985
13 Capizzello A, Peponi E, Simou N, et al. Pure small cell carcinoma of the prostate: A case report and literature review. Case Rep Oncol 2011; 16, 4(1): 88-95
14 Stein ME, Bernstein Z, Abacioglu U, et al. Small cell (neuroendocrine) carcinoma of the prostate:etiology, diagnosis, prognosis, and therapeutic implications-a retrospective study of 30 patients from the rare cancer network. Am J Med Sci 2008; 336(6): 478-488
15 Komiya A, Yasuda K, Nozaki T, et al. Small cell carcinoma of prostate cancer after high-dose-rate brachytherapy for low risk prostatic adenocarcinoma. Oncol Lett 2013; 5(1): 53-56
16 蒋银锋, 徐林锋, 李笑弓, 等. 前列腺小细胞癌1例报告并文献复习. 中华男科学杂志 2015; 21(4): 381-383
17 沈志远, 钱伟庆, 孙忠全. 前列腺小细胞癌长期生存1例.临床泌尿外科杂志 2014; 29(6): 467
(2016-07-28收稿)
R 737.25
*通讯作者,E-mail: wuji2168@ sina.com
doi:10.3969/j.issn.1008-0848.2016.08.013
