倭蜂猴细胞色素b基因和D-loop序列多态性分析
2016-12-22朱万龙蔡金红陈金龙王政昆
朱万龙,蔡金红,陈金龙,王政昆
(1.云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室 云南师范大学生命科学学院,昆明 650500; 2.昆明市海口林场,昆明 650000)
倭蜂猴细胞色素b基因和D-loop序列多态性分析
朱万龙1,蔡金红1,陈金龙2,王政昆1
(1.云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室 云南师范大学生命科学学院,昆明 650500; 2.昆明市海口林场,昆明 650000)
对云南大围山保护区7例倭蜂猴线粒体DNA细胞色素b基因(Cytb)和控制区序列(D-loop)进行了PCR扩增、序列测定、核苷酸组成和多态性分析。结果表明:Cytb中,A、T、C和G 4种核苷酸的比例分别为 29.3%、28.2%、29.8%和12.7%,A+T含量为57.5%,G+C含量为42.5%。在长度为1078 bp的Cytb序列中,存在4个变异位点,核苷酸多样性指数(π值)为0.00106,仅出现3种单倍型。7个倭蜂猴个体的遗传距离为0.000~0.003。D-loop区序列中,A、T、C和G 4种核苷酸的比例分别为31.8%、29.1%、25.0%和14.1%,A+T含量为60.9%,G+C含量为39.1%。在381 bp长的D-loop区序列中,仅存在4个变异位点,核苷酸多样性指数(π值)为0.003 00,仅出现4种单倍型。7个倭蜂猴个体的遗传距离为0.000~0.008。研究表明倭蜂猴种内个体间差异小,群体多态程度低。通过与其他物种相比,进行遗传多样性分析,倭蜂猴遗传多态性低,种群小,发生遗传漂变强度大,因此,倭蜂猴在遗传多样性水平上是迫切需要保护的。
倭蜂猴;细胞色素b基因;D-loop控制区序列
线粒体DNA ( mitochondria DNA,mtDNA)是一类核外的遗传物质,可独立进行复制与转录,相比与核DNA,它具有以下特点:母系遗传、分子结构相对简单、进化速度较快、碱基变异较大等等[1-2]。其通常用于动物遗传变异的研究,在哺乳动物中已有许多报道[3-5]。mtDNA中的细胞色素b基因(cytochrome b gene,Cytb)是一种常用于研究物种内或近缘种遗传变异的分子标记,广泛应用于动物系统进化和分类研究[6-7]。D-loop是mtDNA中一段重要的非编码区,约占线粒体基因组的6%,由于D-loop是非编码基因,因此其DNA序列具有进化速度快、碱基序列和长度变异大等特点,适合做种内群体遗传变异的研究,并已得到广泛应用[3-5]。
倭蜂猴(Nycticebuspygmaeus),属原猴亚目(Strepsirrhine),懒猴科(Lorisidae),为亚洲热带特有种,主要分布于老挝和越南中北部,我国仅分布于云南东南部[8-9],属国家一级保护动物,急需对其进行研究和保护。倭蜂猴因其数量稀少,再加上夜行、树栖、隐蔽等特点,可以用于研究的标本数极少,长期以来对该物种的研究很少,是目前所有原始猴中研究最少的物种之一[10]。本研究组之前对于倭蜂猴的研究集中在其产热机理上,如对其体温调节和产热特征进行了研究[11],蒸发失水的研究[12],细胞呼吸特征的研究[13],能量收支的研究[14]。2014年对蜂猴属D-loop控制区和Cytb的遗传学进行研究,指出蜂猴属由蜂猴和倭蜂猴两物种组成[15]。本研究在之前的研究基础上,进一步测定了7只倭蜂猴线粒体DNA中Cytb和D-loop控制区部分序列,分析其遗传多样性,为倭蜂猴资源的保护和合理利用提供一定的理论依据。
1 材料与方法
1.1 动物来源
实验所采用倭蜂猴是云南大围山国家级自然保护区屏边管理分局通过合法手段没收并饲养,并对其粪便样品进行采集,样本数为7只,样品用95%酒精保存带回实验室,保存于-70℃冰箱内。
1.2 总DNA提取
[15]进行了总DNA的提取。
1.3 引物设计
Cytb和D-loop控制区的引物设计参照文献[15]进行设计。
1.4 PCR扩增
利用上述引物进行PCR扩增。PCR扩增方法参照文献 [15]。 扩增产物用 0.8%琼脂糖凝胶电泳检测。
1.5 PCR的纯化测序和序列分析
PCR 产物送大连宝生物工程有限公司测序(测序使用试剂:ABI BigDye3.1;测序仪器:ABI 3730XL)。Cytb和D-loop的测定结果使用DNASTAR软件包的Editseq、Seqman、Megalign软件进行排序分析,将正反两向序列进行核对,并进行人工的检查校正。用DNASP 4.0计算多态位点以及统计单倍型数目。用MEGA5.0进行初始的序列比较,碱基组成分析和变异计算。
2 结果
2.1 倭蜂猴CytbPCR产物的凝胶电泳
采用Cytb引物进行PCR扩增,Cytb的扩增片段为1078 bp左右,图1显示其中4个个体的CytbPCR扩增产物目的条带。

图1 Cyt b片段的扩增结果(0.8%琼脂糖凝胶电泳)
M:Marker DL 2000
2.2Cytb的核苷酸组成及序列多态性分析Cytb中,A、T、C和G 4种核苷酸的比例分别为 29.3%、28.2%、29.8%和12.7%,A+T含量为57.5%,G+C含量为42.5%。4种核苷酸在密码子中的使用频率如表1所示。在密码子第1位,4种核苷酸的使用频率相差不大。但是,在密码子第2位和第3位上有较大差别。密码子第2位,T的使用频率为40.0%,是A的1.9倍,更是G的3.1倍。而密码子第3位却表现了对A或C的偏好,使用频率分别达到40.1%和36.3%(表1)。

表1 Cyt b序列4种核苷酸的使用频率
在长度为1078 bp 的Cytb序列中,7个样本存在4个变异位点和3种单倍型。这4个变异位点分别为第262位、468位、723位、784位,前面3个位点为G-C转换,最后一个为A-T转换(图2)。所有样本的平均核苷酸差异(K)为1.143,核苷酸多样性指数(π值)为0.00106,单倍型多样性指数(Hd)为0.524。
基于Kimura双参数模型对本实验所测倭蜂猴,统计两两序列间的遗传距离(表2)。从表2中可以看出,7个倭蜂猴个体的遗传距离为0.000~0.003。
2.3 倭蜂猴D-loop控制区PCR产物的凝胶电泳
采用D-loop控制区基因片段引物进行PCR扩增,D-loop控制区的扩增片段为400 bp左右,图3显示了其中4个个体的D-loop控制区的PCR扩增产物目的条带。


图2 Cyt b序列的核苷酸组成

WFHCytb1WFHCytb2WFHCytb3WFHCytb4WFHCytb5WFHCytb6WFHCytb20.000WFHCytb30.0030.003WFHCytb40.0000.0000.003WFHCytb50.0000.0000.0030.000WFHCytb60.0000.0000.0030.0000.000WFHCytb70.0010.0010.0040.0010.0010.001
图3D-loop控制区基因片段的扩增结果(0.8%的琼脂糖凝胶电泳)
Fig 3 A gene segment amplified fromD-loopcontrol region(0.8% agarose gel)
M:Marker DL 2000

图4 D-loop区序列的核苷酸组成
2.4D-loop区序列的核苷酸组成及多态性分析
D-loop区序列中,A、T、C和G 4种核苷酸的比例分别为31.8%、29.1%、25.0%和14.1%,A+T含量为60.9%,G+C含量为39.1%。在长度为381bp的D-loop区序列中,7个样本存在4个变异位点和4种单倍型。这4个变异位点分别为第185位、209位、251位、340位,185位点为G-C转换,209和251位点都为A-T转换,最后一个为G-T颠换(图4)。所有样本的平均核苷酸差异(K)为1.143,核苷酸多样性指数(π值)为0.003 00,单倍型多样性指数(Hd)为0.714。
采用Mega4.0软件,基于Kimura双参数模型对本实验所测倭蜂猴,统计两两序列间的遗传距离(表3)。从表中可以看出,本研究测定的7个倭蜂猴个体的遗传距离为0.000~0.008。
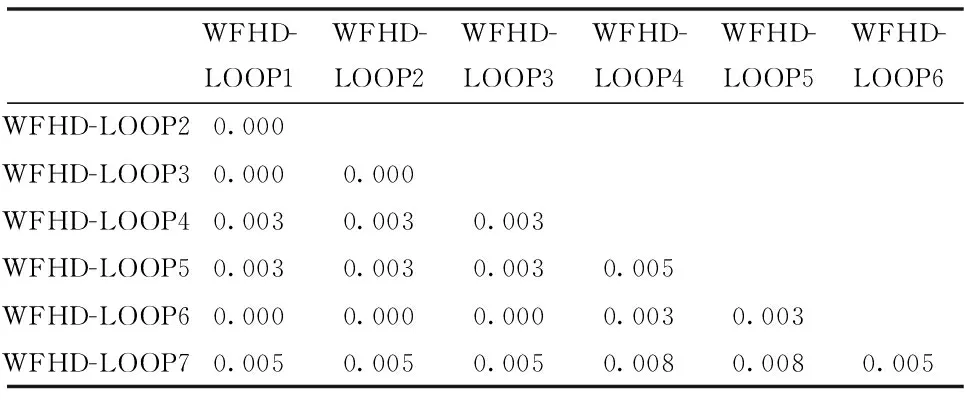
表 3 D-loop区序列的Kimura双参数模型的遗传距离
3 讨论
本研究所得的倭蜂猴Cytb和D-loop区序列中,A、T、C和G 4种核苷酸的比例分布不均,这可能与4种核苷酸在线粒体基因组中分布不均是动物线粒体基因组的共性有关[16]。倭蜂猴Cytb和D-loop区序列中的A+T含量比G+C含量高,这与其他脊椎动物线粒体核苷酸组成的特点相似[17-18]。Cytb中存在4个变异位点和3种单倍型。这4个变异位点分别为第262位、468位、723位、784位,前面3个位点为G-C转换,最后一个为A-T转换。D-loop区序列中仅发生一个颠换(transversion),转换与颠换的比值为0。哺乳动物的mtDNA碱基替换中存在转换偏倚性(Bias),随着进化时间增加,颠换的积累,转换偏倚性会下降[19],因此,本研究中Cytb和D-loop区序列的突变仍未达到饱和状态[20]。
遗传变异是保护生物学研究的核心之一[21]。濒危动物多是典型的小种群,易发生遗传漂变,易发生多样性丢失,从而降低对环境变化的进化适应能力,使得种群灭绝的概率增大,因此濒危动物保护的关键是保护物种的遗传多样性或进化潜力。衡量一个种群的分子遗传变异的重要指标是核苷酸多态性(π值),由于π值考虑了各种单倍型在群体中所占的比例,π值越大表示群体多态性越高[22]。7个样本的Cytb中,K为1.143,π值为0.001 06,D-loop控制区部分序列作遗传变异分析表明,K为1.143,π值为0.003 00,远低于其他哺乳动物。如Neigel统计同种哺乳动物个体之间的平均核苷酸顺序歧异值在0.3%到4%之间,最大时竟达10%以上[21]。滇金丝猴的线粒体DNA多样性为1.144%[23],野猪种群的线粒体DNA多样性为0.865%,K为9.859 36,藏羚羊线粒体DNA多样性为2.963%[24]等。
综上所述,本研究表明倭蜂猴种内个体间差异小,群体多态程度低。通过与其他物种相比,倭蜂猴遗传多态性低,种群小,发生遗传漂变强度大,因此,倭蜂猴在遗传多样性水平上是迫切需要保护的。
参考文献
[1]张亚平,施立明.动物线粒体 DNA 多态性的研究概况[J].动物学研究,1992,13(3): 289-298.
[2]XU W,JAMESON D,TANG B,et al.The relationship between the rate of molecular evolution and the rate of genome rearrangement in animal mitochondrial genomes[J].J Mol Evo,2006,63(3): 375-392.
[3]GOKEY N G,CAO Z,PAK J W,et al.Molecular analyses of mtDNA deletion mutations in micro dissected skeletal muscle fibers from aged rhesus monkeys[J].Aging Cell,2004,3(5):319-326.
[4]SMITH D G,MCDONOUGH J W,GEORGE D A.Mitochondrial DNA variation within and among regional populations of longtail macaques (Macacafascicularis) in relation to other species of the fascicular is group of macaques[J].Am J Primato,2007,69 (2): 182-198.
[5]BLANCHER A,BONHOMME M,CROUAU-ROY B,et al.Mitochondrial DNA sequence phylogeny of 4 populations of the widely distributed cynomolgus macaque (Macacafascicularisfascicularis)[J].J Hered,2008,99(3): 254-264.
[6]ANDRIANTOMPOHAVANA R,RANDRIAMANANA J C,SOMMER J A,et al.Characterization of 22 microsatellite loci developed from the genome of the Woolly Lemur (Avahilaniger)[J].Mol Ecol,2004,4(3): 400-403.
[7]HELM-BYCHOWSKI K,CRACRAFT J.Recovering phylogenetic signal from DNA sequences: relationships within the corvine assemblage (classaves) as inferred from complete sequences of the mitochondrial DNA cytochrome-b gene[J].Mol Biol Evo,1993,10(6): 1196-1214.
[8]王应祥.中国濒危物种保护红皮书: 兽类[M].北京: 科学出版社,1998:25-32.
[9]DANG H H.Ecology,biology and conservation status of prosimain species in Vietnam[J].Folic Primatol Ecol,1998,69(S1): 101-108.
[10]FITCH-SNYDER H,JURKE M.Reproductive patterns in pygmy lorises(Nycticebuspygmaeus): behavioral and physiological correlates of gonadal activity[J].Zoo Biol,2003,22(1): 15-32.
[11]王政昆,孙儒泳,李庆芬.倭蜂猴静止代谢率和体温调节的研究[J].动物学报,1995,41(2): 149-157.
[12]肖彩虹,王 睿,王政昆,等.昆明动物园笼养倭蜂猴的能量代谢[J].兽类学报,2009,29(4): 443-446.
[13]王政昆,刘 璐,李庆芬,等.倭蜂猴的产热及细胞呼吸特征[J].兽类学报,2000,20(1): 13-20.
[14]XIAO C H,WANG Z K,ZHU W L,et al.Energy metabolism and thermore gulation in pygmy lorises(Nycticebuspygmaeus) from Yunnan Daweishan Nature Reserve[J].Acta Ecologica Sinica,2010,30(3): 129-134.
[15]朱万龙,章 迪,高文荣,等.蜂猴属(Nycticebus) D-loop控制区和Cyt b基因遗传学研究[J].生物学杂志,2014,31(5): 1-5.
[16]Meyer A.Evolution of mitochondria DNA in fishes[M].In: Hochachka P W and Mommsen T P(ed).Biochemistry and Molecular Biology of Fishes.New York: Elsevier:1993:1-38.
[17]徐怀亮,李地艳,程安春,等.四川地区猕猴线粒体DNA控制区遗传多样性及其种群遗传结构[J].兽类学报,2010,30(3): 247-255.
[18]李 娜,陈少波,谢起浪,等.闽浙地区香鱼线粒体Cyt b基因和D-loop区序列多态性分析[J].遗传,2008,30(7): 919-925.
[19]HEDGES S B,BEZY R L,MAXSON L R.Phylogenetic relationships and biogeography of Xantuslid lizards,inferred from mitochondrial DNA sequences[J].Mol Bio Evol,1991,8(6): 767-780.
[20]KINGHT A,MINDELL D P.Substitution bias,weighting of DNA sequences evolution,and the phylogenetic positions of Fea′s viper[J].Sys Bio,1993,42(1): 18-31.
[21]NEIGEL J E,AVISE J C.Application of a random walk model to geographic distributions of animal mitochondrial DNA variation[J].Genetics,1993,135(4): 1209-1220.
[22]刘若余,夏先林,雷初朝,等.贵州黄牛mtDNA D-loop遗传多样性研究[J].遗传,2006,28(3): 279-284.
[23]潘 登,符云新,张亚平.基于线粒体控制区的滇金丝猴群体遗传学研究[J].遗传,2006,28(4): 432-436.
[24]周 慧,李迪强,张于光,等.藏羚羊mtDNA D-loop区遗传多样性研究[J].遗传,2006,28(3): 299-305.
Analysis of gene sequence polymorphism in the sequences ofCytbandD-loopinNycticebuspygmaeus
ZHU Wan-long1,CAI Jin-hong1,CHENG Jin-long2,WANG Zheng-kun1
(1.Key Laboratory of Ecological Adaptive Evolution and Conservation on Animals-Plants in Southwest Mountain Ecosystem of Yunnan Province Higher Institutes College,School of Life Sciences,Yunnan Normal University,Kunming 650500; 2.Kunming Haikou Forest Farm,Kunming 650000,China)
CytbandD-loopof mitochondrial DNA inNycticebuspygmaeus(sample=7) in Daweishan Nature Reserve from Yunnan province were PCR amplification in the present study,and the sequences ofCytbandD-loopwere tested,nucleotide compositions and polymorphism were analyzed.The results showed that in the gene ofCytb,the proportion of four nucleotides(A,T,C and G) were 29.3%,28.2%,29.8% and 12.7%,respectively.Content of A+T was 57.5%,and content of G+C was 42.5%.InCytbgene sequences (1078 bp in length ),there were 4 variable sites,π value was 0.00106,only 3 haplotypes appeared in 7 samples.Genetic distance was 0.000-0.003 inN.pygmaeus.In the gene ofD-loop,the proportions of four nucleotides(A,T,C and G) were 31.8%,29.1%,25.0% and 14.1%,respectively.Content of A+T was 60.9%,and content of G+C was 39.1%.InD-loopgene sequences (381 bp in length),there were 4 variable sites,π value was 0.00300,only 4 haplotypes appeared.Genetic distance was 0.000-0.003 inN.pygmaeus.All of the results suggested that litter differences existed between individuals within species,and had low levels of polymorphism in groups.Compared with other species,through the analysis of genetic diversity,N.pygmaeusshowed lower hereditary and population numbers,genetic drift occured larger.Therefore,it was eager to protect theN.pygmaeuson the level of genetic diversity.
Nycticebuspygmaeus;Cytb;D-loop
2015-11-03;
2015-11-16
收稿日期:国家自然科学基金项目(No.31260097;31560126)
朱万龙,副教授,研究方向为动物生理生态,E-mail: zwl_8307@163.com;朱万龙和蔡金红为并列第一作者
王政昆,教授,研究方向为动物生理生态,E-mail: wzk_930@126.com
10.3969/j.issn.2095-1736.2016.06.020
Q953.3;Q78
A
2095-1736(2016)06-0020-04
