人-鼠嵌合单链抗体的构建及其在大肠杆菌中的高效可溶性表达和发酵条件优化
2016-12-22杨艳坤白仲虎
刘 萌,孙 杨,杨艳坤,白仲虎
(1.江南大学 粮食发酵工艺与技术国家工程实验室,无锡 214122;2.江南大学 工业生物技术教育部 重点实验室,无锡 214122;3.江南大学 糖化学与生物技术教育部重点实验室,无锡 214122)
人-鼠嵌合单链抗体的构建及其在大肠杆菌中的高效可溶性表达和发酵条件优化
刘 萌1,2,3,孙 杨1,2,3,杨艳坤1,2,3,白仲虎1,2,3
(1.江南大学 粮食发酵工艺与技术国家工程实验室,无锡 214122;2.江南大学 工业生物技术教育部 重点实验室,无锡 214122;3.江南大学 糖化学与生物技术教育部重点实验室,无锡 214122)
从人血清白蛋白HSA免疫小鼠制备的杂交瘤单克隆抗体细胞中提取总RNA,通过反转录得到cDNA,经RT-PCR的方法扩增出单克隆抗体的重链可变区VH和轻链可变区VL的DNA编码序列,通过基因重组的方法将鼠源Fab段VH和VL与人源Fab段重链和轻链恒定区进行嵌合,获得人源化嵌合单链抗体(Single-chain Antibody Fragment,scFv),将scFv克隆到构建的表达载体pBY中导入到宿主菌BL21-trxB(DE3)中进行可溶性表达,在摇瓶水平通过对发酵条件进行优化,胞内可溶性表达量达到1.23 g/L,在此基础上进行反应器放大培养,对关键参数进行优化,scFv表达量达到2.49 g/L。通过人源化嵌合抗体的构建表达并完成了小试水平的研究,为进一步开发人源化单链抗体提供了方法和研究基础。
人源化嵌合抗体;scFv;可溶性表达;酶联免疫吸附;发酵条件优化
单克隆抗体(Monoclonal Antibody,mAb)是由小鼠杂交瘤细胞产生的特异性识别一种抗原表位的抗体,因其高靶向性、高特异性、高亲和力以及能诱导一系列的生物学效应而被广泛应用于检验医学诊断、肿瘤靶向治疗、放射免疫显像技术等方面[1-2],但目前广泛应用的多为鼠源性单抗,而且因其作为异种蛋白具有免疫原性,故在人体内反复使用易引起不同程度的人抗鼠抗体反应(Human antimouse antibody response,HAMA)[3],同时由于鼠源性单克隆抗体的Fc段不能有效活化人体FcRn和补体系统的效应功能[4],以及其在人体内的半衰期较短等缺点使其在临床医学的应用受到极大的限制[5]。因此在临床应用中人源性单克隆抗体成为理想的应用抗体。但由于人源性单克隆抗体亲和力较低难以应用到临床医学中[6],因此目前较好的解决办法是利用基因工程技术和蛋白质组学技术等手段对异源性单克隆抗体进行改造[7]。
研究发现,鼠源性单克隆抗体在人体应用中产生的人抗鼠抗体反应(HAMA)90%是由鼠抗体的恒定区引起的,因此研究人员设想用人抗体的恒定区去替代鼠抗体的恒定区,则有可能会明显减弱鼠源性单克隆抗体在人体内的免疫原性。1984年Morrison等[8]首次尝试将鼠抗体的可变区基因克隆到重组的人抗体恒定区基因中,成功表达出半抗原磷酸胆碱的全分子人-鼠嵌合抗体,开创了人源化抗体改造的先河。由于人-鼠嵌合抗体75%~80%是由人抗体的恒定区组成的,鼠抗体的可变区只占20%左右,因此可以大大减少HAMA反应,同时又保留了亲本抗体的亲和力和特异性,并可借助人免疫球蛋白 Fc段介导免疫调理及 ADCC 效应[9]。
本研究通过构建一套高表达系统,使嵌合抗体能够在大肠杆菌中进行高效可溶性表达,并通过发酵条件的优化进一步提高其表达量,为通过Biacore分析以及后续的亲和性成熟实验对人-鼠嵌合抗体的临床应用开发提供一定的研究基础。
1 材料与方法
1.1 材料
1.1.1 宿主菌和质粒
大肠杆菌BL21 TrxB(DE3)感受态细胞购于Millipore公司。所用质粒pBY为本人在实验室所存基础表达载体的基础上构建而得。该质粒采用T7启动子,适用于BL21 (DE3)系列宿主细胞。质粒示意图见图1。
1.1.2 主要试剂和药品
分子生物学相关试剂均购自ThermoFisher公司;胰蛋白胨,酵母提取物购自OXOID公司;异丙基硫代半乳糖苷(IPTG)购自Sigma-Aldrich(中国)公司;HRP-Protein A购自武汉博士德生物工程有限公司;四环素(tetracycline),蛋白定量试剂盒购自生工生物工程(上海)股份有限公司;ELISA相关试剂均购自郑州博赛生物技术股份有限公司;其他药品均为国产分析纯。
1.1.3 培养基配制
LB培养基(g/L):酵母提取物5,蛋白胨10,NaCl 10,pH 7.0,加入1.5 g/L琼脂糖即为固体培养基;TB/SB摇瓶培养基(g/L):酵母提取物24,蛋白胨12,KH2PO42.31,K2HPO4·3H2O 12.55,甘油10,pH 7.0。
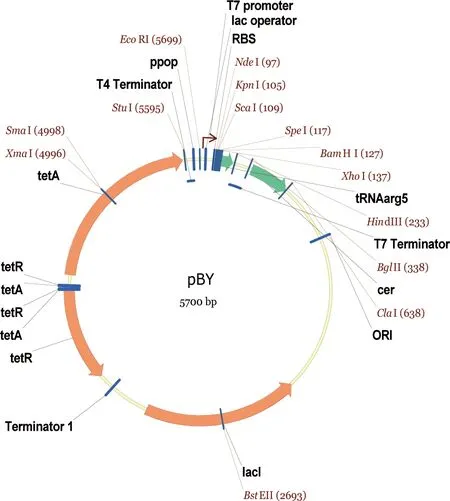
图1 pBY质粒图谱
蛋白纯化上样缓冲液:20 mmol/L磷酸盐缓冲液,含0.15 mol/L NaCl,pH 7.5。A液:称取3.12 g NaH2PO4·2H2O,溶于100 mL ddH2O,制为200 mmol/L NaH2PO4。B液:称取7.16 g Na2HPO4·12H2O,溶于100 mL ddH2O,制为200 mmol/L Na2HPO4。取16 mL A液及84 mL B液,加入8.77 g NaCl混合均匀,再加入ddH2O定容至1000 mL。
蛋白纯化洗脱缓冲液:0.1 mol/L甘氨酸盐酸缓冲液,pH 2.5~3.6。称取7.51 g甘氨酸溶于ddH2O中,用浓盐酸调节pH值后定容至1000 mL。
蛋白纯化清洗液:0.5 mol/L NaOH。称取20.0 g NaOH,溶解至ddH2O中并定容至1000 mL。
蛋白纯化柱保存液:20%乙醇。
脱盐柱缓冲液:50 mmol/L磷酸盐缓冲液,含0.15 mol/L NaCl,pH 7.0。取上述A液38 mL,B液62 mL,加入3.51 g NaCl混合均匀后,用ddH2O定容至400 mL。
10× TBST缓冲液:0.2 mol/L Tris,1.37 mol/L NaCl,1% Tween-20,pH 7.6。
1.1.4 主要耗材和仪器
PCR仪(A500,杭州朗基科学仪器有限公司);酶标仪(EZ Read 800,英国Biochrom公司);洗板机(ST-96W,南京科华生物技术有限公司);冷冻离心机(ST16R,美国ThermoFisher公司);发酵罐(Applikon ez-Control,荷兰Applikon Biotecnology公司);蛋白快速纯化系统(AKTA purifier UPC10,GE Healthcare Bio-Science AB)。
1.2 方法
1.2.1 人-鼠嵌合单链抗体的制备
通过人血清白蛋白HSA免疫小鼠制备杂交瘤单克隆抗体细胞。从单克隆抗体细胞中提取总RNA,经过反转录得到cDNA,采用RACE方法,经RT-PCR扩增出单克隆抗体的Fab段编码序列,通过筛选与测序得到正确的序列,分析重链可变区和轻链可变区(此部分工作由南京金斯瑞公司完成)。通过基因重组的方法将得到的鼠源Fab段的重链可变区和轻链可变区与人源Fab段的重链恒定区和轻链恒定区进行拼接,获得人源化的人鼠嵌合单链抗体scFv序列[10]。对编码序列进行大肠杆菌密码子偏好性改良,并由苏州金唯智生物科技有限公司进行合成。
1.2.2 菌体构建
合成的scFv序列经NdeI/XhoI双酶切连接到表达载体pBY上,转入到表达宿主E.coliBL21 trxB(DE3)感受态细胞中,再从转化平板上挑取单克隆菌株进行验证,验证正确的菌株用15%甘油保存在-80℃冰箱中。
1.2.3 工程菌生长曲线的测定
从-80℃冰箱取出甘油菌,以1%的接种量接种于含有15 μg/mL四环素的LB液体培养基中,30℃,230 r/min摇床培养16 h,测定D600 nm,然后转接到含有15 μg/mL的TB/SB培养基中,转接后D600 nm定为0.05,30℃,230 r/min摇床培养,每隔2 h取样,用紫外分光光度计测定波长在600 nm处的吸光度,绘制生长曲线。
1.2.4 诱导温度对单链抗体可溶性表达的影响
从-80℃冰箱取出甘油菌,以1%的接种量接种于含有15 μg/mL四环素的LB液体培养基中,30℃,230 r/min摇床培养16 h,测定D600 nm,然后转接到含有15 μg/mL的TB/SB培养基中,转接后D600 nm定为0.05,30℃,230 r/min摇床培养7 h后,加入IPTG至终浓度为0.1 mmol/L,分别在16℃、23℃、30℃诱导培养16 h,收集菌体进行SDS-PAGE分析。
1.2.5 诱导剂浓度对单链抗体可溶性表达的影响
从-80℃冰箱取出甘油菌,以1%的接种量接种于含有15 μg/mL四环素的LB液体培养基中,30℃,230 r/min摇床培养16 h,测定D600 nm,然后转接到含有15 μg/mL的TB/SB培养基中,转接后D600 nm定为0.05,30℃,230 r/min摇床培养7 h后,加入诱导剂IPTG至终浓度分别为0、0.05、0.1、0.5、1.0和1.5 mmol/L,根据1.2.3的结果,在最适的温度下诱导培养16 h,收集菌体进行SDS-PAGE分析。
1.2.6 诱导剂加入时间对单链抗体可溶性表达的影响
从-80℃冰箱取出甘油菌,以1%的接种量接种于含有15 μg/mL四环素的LB液体培养基中,30℃,230 r/min摇床培养16 h,测定D600 nm,然后转接到含有15 μg/mL的TB/SB培养基中,转接后D600 nm定为0.05,30℃,230 r/min摇床培养5、7、9 h时,根据1.2.4的结果,分别加入适宜浓度的IPTG,在合适的温度下230 r/min摇床培养16 h,收集菌体进行SDS-PAGE分析。
1.2.7 诱导培养时间对单链抗体可溶性表达水平的影响
从-80℃冰箱取出甘油菌,以1%的接种量接种于含有15 μg/mL四环素的LB液体培养基中,30℃,230 r/min摇床培养16 h,测定D600 nm,然后转接到含有15 μg/mL的TB/SB培养基中,转接后D600 nm定为0.05,根据1.2.3、1.2.4和1.2.5的结果,在230 r/min的摇床上分别培养4、12、16、20、24、27、36、42 h,收集菌体进行SDS-PAGE分析。
1.2.8 菌体处理及SDS-PAGE分析
收获后的菌液转移至1.5 mL的离心管中,10 000 r/min,4℃离心10 min,分离菌体上清及沉淀,再对沉淀做均一化处理,即称取0.02 g湿菌用1 mL PBS重悬,吸取16 μL重悬液加入4 μL 5 × Loading Buffer,开水煮沸5 min进行SDS-PAGE分析目的产物的表达水平,剩下的通过超声波破碎,破碎方法为:20%功率,破碎1 s,间隔2 s,破碎30 min。破碎完成后10 000 r/min,4℃离心10 min,分离上清留待ELISA定量检测。
1.2.9 直接ELISA检测目的产物含量
以本实验室保存的scFv纯品为标准品,按一定比例稀释至不同浓度后,各取50 μL加入酶标板(Corning,USA)。另将样品稀释至合适的倍数后,以PBS为空白对照,TB/SB为阴性对照(样品为菌体裂解液时,以对照菌体裂解液为阴性对照),各取50 μL加入酶标板,37℃温育1 h后用洗板机洗涤5遍,每孔加入300 μL 5%脱脂牛奶,温育及洗涤同上。每孔加入50 μL稀释1500倍的HRP-Protein A,温育及洗涤同上。加入100 μL显色液,37℃避光15 min后,每孔加入100 μL 2 mol/L H2SO4终止反应,用酶标仪读取波长在450 nm和620 nm处的差值。以标准品含量为横坐标,以相应读数为纵坐标做出标准曲线后,代入稀释样品读数计算含量。
1.2.10 单链抗体纯化
利用最优发酵结果发酵样品100 mL离心收集菌体沉淀,再用等体积pH 7.4的PBS重悬,重悬菌体用超声波破碎仪破碎,50 mL体系破碎条件:35%功率,破碎1 s,间歇2 s,破碎30 min,将菌体破碎液12 000 r/min离心15 min,分离上清用0.22 μm的针头式过滤器过滤,过滤样品用上样缓冲液进样,进样完全后用洗脱缓冲液洗涤,收集流穿液和洗脱峰,用以SDS-PAGE分析,目的蛋白峰用pH 9.0的Tris-HCL中和,用超滤管脱盐换液,于-80℃冻存。
2 结果与分析
2.1 pBY-scFv重组菌的构建
合成的scFv片段核心序列如下:gaagtacaactgctggagagcggtggcggcctggttcaaccgggtggttccctgcgcctgtcctgtgcggcatctggtttcaccttcgcatattatggaatgaactgggttcgccaagctccgggcaaaggcctggaatgggtaagctggataaacacctacactggagagccaacctatgctgatgacttcaagggacgctttaccatttctcgtgataactccaaaaacaccctgtacctgcagatgaactccctgcgcgccgaggatactgcggtgtaccattgtgcgctgcaaaattactacggtaataataacagatacttcgatgtctggggtcagggtactctggtcaccgtgagctctgcgtctaccgatatccagatgacccagtctccgtcttctctgtctgcgagcgttggtgaccgtgttaccatcacttgcagggccagctcaagtgtaaattacatgcactggtatcagcagaaaccgggcaaagcgccgaaactgctgatcctggccacatccatcctggcttctggtgttccgtctcgtttctctggcagcggttctggtaccgacttcaccctgactatctctagcctgcagccggaagacttcgcaacctactattgccagcagtggtatagtaacccacggacgttcggtcagggtaccaaagtagaaatcaaacgt。
scFv序列和质粒pBY分别经NdeI/XhoI双酶切,切胶回收片段进行连接,然后转化大肠杆菌BL21 trxB(DE3),在Tet阳性LB平板上挑取单菌落,以碱裂解法提取质粒DNA,经NdeI/XhoI双酶切进行验证,得到阳性克隆(图2)。
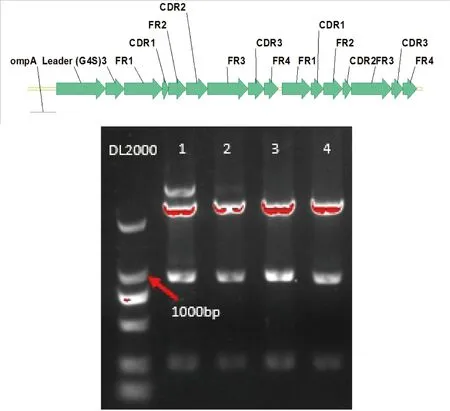
图2 scFv结构示意图及重组质粒双酶切验证
注:泳道1~4为挑选的单克隆
2.2 不同诱导温度对单链抗体可溶性表达的影响
在转接后培养7 h后,加入0.1 mmol/L的IPTG,分别在16℃、23℃、30℃诱导培养16 h后,收获菌体进行SDS-PAGE分析。由图3可知,23℃诱导时单链抗体的表达量较高,说明温度过高过低都不适合单链抗体的表达,温度过高容易形成包涵体,温度过低细菌生长缓慢,蛋白质合成速率也相对较慢,因此本实验选择在23℃条件下诱导培养。
2.3 诱导剂浓度和诱导时机对单链抗体表达的影响
实验比较了在转接后培养7 h,在23℃诱导条件下,加入IPTG至终浓度分别为0、0.05、0.1、0.5、1.0、1.5 mmol/L,在23℃诱导培养16 h。收获菌体进行SDS-PAGE分析单链抗体的表达水平,由图4可知,随着IPTG浓度的增加,单链抗体的表达水平没有明显的差别,但考虑到IPTG的成本以及IPTG对菌体生长的有害影响,故本实验选择以最低浓度0.05 mmol/L的IPTG进行诱导培养。

图3 诱导温度对可溶性表达的影响
注:泳道1~3分别为16℃、23℃、30℃时的表达;4为空载体对照。箭头所指为目标蛋白

图4 IPTG浓度对scFv可溶性表达的影响
注:泳道1~5代表诱导剂浓度分别为0.05、0.1、0.5、1.0、2.0 mmol/L;6为空载体对照。箭头所指的目标蛋白
图5是工程菌在30℃培养条件下的生长曲线,根据此生长曲线拟选择在对数生长期前期、中期、后期进行诱导。本实验最初选定在转接后5、7、9 h分别加入0.05 mmol/L的IPTG 23℃诱导培养16 h,结果如图6-A。从图6中可以看出在5 h时进行诱导,单链抗体的表达量明显高于其他条件。为探究诱导剂提前加入,表达效果是否会更好,本实验在转接后不同时间加入诱导剂,结果如图6-B,可见提前加入诱导剂对其表达量几乎没有影响,但由于诱导剂对菌体生长产生影响故不宜过早加入诱导剂。
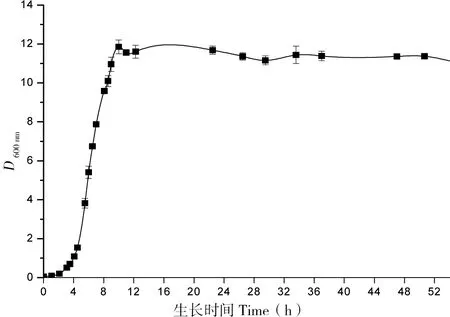
图5 工程菌株生长曲线

图6 IPTG加入时间对scFv可溶性表达的影响
注:A图1~3泳道分别为5、7、9 h的表达,4为空载体对照;B图1~9泳道分别为0.5、1……4、4.5 h的表达,10为空载体对照。箭头处为目标蛋白
2.4 诱导时间对单链抗体可溶性表达的影响
在转接后培养5 h,加入终浓度为0.05 mmol/L的IPTG,23℃分别诱导培养4、12、16、20、24、27、36、42 h,结果如图7所示。可以看出,在诱导培养16 h的单链抗体的表达量达到最高,再随着诱导时间的增加,单链抗体的表达量不再有明显的变化。同时在诱导后16 h,发酵液中菌体生长已经进入稳定期,总菌量基本不再发生变化。所以,诱导时间最终定为16 h。
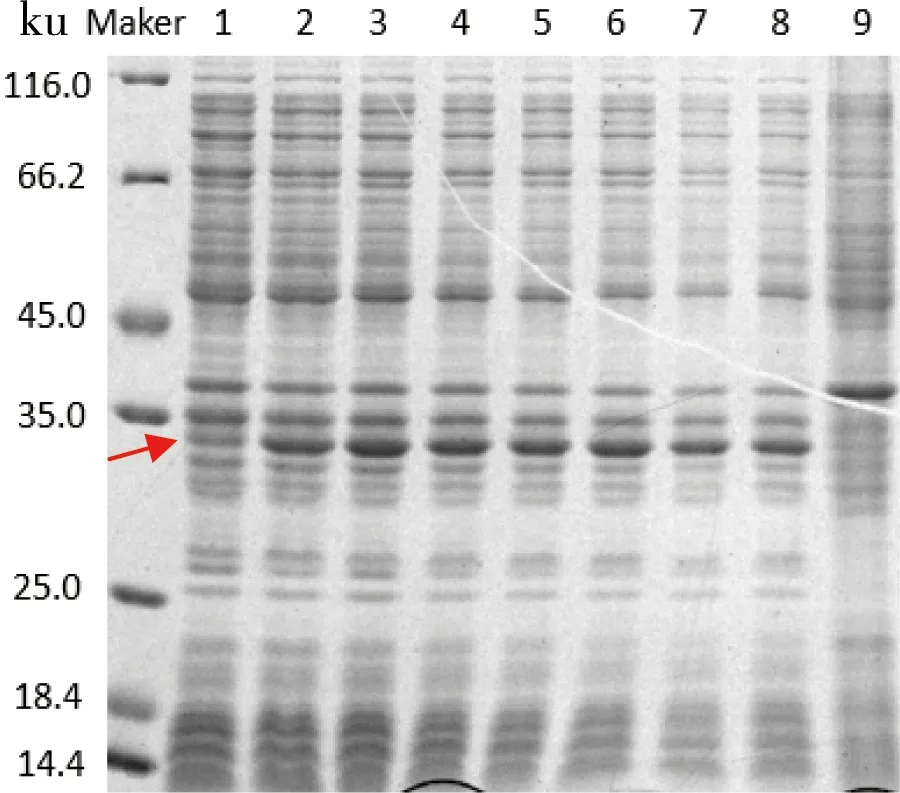
图7 诱导时间对scFv可溶性表达的影响
注:泳道1~8分别代表诱导4、12、16、20、24、27、36、42 h;9为空载体对照
2.5 单链抗体Western blotting鉴定及ELISA检测
收获菌体经SDS-PAGE后,通过半干转的方式转移到PVDF膜上,经PBST洗涤3次,每次洗涤5 min,然后用5%的脱脂奶粉37℃封闭1 h,同样经PBST洗涤3次,加入二抗HRP-ProteinA(1:5000)稀释液,37℃孵育1 h,经3次洗涤后加入底物与发光液,显色观察结果,结果如图8。采用ELISA方法测定scFv的表达量达到了1.23 g/L。
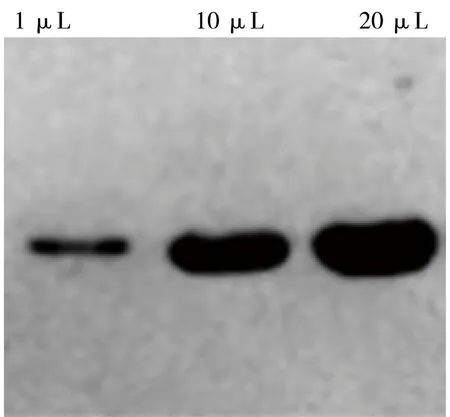
图8 Western blotting鉴定结果
2.6 发酵罐放大培养及关键参数优化
2.6.1 在5 L发酵罐水平上诱导剂加入时间对scFv可溶性表达的影响
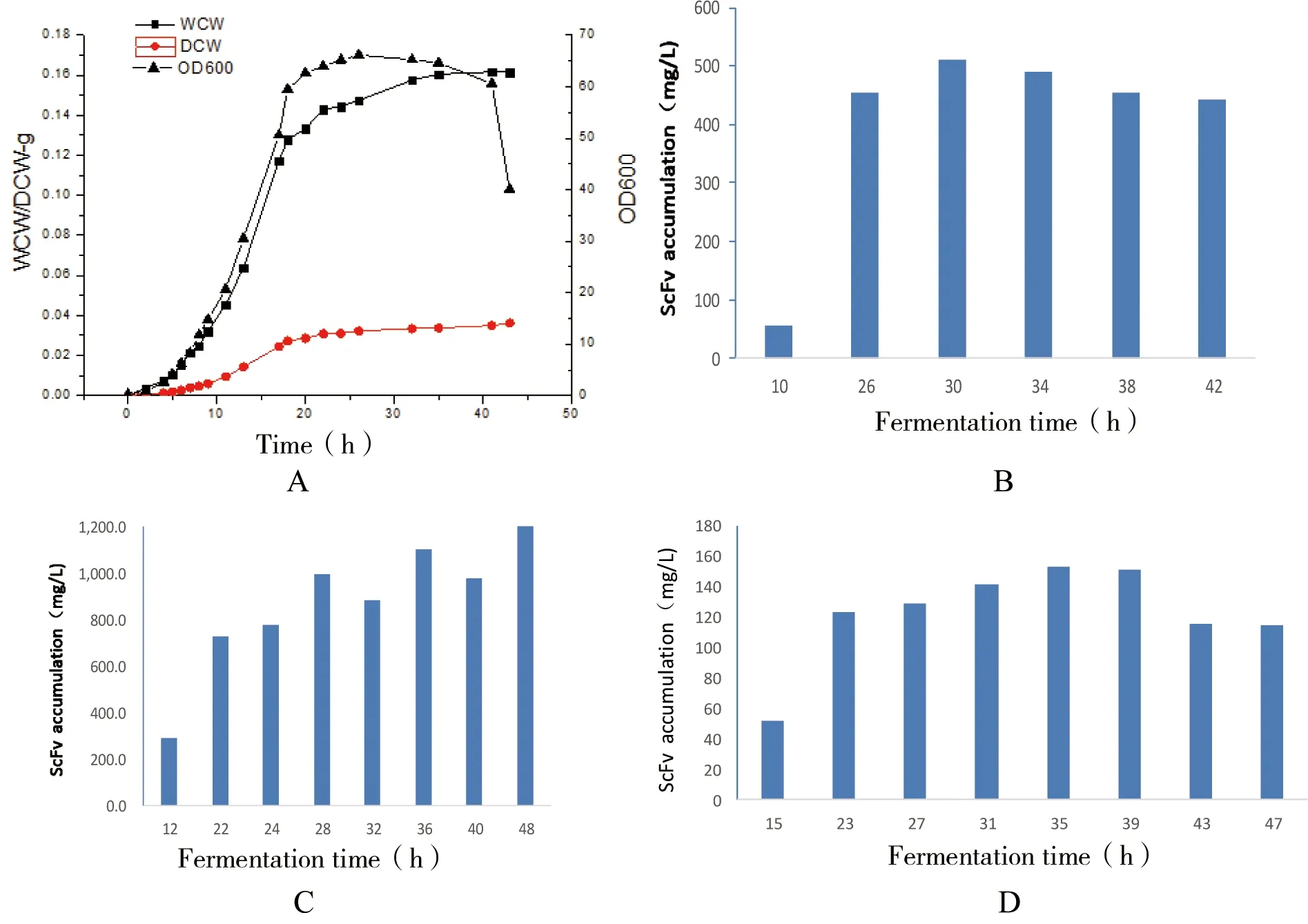
图9 诱导剂加入时间对scFv可溶性表达的影响
注:图A为发酵罐30℃培养生长曲线;图B、C、D为加入诱导剂的时间点分别为10、12、15 h
由于诱导剂的加入时间对scFv的产量有至关重要的作用,加入过早影响菌体的生长,加入过晚影响目的蛋白的表达水平而且有可能产生包涵体,因此我们根据在5 L发酵罐发酵条件下的生长曲线(图9-A)选定3个点作为诱导剂加入时间点,这3个点分布在对数前期、对数中期和对数中后期(图9-B、C和D),诱导剂浓度为0.5 mmol/L,通过直接ELISA法测定scFv的可溶性表达量,结果如图9。由图9可知在对数中期加入诱导剂时表达效果最好,最高达到2.49 g/L。
2.6.2 不同诱导剂浓度对scFv可溶性表达的影响
在2.6.1的基础上选定12 h为诱导剂加入时间点,诱导剂浓度设定为0.1、0.5、1.0、2.0 mmol/L进行诱导培养,用直接ELISA法测定scFv可溶性表达量,结果如图10,由此可知诱导剂浓度在0.5 mmol/L时诱导表达效果最好,并且scFv单细胞的表达量并不是随着诱导时间的加长而升高,而是呈现一个稳定的趋势。
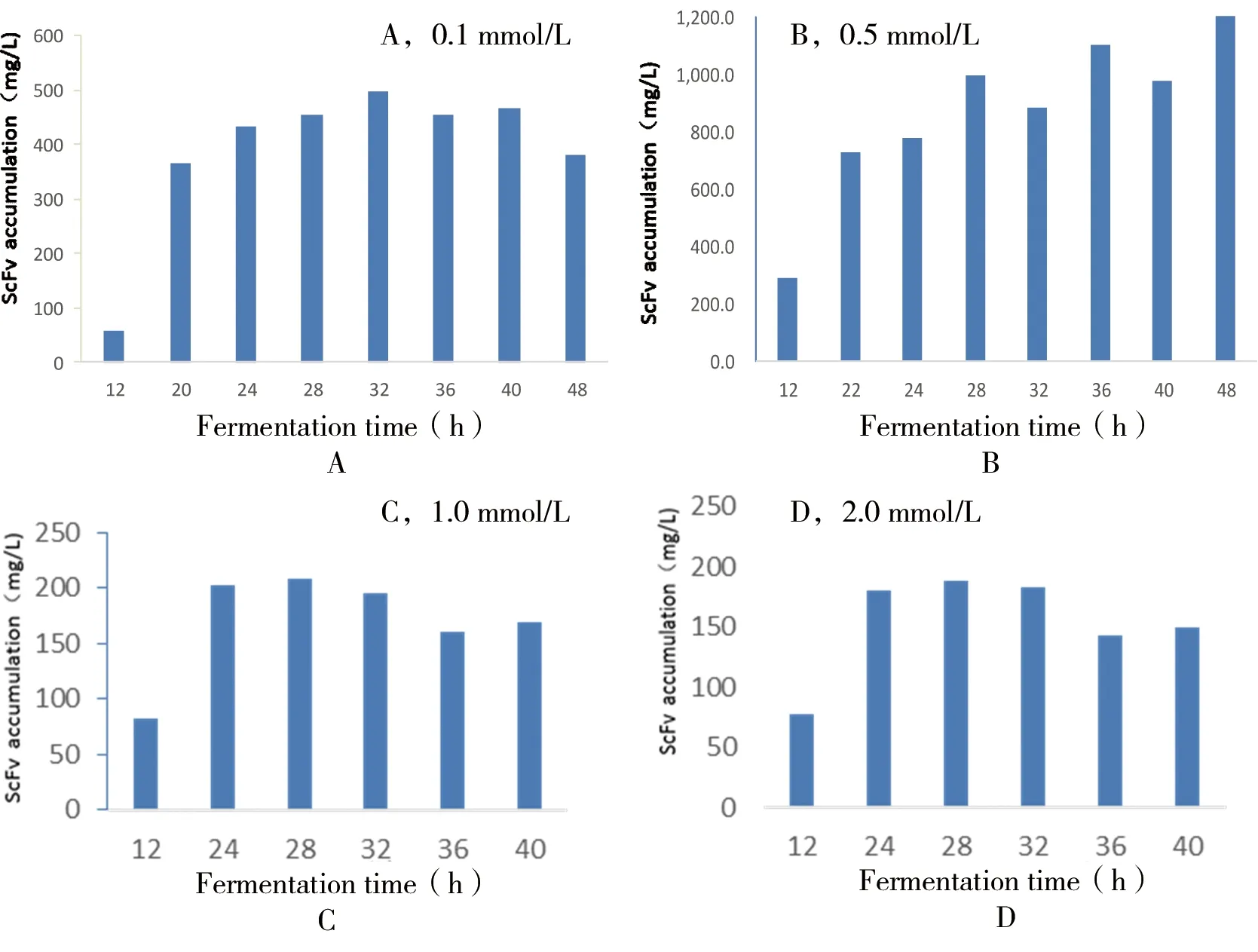
图10 不同IPTG浓度对单链抗体可溶性表达的影响
3 讨论
人-鼠嵌合单链抗体即采用基因工程的方法将鼠源性抗体的重链和轻链的可变区插入到人抗体的恒定区生产的第3代抗体,是一种较为成熟的基因抗体,其具有独特的优势既保留了鼠源抗体的高特异性和高亲和力,又能降低在人体内产生的HAMA反应[11]。到2008年为止,治疗性抗体的产值主要来源于嵌合抗体。到2010年,全球治疗性抗体市场额达到303亿美元[12]。但构建出一套高效的表达系统是嵌合抗体能够规模化生产和应用于临床的必要前提[13],目前已成功表达出单链抗体的表达系统包括大肠杆菌表达系统,酵母表达系统,哺乳动物细胞表达系统以及昆虫表达系统等[14-16],但由于大肠杆菌表达系统目前研究得较为透彻,成本较低,操作简单,而且表达的目的产物单链抗体不需要糖基化修饰[17],最主要的是由于大肠杆菌表达系统的高表达和较高的生物活性[18],本研究利用自己构建的pBY为表达载体,选择以BL21 trxB(DE3)为宿主菌,通过对诱导温度,诱导剂浓度,诱导时机以及诱导培养时间的优化,得到最适培养条件即在转接培养后5 h,IPTG终浓度为0.05 mmol/L时,23℃诱导培养16 h,单链抗体的可溶性表达最高,达到1.23 g/L,在5 L发酵罐水平培养时,通过对诱导时机和诱导剂浓度的优化,单链抗体的可溶性表达量达到2.49 g/L。
本文利用分子生物学技术获得人-鼠嵌合单链抗体的编码基因,通过构建一套表达系统能够使单链抗体在大肠杆菌中进行高效可溶性表达,并对发酵条件进行初步优化和发酵水平的放大,都能够很好地表达,这为单链抗体的后续纯化及理化性质的分析提供了方便,为后续工艺放大及临床应用提供了研究基础。
[1]MAYNARD J,GEORGIOU G.Antibody engineering [J].Annu Rev Biomed Eng,2000,2:339-376.
[2]BREKKE O H,SANDLIE I.Therapeutic antibodies for human diseases at the dawn of the twenty-first century [J].Nat Rev Drug Discov,2003,2(1):52-62.
[3]HOSONO M,ENDO K,SAKAHARA H,et al.Human/mouse chimeric antibodies show low reactivity with human anti-murine antibodies (HAMA) [J].British Journal of Cancer,1992,65(2):197-200.
[4]SALFELD J G.Isotype selection in antibody engineering [J].Nat Biotechnol,2007,25(12):1369-1372.
[5]LOBO E D,HANSEN R J,BALTHASAR J P.Antibody pharmacokinetics and pharmacodynamics [J].J Pharm Sci,2004,93(11):2645-2668.
[6]ELVIN J G,COUSTON R G,VAN DER WALLE C F.Therapeutic antibodies: market considerations,disease targets and bioprocessing [J].Int J Pharm,2013,440(1):83-98.
[7]GRASLUND S,NORDLUND P,WEIGELT J,et al.Protein production and purification [J].Nat Methods,2008,5(2):135-146.
[8]MORRISON S L,JOHNSON M J,HERZENBERG L A,et al.Chimeric human antibody molecules: mouse antigen-binding domains with human constant region domains [J].Proceedings of the National Academy of Sciences of the United States of America,1984,81(21):6851-6855.
[9]WEISSER N E,HALL J C.Applications of single-chain variable fragment antibodies in therapeutics and diagnostics [J].Biotechnol Adv,2009,27(4):502-520.
[10]HOLT L J,BASRAN A,JONES K,et al.Anti-serum albumin domain antibodies for extending the half-lives of short lived drugs [J].Protein Eng Des Sel,2008,21(5):283-288.
[11]HOLLIGER P,HUDSON P J.Engineered antibody fragments and the rise of single domains [J].Nat Biotechnol,2005,23(9):1126-1136.
[12]ECKER D M,JONES S D,LEVINE H L.The therapeutic monoclonal antibody market [J].MAbs,2015,7(1):9-14.
[13]WELCH M,GOVINDARAJAN S,NESS J E,et al.Design parameters to control synthetic gene expression inEscherichiacoli[J].PLoS One,2009,4(9):e7002.
[14]MAKINO T,SKRETAS G,GEORGIOU G.Strain engineering for improved expression of recombinant proteins in bacteria [J].Microb Cell Fact,2011,10:32.
[15]AGOSTINI F,VENDRUSCOLO M,TARTAGLIA G G.Sequence-based prediction of protein solubility [J].J Mol Biol,2012,421(2-3):237-241.
[16]WILKINSON D L,HARRISON R G.Predicting the solubility of recombinant proteins inEscherichiacoli[J].Biotechnology(N Y),1991,9(5):443-448.
[17]CHRISTENDAT D,YEE A,DHARAMSI A,et al.Structural proteomics of an archaeon [J].Nat Struct Biol,2000,7(10):903-909.
[18]LUAN C H,QIU S,FINLEY J B,et al.High-throughput expression ofC.elegansproteins [J].Genome Res,2004,14(10B):2102-2110.
Construction of chimeric single-chain antibody efficient soluble expression inEscherichiacoliand optimization of fermentation conditions
LIU Meng1,2,3,SUN Yang1,2,3,YANG Yan-kun1,2,3,BAI Zhong-hu1,2,3
(1.National Engineering Laboratory for Cereal Fermentation Technology; 2.The Key Laboratory of IndustrialBiotechnology,Ministry of Education,School of Biotechnology; 3.The Key Laboratory of Carbohydrate Chemistry and Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Total RNA was extracted from the hybridoma cells which was prepared through human serum albumin immunized mice and reverse transcribed to cDNA by specific primers.Antibody fragments of VHand VLwere amplified by RT-PCR and spliced with CHand CLgenes of humanized Fab to construct a human-mouse chimeric single-chain antibody fragment (scFv).The scFv was cloned into pBY vector and transformed intoE.coliBL21-trxB(DE3) cells for expression.Through the optimization of fermentation conditions,the soluble expression yield of scFv reached 1.23 g/L and 2.49 g/L in flask and 5 L fermenter respectively.
chimeric antibody;scFv;soluble expression;ELISA;optimization of fermentation conditions
2016-03-21;
2016-03-23
收稿日期:国家自然科学基金项目(31570034);863项目(2015AA020802);973项目(2013CB733602);中央高校基本科研业务费专项资助(JUSRP51401A)
刘 萌,硕士研究生,主要从事单链抗体的表达纯化工作,E-mail:1107988900@qq.com
杨艳坤,副教授,硕士生导师,主要从事微生物学、基因工程、蛋白质分离纯化及特性研究等相关领域,E-mail:yangyankun@jiangnan.edu.cn
10.3969/j.issn.2095-1736.2016.06.001
Q78
A
2095-1736(2016)06-0001-06
