舌癌临床样本N-连接糖链的表达分析
2016-12-22杨刚龙黄如今
郭 辉,张 健,杨刚龙,黄如今,郭 佳
(1.江南大学 无锡医学院,无锡 214122; 2.江南大学 糖化学与生物技术教育部重点实验室,无锡 214122; 3.南京医科大学附属无锡二院 口腔科,无锡 214122)
舌癌临床样本N-连接糖链的表达分析
郭 辉1,张 健3,杨刚龙2,黄如今2,郭 佳2
(1.江南大学 无锡医学院,无锡 214122; 2.江南大学 糖化学与生物技术教育部重点实验室,无锡 214122; 3.南京医科大学附属无锡二院 口腔科,无锡 214122)
从糖组学角度分析健康志愿者和舌癌患者血清中差异表达的N-连接糖链,找出与舌癌密切相关的N-连接糖链结构,为舌癌早期诊断、治疗及预后提供参考依据。以临床血清样品为研究材料,采用滤膜分离全糖蛋白N-连接糖链法(N-glycan-FASP-T)对健康志愿者和舌癌患者血清中全糖蛋白N-连接糖链分别进行比较分析,并利用MALDI-TOF/TOF串联质谱解析糖链结构,通过一级、二级质谱方法分析糖链结构和种类,并通过对糖链丰度数据的ROC曲线分析等统计学方法分析确定其表达水平对舌癌的影响。结果表明,与健康志愿者相比,舌癌患者血清糖链特征主要有:杂合型糖链比例升高;在复合型糖链中,三天线比例升高,而二天线及四天线的比例降低;末端Neu5Gc 增加;平分型糖链比例升高。统计学分析发现其中有10个糖链结构在疾病发生过程中显著上调(AUC值大于0.50,其中m/z=1256.510/1418.573的两个糖链的AUC值达到了0.75),可以作为潜在的生物标志物并可以进行深入探究,为舌癌早期诊断提供临床参考依据。
舌癌;MALDI-TOF/TOF-MS;N-glycan-FASP-T;N-连接糖链;糖组学
舌癌是口腔颌面部常见的恶性肿瘤,具有高发病率和生存率低的特点[1]。流行病学研究发现,口腔易发生癌变的部位是舌体,多发生于男性,且发病年龄越来越年轻化,因此越来越受到众多学者的关注[2]。相关研究中表明在正常的上皮细胞中只能检测到GalNAc-T3,而在舌癌患者上皮细胞中能检测到N-乙酰半乳糖胺转移酶3(GalNAc-T3)和N-乙酰半乳糖胺转移酶6(GalNAc-T6)[3]。由此看来,在舌癌病变的过程中糖链发生变化。因此推测在舌癌患者的血清和组织样本中同样也存在蛋白质糖基化修饰异常的现象。为了验证这一推断,我们以临床健康人和舌癌患者手术前后的血清样品为研究材料,采用滤膜分离血清中全糖蛋白N-连接糖链的方法,利用MALDI-TOF/TOF串联质谱分析不同样品中N-连接糖链的表达差异性,并通过一级、二级质谱数据分析糖链结构和种类,找出与舌癌的发生发展密切相关的糖蛋白N-连接糖链结构,为舌癌早期的诊断、及时治疗及良好预后提供重要的参考依据[4]。
1 材料与方法
1.1 材料
500 μL的分子筛超滤管(SIGMA-ALDRICH公司);1.5 mL离心管(Corning公司);舌癌病人血清样本由无锡市第二人民医院的张健医生惠赠;台式离心机(HITECHI公司);ultrafleXtreme MALDI-TOF/TOF-MS(Bruker Daltonics公司);离心浓缩仪(Martin Christ公司);iMark酶标仪(Biorad公司)。
1.2 方法
1.2.1 样品采集和预处理 实验中所用到的舌癌病人血清样本主要包括舌癌病人血清16例(术前8例,术后8例),健康志愿者血清7例。样品采集方法:从无锡市第二人民医院获取健康志愿者血清,口腔鳞状细胞癌病人术前、术后5 d血清各8份,在30 min~2 h之间对血清进行1200 r/min离心15 min,测定样品的蛋白质浓度,分装-80℃保存备用。为了保证实验的准确性和可信度,以下实验重复3次。
1.2.2 血清样品的选择及N-连接糖链的分离富集
在10 ku超滤膜中加入2 mg蛋白和200 μL的8 mol/L尿素,14 000r/min离心15 min,弃流出液;重复1次;加10 mmol/L的DTT溶液150 μL,混匀,于56℃孵育45 min,14 000 r/min离心10 min,弃流出液;加150 μL的20 mmol/L的IAM,暗室温孵育20 min,14 000 r/min离心10 min,弃流出液;加150 μL的40 mmol/L NH4HCO3,振荡混合2 min,14 000 r/min离心10 min,弃流出液,重复3次。将超滤管移至新的收集管中,加入200 μL PNGase F酶液,振荡混合2 min,37℃湿盒孵育过夜,14 000 r/min离心10 min,弃流出液;加入200 μL的超纯水,14 000 r/min离心8 min,重复1次。冷冻干燥流出液。
1.2.3 糖链的除盐(Clean up)处理 加100 μL的Sepharose 4B和1 mL的甲醇水溶液(1:1)至离心管中,摇匀,12 000 r/min离心5 min,弃上清,重复2次。再加5:1:1的正丁醇:甲醇:水溶液1 mL,摇匀,12 000 r/min离心5min,弃上清,重复清洗2次。向糖链样品中加入500 μL的5:1:1的正丁醇:甲醇:水溶液,上样至Sepharose 4B离心管,摇匀,25℃振荡反应1 h,14 000 r/min离心15 min,弃上清。加1 mL 5:1:1的正丁醇:甲醇:水溶液,摇匀,12 000 r/min离心5 min,弃上清,重复清洗3次。加1 mL的甲醇水溶液(1:1)摇匀,25℃振荡20 min,12 000 r/min离心15 min,收集上清。重复1次,冷冻干燥样品[5]。
1.2.4 MALDL-TOF/TOF-MS解析糖链 应用MALDI-TOF/TOF-MS仪器解析血清中糖蛋白的N-连接糖链。用50%的甲醇溶液4 μL溶解糖链,取1.5 μL糖链溶液点样于MTP Anchorchip 384靶板上,晾干。加20 mg/mL基质DHB 1 μL至样品板上,自然晾干。以反射阳性离子模式鉴定多糖,用标准多肽样品作为外标校正质谱仪。再多点采集每个样品的图谱,每个图谱扫描500次,将所有图谱叠加获得多糖一级图谱。从一级图谱中选择质谱峰进行二级质谱分析,用Glycoworkbench软件分析糖链的二级质谱图[6]。
1.2.5 糖链的质谱结构分析 在flexAnalysis软件中取信噪比大于6的质谱峰做后续分析,将所得糖链的m/z和信号强度用Glycoworkbench软件分析。从数据库导出每一个质荷比可能对应的糖链结构,对这些有可能的结构再进一步通过二级质谱进行确认验证,然后得到可能性较大的一个或几个。
2 结果与分析
2.1 舌癌血液样品N-连接糖链糖组图谱分析
蛋白质的糖基化异常是肿瘤发生与发展过程中的一个基本特性,与肿瘤细胞的侵袭和转移过程有密切的关系[7-10],要了解肿瘤中蛋白质糖基化异常的相关机制,进一步确认潜在的N-连接糖链肿瘤标志物,首先要对特异性N-连接糖链的结构进行鉴定、筛选和解析[11]。在所有糖链结构解析方法中,质谱具有高分辨率和高灵敏性等优点,利用质谱仪对糖链样品进行检测,可以分析获得糖链结构[12-13]。本实验将舌癌病人血清(术前8例,术后8例)和健康志愿者血清(7例)利用一级、二级质谱分析,获得舌癌血清样品的N-连接糖链质谱图,并进行对比分析,找出疾病不同阶段的糖链差异,并对糖链结构进行了二级结构的分析,已确认糖链详细信息(图1)。
经过一级、二级质谱的解析,得到注释(表1)。

图1 健康志愿者、术前舌癌患者和术后5 d舌癌患者血清中N-连接糖链一级(A)、二级(B)质谱图
Fig 1 MALDI-TOF/TOF-MS spectra of total N-glycans of the healthy volunteers,oral cancer patients and oral cancer patients after operative treatment in five days.Profiling of the N-linked glycan chain (A),and MALDI-TOF/TOF-MS analysis of N-glycan precursor ions in MS spectra(B)
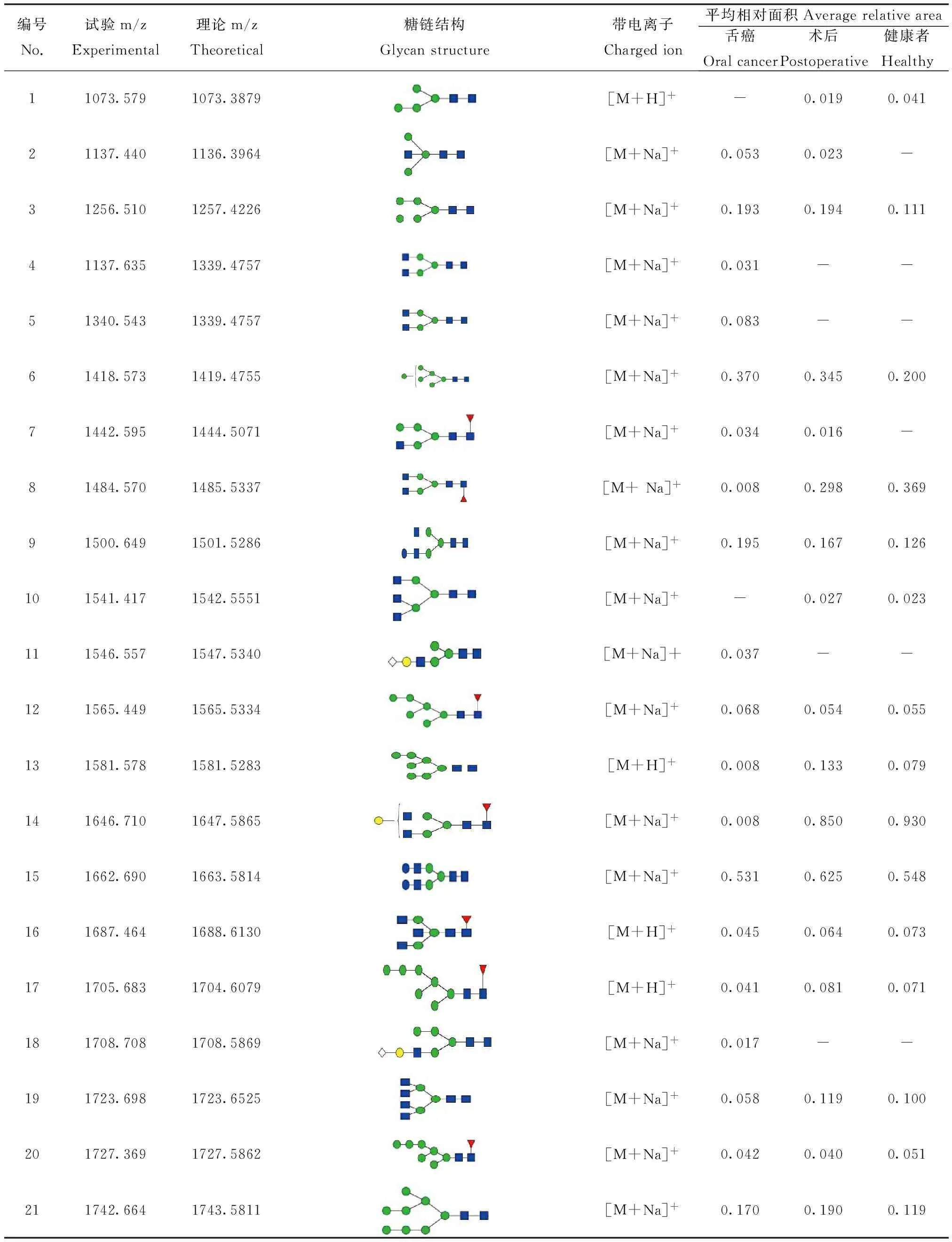
表1 一级质谱数据注释
续表1(continued table 1)
编号No.试验m/zExperimental理论m/zTheoretical糖链结构Glycanstructure带电离子Chargedion平均相对面积Averagerelativearea舌癌Oralcancer术后Postoperative健康者Healthy221808.7561809.6393[M+Na]+0.7860.7540.741231824.6971825.6342[M+Na]+0.0360.0420.090241849.7391850.6659[M+Na]+0.1860.2180.217251865.6581866.6608[M+Na]+0.0320.0700.068261869.6641869.7105[M+H]+-0.006-271894.0041892.6887[M+H]+0.0300.0570.076281904.7591905.6339[M+H]+0.1710.1950.139291909.4941907.6873[M+Na]+0.0840.1280.084301926.3441926.7319[M+H]+0.0130.0270.037311975.8081974.7418[M+H]+0.4300.6530.599321991.4551990.7367[M+H]+0.0660.0650.146332011.8602012.7187[M+Na]+0.1650.1890.144342027.9342028.7136[M+Na]+0.0190.0280.038352031.7342031.7633[M+Na]+0.0470.0500.060362035.5552034.6336[M+Na]+0.0230.0720.049372121.9402120.7997[M+H]+0.1190.1680.206382137.7332135.7742[M+H]+--0.021392158.9902158.7766[M+Na]+0.0220.0330.057402174.5112174.7751[M+Na]+-0.0120.027412177.5822177.8212[M+H]+0.0260.0240.044
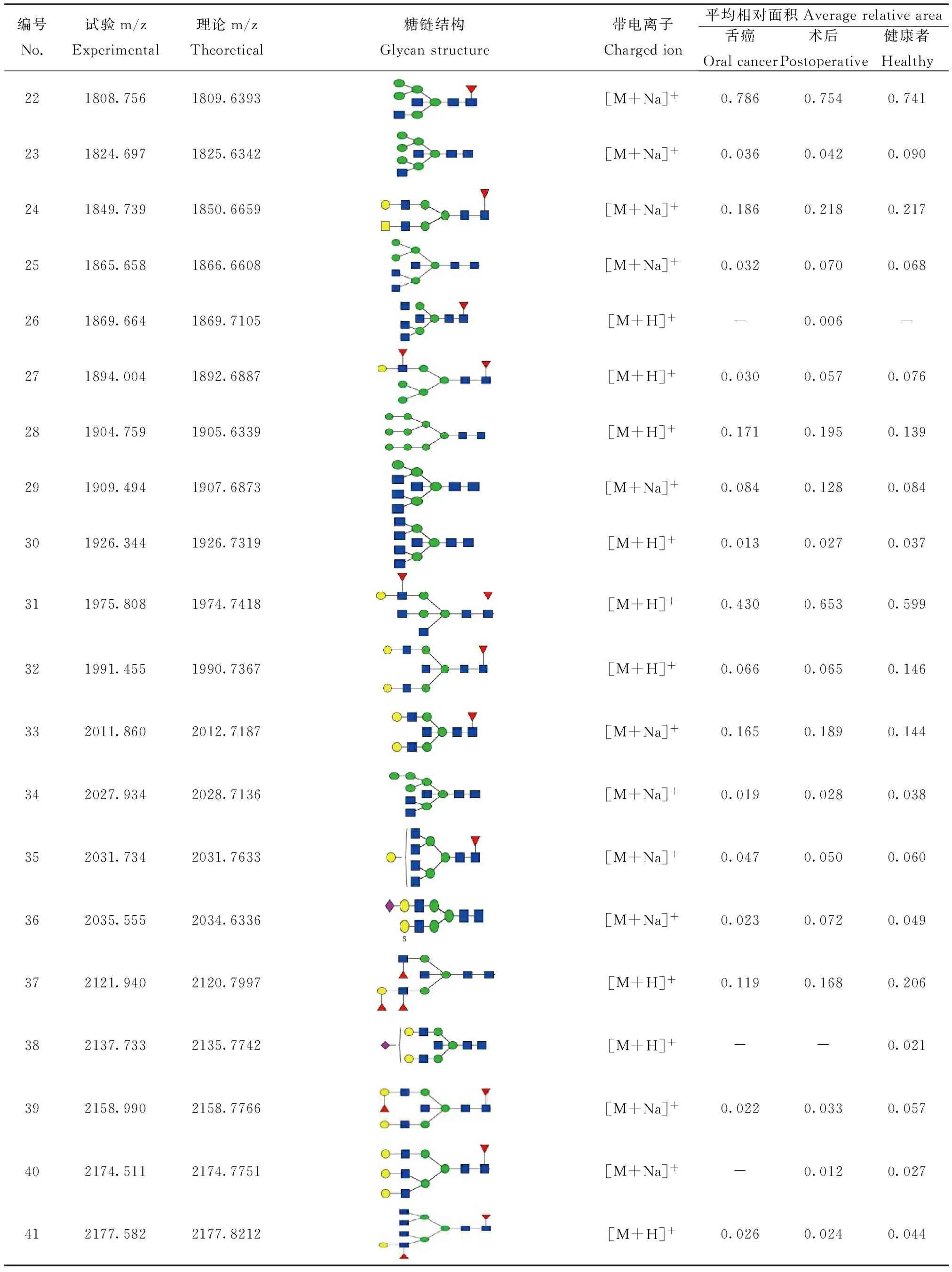
续表1(continued table 1)
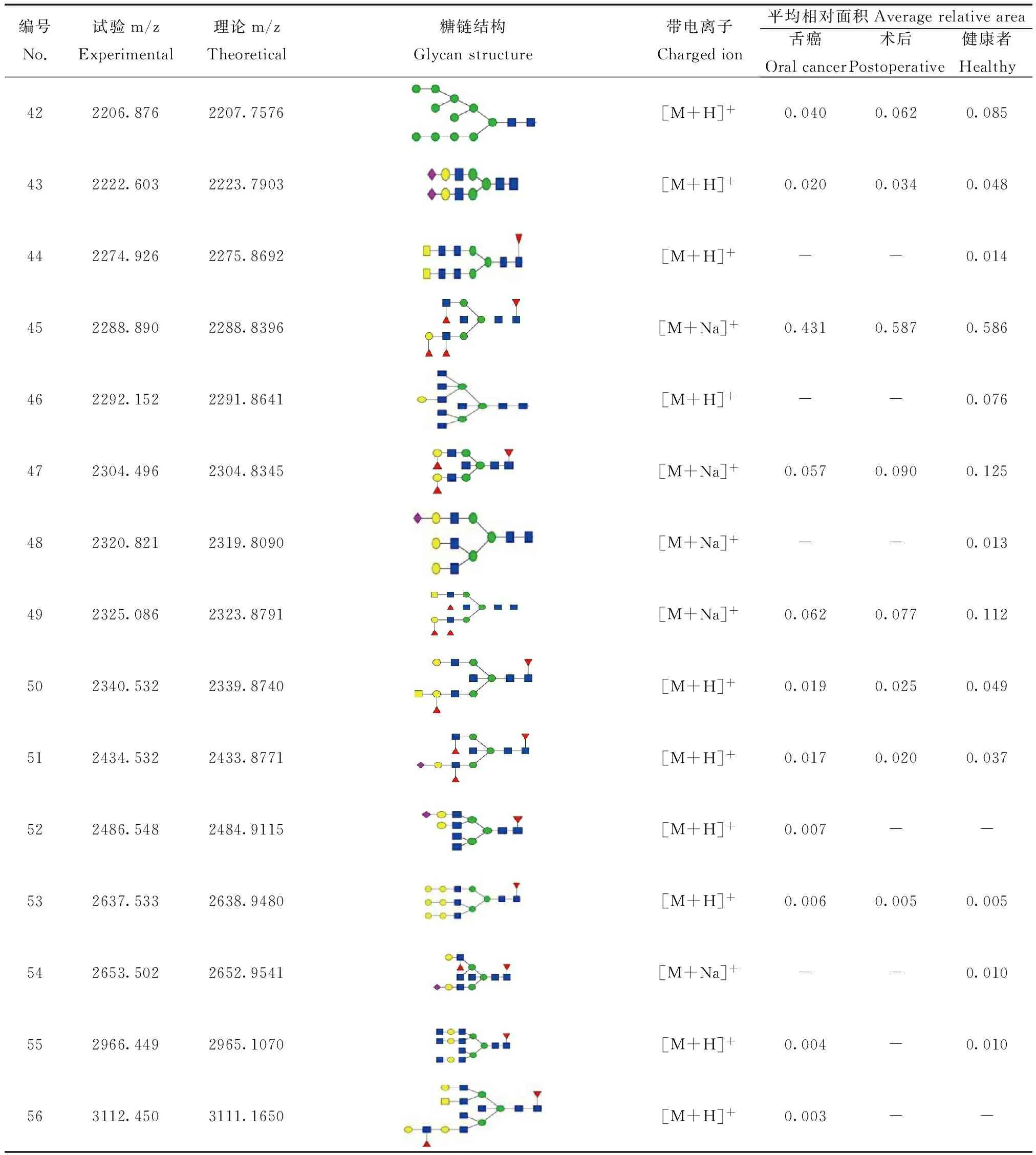
编号No.试验m/zExperimental理论m/zTheoretical糖链结构Glycanstructure带电离子Chargedion平均相对面积Averagerelativearea舌癌Oralcancer术后Postoperative健康者Healthy422206.8762207.7576[M+H]+0.0400.0620.085432222.6032223.7903[M+H]+0.0200.0340.048442274.9262275.8692[M+H]+--0.014452288.8902288.8396[M+Na]+0.4310.5870.586462292.1522291.8641[M+H]+--0.076472304.4962304.8345[M+Na]+0.0570.0900.125482320.8212319.8090[M+Na]+--0.013492325.0862323.8791[M+Na]+0.0620.0770.112502340.5322339.8740[M+H]+0.0190.0250.049512434.5322433.8771[M+H]+0.0170.0200.037522486.5482484.9115[M+H]+0.007--532637.5332638.9480[M+H]+0.0060.0050.005542653.5022652.9541[M+Na]+--0.010552966.4492965.1070[M+H]+0.004-0.010563112.4503111.1650[M+H]+0.003--
2.2 不同糖型N-连接糖链在舌癌中的比较分析
本实验从血清中共分离获得56种N-连接糖链结构,糖链结构峰型明显,信噪比均大于6。通过对每个样本、多次重复的实验,我们发现患者血清(样本数:16)与健康志愿者血清(样本数:7)中36个糖链的表达有明显的差异,其中有30个糖链结构为岩藻糖化,有5个在健康志愿者体内特异性的表达,有6个在病人体内特异性表达;7个糖链结构为唾液酸化。为了准确、直观地分析血清中各种类型的 N-连接糖链表达水平的变化,我们把注释的糖链分为高甘露型糖链(high-mannose)、杂合型糖链(hybrid)、二天线型糖链(biantennary)、多天线型糖链 (multiantennary)和平分型糖链(bisected)等5类,分别分析这5种糖链,希望发现不同糖链在舌癌发生过程中的规律,进而了解N-连接糖链与舌癌之间的关系。从表中可以看出不同类型的N-连接糖链在舌癌中有较明显的变化。健康志愿者和舌癌患者血清在杂合型的表达上具有明显的差别:健康志愿者血清中杂合型比例明显要低于病人手术前(20.0% VS 31.9%),病人手术后该比例有一定的降低。在健康志愿者和舌癌患者血清中复杂型糖链的精细结构发生明显变化。与健康志愿者相比,舌癌患者血清中糖链结构具有3个典型的特点:1)在复合型糖链中,三天线比例升高,而二天线及四天线的降低。2)末端Neu5Gc增加,人体细胞缺少从Neu5Ac转化为Neu5Gc的唾液酸羟化酶,因此健康志愿者体内不存在Neu5Gc。在肿瘤细胞表面却高表达Neu5Gc,推测肿瘤细胞中的唾液酸羟化酶高表达,将Neu5Ac转化为Neu5Gc,导致肿瘤细胞中的Neu5Ac减少[14]。3)平分型糖链比例较高,在手术后有降低的现象(见表2)。
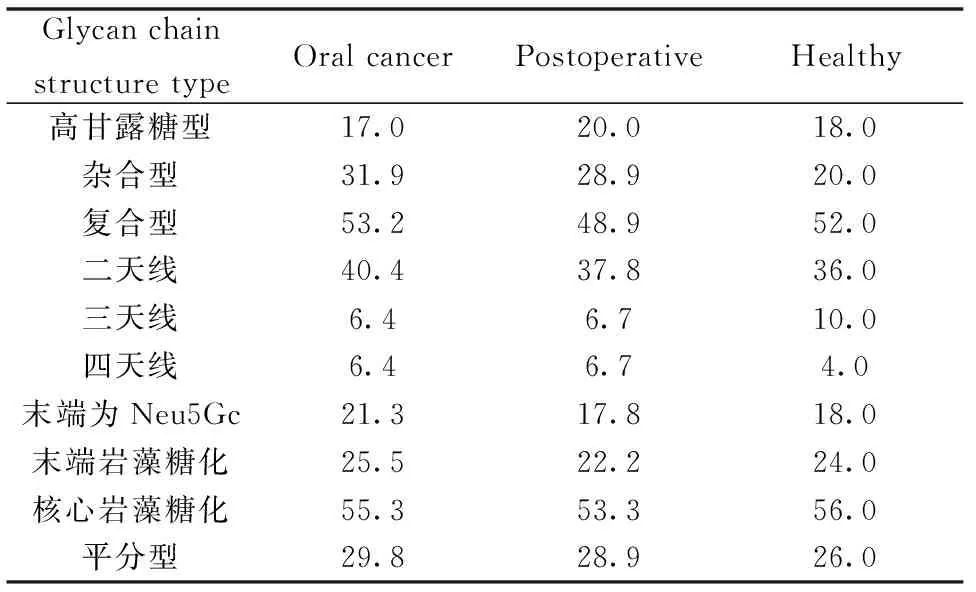
表2 血清样本中不同类型的糖链比例(%)
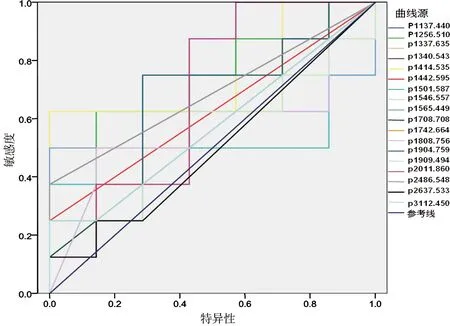
图2 舌癌血清样品中 N-连接糖链AUC值大于0.5的ROC曲线分析图Fig 2 ROC curve analysis of serum samples oral cancer N-glycan chain
2.3 舌癌血清样品中 N-连接糖链的ROC曲线分析
为了寻找潜在的糖链分子标志物,作为临床诊断。将每一个糖链进行ROC曲线分析。从源数据56个糖链中,挑选出18个糖链作为可能的诊断依据,其AUC值大于0.5,在统计学上可以认为是准确的,而其中的1256.510、1418.573两个糖链的AUC值为0.750,可以认为十分准确。从ROC曲线分析可以发现m/z为1137.440、1337.635、1340.543、1418.535、1442.595、1500.649、1546.557、1708.708、1808.756、2486.548 10个峰在病人血清中表达上调,同时他们的AUC值均大于0.5,基本可以作为诊断依据。m/z为1256.463、1418.535这两个峰的AUC值达到0.7以上(图2),可以作为诊断依据。
3 讨论
肿瘤的发生发展是一个极其复杂的过程,在这个过程中有多种基因及其产物参与其中,因此,探讨舌癌发生发展过程中的关键性因素并加以干预,或许能推迟或遏止舌癌的发生发展[15]。许多学者希望能从血液、体液等非创伤的临床样品中找到一种用于诊断舌癌的分子标志物。目前有研究者发现与舌组织发生癌变相关的基因和蛋白质有TWIST1、MMPs、p53、HMGB1[16-17],但是只能在晚期才能进行临床的检测确认与癌变有关的标志物,有的标志物则在良性与恶性肿瘤中无明显差异性的表达,目前尚未找到十分有力的诊断参考标志物[18]。大量研究表明,在探讨癌症生物标记分子的过程中,大多数细胞的糖蛋白异常表达,例如在肝癌发生发展的过程中,异常表达唾液酸化糖聚合物,检测到在健康志愿者体内不存在的Neu5Gc[19];前列腺癌的临床样本中,也发现某一些糖链异常表达[20]等。这些研究结果均表明糖类物质和癌症之间存在一定的关系,但是很少从糖链的角度来研究舌癌的发病机理,尚未有人把糖链作为临床诊断的标志物。鉴于糖组学技术(如芯片技术和质谱技术等)可以用于深入广泛地研究糖类物质在舌癌发生过程中的作用[21-22],目前,与CEA(Carcinoembryonic Antigen )、CA125(Cancer Antigen 125)、TSGF(Tumor Supplied Group of Factors)和CA153(Cancer Antigen 153)等联合诊断方法相比较,糖链结构的检测更具有特异性与灵敏性[23]。同时,由于糖链结构的高度多变性,舌癌的临床诊治标准有望越来越细化,并具有个体性。
本实验利用滤膜分离全糖蛋白N-连接糖链法(N-glycan-FASP-T)[24]建立一种在糖蛋白水平上鉴定舌癌发生时人血清中糖蛋白的变化情况,使其能够作为一种舌癌发生早期诊断方法。最后利用MALDI-TOF/TOF-MS技术对23例,3类临床血清样本的N-连接糖链进行定量分析,获得舌癌的 N-连接糖链的谱图,共鉴定和注释56种 N-连接糖链及其最可能的糖链结构。通过对糖链在不同血清样本中定量分析对比,确定N-连接糖链在健康志愿者和舌癌患者血清中的表达差异性,为进一步探索有效的舌癌分子标志物开拓了新的思路。对获得的糖链结构进行糖型分析后发现,在舌癌患者血清中高表达复合型糖链中的三天线、唾液酸化、岩藻糖化和平分型糖链,并推测高表达唾液酸糖基转移酶和岩藻糖基转移酶,为研究相关糖基转移酶表达的变化提供信息基础。然而,在手术后平分型糖链、唾液酸化复合型中二天线和四天线以及杂合型糖链有降低的现象,从而表明舌癌病人在手术后,病情得到好转,从糖链的角度来分析,术后舌癌患者越来越接近健康志愿者的水平。我们推测通过阐明这些抑制复杂型糖过表达的分子机理有可能为防止舌癌肿瘤恶化提供一定的指导意义。
总之,该研究成果为进一步对舌癌相关的糖组学研究提供定量分析参考。我们认为,为进一步揭示舌癌恶性演变与其糖组学的关系,可以从大量临床样本如血清水平上,进行对比分析,筛选出最可能的分子标志物。在本研究的基础上可以在后续的相关研究中进行一定的验证性实验和扩展性实验。这些实验可以包括:凝集素组化、功能糖蛋白质组学和分子机理探究[25-26]。
[1]ZHANG Z,YANG X F,HUANG K Q,et al.The clinicopathological significances and biological functions of parafibromin expression in head and neck squamous cell carcinomas[J].2015,36(12):9487-9497.
[2]BARRIOS R,TSAKOS G,GARCIA-MEDINA B,et al.Oral health-related quality of life and malnutrition in patients treated for oral cancer[J].Support Care Cancer,2014,22(11):2927-2933.
[3]WANDALL H H,DABELSTEEN S,SORENSEN J A,et al.Molecular basis for the presence of glycosylated onco-foetal fibronectin in oral carcinomas: the production of glycosylated onco-foetal fibronectin by carcinoma cells[J].Oral Oncol,2007,43(3):301-309.
[4]王承健,王仲孚.糖链的生物质谱分析[J].生命科学,2011,23(6):569-576.
[5]YANG G,CUI T,WANG Y,et al.Selective isolation and analysis of glycoprotein fractions and their glycomes from hepatocellular carcinoma sera[J].Proteomics,2013,13(9):1481-1498.
[6]CERONI A,MAASS K,GEYER H,et al.GlycoWorkbench: a tool for the computer-assisted annotation of mass spectra of glycans[J].J Proteome Res,2008,7(4):1650-1659.
[7]DURAND G,SETA N.Protein glycosylation and diseases: blood and urinary oligosaccharides as markers for diagonosis and therapeutic monitoring[J].Clin Chem,2000,46(6 Pt 1):795-805.
[8]ALPER J.Glycobiology.Turning sweet on cancer[J].Science,2003,301(5630):159-160.
[9]PHAN U T,WALDRON T T,SPRINGER T A.Remodeling of the lectin-EGF-like domain interface in P-and L-selectin increases adhesiveness and shear resistance under hydrodynamic force[J].Nat Immunol,2006,7(8):883-889.
[10]PATRIDGE E A,LE ROY C,DI GUGLIELMO G M,et al.Regulation of cytokine receptors by Golgi N-glycan processing and endocytosis[J].Science,2004,306(5693):120-124.
[11]齐义军,王 攀,牛保华,等.植物凝集素串联法富集纯化血清多个亚糖蛋白质组[J].中国科学:生命科学,2011,419(5):377-383.
[12]RAMAN R,RAGURAM S,VENKATARAMAN G,et al.Glycomics: an integrated systems approach to structure-function relationships of glycans[J].Nat Methods,2005,2(11):817-824.
[13]MEDZIHRADSZKY K F,CAMPBELL J M,BALDWIN M A,et al.The characteristics of peptide collision-induced dissociation using a high-performance MALDI-TOF/TOF tandem mass spectrometer[J].Analytical Chemistry,2000,72(3): 552-558.
[14]SCHAUER R.Sialic acids as regulators of molecular and cellular interactions[J].Curr Opin Struct Biol,2009,19(5):507-514.
[15]YOSHIMITSU K,WRIGHT K C,WALLACE S,et al.Hepatic arterial infusion of recombinant platelet factor-4 suppresses metastases of the lungs from tumors implanted into the livers of rabbits[J].Cancer,1995,75(10):2435-2441.
[16]THORBURN J,FRANKEL A E,THORBURN A.Regulation of HMGB1 release by autophag[J].Autophagy,2009,5(2):247-249.
[17]胡砚平,程 筠,赵 炜,等.高迁移率族蛋白在舌癌组织中的表达及意义[J].实用口腔医学杂志,2013,29(1):76-79.
[18]KIRITA T.Oral cancer: current status of molecular biology and treatment strategy[J].Int J Clin Oncol,2014,19(3):421-422.
[19]YANG G,CHU W,ZHANG H,et al.Isolation and identification of mannose-binding proteins and estimation of their abundance in sera from hepatocellular carcinoma patients[J].Proteomics,2013,13(5):878-892.
[20]KYSELOVA Z,MECHREF Y,AL BATAINEH M M,et al.Alterations in the serum glycome due to metastatic prostate cancer[J].Journal of Proteome Research,2007,6(5):1822-1832.
[21]FEIZI T.Progress in deciphering the information content of the glycome′ a crescendo in the closing years of the millennium[J].Glycoconjugate Journal,2000,17(7-9):553-565.
[22]MECHREF Y,HU Y,DESANTOS-GARCIA J L,et al.Quantitative glycomics strategies[J].Molecular & Cellular Proteomics,2013,12(4):874-884.
[23]王名南,黄德秋,陈 燕.血清TSGF,CA153,CA125及CEA联合检测对乳腺癌早期诊断的意义[J].当代医学,2011,17(19):106-107.
[24]杨刚龙,马恬然,李 铮.基于超滤膜辅助的糖蛋白全N-连接糖链的富集和质谱解析(英文)[J].生物化学与生物物理进展,2014,41(4):403-408.
[25]OHTSUBO K,MARTH J D.Glycosylation in cellular mechanisms of health and disease[J].Cell,2006,126(5):855-867.
[26]尹 稳,伏 旭,李 平.蛋白质组学的应用研究进展[J].生物技术通报,2014(1):32-38.
Analysis of N-linked glycans in tongue cancer
GUO Hui1,ZHANG Jian3,YANG Gang-long2,HUANG Ru-jin2,GUO Jia2
(1.Wuxi Medical School,Jiangnan University,Wuxi 214122; 2.Key Laboratory of Carbohydrate Chemistry & Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122; 3.Department of Stomatology,Wuxi second Hospital Attiliated to Nanjing Medical University,Wuxi 214122,China)
In order to identify the N-glycans which are closely related with tongue cancer and provide the evidence to help the early diagnosis,prevention and treatment,the N-glycome in the serum of the healthy volunteers and patients with tongue cancer was compared.The human serum samples was collected and the N-glycans of the whole glycoprotein using N-glycan-FASP-T was isolated,and then identified and was their structures determined by MALDI-TOF/TOF tandem mass spectrometry.After that,the relationship between N-glycan abundance and the tongue cancer was analyzed by the method of ROC curve.Compared to healthy volunteers,in the serum of the patients with tongue cancer,the level of hybrid type,three-antenna and bisecting N-glycans are increased,while the two antennas and four antennas are N-glycans reduced.In addition,there are more terminal Neu5Gc.The statistical analysis results showed that 10 N-glycan structures were significantly upregulated in the course of tongue cancer (AUC>0.50,and AUC to 0.75,which m/z=1256.510/1418.573).
oral cancer; MALDI-TOF-MS; N-glycan-FASP-T; N-linked glycans; glycomics
2016-03-21;
2016-04-08
收稿日期:国家自然科学基金青年科学基金(编号:81402115)
郭 辉,硕士,助理实验师,研究方向为糖生物学和肿瘤生物学研究,E-mail:270724902@qq.com
郭 佳,博士,讲师,研究方向为糖生物学和肿瘤生物学研究,E-mail:guojia@jiangnan.edu.cn
10.3969/j.issn.2095-1736.2016.06.007
R739.86
A
2095-1736(2016)06-0007-08
