遮荫处理对罗汉果果肉组织中罗汉果苷和糖分含量的影响
2016-12-22王海英马小军莫长明涂冬萍白隆华冯世鑫
王海英, 马小军, 莫长明, 赵 欢, 涂冬萍, 白隆华, 冯世鑫
( 1. 天津中医药大学 中药学院, 天津 300193; 2. 中国医学科学院 中国协和医科大学药用植物研究所, 北京 100193; 3. 广西药用植物园, 南宁 530023 )
遮荫处理对罗汉果果肉组织中罗汉果苷和糖分含量的影响
王海英1,2, 马小军2*, 莫长明3, 赵 欢2, 涂冬萍2, 白隆华3, 冯世鑫3
( 1. 天津中医药大学 中药学院, 天津 300193; 2. 中国医学科学院 中国协和医科大学药用植物研究所, 北京 100193; 3. 广西药用植物园, 南宁 530023 )
该研究以罗汉果品种“永青1号”为材料,在果实发育后期进行不同强度的遮荫处理,测定遮荫处理下果肉组织中罗汉果苷各组分含量、各种糖分的积累及其相关糖代谢酶活性、叶片光合特性的变化。结果表明:重度遮荫(70%遮荫)会导致果实中罗汉果甜苷Ⅴ含量显著提高,遮荫60 d(授粉后90 d),对照与70%遮荫处理果实中罗汉果甜苷Ⅴ含量分别为4.83%、5.79%,差异达极显著水平(P<0.01);70%遮荫处理下果实中葡萄糖、果糖含量也明显高于对照(P<0.05)。与罗汉果甜苷Ⅴ、葡萄糖、果糖含量的变化不同,遮荫60 d,70%遮荫处理下罗汉果果实中可溶性糖、蔗糖的含量分别显著(P<0.05)和极显著(P<0.01)低于对照。另外,遮荫处理导致罗汉果叶片净光合速率下降,遮荫40 d,70%遮荫处理下叶片的净光合速率显著低于对照(P<0.05)。综上说明,重度遮荫处理可以引起罗汉果果实品质的改变;光合速率下降是遮荫处理下可溶性糖含量降低的主要原因;SPS、AI、SSC活性的改变则是遮荫导致蔗糖含量降低及葡萄糖、果糖含量上升的重要因素;重度遮荫条件下,荫棚中温度降低可能是罗汉果果实中甜苷Ⅴ含量增高的关键诱因。该研究结果为罗汉果的生产及品质调控提供了理论依据。
罗汉果, 遮荫, 果实品质, 糖, 罗汉果苷, 蔗糖代谢酶活性
罗汉果果实中含有糖、蛋白、维生素和氨基酸等多种营养成分,其中糖含量很高,干果中可溶性糖含量占全果干重的32.08%~39.18%,大果果肉和果皮组织中占干重的45%(钟名诚等,2010;何超文等,2012)。糖类物质是果实的重要成分,其组成与含量对果实的内在品质具有重要影响(龚荣高和张光伦,2003)。然而,由于罗汉果中的生物活性成分——罗汉果甜苷Ⅴ,不仅具有清热润肺镇咳、润肠通便之功效,而且味道极甜,甜度为蔗糖的200~350倍。因此,罗汉果的品质优劣主要由罗汉果甜苷Ⅴ决定,长期以来,研究者的关注点也主要集中在罗汉果甜苷Ⅴ上,而对罗汉果果实中的糖类物质研究较少。尽管罗汉果果实中的甜度主要由罗汉果甜苷Ⅴ决定,但其含量较低,占果实干重的1%左右。而我们以往对罗汉果品种农院B6的研究表明,烘干的成熟果实中,蔗糖、果糖、葡萄糖是含量最高的三类糖分,其中甜度为蔗糖1.8倍的果糖含量仅次于蔗糖而高于葡萄糖。因此,果实中这些总含量达30%的糖类的甜度应高于相同浓度的蔗糖甜度,对于罗汉果果实总甜度也会产生一定的影响,在考察果品质量时不应完全忽略。另外,从结构上看,罗汉果甜苷Ⅴ中含有5个葡萄糖分子。这就意味着,罗汉果果实中的糖类、尤其是葡萄糖含量的多少及其代谢过程很可能会影响罗汉果甜苷Ⅴ的生物合成。因此,研究罗汉果果实中糖的积累过程,从基础上阐述果实内糖代谢的生理机制,对于揭示罗汉果甜苷Ⅴ的生物合成具有较为重要的意义。
遮荫是农业生产中常用的调控措施之一,遮荫对植物体中的初生代谢产物(王洋等,2004;齐欣等,2004)和次生代谢产物(Bargali & Tewari,2004;Liu & St Tzel,2004;Coelho et al,2007)都会产生显著影响。因此,利用遮荫处理罗汉果,有可能同时引起果实中糖类及罗汉果苷含量的变化,便于研究其积累规律及相关机制。本研究以罗汉果品种“永青1号”为材料,测定了不同遮荫处理对罗汉果果实中葡萄糖、果糖、蔗糖、可溶性总糖、淀粉及罗汉果苷含量的影响,并分析了相关糖代谢酶:包括转化酶(invertase,EC3.2.1.26,又分为酸性转化酶(AI)和中性转化酶(NI),主要作用是催化蔗糖分解为单糖、蔗糖合成酶(sucrose synthase,SS,EC2.4.1.13,又分为蔗糖合成方向SSS(in synthesis direction)和分解方向(in cleavage direction)、蔗糖磷酸合成酶(sucrose phosphate synthase,SPS,EC2.4.1.14)活性的变化。通过上述研究,探讨罗汉果果实中糖含量与罗汉果苷合成之间可能的相关性,为今后农业生产上罗汉果的品质调控提供理论依据。
1 材料与方法
1.1 材料
试验于广西南宁广西药用植物内(2010年)进行。选用“永青1号”当年栽种健壮无性组培苗为实验材料,所有材料均经收集鉴定,由桂林亦元生现代生物技术有限公司提供。按随机区组进行试验设计,重复3次,每小区10株。每年4月定植,7月下旬左右开花,8月初授粉挂牌。生长期间田间管理均按杭玲等(2005)的方法进行。
1.2 遮荫方法
授粉后30~90 d,对罗汉果植株进行遮荫处理。选取长势一致的品种“永青1号”植株,冠层采取不同的遮荫率设4种处理:轻度遮荫(标记为遮荫30%),中度遮荫(标记为遮荫50%),重度遮荫(标记为遮荫70%),100%全光照(标记为CK),每处理重复3次,其它日常管理相同。不同遮荫处理的荫棚间距在3.0 m以上,遮荫棚为东西朝向,顶部及东西面遮荫,南北面打开,棚顶遮阳网距冠层高1.0 m的高架,遮阳网的透光率用照度计反复测量确定,遮荫材料为黑色遮阳网和白色尼龙网。
分别在授粉后30、50、70、90 d(即遮荫0、20、40、60 d)采样。每次取样每个小区从不同单株随机取果3个,采果后迅速将果实剥开取出果肉,组成混合样,一部分液氮速冻后储存于-80 ℃冰箱用于测定蔗糖代谢相关酶活性,另一部分低温冻干混匀后用于测定糖及罗汉果苷含量。
1.3 实验方法
1.3.1 果实中可溶性糖的提取 称罗汉果干燥果肉冻干粉0.1 g,80%的乙醇提取,离心,将装有上清液混合液的蒸发皿置于85 ℃沸水浴中蒸干,再加2 mL蒸馏水溶解,离心后,上清液再经过SEP-C18萃取柱 (Supelclean ENVI C18 SPE)和0.22 μm微孔滤膜过滤,滤液用于接下来利用高效液相色谱(HPLC)鉴定可溶性糖的组分及其含量。
1.3.2 高效液相色谱-示差折光检测法分析果肉中糖的含量 液相色谱仪采用Waters测定系统,色谱柱为Waters Sugar-Pak-Ⅰ(6.5 mm×300 mm),柱温75 ℃,示差折光检测器,流动相为脱气后的重蒸水,流速0.5 mL·min-1,进样量20 μL。
1.3.3 酶液制备 参照Keller & Ludlow(1993)的方法:称取0.5 g果肉的冷冻样品,5 mL提取液提取。提取液成分:50 mmol·L-1HEPES-NaOH (pH7.5),10 mmol·L-1MgCl2,1 mmol·L-1EDTA,2.5 mmol·L-1DTT,0.1%(w/v)BSA和0.05% (v/v) Triton X-100。4 ℃,10 000 g离心10 min。上清液移入透析袋中,用稀释10倍的提取缓冲液 [不含0.05%(v/v)Triton X-100] 4 ℃下透析18 h以去除可溶性糖,透析后的酶液用于相关酶活性的测定。
1.3.4 酸性转化酶(AI),中性转化酶(NI) 酸性转化酶(AI)活性测定参照Miron & Scaffer(1991)的方法并加以改进。500 μL 反应体系。AI反应混合液成分为800 mmol·L-1磷酸二氢钾(pH4.8)、1 mol·L-1蔗糖、酶液;NI应混合液成分为800 mmol·L-1磷酸氢二钾(pH7.5)、1 mol·L-1蔗糖、酶液。37 ℃水浴保温30 min后,加500 μL DNS试剂终止反应,沸水浴5 min,冷却后在540 nm处测OD值,测定从蔗糖释放还原糖的量。对照用蒸馏水代替酶液。根据标准曲线计算样品的两种转化酶活性。
1.3.5 淀粉酶 淀粉酶活性测定按照Merlo & Passera(1991)的方法并加以改进。500 μL 反应体系中包括1 mol·L-1乙酸钠-乙酸(pH6.5)、15 mmol·L-1NaF、50 mmol·L-1Ca(NO3)2、5%可溶性淀粉和酶的提取液。反应液37 ℃保温30 min后,加500 μL DNS试剂终止反应,沸水浴5 min,冷却后在540 nm处测OD值。对照用蒸馏水代替酶液。根据标准曲线计算样品的淀粉酶活性。
1.3.6 蔗糖合成酶(SS)活性测定 参照Zhu et al(1997)的方法并加以改进。70 μL反应体系包括 500 mmol·L-1HEPES-NaOH (pH7.5)、150 mmol·L-1MgCl2、100 mmol·L-1果糖、30 mmol·L-1UDPG(最后加)、酶提取液。混合液37 ℃保温40 min后,加70 μL的5 mol·L-1NaOH终止反应,沸水浴10 min,冷却后加入1 mL 0.14%的蒽酮(溶解在13.8 mol·L-1的硫酸中),40 ℃下反应20 min,冷却后在620 nm下测定OD值,通过测定从UDPG生成的蔗糖来定量。对照反应体系中不含UDPG,用蒸馏水代替酶液。根据标准曲线计算样品的蔗糖合成酶活性。
1.3.7 蔗糖磷酸合成酶(SPS)活性测定 参照Zhu et al(1997)的方法并加以改进。70 μL反应体系包括500 mmol·L-1HEPES-NaOH(pH7.5)、150 mmol·L-1MgCl2、40 mmol·L-1F6P,200 mmol·L-1G6P、30 mmol·L-1UDPG(最后加入)、酶提取液。混合液37 ℃保温40 min后,加70 μL 5 mol·L-1NaOH终止反应。后面步骤同1.3.6 SS活性测定。

图 1 不同遮荫处理在授粉后30 d(a)、50 d(b)、70 d(c)、 90 d(d)对罗汉果果肉组织中罗汉果苷组分及含量的影响 不同小写字母表示处理间差异显著(P<0.05); 不同 大写字母表示处理间差异极显著(P<0.01)。数据 均为平均值±标准误 (n=3)。下同。Fig. 1 Effects of different shading treatments on the compositions and contents of mogrosides in the fruit flesh of S. grosvenori 30 d(a),50 d(b),70 d(c)and 90 d(d) after pollination Different small letters indicate significant differences (P<0.05), and different capital letters indicate extremely significant differences (P<0.01) between different shading treatments. Each). The same below.

图 2 不同遮荫处理下罗汉果果肉组织中 可溶性糖(a)及淀粉(b)含量变化Fig. 2 Levels of soluble total carbohydrates (a) and starch (b) in the fruit flesh of two cultivars of S. grosvenori at different developmental stages under full sunlight and different shade treatments

图 3 不同遮荫处理对罗汉果果肉组织中 葡萄糖(a)、果糖(b)、蔗糖(c)含量变化的影响Fig. 3 Effects of shading treatments on the levels of glucose (a), fructose (b) and sucrose (c) in fruit flesh of S. grosvenori over the course of fruit development

图 4 不同遮荫处理对罗汉果果肉组织中 SSS(a)、SPS(b)活性的影响Fig. 4 Effects of shading treatments on sucrose synthesizing enzyme SSS (a) and SPS (b)activities in fruit flesh of S. grosvenori over the course of fruit development

图 5 不同遮荫处理对罗汉果果肉组织中 AI(a)、NI(b)、SSC(c)活性的影响Fig. 5 Effects of shading treatments on sucrose cleavage enzymes AI (a), NI (b) and SSC (c) activities in fruit flesh of S. grosvenori over the course of fruit developments
2 结果与分析
2.1 遮荫对果肉组织中罗汉果苷含量的影响
不同遮荫处理对罗汉果果肉组织中各种罗汉果苷单体含量的影响不同。遮荫0 d(授粉后30 d),果实中罗汉果苷主要由苷Ⅱ(M-Ⅱ)、苷Ⅲ(M-Ⅲ)组成,各处理中两种苷的含量无显著差异(图1:a)。遮荫处理20 d(授粉后50 d),果肉组织中检测出罗汉果苷Ⅱ、苷Ⅲ,苷Ⅳ(M-Ⅳ)和苷Ⅴ(M-Ⅴ)四种单体,且不同遮荫处理下各种罗汉果苷单体的含量有显著不同:对照(CK)和30%遮荫处理的果实中苷Ⅱ含量显著低于苷Ⅳ和苷Ⅴ含量则显著高于中度与重度遮荫处理(图1:b)。之后随着果实发育时间的延长,罗汉果苷Ⅱ、苷Ⅲ、苷Ⅳ消失,罗汉果苷只由甜苷Ⅴ一种单体组成。遮荫40 d(授粉后70 d)、70%遮荫处理下果实中的甜苷Ⅴ显著高于对照(P<0.05)(图1:c);遮荫60 d(授粉后90 d)、对照与70%遮荫处理果实中甜苷Ⅴ含量分别为4.83%和5.79%,呈极显著差异(P<0.01)(图1:d)。
2.2 遮荫对果肉组织中各种糖含量的变化
2.2.1 遮荫对可溶性总糖与淀粉含量的影响 图2显示,遮荫0 d与20 d,三种遮荫处理果实中的可溶性糖含量与对照相比无显著差异,但随着果实的发育,70%遮荫处理下果实中可溶性糖含量显著下降;遮荫60 d,对照与70%遮荫果实中的可溶性糖含量分别为654.57和460.99 mg·g-1DW,达到显著差异水平(P<0.05)。这表明70%遮荫处理引起了罗汉果果实中可溶性糖含量的降低,30%与50%遮荫处理虽然也降低了果实中可溶性糖的积累,但与对照相比无显著差异(图2:a)。
2.2.2 遮荫对葡萄糖、果糖及蔗糖含量的影响 由图3可知,与对照相比,30%遮荫与50%遮荫对果实中葡萄糖含量影响不大,但70%遮荫导致果实中葡萄糖含量的显著提高;遮荫40 d与60 d,70%遮荫处理下果实中的葡萄糖含量显著高于对照(P<0.05)(图3:a)。果实发育中果糖含量的变化趋势与葡萄糖相似,70%遮荫处理导致果实中果糖含量的显著上升(图3:b)。蔗糖含量的变化与上述两种还原糖不同。图3:c显示,遮荫0 d和20 d,果肉组织中蔗糖含量很低,且与对照相比三种遮荫处理也未对蔗糖含量造成显著影响。随着发育时间的延长,果实中蔗糖含量急剧上升。与对照相比,70%遮荫处理导致果肉组织中蔗糖含量的显著降低。授粉后90 d,50%(P<0.05)、70%(P<0.01)遮荫处理下果肉组织中的蔗糖含量显著低于对照,但30%遮荫处理未对果实中蔗糖含量产生显著影响(图3:c)。
2.3 遮荫处理对果实中相关糖代谢酶活性的影响
2.3.1 遮荫处理对SPS、SSS活性的影响 从图4可以看出,与对照相比,遮荫处理下SSS和SPS活性都有不同程度的降低,SSS活性下降较少,三种遮荫强度下SSS活性与对照相比均未达到显著差异(图4:a)。不同遮荫强度对SPS活性的影响不同:轻度遮荫未引起SPS活性的显著变化;中度遮荫虽导致SPS活性下降,但只在授粉后70 d就达到显著差异。重度遮荫处理对SPS活性的影响最为明显:遮荫40、60 d,对照果肉组织中SPS活性分别为10.84、9.71 μmol蔗糖·g-1FW·h-1,显著高于70%遮荫果实中的7.77、7.52 μmol蔗糖·g-1FW·h-1(图4:b)。
2.3.2 遮荫处理对AI、NI和SSC活性的影响 随着果实发育,遮荫处理和对照果实中的AI活性都呈现下降趋势,但不同遮荫处理对AI活性的影响有所不同:与对照相比,30%遮荫未引起AI活性的显著变化;50%遮荫只在授粉后50 d显著延缓了AI活性的降低;70%遮荫处理对AI活性的影响最为明显:从授粉后50 d到授粉后90 d,70%遮荫处理下果实中的AI活性始终显著高于对照(图5:a)。SSC活性的变化与AI相似,70% 遮荫跟对照相比显著延缓了SSC活性的下降,但30%和50%遮荫未引起显著变化(图5:c)。与AI和SSC活性变化趋势相反,NI活性在果实发育期间逐渐上升,但各遮荫处理与对照之间无显著差异(图5:b)。
2.3.3 遮荫处理对α-淀粉酶活性的影响 图6所示,随着果实发育时间的延长,α-淀粉酶活性迅速升高,但与对照相比,30%遮荫、50%遮荫及70%遮荫处理均未对果实中的α-淀粉酶活性造成显著影响。

图 6 不同遮荫处理对罗汉果果肉组织中 α-淀粉酶活性的影响Fig. 6 Effects of shading treatments on α-amylase activities in fruit flesh of S. grosvenori over the course of fruit development
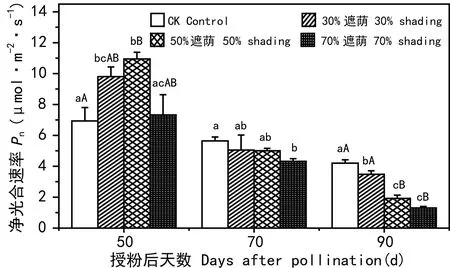
图 7 不同遮荫处理下罗汉果叶片Pn的变化Fig. 7 Changes in net photosynthetic rate Pn of S. grosvenori leaves grown under full sunlight and partital shading treatments
2.4 遮荫对罗汉果叶片净光合速率的影响
图7显示,遮荫20 d,50%遮荫处理下的叶片净光合速率最高,30%遮荫次之,对照和70%遮荫处理下叶片的净光合速率最低。但随着植株的生长及遮荫时间的延长,叶片光合速率发生了极大改变。遮荫40 d,对照叶片的光合速率高于3个遮荫处理,且与70%遮荫处理达到显著差异(P<0.05)。授粉后90 d(遮荫60 d),三种遮荫处理下罗汉果叶片的净光合速率与对照相比下降更为显著,30%遮荫、50%遮荫和70%遮荫与对照相比分别达到显著(P<0.05)、极显著差异水平(P<0.01)。
3 讨论与结论
3.1 遮荫处理对罗汉果叶片光合速率的影响
罗汉果是喜光植物,但光照过强又会抑制其正常生长。正是由于罗汉果的这种生长习性,才使得遮荫处理对不同生长期的叶片净光合速率产生了不同影响。授粉后50 d是2010年9月20日,此时南宁还是夏季,气候炎热、光照强烈。在这样的气候条件下,生长在全光照环境中的对照植株叶片可能由于不耐受长时间强光照射产生了光抑制,从而导致净光合速率较低。30%与50%遮荫处理可降低直射到叶片上的光强,也在一定程度上降低了光抑制作用。与30% 遮荫使用的白色遮阳网相比,50%遮荫处理采用的黑色单层遮阳网能吸收更多的光能,因此对光抑制的解除作用强于30%遮荫,净光合速率最高;而70%遮荫处理由于双层黑色遮阳网吸收了大部分光能,使到达叶片的光强很弱,叶片无法获得充足光能进行光合作用,从而净光合速率也处于较低水平。授粉后70 d和90 d分别是2010年10月10日和10月30日,此时南宁气候已逐渐转凉,光强较9月有了明显减弱,成为光合作用的限制因子。因此,叶片净光合速率与环境中光照强度显著相关,对照植株叶片净光合速率高于遮荫处理,且遮荫强度越大,光合速率降低幅度越大。
3.2 遮荫对罗汉果果实中淀粉、葡萄糖、果糖和蔗糖含量的影响
遮荫处理对罗汉果果实中的淀粉含量无明显影响,但葡萄糖、果糖、蔗糖含量发生显著改变,SPS活性下降、AI和SSC活性上升是引起3种糖含量改变的重要原因。罗汉果果肉组织中前期大量积累淀粉,随着果实逐渐成熟,α-淀粉酶活性增高,将淀粉水解,果肉逐渐变软,淀粉含量下降,可溶性糖含量迅速上升。遮荫处理对淀粉含量与淀粉酶活性没有明显影响。
遮荫处理可引起植物组织或器官中可溶性糖含量的改变。红茅草(Rhynchelytrumrepens)在遮荫条件下植株中的可溶性糖含量降低(Souza et al,2004),但芦荟渗出液中可溶性糖含量则没有明显变化(Paez et al,2000)。本研究中,通过分析不同生长期、不同遮荫强度下罗汉果果实中可溶性糖含量变化,我们发现不同遮荫强度对罗汉果果实中可溶性糖含量的影响不同。轻度(30%)与中度(50%)遮荫对可溶性糖含量影响较小,但重度(70%)遮荫则导致了果实中可溶性糖含量的显著降低。果实中可溶性糖主要来源于叶片光合产物的输送。在一定的光强范围内,植物的光合速率随光照的增强而增加,合成碳水化合物也会相应增多。本研究中,在重度遮荫条件下,由于环境中光照强度大幅度减弱(为正常条件下的30%),使得罗汉果植株叶片光合速率降低,向果实中输送的碳水化合物减少,最终导致了可溶性糖含量的显著下降。
除可溶性总糖含量之外,遮荫条件下罗汉果果实中几种重要糖分的含量也发生了显著改变。与对照相比,70%遮荫处理下果实中的葡萄糖和果糖两种还原糖含量显著升高,而蔗糖含量则显著降低。这一结果与Geromel et al(2008)在咖啡中的研究结果相似。与糖含量变化相对应的是遮荫条件下相关糖代谢酶活性也发生了改变。70%遮荫处理下,SPS活性与对照相比显著降低,但AI和SSC活性则明显升高。这些结果表明了重度遮荫改变了罗汉果果实中SPS、AI和SSC的活性:SPS活性下降抑制了蔗糖的合成;而AI和SSC活性的上升则促进了蔗糖的降解,两类酶的共同作用最终导致了果实中葡萄糖和果糖含量的上升和蔗糖含量的下降。
3.3 在果实发育后期,甜苷Ⅴ以幼果中低糖苷作为前体,经过数次糖基化修饰而形成
本研究表明,授粉后30 d,果实中只含有二糖苷(M-IIE)和三糖苷(M-Ⅲ)两种低糖苷。之后随着果实发育的进行,三糖苷含量下降,到授粉后50 d时,二糖苷和三糖苷含量显著下降,且伴随着它们含量的降低,四糖苷(M-Ⅳ)和五糖苷(M-Ⅴ)出现。至授粉后70 d,二糖苷、三糖苷、四糖苷已检测不到,五糖苷M-Ⅴ成为果实中主要苷类且含量较高,这种情况持续到授粉后90 d罗汉果完全成熟。由于本研究着重检测的是果实发育后期罗汉果苷的积累规律,授粉后30 d以前幼果中的罗汉果苷组成未能详细检测。但李典鹏等(2004)报道在授粉5 d 后即有罗汉果二糖苷出现,且随着座果生长日龄增加,二糖苷会逐渐减少;向秋等(2009)则在授粉后10 d的果实中检测到大量的二糖苷(约占总苷量的99%)和少量的三糖苷(约占总苷量的1%)。本研究还发现,罗汉果果实发育初期最早形成的是二糖苷M-IIE,随着果实发育时间延长,三糖苷、四糖苷、五糖苷依次出现,且伴随着高糖苷形成,低糖苷含量持续下降,直至低到无法检测。这提示成熟罗汉果果实中的甜苷Ⅴ可能是以幼果中低糖苷为前体,经数次糖基化修饰作用,连接数个新的葡萄糖基而产生的,而葡萄糖基转移酶无疑应是催化这一转化过程完成的关键酶。这与向秋等(2009)的研究结果一致。
3.4 重度遮荫显著提高了罗汉果甜苷Ⅴ的含量
植物的次生代谢是植物在长期进化中与环境(生物的和非生物的)相互作用的结果,其产生和变化比初生代谢产物与环境有着更强的相关性和对应性(阎秀峰等,2007)。遮荫处理是农业生产上常用的一种栽培措施,可以改变植物生长小环境中光强、温度甚至湿度等因子。遮荫处理可以引起植物体组织或器官中次生代谢产物含量改变。在遮荫条件下,喜树中喜树碱(王博文等,2006)和延胡索中生物碱(许翔鸿等,2004)含量增加,但高山红景天中红景天苷含量降低(阎秀峰等,2004)。本研究中,作为罗汉果果实中最重要的次生代谢产物,罗汉果甜苷Ⅴ含量在重度(70%)遮荫条件下明显上升,与对照相比达到显著差异。
遮荫处理不仅改变环境中的光照条件,还影响荫棚下植株的生长温度。程孝(2008)报道在高温时段(13:00-15:00),遮荫可显著降低茶园温度,单层遮阳网降温在4 ℃以上,双层遮阳网则在8 ℃左右。本研究在授粉后60 d、遮荫30 d测定了不同遮荫处理下荫棚内的温度。从早上8:00开始,随时间推移温度逐渐升高,在12:00时达到峰值,对照、30%遮荫、50%遮荫和70%遮荫的温度分别为29.54 ℃、27.89 ℃、26.63 ℃、24.68 ℃,18:00以后温度逐渐下降。与对照组相比,不同遮荫处理分别降低了4.86 ℃(遮荫70%)、2.91 ℃(遮荫50%)和1.65 ℃(遮荫30%),以遮荫70%降低幅度最大。
温度与植物体内多种代谢酶的活性密切相关。本课题组在2007年曾发现,当年11月桂林雨水很多,气温较正常年份偏低,但采收的罗汉果中甜苷Ⅴ含量明显高于往年,提示罗汉果发育晚期低温可能促进甜苷Ⅴ的积累。本研究虽然只测定了授粉后60 d即遮荫30 d的温度变化,但也可以看出,不同遮荫处理均降低了荫棚下的温度,尤其是重度遮荫降低了近5 ℃。因此,对于重度遮荫引起的罗汉果果实中“低光合、高甜苷Ⅴ含量”现象,我们推测:虽然重度遮荫引起了叶片光合功能的下降,但果实发育后期温度对甜苷Ⅴ合成关键酶活性的影响更为关键。罗汉果果实中的葡萄糖基转移酶可能是温敏型酶类,对环境温度的变化非常敏感,高温会抑制其活性,而在低温条件下活性则可明显提高。重度遮荫可能是通过降低荫棚中的温度,提高了糖基转移酶活性,最终促进了甜苷Ⅴ的积累。
3.5 糖与罗汉果甜苷Ⅴ积累的相关性探讨
重度遮荫条件下,罗汉果果实中葡萄糖含量、果糖含量与对照相比显著上升,蔗糖含量下降,甜苷Ⅴ含量则明显上升。葡萄糖、果糖两种还原糖含量与甜苷Ⅴ含量之间都存在“高葡萄糖含量、高甜苷Ⅴ含量”与“高果糖含量、高甜苷Ⅴ含量”现象。葡萄糖为罗汉果甜苷Ⅴ后期生物合成的重要底物,因此遮荫处理下,甜苷Ⅴ含量增加有两种可能的原因:第一,遮荫改变了相关糖代谢酶的活性,使底物葡萄糖供应增多,甜苷Ⅴ生成量增大;第二,除作为结构物质外,糖类物质还可作为重要的信号转导物质调节植物次生代谢产物生成。Julie & Oksana(2004)报道,拟南芥pho3突变体与对照相比可积累大量蔗糖,蔗糖作为信号分子,调控多个与花色素苷合成相关基因的转录,最终增加了花青素苷的含量。本研究中,重度遮荫处理下,葡萄糖、果糖含量均显著高于对照,是否也有可能是上述两种糖中的一种或几种以信号分子的方式在转录水平上刺激了与甜苷Ⅴ合成相关的某些基因的表达,从而最终使得甜苷Ⅴ积累量增加呢?这一问题还需要深入研究。
综上表明,重度遮荫(70%遮荫)导致了果实品质的改变:葡萄糖、果糖、甜苷Ⅴ含量的显著提高,但可溶性总糖、蔗糖含量明显下降。SPS、AI、SSC活性的改变是蔗糖含量降低及葡萄糖、果糖含量上升的主要原因。葡萄糖基转移酶可能是对温度敏感的酶类,重度遮荫条件下荫棚中温度的降低促进了其活性提高,进而提高了甜苷Ⅴ含量。
BARGALI K,TEWARI A, 2004. Growth and water relation parameters in drought-stressedCoriarianepalensisseedlings [J]. J Arid Environ,58(4): 505-512.
CHENG X, 2008. Studies on the relativity of tea plantation shading cultivation and tea quality [D]. Changsha: Hunan Agricultural University. [程孝, 2008. 茶园遮荫栽培与茶叶品质相关性机理的研究 [D]. 长沙: 湖南农业大学.]Coelho GC,Rachwal MFG,Dedecek RA,et al, 2007. Effect of light intensity on methylxanthine contents ofIlexparaguariensisA. St. Hil [J].BiochemSystEcol,35(2): 75-80.GEROMEL C,FERREIRA LP,DAVRIEUX F,et al, 2008. Effects of shade on the development and sugar metabolism of coffee (CoffeaarabicaL.) fruits [J]. Plant Physiol Biochem,46: 569-579.
GONG RG,ZHANG GL, 2003. Advances in research on sugar metabolism in citrus fruit [J]. J Sichuan Agric Univ,12 (4): 343-346. [龚荣高,张光伦, 2003. 柑橘果实糖代谢的研究进展 [J]. 四川农业大学学报,12 (4): 343-346.]
HANG L,SU GX,HUANG ZZ,et al, 2005. Characteristics and cultivation techniques of Luohanguo variety “Guihan Qingpi 1 hao” [J]. S Chin Fruits,34(6): 52-53. [杭玲,苏国秀,黄卓忠,等, 2005. 广西罗汉果组培品种桂汉青皮1号特征特性及其栽培要点 [J]. 中国南方果实,34(6): 52-53.]
HE CW,ZHU XY,LIU LJ,et al, 2012. Analysis and comparison the nutrient compositions of fresh and dry tissue culture seedling Luohanguo [J]. Guihaia,32(5):706-709. [何超文,朱晓韵,刘丽君,等, 2012. 组培苗鲜罗汉果与干罗汉果营养成分的分析和比较 [J]. 广西植物,32(5):706-709.]
JULIE CL,OKSANA VZ, 2004. Responses of primary and secondary metabolism to sugar accumulation revealed by microarray expression analysis of theArabidopsismutant,pho3 [J]. J Exp Bot,55(400):1221-1230.
KELLER F,LUDLOW MM, 1993. Carbohydrate metabolism in drought-stressed leaves ofPigeonpea(CajanuscajanL.) [J]. J Exp Bot,44: 1351-1359.
LI DP,CHEN YY,PAN ZH,et al, 2004. Study on variation of mogrol glycosides from fruits ofSiraitiagrosvenoriiin different growing ages [J]. Guihaia,24(6): 546-549. [李典鹏,陈月圆,潘争红,等, 2004. 不同生长日龄罗汉果苷类成分变化研究 [J]. 广西植物,24(6): 546-549.]LIU F,ST TZEL H, 2004. Biomass partitioning,specific leaf area,and water use efficiency of vegetable amaranth(Amaranthusspp.) in response to drought stress [J]. Sci Hortic,102(1): 15-27.
MERLO L,PASSERA C, 1991. Changes in carbohydrate and enzyme levels during development of leaves ofPrunuspersica, a sorbitol synthesizing species [J]. Physiol Planta,83:621-626.MIRON D,SCHAFFER AA, 1991. Sucrose phosphate synthase,sucrose synthase,and acid invertase activities in developing tomato fruit ofLycopersiconescufenfumMill and the sucrose accumulatingL.hirsutumHumb. and Bonpl. [J]. Plant Physiol,95: 623-627.PAEZ A,GEBRE GM,GONZALEZ ME,et al, 2000. Growth,soluble carbohydrates,and aloin concentration ofAloeveraplants exposed to three irradiance levels [J]. Environ Exp Bot,44(2): 133-139.
QI X,CAO KF,FENG YL, 2004. Photosynthetic acclimation to different growth light environments in seedlings of three tropical rainforestSyzyciumspecies [J]. Acta Phytoecol Sin,28(1): 31-38. [齐欣,曹坤芳,冯玉龙, 2004. 热带雨林蒲桃属3个树种的幼苗光合作用对生长光强的适应 [J]. 植物生态学报,28(1): 31-38.]
SOUZA A,PAULA AD,FIGUEIREDO-RIBEIRO RC, 2004. Effects of irradiance on non-structural carbohydrates,growth,and hypoglycemic activity ofRhynchelytrumrepens(Willd.) C.E. Hubb. (Poaceae) [J]. Braz J Biol,64(3B): 697-706.
WANG BW,WANG Y,YAN XF, 2006. Effect of light intensity on camptothecin content and a llocation inCamptothecaacuminataseedlings [J]. J Nat Sci Heilongjiang Univ,23(2): 260-264. [王博文,王洋,阎秀峰, 2006. 光强对喜树幼苗喜树碱含量及分配的影响 [J]. 黑龙江大学自然科学学报,23(2): 260-264.]WANG Y,DAI SJ,YAN XF, 2004. Effects of light intensity on secondary metabolite camptothecin production in leaves ofCamptothecaacuminataseedlings [J]. Acta Ecol Sin,24(6): 1118-1122. [王洋,戴绍军,阎秀峰, 2004. 光强对喜树幼苗叶片次生代谢产物喜树碱的影响 [J]. 生态学报,24(6): 1118-1122.]
XIANG Q,LEI X,HUANG LZ, 2009. Study of metabolic conversion of mogrol glycosides in fruit ofSiraitiagrosvenorii[J]. Biotechnology,19(4): 49-51. [向秋,雷迅,黄岚珍, 2009. 罗汉果皂甙类成分代谢转化规律分析 [J]. 生物技术,19(4): 49-51.]
XU XH,WANG ZT,YU GD, 2004. Preliminary study on effects of light on plant development and alkaloid accumulation ofCorydalisrhizome[J]. J Chin Med Mat,27(11): 804-805. [许翔鸿,王峥涛,余国奠, 2004. 光照对延胡索生长及生物碱积累影响的初步研究 [J]. 中药材,27(11): 804-805.]
YAN XF,WANG Y,GUO SL,et al, 2004. Seasonal variations in biomass and salidroside content in roots ofRhodiolasachalinensisasaffected by gauze and red film shading [J]. Chin J Appl Ecol,(15): 382-386. [阎秀峰,王洋,郭盛磊,等, 2004. 遮荫和红膜处理对高山红景天根生物量及红景天苷含量季节变化的影响 [J]. 应用生态学报,(15): 382-386.]YAN XF,WANG Y,LI YM, 2007. Plant secondary metabolism and its response to environment [J]. Acta Ecol Sin(生态学报),27(6): 2554-2562. [阎秀峰,王洋,李一蒙, 2007. 植物次生代谢及其与环境的关系 [J]. 生态学报,27(6): 2554-2562.]
ZHONG MC,LI Q,XIAO C, 2010. Study on quality standard for fructus Momordicae [J]. Chin Pharm,13(5):654-656. [钟名诚,李琦,肖聪, 2010. 罗汉果的质量标准 [J]. 中国药师,13(5):654-656.]
ZHU YJ,KOMOR E,MOORE PH, 1997. Sucrose accumulation in the sugarcane stem is regulated by the difference between the activities of soluble acid invertase and sucrose phosphate synthase [J]. Plant Physiol,115(2): 609-616.
Effects of shading on contents of mogrosides and sugars in fruit flesh ofSiraitiagrosvenorii
WANG Hai-Ying1,2, MA Xiao-Jun2*, MO Chang-Ming3, ZHAO Huan2,TU Dong-Ping2, BAI Long-Hua3, FENG Shi-Xin3
( 1.CollegeofTraditionalChinesePharmacy,TianjinUniversityofTraditionalChineseMedicine, Tianjin 300193, China;2.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing 100193, China; 3.GuangxiBotanicalGardenofMedicinalPlant, Nanning 530023, China )
With the commonSiraitiagrosvenoriivariety of “Yongqing 1” as experimental material, we measured the changes of concentrations of mogrosides monomers, soluble sugars, glucose, fructose, sucrose and starch in the fruit flesh, as well as the activities of sucrose metabolism enzymes, including acid invertase(AI), neutral invertase (NI), sucrose synthase (in synthesis direction, SSS;in cleavage direction SSC), sucrose phosphate synthase (SPS) and the net photosynthetic rates, during the late development stage of fruit under different shading treatments. The results indicated that in comparison with control, severe shading (70% shading) resulted in significant increase of mogroside V content: 60 d after shading (90 d after pollination), the content of mogroside V in the fruit flesh of 70% shading treatment was 5.79%, significantly higher than that of control group (4.83%,P<0.01). Meanwhile, the concentrations of glucose, fructose were also much higher than those of controls (P<0.05). On the contary, the changes of concentrations of total soluble carbohydrates and sucrose were far different from those of mogroside V, glucose and fructose: 60 d after shading, the levels of total soluble carbohydrates, sucrose in the fruit flesh of 70% shading treatment were significantly (P<0.05 ), extremely significantly (P<0.01) lower than those of controls, respectively. On the other hand, shading treatment led to a decrease of net photosynthetic rate (Pn): 40 d after shading,Pnof leaves under 70% shading treatment was significantly (P<0.05) lower than that of controls. The above results implied that severe shading treatment could result in the improvement of fruit quality ofS.grosvenorii. In additon, under shading treatment, the decrease of photosynthetic rate could be the major reason for the decline of soluble sugar content, while changes of sucrose, fructose and glucose contents should be mainly resulted from the changes of activities of SPS, AI and SSC. In addition, under severe shading treatment, fall of temperature could be regarded as the probable cause for the increase of mogroside V content. The research provides the theoretical basis for the production techniques and the quality control ofS.Grosvenoriifruit. Key words:Siraitiagrosvenorii, shading, fruit quality, sugars, mogroside, activity of sucrose metabolic enzymes
10.11931/guihaia.gxzw201405062
2015-06-29
2015-12-11
国家自然科学基金(30860379);国家科技支撑计划项目(2011BA101B03);广西自然科学基金重点项目(2013GXNSFDA019021) [Supported by the National Natural Science Foundation of China(30860379); National Key Technology R & D Program of China(2011BA101B03); the Natural Science Foundation of Guangxi(2013GXNSFDA019021)]。
王海英(1972-),女,河北唐山人,博士,副教授,主要从事药用植物生理与分子生物学研究,(E-mail)haiyingwang-99@163.com。
*通讯作者: 马小军,博士,研究员,研究方向为药用植物生物技术,(E-mail)mayixuan10@163.com。
Q945.1
A
1000-3142(2016)11-1344-09
王海英,马小军,莫长明,等. 遮荫处理对罗汉果果肉组织中罗汉果苷和糖分含量的影响 [J]. 广西植物, 2016, 36(11):1344-1352
WANG HY, MA XJ, MO CM, et al. Effects of shading on contents of mogrosides and sugars in fruit flesh ofSiraitiagrosvenorii[J]. Guihaia, 2016,
36(11):1344-1352
