马尾松组培生根关键因子分析
2016-12-22姚瑞玲吴幼媚
姚瑞玲, 王 胤, 吴幼媚
( 广西优良用材林资源培育重点实验室, 广西壮族自治区林业科学研究院, 南宁 530002 )
马尾松组培生根关键因子分析
姚瑞玲, 王 胤*, 吴幼媚
( 广西优良用材林资源培育重点实验室, 广西壮族自治区林业科学研究院, 南宁 530002 )
该研究以马尾松(Pinusmassoniana)优良种群无性化组培继代芽为材料,探讨了影响马尾松组培单芽生根的几个关键因素如基本培养基、基因型、激素及光温条件,所有数据均采用SPSS 19.0统计分析软件进行方差分析及显著性检验。结果表明:(1) 以半量的WPM、DCR、GD、MS和改良MS为基本培养基进行生根处理,生根率差异显著,其中以1/2改良MS的生根效果最佳。(2) 基因型不同,马尾松组培生根能力差异显著,在供试无性系中,以GLM-80的组培生根能力较强。(3) 生根激素的浓度显著影响了马尾松组培生根,低浓度的生长素处理,生根率高、根系发达,与IAA、IBA相比,低浓度0.1~0.2 mg·L-1NAA处理下的组培生根效果好。(4) 光照强度对马尾松组培生根影响不明显,但对芽苗地上部分形态建成影响显著;在2 000 lx光照强度处理下,芽苗生长健壮、移栽成活率高,而温度对马尾松组培生根具有显著的影响;在25 ℃培养条件下,生根效果稳定。该研究结果为马尾松组培苗工厂化生产提供了科技支撑, 为实现马尾松无性系育林、加快良种选育进程奠定了坚实基础。
松树, 组培快繁, 规模化生产, 无性育林, 生物技术
马尾松系我国南方最重要的造林用材树种之一,作为一种综合利用价值高、推广前景广阔的树种,大力发展马尾松人工林很有必要(丁贵杰等,2006)。自“六五”国家科技攻关以来,我国在马尾松良种选育和速生丰产栽培技术等方面取得了较大突破。马尾松在我国广西、江西、贵州、四川等16 个省(区)均有广泛分布,由于气候和地理环境等自然条件的优势,马尾松在广西生长性状表现较佳。广西多年来一直从事马尾松良种选育方面的工作,选育出大批速生、优质、高产、高抗优良的马尾松种源、家系,在全国很多省(区)均有引种栽培(丁贵杰等,2006)。近年来,由于种子园母树老化,育种周期长,马尾松良种匮乏,严重制约了马尾松产业的快速发展(杨模华等,2011)。组培快繁技术是实现马尾松无性育林可靠保障,从而加快马尾松良种选育与推广利用进程,对推动林业经济发展意义重大(李校雨等,2009;伊书亮等,2013)。多年来,众多学者对马尾松组织培养技术进行了广泛的研究(黄健秋和卫志明,1994;李校雨等,2009;姚瑞玲等,2014)。但马尾松组培生根困难,通过组培虽先后成功获取了马尾松离体植株,但整体上生根率不稳定,根系质量不理想,成活率不高,未能实现规模化生产上的应用。Zhu et al(2010)通过接种外生菌根真菌彩色豆马勃(Pisolithustinctorius)的瓶内菌根化法,在生根及成活率方面有了改善,然而由于其技术性较强,操作要求高,在生产实践中未能广泛使用。
2012年,本课题组对马尾松组培育苗关键技术进行研究,突破了马尾松组培生根困难的难题,创建了规模化繁育马尾松组培苗的高效育苗技术体系,形成了工厂化生产马尾松组培苗的中试平台,实现了马尾松优良群体无性化造林(刘达峰,2013;甘剑伟和龙娟,2014)。根据目前所取得的研究成果,本研究首次从马尾松组培生根的几个关键因素进行了阐述,以期为实现马尾松组培育苗产业化提供科技支撑。
1 材料与方法
1.1 材料
从广西林业科学研究院生物所培育的马尾松优良群体无性化组培继代芽中,筛选继代培养活力旺盛、芽苗健壮的无性系为试验材料。其中,以无性系GLM-80为研究对象进行基本培养基、生根激素、活性炭、光照温度对马尾松组培继代单芽瓶内生根影响试验。在基因型对生根影响试验中,以GLM-3、GLM-29、GLM-36、GLM-76、GLM-80五个无性系为研究对象。
1.2 试验处理
1.2.1 基本培养基 以半量的WPM、DCR、GD、MS和改良MS为基本培养基进行生根处理,培养基中添加生长素NAA 0.15 mg·L-1促生根。其中,改良MS主要是在MS基础上将NH4NO3减半,肌醇加倍。
1.2.2 基因型 以1/2改良MS为基本培养基,培养基中添加生长素NAA 0.15 mg·L-1,进行5种不同基因型马尾松无性系组培生根能力差异分析。
1.2.3 生根激素 以1/2改良MS为基本培养基,分别附加IAA、NAA或IBA 三种较为常用的促根生长素中的一种,每种生长素均设置0.1、0.2、0.4、0.8、1.6、3.2 mg·L-1不同浓度,以不添加任何生长素为对照(CK)。其中,IAA在培养基高温高压灭菌后在超净台用过滤方式加入培养基中,NAA、IBA在培养基高温高压灭菌前直接加入培养基中。
1.2.4 光强与温度 以1/2改良MS为基本培养基,添加NAA 0.15 mg·L-1,在光照培养箱(SPX-250-GB)中进行同一温度[(25±0.5) ℃]、不同光照强度500、1 000、2 000、4 000、6 000 lx,以及同一光照强度(1 500 lx)、不同温度15、20、25、30、35 ℃条件下的生根诱导处理,光照时间均为12 h·d-1。
1.3 培养条件
上述试验,除“1.2.4 光强与温度”处理外,所有的生根培养试验均在普通无菌培养室完成,培养温度(28 ± 2)℃,光照强度1 500~2 000 lx,光照时间12 h·d-1。
1.4 苗木移栽
将已生根的组培苗移栽于泥炭土、蛭石和珍珠岩体积比为1∶1∶1的混合轻型基质中,并按苗圃常规育苗方法进行水肥及病虫害管理。
1.5 数据统计分析
在不同因素影响下马尾松组培继代单芽瓶内生根试验中,每种试验设不同处理,每处理5重复,每重复200瓶(玻璃生根瓶规格: Ф=6 cm,高=9 cm),每瓶接继代单芽3~6株。所有试验处理重复操作4次。当生根苗根系长度在0.5 cm以上时,统计生根率、根系条数、生根时间及芽苗生长情况,然后进行苗圃组培生根苗移栽,1个月后统计移栽成活率。数据采用SPSS 19.0统计分析软件, 进行方差分析及差异性显著检验。
2 结果与分析
2.1 基本培养基对生根影响
不同基本培养基处理下,马尾松组培继代单芽生根情况如表1所示。方差分析结果表明,基本培养基对马尾松继代单芽的生根率、根系条数、生根时间及移栽成活率的影响均差异显著。其中,以1/2改良MS的生根效果最佳,芽苗生长好、活力旺盛,移栽成活率高达94.2%。
2.2 基因型对生根影响
为进一步分析基因型对马尾松组培生根的影响,以1/2改良MS为基本培养基,分析了GLM-3、GLM-29、GLM-36、GLM-76及GLM-80五个供试马尾松无性系的组培生根能力差异(表2)。根据方差分析结果显示,在同一培养基处理下,不同无性间生根率、根系条数、生根时间及移栽成活率均差异显著。
表 1 不同基本培养基处理下马尾松组培芽生根情况
Table 1 Rooting of tissue cultured shoots inPinusmassonianaunder the treatments of different basal media
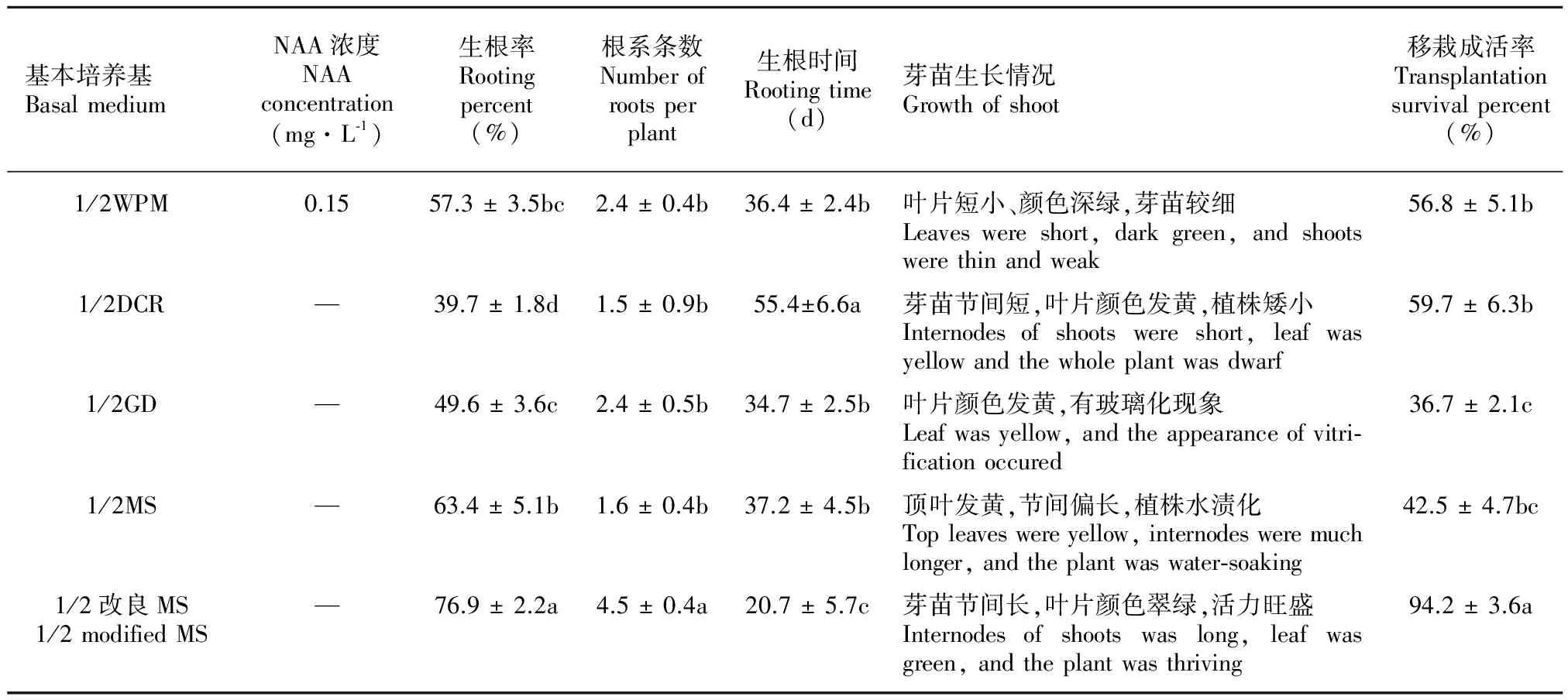
基本培养基BasalmediumNAA浓度NAAconcentration(mg·L⁃1)生根率Rootingpercent(%)根系条数Numberofrootsperplant生根时间Rootingtime(d)芽苗生长情况Growthofshoot移栽成活率Transplantationsurvivalpercent(%)1/2WPM1/2DCR1/2GD1/2MS1/2改良MS1/2modifiedMS0.15————57.3±3.5bc2.4±0.4b36.4±2.4b叶片短小、颜色深绿,芽苗较细Leaveswereshort,darkgreen,andshootswerethinandweak56.8±5.1b39.7±1.8d1.5±0.9b55.4±6.6a芽苗节间短,叶片颜色发黄,植株矮小Internodesofshootswereshort,leafwasyellowandthewholeplantwasdwarf59.7±6.3b49.6±3.6c2.4±0.5b34.7±2.5b叶片颜色发黄,有玻璃化现象Leafwasyellow,andtheappearanceofvitri⁃ficationoccured36.7±2.1c63.4±5.1b1.6±0.4b37.2±4.5b顶叶发黄,节间偏长,植株水渍化Topleaveswereyellow,internodesweremuchlonger,andtheplantwaswater⁃soaking42.5±4.7bc76.9±2.2a4.5±0.4a20.7±5.7c芽苗节间长,叶片颜色翠绿,活力旺盛Internodesofshootswaslong,leafwasgreen,andtheplantwasthriving94.2±3.6a
注: 小写字母表示α=0.05水平不同基本培养基处理间差异性显著。
Note: Small letters show the significant differences in basal media.
整体上,以GLM-80的生根、芽苗生长及移栽效果最好(图1)。
2.3 激素对生根影响
从图2可以看出,生根激素浓度对马尾松组培继代单芽生根效果影响显著,高浓度的外源生根激素明显抑制了马尾松组培生根能力。在本实验中,IAA、NAA、IBA三种激素浓度达到3.2 mg·L-1时,生根率及生根苗移栽成活率明显降低,生根时间较长,根系条数偏少。从激素种类来看,不同激素对马尾松组培生根的最适作用浓度范围及作用效果不同。其中, 在0.1~0.2 mg·L-1低浓度NAA的处理下, 获得了较佳的马尾松无性系GLM-80的组培生根及移栽效果。
表 2 基因型对马尾松组培芽生根影响
Table 2 Effects of genotypes on rooting of tissue cultured shoots inPinusmassoniana

无性系Clone生根率Rootingpercent(%)根系条数Numberofrootsperplant生根时间Rootingtime(d)芽苗生长情况Growthofshoot移栽成活率Transplantationsurvivalpercent(%)GLM⁃325.4±2.1d2.1±0.5cd44.4±3.5a叶片出现双针叶,芽苗老化快,根部愈伤大Leavesinbunchesoftwo,shootswerematuringquicklyandcallusofrootswasserious36.5±2.4cGLM⁃2959.4±2.3b3.4±1.2bc29.4±6.2bc叶片颜色翠绿,有轻微水渍化,根部愈伤明显Leafwasgreenandslightlywater⁃soaking,andcallusofrootswasobvious65.4±4.7bGLM⁃3662.8±2.1b4.9±1.3a30.9±6.4b芽苗生长正常,叶片颜色翠绿,根部愈伤明显Growthofshootswasgood,leafwasgreenandcallusofrootswasobvious77.9±6.8bGLM⁃7649.7±5.3c1.6±0.3d39.8±3.9ab芽苗细弱,水渍化明显,植株颜色浅绿,愈伤较大Shootswerethin,weakandapparentlywater⁃soaking,theplantwaslightyellow,andcallusofrootswasbig39.2±5.6cGLM⁃8076.9±2.2a4.5±0.4ab20.7±5.7c芽苗生长正常,叶片颜色翠绿,活力旺盛,愈伤小Growthofshootswasgood,leafwasgreenanddynamic,callusofrootswasslight94.2±3.6a
注: 小写字母表示α=0.05水平不同无性间差异性显著。
Note: Small letters show the significant differences in clones.

图 1 马尾松无性系GLM-80组培生根及移栽成活苗Fig. 1 Tissue cultured seedlings after rooting and transplanting in the clone GLM-80 of Pinus massoniana
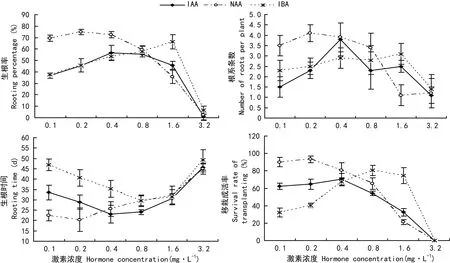
图 2 激素对马尾松组培芽生根影响Fig. 2 Effects of hormone on rooting of tissue cultured shoots in Pinus massoniana
2.4 光强、温度对生根影响
方差分析结果表明,光照强度对马尾松组培生根率、根系条数及生根时间的影响不明显,但光照强度对地上部分芽苗形成建成影响较大,导致不同光照强度处理下的生根苗移栽成活率差异显著(表3)。较低光照强度(500~1 000 lx)处理下,芽苗较为细弱,移栽成活率偏低;而光照强度较高(4 000~6 000 lx),植株活性差,叶片枯焦,移栽效果差。
从表3可以看出,生根诱导处理的温度对马尾松组培生根能力的影响显著。温度较低(15~20 ℃),芽苗生长缓慢,切口愈合慢,生根率低,生根时间长,移栽成活率低;而温度较高(30~35 ℃)时,芽苗水渍玻璃化现象明显,茎基部愈伤较大,生根率降低,根系质量差,移栽后易发生根腐,成活率下降。
3 讨论
细胞分化的本质是不同类型的细胞专一激活了某些基因,再使它转录成特定的mRNA的过程,因此不定根发生是由植物基因控制的,不同基因型不定根发生能力也不同(陈勤等,2011;Bergmann & Stomp,1994;López-Bucio et al, 2015)。杉木不同优良无性系之间生根效果差异较大(曾雷等,2009),彭绿春等(2010)也发现,北美红杉观赏型较用材型生根能力强。在相同生根诱导处理的条件下,本研究中5种不同基因型的马尾松无性系也表现出了不同生根效果。其中,GLM-3表现最差,生根率低,根系质量差,愈伤大,移栽成活率低;而GLM-80则表现出了较为稳定的生根效果,其生根率及移栽成活率分别为GLM-3的2~3倍。因此,在今后的马尾松组培生根育苗的生产中,应重视不同基因型选择。同时,为加快马尾松育种进程及良种快繁与推广应用,在马尾松生根功能基因鉴定及调控方面的分子育种应加大力度。
马尾松属组培生根困难的树种,从解剖构造来看,根系主要是由诱导不定根原基形成,无潜伏根原基(李校雨等,2009)。关于马尾松不定根的发生尚无明确机理可循,许多研究工作仍处于摸索阶段(季孔庶等,1996;李校雨等,2009;姚瑞玲等,2014)。植物激素与根发育间存在的密切关系,是被广泛公认的(Ma et al, 2015;Wendling et al, 2015)。季孔庶等(2001)通过对马尾松扦插生根试验,认为马尾松难生根的生理原因主要是由于低内源的生长素(IAA),高内源的赤霉素(GA)、脱落酸(ABA)、抑制物以及较高的吲哚乙酸氧化酶活性所致,根据研究结果,自制了复配型生根调节剂,取得了较好的扦插生根效果。一般认为,生长素能明显促进不定根的发生、生长作用(Guseman et al, 2015;Ivanchenko et al, 2015);赤霉素对不定根的形成没有影响或影响甚微(Da-Costa et al, 2013);脱落酸则抑制不定根的生长(Luo et al, 2014)。由于在不定根形成过程中生长素起到了至关重要的作用(Da-Costa et al, 2013),因此基于生长素生理活动代谢来调控马尾松不定根发生是突破马尾松组培生根的有效途径。本研究结果表明,生长素类型及使用浓度对马尾松组培生根效果影响显著。就马尾松无性系GLM-80而言,0.2 mg·L-1低浓度的NAA处理下的生根效果最好,移栽成活率高,而随着NAA使用浓度的增加,GLM-80生根率下降,成活率低。与IBA相比,NAA使用浓度偏低,生根诱导处理所需时间较短。研究还发现,相较NAA,IBA处理下根系较为绵软、细长,更易移栽成活,这与以往IBA对根系形态建成的影响及根系质量与植株生长表现间相关性的研究结果相似(Anderson et al, 1992;San José et al, 2012)。IAA由于自身化学性质不稳定,不能直接加入培养基中进行高温高压灭菌,过滤灭菌消毒方式较为复杂,不适于生产中应用。在今后工作中,可考虑以NAA、IBA为马尾松组培生根的主要激素,具体最适激素浓度及种类应根据不同基因型进行调整,但考虑到根系质量直接影响到移栽成苗效果,整体上生根激素用量应控制在产生根系愈伤最小化的较低浓度范围内。
表 3 光强、温度对马尾松组培芽生根影响
Table 3 Effects of light intensity and temperature on rooting of tissue cultured shoots inPinusmassoniana

光强Lightintensity(lx)温度Tempe⁃rature(℃)生根率Rootingpercentage(%)根系条数Numberofrootsperplant生根时间Rootingtime(d)芽苗生长情况Growthofshoot移栽成活率Transplantationsurvivalpercent(%)500100020004000600025±0.525±0.525±0.525±0.525±0.579.4±2.13.1±0.523.1±3.2叶片颜色浅黄绿,叶片下垂卷曲,芽苗矮小Leafwaslightgreenyellow,down,curly,andshootsweredwarf16.5±4.1c85.4±2.33.4±1.221.4±6.2叶片颜色浅绿,中下部叶片微卷,芽苗细弱Leafwaslightyellow,leavesfrommiddleandbasepartswereslightlycurly,andshootswerethinandweak59.3±2.2b80.8±1.24.5±1.321.9±6.4芽苗生长正常,叶片颜色翠绿,芽苗粗壮Growthofshootswasgood,leafwasgreenandshootswererobust97.2±3.7a77.1±3.33.6±0.324.4±3.3叶尖发黄,茎基部发红,芽苗生长缓慢Topofleafwasyellow,thebasalstemwasredandshootsgrewslowly70.2±5.7b71.4±2.43.1±0.527.4±3.5植株枯焦,茎杆发红,芽苗无明显生长Plantwasburned,stemwasred,andgrowthofshootswasquiteslow23.5±2.8c15001520.1±2.4c1.7±1.5c41.4±3.5a植株矮小,芽苗活性差,茎切口愈合慢,愈伤极小Plantwasdwarf,shootsactivitywaspoor,steminci⁃sionhealedslowlyandcallusofrootwasverysmall56.2±4.9b15002054.4±2.3b3.6±1.2b37.4±6.2a叶片颜色翠绿,芽苗生长较慢,根部无明显愈伤Leafwasgreen,shootsgrewslowlyandcallusofrootswasnotobvious85.4±4.7a15002589.9±1.9a4.3±0.4a20.4±5.5b芽苗健壮,叶片颜色翠绿,活力旺盛,愈伤小Shootswererobust,leafwasgreenandactive,callusofrootswasslight98.1±1.8a15003072.1±2.3a3.1±1.2ab24.4±6.2b叶片颜色翠绿,芽苗轻度水渍化,根部愈伤明显Leafwasgreen,shootsappearedslightlywater⁃soa⁃king,callusofrootwasobvious55.4±4.7b15003523.4±1.2c2.1±0.5bc26.4±3.8b叶片颜色正常,芽苗水渍化,根部愈伤极大Leafwasgreen,shootsappearedwater⁃soaking,callusofrootswasveryserious10.2±4.4c
注: 小写字母表示α=0.05水平下同一温度不同光照强度或同一光照强度不同温度处理间差异性显著。
Note: Small letters show significant differences in light intensity treatments under the same temperature or in temperature treatments under the same light intensity.
基本培养基的成分对松属树种组培中芽的分化至关重要,究其原因主要是在于硝态氮与铵态氮的总量及比例上,过高铵态氮不利于芽的分化与生长(黄健秋和卫志明,1994;李校雨等,2009)。相对低盐GD、SH和DCR,高盐MS处理下马尾松芽苗生长较快,继代芽组培生根率较高,但从地上部分芽苗形态建成来看,由于铵态氮含量较高,芽苗出现玻璃化现象,顶芽偏黄。本研究在MS基础上通过降低硝酸铵用量,调整了硝态氮和铵态氮比例,从而获得了良好的芽苗生长效果,芽苗生长健壮、活力旺盛、形态建成好。此外,改良MS培养基还增加了原有MS培养基中肌醇用量。从生长素的生理代谢、运输来看,生长素在不断合成的同时,也不断被降解或与其他化合物合成而束缚生长素,影响其活性(Henrique et al, 2006)。通常在活力旺盛较为幼嫩的植物器官或组织中,生长素含量较高,生根较为容易 (Oliveira et al, 2012)。崔凤国(2011)研究发现,为便于运输,生长素还能与肌醇形成吲哚乙酸肌醇,有效提高了生长素利用速率。在本研究不同基本培养基处理下,马尾松组培生根效果差异明显。因此,本研究中1/2改良MS基本培养基上所获得的较好马尾松组培生根效果,是否是由于该培养基更适于马尾松芽苗生长,芽苗生长旺盛、活性好,同时加倍的肌醇更利于生长素的运输,从而提高了生长素在生根过程中的利用效率所致,这有待进一步研究。
光照强度对马尾松组培生根能力影响不明显,但对地上部分芽苗形态建成影响显著。在500 lx较低光照下,马尾松芽苗黄化现象明显,移栽后成苗率低。而4 000~6 000 lx光照下,芽苗老化快,生长活力差,不易于移栽。因此,适度的光照更适于芽苗生长。温度对马尾松组培生根具有显著的影响,温度较低≤15 ℃时,茎切口愈合慢,生根困难,不利于芽苗分化与生长;温度较高≥30 ℃时,茎基部易腐烂,根系愈伤大,移栽甚至成大苗后对环境耐湿能力弱,根腐现象严重,导致苗木大量死亡。在马尾松组培苗生产过程中,合理控制光温条件,能有效地提高马尾松组培生根稳定性。
ANDERSON AB, FRAMPTON LJ, MCKEAND SE, et al, 1992. Tissue-culture shoot and root system effects on field performance of loblolly pine [J]. Can J For Res, 22(1): 56-61.
BERGMANN BA, STOMP AM, 1994. Effect of genotype on rooting of hypocotyls and in vitro-produced shoots ofPinusradiata[J]. Plant Cell Tiss Org, 39(3): 195-202.
CHEN Q, WANG F, JU SM, 2011. Review on rooting mechanism of taxodiaceae by tissue culture [J]. Pract For Technol, 54(5): 3-5. [陈勤, 王斐, 琚淑明, 2011. 杉科植物组培生根机理研究综述 [J]. 林业实用技术, 54(5): 3-5.]
CUI FG, 2011. Metoblism and function mechanism of auxin [J]. Biol Teachnol, 36(8): 71-72. [崔凤国, 2011. 生长素的代谢及作用机理 [J]. 生物学教学, 36(8): 71-72.]
DA-COSTA CT, DE-ALMEIDA MR, RUEDELL CM, et al, 2013. When stress and development go hand in hand: main hormonal controls of adventitious rooting in cuttings [J]. Front Plant Sci, 4: 1-19.
DING GJ, ZHOU ZC, WANG ZR, et al, 2006. Cultivation and Utilization of Pulpwood Stand forPinusmassoniana[M]. Beijing: China Forestry Press: 1-10. [丁贵杰, 周志春, 王章荣, 等, 2006. 马尾松纸浆用材林培育与利用 [M]. 北京: 中国林业出版社, 1-10.]
GAN JW, LONG J. 2014. WU YM: the broad application prospect of tissue cultured seedlings inPinusmassoniana[J]. Guangxi For, 33(5): 20. [甘剑伟, 龙娟, 2014. 吴幼媚: 马尾松组培苗应用前景广阔 [J]. 广西林业, 33(5): 20.]
GUSEMAN JM, HELLMUTH A, LANCTOT A, et al, 2015. Auxin-induced degradation dynamics set the pace for lateral root development [J]. Development, 142: 905-909.
HENRIQUE A, CAMPINHOS EN, ONO EO, et al, 2006. Effect of plant growth regulators in the rooting ofPinuscuttings [J]. Braz Arch Biol Technol, 49(2): 189-196.
HUANG JQ, WEI ZM, 1994. Tissue and protoplast culture ofPinusspecies [J]. Chin Bull Bot, 11(1): 34-42. [黄健秋, 卫志明, 1994. 松属树种的组织培养和原生质体培养 [J]. 植物学通报, 11(1): 34-42.]
IVANCHENKO MG, ZHU J, WANG B, et al, 2015. The cyclophilin A DIAGEOTROPICA gene affects auxin transport in both root and shoot to control lateral root formation [J]. Devel, doi: 10.1242/dev.113225.
JI KS, 1996. Studies on the pysiological genetics of cutting propagation and mineral nutrition ofPinusmassonianalamb [D].Nanjing: Nanjing Forestry University: 35-42. [季孔庶, 1996. 马尾松扦插繁殖与矿质营养的生理遗传学研究 [D].南京: 南京林业大学: 35-42. ]
JI KS, WANG ZR, CHEN TH, et al, 2001. Effects of root-inducing regulators in rooting of cuttings fromPinusmassonianaLamb [J].J Fujian Coll For, 21(2): 120-123. [季孔庶, 王章荣, 陈天华, 等, 2001. 几种生长调节剂对马尾松插穗促根的效应.福建林学院学报, 21(2): 120-123.]
LI XY, LÜ CQ, HUANG BL, et al, 2009. Advent itious roots induction ofPinusmassonianashoots in test tubes and anatomical observation [J]. J NW For Univ, 24(3): 80-84. [李校雨, 吕成群, 黄宝灵, 等, 2009. 马尾松组培苗不定根诱导及不定根解剖观察 [J]. 西北林学院学报, 24(3): 80-84.]
LIU DF, 2013. A major breakthrough in critical technologies of rapid propagation inpinustrees by tissue culture [EB/OL]. [2015-09-21]. http://www.gxst.gov.cn/dtxx/gxkj/zzq/675983.shtml. [刘达峰, 2013. “松树组培快繁关键技术攻关”取得重大突破 [EB/OL]. [2015-09-21]. http://www.gxst.gov.cn/dtxx/gxkj/ zzq/675983.shtml.]
LUO X, CHEN Z, GAO J, et al, 2014. Abscisic acid inhibits root growth inArabidopsisthrough ethylene biosynthesis [J]. Plant J, 79(1): 44-55.
MA J, ALONI R, VILLORDON A, et al, 2015. Adventitious root primordia formation and development in stem nodes of ‘Georgia Jet’ sweetpotato,Ipomoeabatatas[J]. Am J Bot, 102(7): 1040-1049.
OLIVEIRA LF, RIBAS LLF, QUOIRIN M, et al, 2012. Micropropagation ofPinustaedaL. from juvenile material [J]. Tree For Sci Biotechnol, 6(1): 96-101.
PENG LC, SU Y, WANG LH, et al, 2010. Study on standardized technology ofinvitropropagation ofSequoiasempervirenswith softwood [J]. Chin Agr Sci Bull, 26(4): 89-92. [彭绿春, 苏艳, 王丽花, 等. 2010. 北美红杉嫩枝的标准化离体繁殖技术研究 [J]. 中国农学通报, 26(4): 89-92.]
SAN JOSÉ MC, ROMERO L, JANEIRO LV, 2012. Effect of indole-3-butyric acid on root formation inAlnusglutinosamicro-
(Continueonpage1375)(Continuefrompage1294)
cuttings [J]. Silva Fenn, 46(5): 643-654.
WENDLING I, BROOKS PR, TRUEMAN SJ, 2015. Topophysis inCorymbiatorelliana×C.citriodoraseedlings: adventitious rooting capacity, stem anatomy, and auxin and abscisic acid concentrations [J]. New For, 46(1): 107-120.
YANG MH, ZHANG DL, LI ZH, et al, 2011. Somatic embryogenesis with immature embryos of Masson pine (PinusmassonianaLamb.) [J]. Plant Physiol J, 47(9): 904-912. [杨模华, 张冬林, 李志辉, 等. 2011. 马尾松幼胚体细胞胚胎发生研究 [J]. 植物生理学报, 47(9): 904-912.]YAO RL, WU YM, CAI L, 2014. A method to improve rooting of subcultured shoots inPinusmassoniana[P]. China, CN201410041856.3. [姚瑞玲, 吴幼媚, 蔡玲, 2014. 一种促进马尾松组培继代芽生根方法 [P]. 中国, CN201410041856.3.]YI SL, ZHANG DL, YANG MH, et al, 2013. Effects of explant collection time and storage duration on callus induction ofPinusmassoniana[J]. Guangxi For Sci, 42(1): 8-13. [伊书亮, 张冬林, 杨模华, 等, 2013. 外植体采集时期与冷藏处理对马尾松愈伤组织诱导的影响 [J]. 广西林业科学, 42(1): 8-13.]
ZENG L, HU DH, WANG RH, et al, 2009. A study on technique of tissue culture of Chinese fir supeior clones [J]. Guangdong For Sci Technol, 25(6): 64-69. [曾雷, 胡德活, 王润辉, 等, 2009. 杉木优良无性系组织培养技术研究初报 [J]. 广东林业科技, 25(6): 64-69.]
ZHU LH, WU XQ, QU HY, et al, 2010. Micropropagation ofPinusmassonianaand mycorrhiza formationinvitro[J]. Plant Cell Tiss Org, 102(1): 121-128.
Key factors affecting rooting ofPinusmassonianaby tissue culture
YAO Rui-Ling, WANG Yin*, WU You-Mei
(GuangxiKeyLaboratoryofSuperiorTimberTreesResourceCultivation,GuangxiForestryResearchInstitute, Nanning 530002, China )
Influence of certain selected factors including basal media, genotypes, hormone and conditions of light and temperature on rooting ofinvitrosingle buds was explored using tissue-cultured shoots of good variety population inPinusmassoniana. SPSS 19.0 statistic software was used to analyze those data. Results were as follows: (1) Rooting percentage was significantly different under the treatments of half-strength WPM, DCR, GD, MS and modified MS basic media. The best rooting was observed in the treatment of 1/2 modified MS. (2) The difference in rooting ability was significant in genotypes ofP.massoniana. Rooting capacity of GLM-80 was stronger than other clones tested. (3) Hormone concentration remarkably affectedinvitrorooting ofP.massoniana. Rooting percentage was high and root system was developed under the treatment of low-concentrate auxin. The performance of rooting by tissue culture was good with the treatment of 0.1-0.2 mg·L-1NAA compared to IAA and IBA. (4) Light intensity did not affectinvitrorooting ofP.massoniana, while significantly influenced morphogenesis of aerial parts of shoots. Shoots grew well and transplantation survival percentage was high when treated with the light intensity of 2 000 lx. There was significant of temperature oninvitrorooting ofP.massoniana, and rooting effect was stable under the cultural condition of 25 ℃. This study provides the scientific and technological support for the industrialized production of tissue cultured plantlets, and for the implementation of clonal forestry as well as the acceleration of the process for improved varieties breeding inP.massoniana.
pine trees, rapid propagation by tissue culture, massive production, clonal afforestation, biotechnology
10.11931/guihaia.gxzw201509017
2015-11-19
2016-02-24
广西科学研究与技术开发计划项目(桂科合14125008-2-17,桂科攻1598006-5-7); 国家自然科学基金(31360178); 广西林业科技重点项目(桂林科研 [2015]7号); 广西优良用材林资源培育重点实验室自主研究课题(13A-01-01) [Supported by the Program of Science Research and Technology Development from the Department of Science and Technology of Guangxi (14125008-2-17, 1598006-5-7); the Natural Science Foundation of China (31360178); the Key Program of Guangxi Forestry Bureau ( [2015]7); the Independent Program from the Key Laboratory of Gaungxi Fine Timber Forest Resources Cultivation (13A-01-01)]。
姚瑞玲(1979-),女(侗族),贵州施秉县人,博士,副研究员,主要从事林木活性成分代谢调控与松树组培快繁研究,(E-mail)jullyudi@163.com。
*通讯作者: 王胤,高级工程师,从事松树良种繁育与森林培育研究,(E-mail)147979716@qq.com。
Q943.1, S722.8
A
1000-3142(2016)11-1288-08
姚瑞玲, 王胤, 吴幼媚. 马尾松组培生根关键因子分析 [J]. 广西植物, 2016, 36(11):1288-1294
YAO RL, WANG Y, WU YM. Key factors affecting rooting ofPinusmassonianaby tissue culture [J]. Guihaia, 2016, 36(11):1288-1294
