几种定量线粒体DNA1555A>G异质性突变检测方法
2016-12-22高慧沈姗姗刘晶晶王琳凯梁少明张阮章胡玉华郭辉林玉梅王沙燕
高慧沈姗姗刘晶晶王琳凯梁少明张阮章胡玉华郭辉林玉梅王沙燕
1暨南大学第二临床医学院,深圳市人民医院(深圳518020)
2亚能生物技术(深圳)有限公司(深圳518133)
·技术与方法·
几种定量线粒体DNA1555A>G异质性突变检测方法
高慧1沈姗姗1刘晶晶2王琳凯1梁少明2张阮章1胡玉华1郭辉1林玉梅1王沙燕1
1暨南大学第二临床医学院,深圳市人民医院(深圳518020)
2亚能生物技术(深圳)有限公司(深圳518133)
目的 利用TaqMan探针建立熔解曲线定量分析技术平台,比较TaqMan探针熔解曲线技术、变性高效液相色谱技术(DHPLC)及测序技术在检测线粒体DNA 1555A>G异质性突变负荷方面的差异。方法 建立TaqMan探针熔解曲线技术,分析氨基糖苷类药物性耳聋家系及正常人群的线粒体DNA 1555A>G异质性突变水平,并与前期实验中DHPLC技术及测序技术的检测结果进行对比分析。结果TaqMan探针熔解曲线技术成功分析50例样本的线粒体DNA 1555A>G突变水平,相比于Sanger测序技术多发现1例异质性突变,但比DHPLC技术少发现3例异质性突变。结论 本实验建立的TaqMan探针熔解曲线技术成功检出19%至86%范围内的线粒体DNA 1555A>G异质性突变水平,操作简单,成本低。
线粒体DNA 1555A>G;耳聋;TaqMan探针;熔解曲线;变性高效液相色谱分析技术
Fund:Supported by the Strategic Emerging Industry Development Fund of Shenzhen,No.CXZZ20130517143111780.
Declaration of interest:The authors report no conflicts of interest.
耳聋是人类常见的致残性疾病,1993年Prezant等[1]首次发现药物性耳聋与线粒体DNA 12S rRNA 1555A>G突变密切相关,并认为氨基糖苷类抗生素是药物性耳聋的主要诱因。最初认为线粒体相关的致聋基因以线粒体DNA同质性突变的形式致病,然而1997年el-Schahawi等[2]首次提出线粒体DNA 12S rRNA 1555A>G存在异质性突变,2003年del Castillo等[3]认为1555A>G突变致聋的临床表型与其突变负荷有关。当突变负荷小于20%时,无临床症状或表现为轻度耳聋。然而当突变负荷大于52%时,可导致中到重度听力残疾。我们前期也通过检测线粒体DNA 12S rRNA 1555A>G异质性突变一大家系,对线粒体DNA 1555A>G异质性突变与耳聋临床表型的相关分析进行了同类报道[4],明确了线粒体DNA 1555A>G异质性突变水平与临床表型及向下一代的突变传递量有关。可见定量检测线粒体DNA 1555A>G异质性突变水平有助于预测及分析药物性耳聋的临床表型。
目前,检测1555A>G异质性突变方法主要报道限制性片段长度多态性(PCR-RFLP)[2]、毛细管电泳[3]、变性高效液相色谱(Denaturing High Perfor⁃mance Liquid Chromatography,DHPLC)[4]、实时定量PCR[5]及SnaPshot[6]等技术。近年来,探针熔解曲线技术已逐步兴起,现已用于各种临床疾病的基因诊断[7,8]。其基于荧光PCR平台,利用探针多色性及双链DNA解链温度(Tm)的差异,快速地完成基因突变的检测及基因分型[9]。然而该技术对于异质性突变的研究很少[10],本研究拟利用TaqMan探针熔解曲线技术分析药物性耳聋相关线粒体DNA 1555A>G异质性突变水平,比较TaqMan探针熔解曲线技术、DHPLC及测序技术在检测线粒体DNA 1555A>G异质性突变负荷方面的差异。
1 探针熔解曲线定量技术的建立
1.1 构建质粒标准品
选择优化的PCR引物对线粒体DNA进行PCR扩增,然后将PCR产物送至上海旭冠生物科技发展有限公司进行克隆及构建线粒体DNA nt1555(A/G)位置的突变型及野生型质粒,并利用ABI 3130测序仪测序验证。将质粒稀释至工作浓度,利用相同浓度1555A>G野生型与突变型质粒,按不同体积比例构建0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%十一个不同突变负荷的标准品备用。
1.2 PCR反应及标准曲线绘制
根据探针及引物设计的一般原则,利用prim⁃er5.0设计正向引物5’-AGTAGAGTGCTTAGTTGAA⁃CAGGGC-3’,反向引物5’-CCAAGTGCACTTTC⁃CAGTACACTTA-3’,扩增155bp的线粒体DNA nt1441~1595基因片段(包含nt1555位点)。利用Oli⁃go7.0设计36bp的TaqMan探针5-ROX-CCCTACG⁃CATTTATATAGAGGAGACAAGTCGTAACAHQ1-3’(5’端标记荧光基团,3’端标记淬灭基团)。反应体系:1×buffer,3.0 mM MgCl2,0.2 mM dNTPs,上游引物0.04 μM,下游引物0.4 μM,TaqMan探针0.4 μM,2.5U Taq酶,20ng DNA(50000copies质粒),加蒸馏水补至25μl。结合研究中Taq酶最适的延伸温度,参考厦门致善生物科技有限公司“遗传性耳聋基因检测试剂盒(荧光PCR熔解曲线法)”提供的反应条件:(1)95℃预变性10min;95℃15s,65℃15s(每个循环降低1℃),74℃20s,10个循环;(2)95℃15s,55℃15s,74℃20s,50个循环;(3)95℃1min,40℃3min,45℃升逐渐升温至85℃并每升高0.4℃收集ROX荧光。仪器选择:SLAN-96S Real Time System(上海宏石医疗科技有限公司)。标准曲线的绘制:取50000copies不同突变负荷的质粒标准品置于反应体系中,按照优化的反应条件进行扩增,将获得的熔解曲线作为标准曲线。
1.3 标准曲线统计学分析
采用SPSS13.0软件Scatter散点图功能,分析标准品的熔解曲线与突变负荷关系。根据散点图的图形分布做统计学分析,并求出定量突变负荷的函数。
2 验证及对比分析
2.1 临床样本
已排除耳聋以外的其他疾病,遵循知情同意原则,选择有异质性突变的耳聋家系作为病例对照,共收集18例,均为本实验室已发表文献中的氨基糖苷类药物性耳聋大家系成员[4]。按统计学原则,随机选择听力正常人群作为正常对照,共收集32例。利用EDTA-K2真空抗凝管采集2ml全血,选择德国QIA⁃GEN公司的QIAamp DNA全血抽提试剂盒,按照提取步骤说明书提取全基因组DNA,置-20℃保存。
2.2 对比验证
选择上述家系中不同突变负荷样品18例及正常对照组32例,共50例。利用建立的TaqMan探针熔解曲线方法检测50例样本的1555A>G异质性突变水平,根据所建立的标准函数,分析每个样本的异质性突变负荷。利用实验室前期建立的DHPLC分析技术定量正常对照样本的线粒体DNA突变负荷[11],并与TaqMan探针熔解曲线结果进行对比分析。异质性家系成员的TaqMan探针熔解曲线检测结果直接与前期运用DHPLC技术定量线粒体DNA突变负荷的结果[4]进行分析对比。采用SPSS13.0软件中P-P图对实验数据进行正态性检验,根据检验结果选择t检验或者配对样本比较的Wilcoxon符号秩检验分析TaqMan探针熔解曲线与DHPLC两种技术所得结果有无差别,进一步探讨探针熔解曲线技术对基因异质性突变水平检测的灵敏度与特异性。选择Sanger测序技术验证所有样本是否存在1555A>G突变。
3 结果
3.1 标准熔解曲线
熔解曲线分析可知,TaqMan探针与野生型质粒模板完全匹配,双链DNA具有较高的解链温度,野生峰Tm值为72.5±1℃。突变型质粒模板中nt1555处碱基由A突变为G,TaqMan探针与模板匹配不完全,双链DNA则具有较低的解链温度,突变峰Tm值为69.5±1℃。十一种不同突变负荷的质粒熔解曲线分析显示,突变水平从0%到100%变化时,野生型峰高逐渐降低,突变型峰高逐渐升高,不同突变负荷的质粒可获得形状不同的熔解曲线图(图1)。对于10%水平的低异质性突变,与0%突变负荷相比,其熔解曲线图形在Tm=69.5℃处有较明显的凸峰。
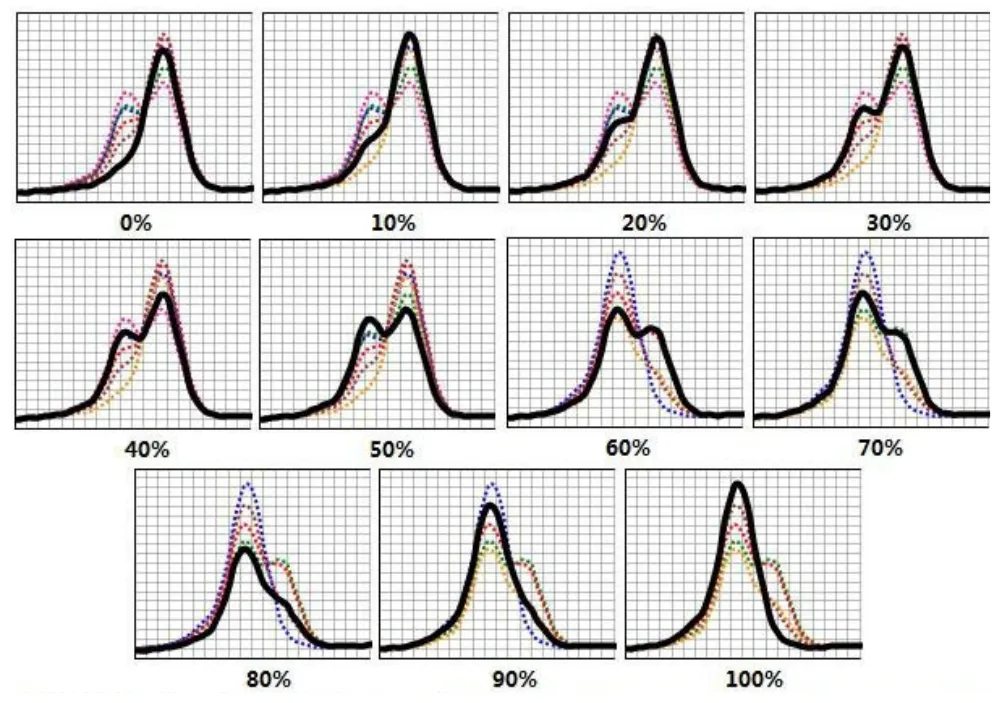
图1 标准品的TaqMan探针溶解曲线X轴:温度;Y轴:-d(Rn)/dT(荧光变化值/温度变化值)黑水粗线:0%至100%十一种突变负荷标准品各自的溶解曲线结果图;彩色虚线1(0%至50%标示图):标示0%至50%突变负荷标准品的溶解曲线结果汇总图;彩色虚线2(60%至100%标示图):标示60%至100%突变负荷标准品的溶解曲线结果汇总图;Fig.1 X-axle represent Temperature,Y-axle represent the ratio of difference fluorescence and difference Temperature.Black solid curves show the TaqMan probe melting curve results of plasmid standards which include 0 to 100 percentage of mutant mtDNA1555A>G copies. Colorful dotted curve as the background of pictures marked 0%to 50% simultaneously show the whole melting curve results of plasmid standards which include 0 to 50 percentage of mutant mtDNA 1555A>G copies.Colorful dotted curve as the background of pictures marked 60% to 100%simultaneously show the whole melting curve results of plasmid standards which include 60 to 100 percentage of mutant mtDNA 1555A>G copies
3.2 函数及相关性分析
多次实验显示基因突变负荷从0%到100%变化时,野生型及突变型熔解曲线峰高随着突变负荷变化而升降的趋势基本一致。则选择野生峰与突变峰的平均Tm(72.5℃与69.5℃)处,读取每个样本的两处峰高(Y值);采用野生型峰高与突变型峰高的比值(Y72.5℃/Y69.5℃),结合突变负荷做散点图分析,探讨高度比与突变负荷的关系。通过散点图分析可知突变负荷与高度比存在明显的曲线关系(图2A)。利用SPSS13.0曲线拟合技术,可得最优拟合曲线方程:Y=112.88-76.70x+19.50x2-1.85x3。曲线方程计算的突变负荷与理论突变负荷的相关系数R2可达到0.999(图2B)。可见该函数理论上可用于线粒体DNA 1555A>G异质性突变负荷的计算。
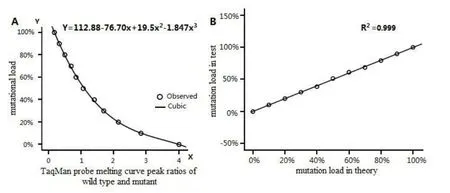
图2 曲线拟合及相关性分析Fig.2 Curve fitting and correlation analysis
3.3 临床样本分析及方法学比较
根据熔解曲线图形中野生型峰高与突变型峰高的比值(x=Y72.5℃/Y69.5℃),利用标准函数(Y= 112.88-76.70x+19.50x2-1.85x3)计算出各个样本的突变负荷。选择SPSS13.0软件,比较分析TaqMan探针熔解曲线技术与DHPLC技术的检测结果(表1)。P-P图分析显示突变负荷数据明显不服从正太分布,则选择配对样本比较的Wilcoxon符号秩检验比较两种检测技术,统计分析结果显示Z=-3.44,P= 0.001,可认为两种方法结果有差别。经研究分析可知,TaqMan探针熔解曲线技术检测突变负荷<19%与>86%的样本时,与DHPLC技术结果差异较大。去除检测值<19%与>86%的样本后,再次进行配对样本比较的Wilcoxon符号秩检验分析,结果显示Z=-0.68,P=0.499,其差异无显著性意义。因此,在该范围内尚不能认为两种方法检测线粒体DNA 1555A>G结果有差别。可见TaqMan探针熔解曲线技术在检测突变负荷为19%~86%的异质性突变水平中具有一定的可信度(图3)。将TaqMan探针熔解曲线技术检测值<19%判断为正常,19%-86%判断为异质性突变,>86%判断为同质突变。则32例正常人均无1555A>G突变,18例耳聋家系成员检测出2例无突变,7例异质性突变和9例同质性突变。Sanger测序技术结果显示,在线粒体DNA 12S rRNA nt1555处可看见明显A峰、G峰或A+G杂合峰,与TaqMan探针熔解曲线技术检测结果相比,TaqMan探针熔解曲线技术能检测出Sanger测序未发现的异质性突变(II-3)(表1)。
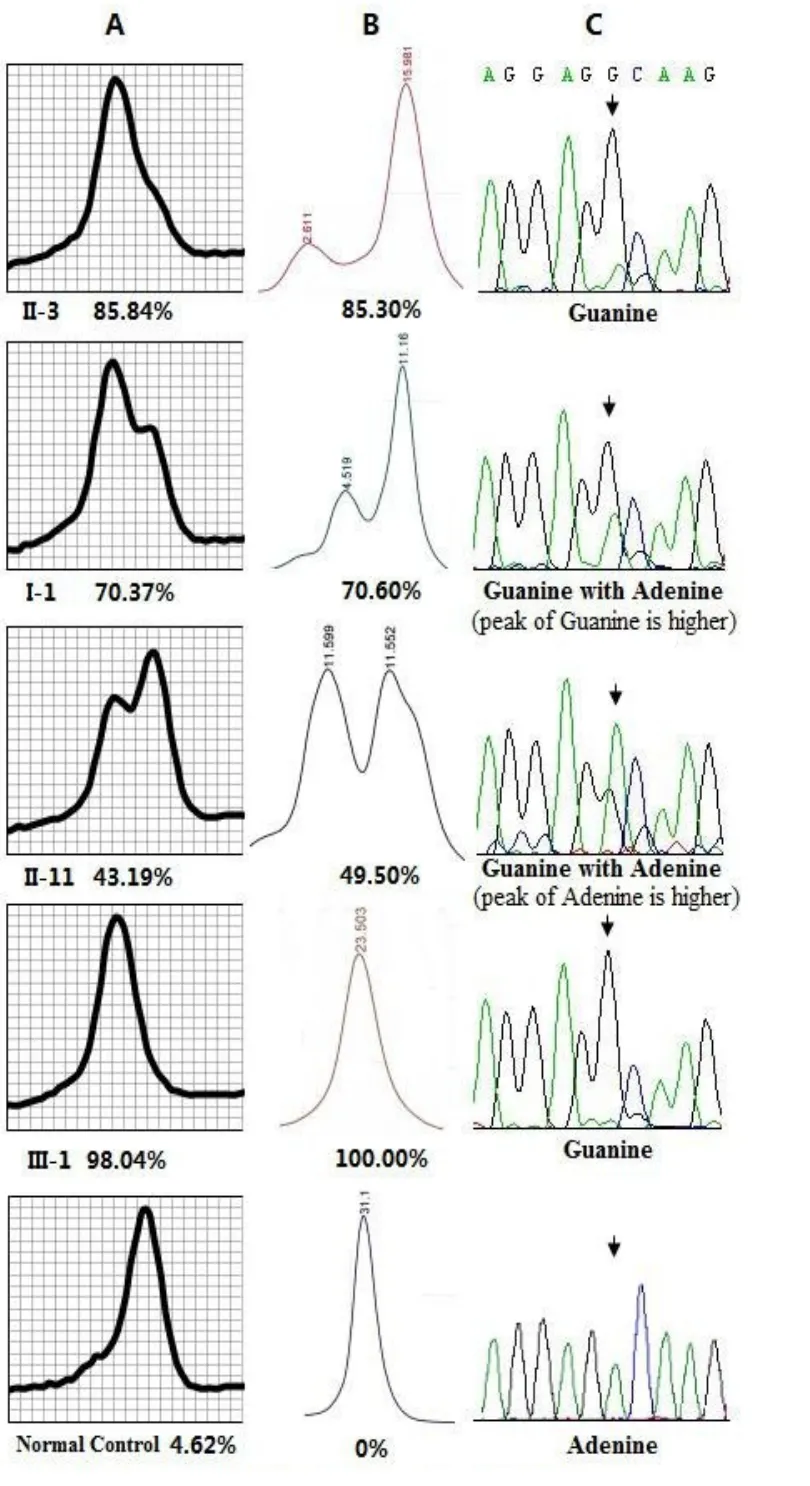
图3 异质性突变检测结果A:溶解曲线技术B:DHPLC技术C:测序技术Fig.3 Results of heteroplasmic Mutation.(A)TaqMan probe melting curve technology.(B)DHPLC method.(C)Sanger sequencing technology
异质性突变的检测至今无金标准,测序技术也只能检测20%以上的异质性突变水平,本文以DH⁃PLC技术作为参考,可获得测序技术与TaqMan探针熔解曲线技术相对特异性与灵敏度(表2、表3)。
测序技术:异质性突变检出的相对特异性=40/ 40=100%
异质性突变检出的相对灵敏度=6/10=60%
TaqMan探针熔解曲线技术:异质性突变检出的相对特异性=40/40=100%
异质性突变检出的相对灵敏度=7/10=70%
4 讨论
药物性耳聋的临床表型存在明显的异质性[12],如受药物影响程度多样化、发病年龄多样化、耳聋程度多样化,其中线粒体DNA 12S rRNA 1555A>G异质性突变对临床表型影响最为关键。del Castillo等[3]研究西班牙家系认为1555A>G突变负荷大于52%时可导致中到重度听力残疾,而我们在研究线粒体DNA 12S rRNA 1555A>G异质性突变家系中[4],发现在50%突变负荷左右的耳聋家系成员中仅存在高频听力损失,高于70%可表现轻度、中度或重度耳聋,可见不同地区或人种的1555A>G异质性突变与临床表型有所差异,其机理需要在更多的家系中进一步研究。并且异质性突变母亲极有可能生下同质性突变的子代[4,13],导致子代产生更加严重的临床表现。然而1555A>G异质性突变检测技术报道相对较少,并且低水平的异质性突变更加难以检测,测序技术报道只能检测20%以上的异质性突变水平[11]。2008年ballana等[14]利用DHPLC技术及焦磷酸测序技术能检出低至5%的异质性突变,但该方法需特殊仪器及操作复杂,难以在临床普及。探针熔解曲线技术以省时、操作简单等优势,已在临床实验室用于野生型,突变型或杂合子等基因检测,但精确定量异质性突变研究相对较少[10]。本实验首次利用TaqMan探针建立熔解曲线技术平台,成功分析出21.51%至85.84%范围内的7例1555A>G异质性突变,比Sanger测序技术多发现1例85.84%的突变。但与DHPLC技术相比,少发现3例异质性突变,当DHPLC及Sanger测序检测为野生型时,熔解曲线标准函数计算结果多为-3.75%~8.86%,并未检出14.80%与11.50%异质性突变。当DHPLC及Sanger测序检测为同质性突变时,熔解曲线标准函数计算结果多为93.06%~101.10%,DHPLC定量为97.9%的样本检测为91.40%。以DHPLC技术作为参考,测序技术检出异质性突变的相对灵敏度为60%,TaqMan探针熔解曲线技术检出异质性突变的相对灵敏度为70%。可见,本实验中建立的TaqMan探针熔解曲线技术不及DHPLC方法灵敏,对<15%及>90%的突变难以准确定量,需进一步对其检测方法进行优化,以提高其检测的敏感性与准确性。
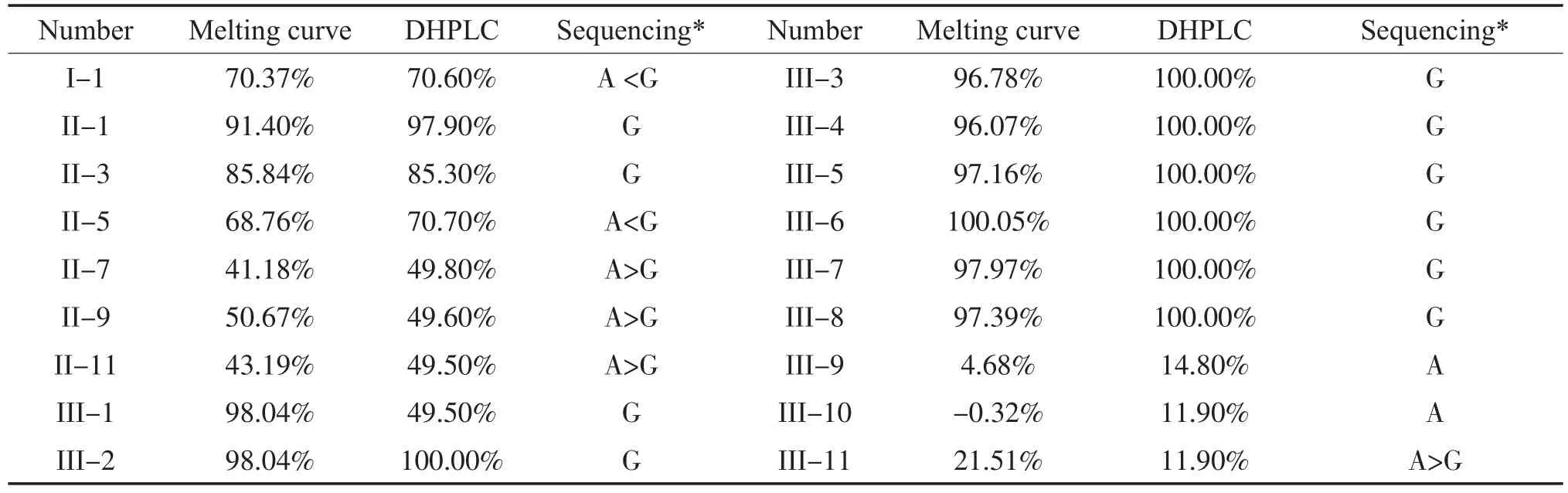
表118 例药物性耳聋家系成员检测结果Table 1 The test results of 18 cases of drug-induced deafness family members
TaqMan探针熔解曲线技术分析线粒体DNA 1555A>G异质性突变负荷主要受两方面的影响。首先是探针设计,探针是决定实验成败的关键。结合实验,观察异质性突变水平从0%到100%变化时熔解曲线变化的趋势,从而筛选出最优探针。本实验选择36bp的TaqMan探针,获得的熔解曲线能较好的反映异质性突变水平的变化(图1)。其次是突变负荷的定量,根据样品的熔解曲线图形,可粗略地估算出样本的突变水平,但要精确定量其突变负荷,则需采用统计学分析。本实验采用熔解曲线高度比与突变负荷作曲线拟合,成功分析19%至86%的异质性突变水平。由于技术局限,本文并未深入探讨熔解曲线面积比或面积与高度相结合分析突变负荷的情况。此外,本实验研究的异质性突变样本量较少,结果也许会存在偏倚,所以TaqMan探针熔解曲线技术精确定量突变负荷仍期待增加样品数量进一步探讨。TaqMan探针熔解曲线技术对样本要求不高。在进行定量线粒体DNA 1555A>G异质性突变负荷时,利用全基因组DNA作为模板与利用mtDNA Ex⁃tractor WB Kit提取的线粒体DNA作为模板所获得的分析结果并无显著差别。虽然,本实验的数据提示TaqMan探针熔解曲线技术灵敏度不及DHPLC技术,但比Sanger测序技术多发现1例异质性突变,并且操作简单,成本相对较低,更加便于在临床实施。

表2 测序技术与DHPLC技术结果对比分析Table 2 Compare the results of Sanger sequencing technology and DHPLC method

表3 TaqMan探针熔解曲线技术与DHPLC技术结果对比分析Table 3 Compare the results of TaqMan probe melting curve technology and DHPLC method
1 Prezant TR,Agapian JV,Bohlman MC,et al.Mitochondrial ribosomal RNA mutation associated with both antibiotic-induced and non-syn⁃dromic deafness[J].Nat Genet,1993,4(3):289-294.
2 el-Schahawi M,López de Munain A,Sarrazin AM,et al.Two large Spanish pedigrees with nonsyndromic sensorineural deafness and the mtDNA mutation at nt 1555 in the 12s rRNA gene:evidence of heteroplasmy[J].Neurology,1997,48(2):453-456.
3 del Castillo FJ,Rodríguez-Ballesteros M,Martín Y,et al.Heteroplasmy for the 1555A>G mutation in the mitochondrial 12S rRNA gene in six Spanish families with non-syndromic hearing loss[J].J Med Gen⁃et,2003,40(8):632-636.
4 沈姗姗,王琳凯,刘畅,等.线粒体DNA1555A>G异质性突变大家系的临床与实验分析[J].中华耳科学杂志,2013,11(3):435-439. Shanshan Shen,Linkai Wang,Chang Liu,et al.A Large Family With mtDNA 1555A>G Heteroplasmic Mutation[J].Chinese Journal of Otology,2013,11(3):435-439.
5 程祖建,杨滨,江凌,等.非综合征型耳聋患者mtDNA A1555G异质性突变比例与临床表型的关系[J].中华耳科学杂志,2008,6(4): 381-384. Zujian Cheng,Bin Yang,Ling Jiang,et al.Correlation between the per⁃centage of mitochondrial DNA copies with the A1555G mutation and the phenotype of mitochondrial deafness[J].Chinese Journal of Otolo⁃gy,2008,6(4):381-384.
6 朱玉华,翟所强,戴朴.线粒体12SrRNAA1555G突变耳聋家系的异质率研究[J].中华耳科学杂志,2014,12(1):50-53. Yuhua Zhu,Suoqiang Zhai,Pu Dai.Heteroplasmy Levels of Mitochon⁃drial 12S rRNA A1555G Mutation in Pedigrees with Aminoglyco⁃side-Induced and Non-Syndromic Hearing Loss as Detected Using SNaPshot Technique[J].Chinese Journal of Otology,2014,12(1): 50-53.
7 Xiong F,Huang Q,Chen X,et al.A melting curve analysis--based PCR assay for one-step genotyping of beta-thalassemia mutations a multicenter validation[J].J Mol Diagn,2011,13(4):427-435.
8 Hu S,Li G,Li H,et al.Rapid detection of isoniazid resistance in Myco⁃bacterium tuberculosis isolates by use of real-time-PCR-based melting curve analysis[J].J Clin Microbiol,2014,52(5):1644-1652.
9 Huang Q,Liu Z,Liao Y,et al.Multiplex fluorescence melting curve analysis for mutation detection with dual-labeled,self-quenched probes[J].PLoS One,2011,6(4):e19206.
10 高旭,李静,柳清云,等.异质性耐药对结核分枝杆菌表型和基因型耐药检测结果的影响[J].中华结核和呼吸杂志,2014,37(4): 260-265. Xu Gao,Jing Li,Qingyun Liu,et al.Heteroresistance in Mycobacteria tuberculosis is an important factor for the inconsistency between the results of phenotype and genotype drug susceptibility tests[J].Chin J Tuberc Respir Dis,2014,37(4):260-265.
11 王琳凯,沈姗姗,刘畅,等.DHPLC方法检测并定量线粒体DNA1555A>G异质性突变[J].中华耳科学杂志,2013,11(3): 469-473. Linkai Wang,Shanshan Shen,Chang Liu,et al.Detection and quantifi⁃cation of mitochondrial DNA 1555A>G Mutation heteroplasmy by DHPLC method[J].Chinese Journal of Otology,2013,11(3): 469-473.
12 刘畅,王沙燕.线粒体DNA A1555G突变的异质性研究进展[J].国际遗传学杂志,2009,32(4):302-306. Chang Liu,Shayan Wang.Advances in the Research of Mitoehondrial DNA A1555G Mutation Heteroplasmy[J].Int J Genet Aug,2009,32 (4):302-306.
13 Park MK,Sagong B,Lee JD,et al.A1555G homoplasmic mutation from A1555G heteroplasmic mother with Pendred syndrome[J].Int J Pedi⁃atr Otorhinolaryngol.2014,78(11):1996-1999.
14 Ballana E,Govea N,de Cid R,et al.Detection of unrecognized low-lev⁃el mtDNA heteroplasmy may explain the variable phenotypic expres⁃sivity of apparently homoplasmic mtDNA mutations[J].Hum Mutat,2008,29(2):248-257.
Melting curve quantitative technology in quantification of mitochondrial DNA 1555A>G heteroplasmic mutation
GAO Hui1,SHEN Shanshan1,LIU Jingjing2,WANG Linkai1,LIANG Shaoming2,ZHANG Ruanzhang1, HU Yuhua1,GUO Hui1,LIN Yumei1,WANG Shayan1
1 Second Clinical medical college of Jinan University,Shenzhen People's Hospital,Shenzhen 518020,China
2 Yaneng Bioscience(Shenzhen)Co.ltd.,Shenzhen 518133,China
Objective The melting curve quantitative technology was established using the TaqMan probe and compared with DHPLC and Sanger sequencing technologies in detecting mtDNA 1555A>G heteroplasmic mutation.Methods TaqMan probe melting curve technology was used to test aminoglycoside-induced hearing loss families and normal individuals.The results were compared with our previous results using DHPLC and Sanger sequencing technologies.Results The level of mutant mtDNA 1555A>G was detected by TaqMan probe melting curve technology successfully in 50 samples, identifying one more case than Sanger sequencing,but three less than DHPLC.Conclusions The quantity of mutant mtDNA 1555A>G copies ranging from 19%to 86%was accurately detected by the TaqMan probe melting curve technology used in this experiment.
mtDNA1555A>G;hearing loss;Taq Man probe;Melting Curve Analysis;DHPLC.
R764.1
A
1672-2922(2016)05-686-6
2015-10-30审核人:翟所强)
10.3969/j.issn.1672-2922.2016.05.026
2013年深圳市战略新兴产业发展专项资金(CXZZ20130517143111780)
高慧,研究生,研究方向:医学遗传学
王沙燕,Email:shayanw@yahoo.com
