P选择素为靶标的MRI在大鼠急性胰腺炎病情轻重分级中的应用
2016-12-22田冰刘日陈士跃刘芳贾国荣李晶陈录广王莉陆建平
田冰 刘日 陈士跃 刘芳 贾国荣 李晶 陈录广 王莉 陆建平
·论著·
P选择素为靶标的MRI在大鼠急性胰腺炎病情轻重分级中的应用
田冰 刘日 陈士跃 刘芳 贾国荣 李晶 陈录广 王莉 陆建平
目的 探讨P选择素为靶标的磁共振靶向对比剂(P-Gd-probe)在大鼠急性胰腺炎(AP)病情轻重分级中的应用。方法 采用腹腔注射L-精氨酸溶液(100mg/100g体重)3次、间隔1h的方法制备SD大鼠AP模型,对照组注射等容积生理盐水,依照病理结果将AP大鼠分为急性水肿性胰腺炎(AEP,造模后6、12h)组及急性坏死性胰腺炎(ANP,造模后24、48h)组。造模6、12、24、48h大鼠及对照组大鼠行磁共振T1加权横断位平扫及增强扫描,对比剂采用P-Gd-probe。测量增强前后胰腺部位的信号声噪比(SNR)。扫描完成后取胰腺组织行病理学检查,采用免疫组织化学方法检测胰腺组织P选择素表达。结果 造模6h后胰腺组织出现炎症改变,且炎性程度随造模时间延长而加重,胰腺组织P选择素蛋白表达也随AP的炎性程度加重而增高。对照组增强前后胰腺组织SNR值基本不变;AEP组增强前后SNR值分别为17.22±1.35、37.38±1.66,ANP组分别为16.29±1.39、58.18±1.03,这两组增强后的SNR值均显著高于增强前,差异均有统计学意义(t值分别为-49.59、-86.09,P值均<0.001)。结论MRI时选择P选择素为靶标的单克隆抗体靶向对比剂有助于对AP病情严重程度的判断。
胰腺炎,急性坏死性;P选择素; 靶向对比剂; 磁共振成像
Fund program: National Natural Science Foundation of China(81300366)
急性胰腺炎(AP)是胰酶消化自身及周围组织所引起的炎症反应。轻症急性胰腺炎(MAP)具有自限性,但20%~30%可以发展成为重症急性胰腺炎(SAP),SAP病情凶险,预后较差。因此,及早诊断、分型和评估对掌握AP的进展、及时有效干预治疗及判断预后尤为重要。目前的临床诊断及评分系统都存在一定的局限性,如何准确、客观、简易地判断AP的病情轻重成为临床亟待解决的关键问题。基于P选择素在AP时表达增高,且在MAP与SAP中表达具有差异的特征[1],本研究构建以P选择素为靶标的单克隆抗体磁共振成像(MRI)靶向对比剂,并对AP大鼠行MRI,观察P选择素的表达,探讨其在判断AP病情严重程度中的应用价值。
材料与方法
一、大鼠AP模型制作
25只雄性SD大鼠,体重250~300 g,按数字表法随机分为对照组及AP 6、12、24、48 h组,每组5只。实验前大鼠禁食12 h,自由饮水。用生理盐水配制浓度为20%的L-精氨酸溶液。以腹腔注射L-精氨酸溶液100 mg/100 g体重3次、间隔1 h的方法制备AP模型。对照组同法注射等容积生理盐水。3次注射完成后,给予大鼠正常食物和水[2]。
二、P选择素为靶标的磁共振对比剂(P-Gd-probe)的制备
精密称取14 mg的磷脂材料DSPE-PEG-COOH和2 mg的Gd造影材料Gd-DTPA-SA,应用甲醇充分溶解后倒入烧瓶中进行旋转蒸发1 h,加入1 ml蒸馏水超声充分溶解剩余产物,通过纳米级薄膜挤压20次,形成载Gd-DTPA的MRI探针(Gd-probe)。向该探针溶液加入100 mg的P选择素单克隆抗体以及50 μg的二氯乙烷,混合后透析除去游离分子,最终获得P选择素单克隆抗体修饰的MRI探针(P-Gd-probe)。
三、在体MRI扫描
MRI扫描采用Siemens 3.0T磁共振成像仪(Skyra, Siemens medical solution, Erlangen, Germany)。 AP组分别于造模后6、12、24、48 h时间点通过小动物气麻机麻醉大鼠,固定于MRI手臂线圈中,采用T1加权快速自旋回波序列(T1weighted image Turbo Spin Echo, T1WI TSE)进行扫描,获取T1WI的横断面图像。成像参数:重复时间(TR) 460 ms,回波时间(TE) 12 ms,视野68 mm×80 mm,矩阵216×256,层厚1 mm,层间距0,回波链长度3,层数20,平均数6,扫描时间(TA)6∶40。T1WI平扫结束后经尾静脉注射P-Gd-probe靶向对比剂(Gd剂量为0.1 mmol/kg体重),注射完成后采用上述T1加权序列获取增强后图像。扫描结束后测量增强前后T1WI序列胰腺部位的信号声噪比(signal noise ratio, SNR)。
四、胰腺组织病理学检查及P选择素表达检测
MRI扫描结束后立即处死大鼠,迅速取出胰腺腺体以甲醛溶液固定,常规行组织病理学检查,由病理科医师盲法读片,并参考Schmidi等[3]的方法从水肿、腺泡坏死、出血、脂肪坏死、炎症及血管周围浸润等方面进行病理评分。同时采用免疫组织化学方法检测胰腺组织P选择素蛋白表达。
结 果
一、各组大鼠胰腺组织病理改变及P选择素表达变化
对照组大鼠胰腺组织无明显病理损伤(图1A);AP 6 、12 h组大鼠胰腺组织充血、间质水肿、少量炎症细胞浸润,少量散在的出血坏死灶,呈现急性水肿性胰腺炎(acute edematou pancveatitis, AEP,即MAP)改变(图1B、1C);24、48 h组大鼠胰腺组织结构破坏、大片出血坏死灶、大量炎细胞浸润,呈现急性坏死性胰腺炎(acute necratizing pancreatitis, ANP,即SAP)改变(图1D、1E)。依照病理检测结果将大鼠分为对照组、AEP组及ANP组。免疫组织化学染色结果显示,ANP组大鼠胰腺组织P选择素蛋白高表达,AEP组大鼠胰腺组织低表达,对照组大鼠胰腺组织未见表达(图1F、1G、1H、1I、1J)。
二、各组大鼠胰腺MRI图像的SNR值
对照组大鼠MRI扫描增强前后胰腺组织的SNR值分别为17.16±0.68、18.18±0.56,差异无统计学意义(t=-2.72,P=0.06);AEP组增强前后SNR值分别为17.22±1.35、37.38±1.66,ANP组分别为16.29±1.39、58.18±1.03,这两组增强后的SNR值均显著高于增强前,差异均有统计学意义(t值分别为-49.59、-86.09,P值均<0.001,图2),且ANP组的增加较AEP组更为显著,差异有统计学意义(t=-5.94;P<0.001)。
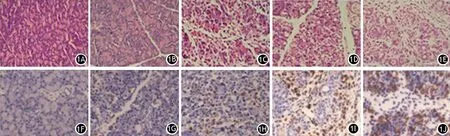
图1 对照组、AEP组、ANP组大鼠胰腺组织病理改变(1A、1B、1C、1D、1E,HE×200)及P选择素蛋白表达(1F、1G、1H、1I、1J,免疫组织化学×200)
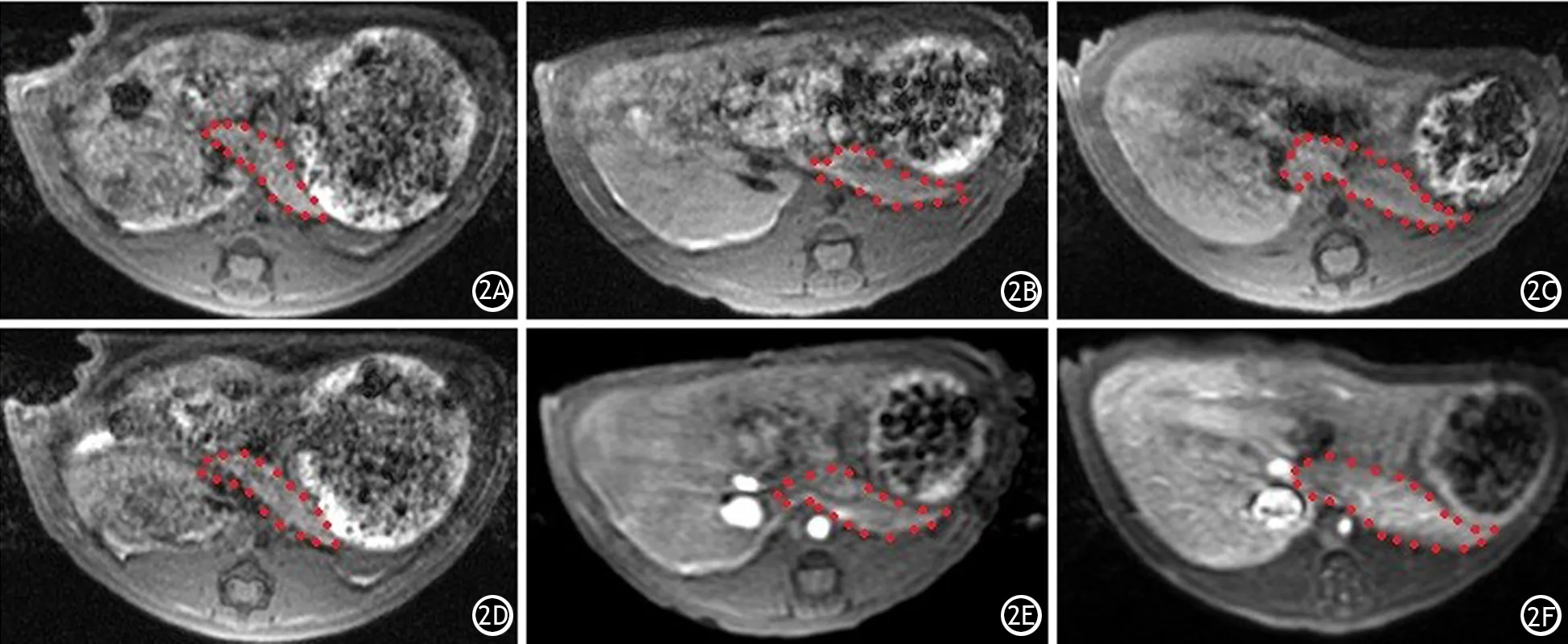
图2 对照组、AEP组、ANP组磁共振增强前(2A、2B、2C)及增强后(2D、2E、2F)T1WI横断位图
AP是指多种病因引起的胰酶激活,以胰腺局部炎症反应为主要特征,伴或不伴有其他器官功能改变的疾病,临床上包括MAP和SAP。SAP病情凶险,病死率高,病程中常伴发肝、肾等胰外器官的损害[4]。早期发现疾病重症趋势能够指导临床医师在一定的时间窗内采取更积极的干预措施,从而减轻不良后果[5]。虽然临床上有APACHEⅡ评分、Ranson评分、Balthazar CT分级[6]等多个客观评估标准和反映胰腺病理形态学改变的影像学标准,但几种评分系统的侧重点及测评时间不同,单独应用都不可避免存在片面性,因此需要一种简单、方便的方法对AP进行早期诊断及预后判断。
AP的发生、发展不完全取决于胰酶的消化,也与胰腺微循环障碍及炎症递质造成的多器官损害有关。研究表明胰腺血液循环障碍可以诱发AP和促使水肿性胰腺炎发展成为出血坏死性胰腺炎[7]。P选择素存在于血小板α颗粒和血管内皮细胞Weibel-Palade小体,为具有特异性的血小板活化标志物,是血小板活化和释放功能最直接、最敏感的指标。生理情况下P选择素表达很低,在凝血酶、白三烯、TNF-α等炎症因子及炎症递质的激活下,P选择素迅速在活化的内皮细胞和血小板表面表达,其作用是促进细胞之间的连接,在调节红细胞和内皮细胞的相互作用和血小板活化中起着重要的作用[8]。有研究结果[9]显示,MAP患者血小板仅轻度活化,而SAP患者血小板处于高度活化状态,血小板活化程度与AP患者病情轻重程度密切相关,提示监测血浆P选择素含量有助于对AP患者病情轻重的判别。
MRI是一种完全无创的影像学诊断方法,在此基础上,基于细胞与分子水平的MRI靶向成像已经成为分子影像学的研究热点[10]。利用单克隆抗体进行活体成像是MRI的重要方法之一,单克隆型MRI对比剂是将单克隆抗体与MRI顺磁性或超顺磁性粒子结合,新形成的螯合物既具有靶向特异性又具有MRI对比剂的作用,其不仅能够与某些器官、组织及病灶靶特异性结合,而且能够增强其MRI信号强度,从而达到靶向诊断的目的。Gd-DTPA是一种顺磁性T1WI阳性对比剂,具有亲水性、分子量小的特点,注入血管后迅速向周围组织间隙分布,由肾脏排泄,即使肾功能有损害,它也能经肾排除,是目前应用最广泛的MRI对比剂。Gd-DTPA不具有组织或器官的选择性,故如果要作为靶向的对比剂,即需要连接特异性的抗体。
本研究基于P选择素在AP中表达增高且在MAP与SAP中表达具有差异的特点,构建以P选择素为靶标的单克隆抗体磁共振靶向对比剂,并进行大鼠AP模型活体MRI观察。研究结果表明,靶向对比剂P-Gd-probe增强前后对照组、AEP组及ANP组胰腺组织的SNR的变化具有显著差异。因此,MRI时选用P选择素为靶标的单克隆抗体磁共振靶向对比剂可区分AEP与ANP,有助于AP病情严重程度的判断。
[1] Zhang H, Ling XL, Wu YY, et al. CD64 expression is increased in patients with severe acute pancreatitis: clinical significance[J]. Gut Liver, 2014, 8(4): 445-451. doi: 10.5009/gnl.2014.8.4.445.
[2] 汤海涛,刑雪.急性胰腺炎实验动物模型的建立方法及研究进展[J].中国现代普通外科进展,2014, 17(5): 412-415. DOI: 10.3969/ j.issn.1009-9905.2014.05.026.
[3] Schmidt J, Rattner DW, Lewandrowski K, et al. A better model of acute pancreatitis for evaluating therapy [J]. Ann Surg, 1992, 215(1):44-56. DOI:.org/10.1097/00000658-199201000-00007.
[4] Renzulli P, Jakob SM, Tauber M, et al. Severe acute pancreatitis: case-oriented discussion of interdisciplinary management [J]. Pancreatology, 2005, 5(2-3):145-156. DOI:.org/10.1159/000085266.
[5] Singh VK, Wu Bu, Bollen TL, et al. A prospective evaluation of the bedside index for severity in acute pancreatitis score in assessing mortality and intermediate markers of severity in acute pancreatitis [J]. Am J Gastroenterol, 2009, 104(40):966-971. DOI:.org/10.1038/ajg.2009.28.
[6] Balthazar EJ, Rainson DL, Megibow AJ, et al. Acute pancreatitis: value of CT in establishing prognosis [J]. Radiology, 1990, 174(2): 331-336. DOI:.org/10.1148/radiology.174.2.2296641.
[7] Sha H, Ma Q, Jha RK. Trypsin is the culprit of multi organ injury with severe acute pancreatitis [J]. Med Hypotheses, 2009, 72(2):180-182. DOI:.org/10.1016/j.mehy.2008.09.007.
[8] Kelly MH, Wang JM, Kubes P. Modulating leukocyte recruitment in inflammation [J]. J Allergy Clin Immunol, 2007, 120(1):3-10. DOI:.org/10.1016/j.jaci.2007.06.007.
[9] Hartman H, Abdulla A, Awla D, et al. P-selection mediates neutrophil rolling and recruitment in acute pancreatitis [J]. British Journal of Surgery, 2012, 99:246-255. DOI:.org/10.1002/bjs.7775.
[10] Chang D, Wang YC, Zhang SJ, et al. Visualizing myocardial inflammation in a rat model of type 4 cardiorenal syndrome by dual-modality molecular imaging[J]. Biomaterials. 2015, 68:67-76. DOI:.org/10.1016/j.biomaterials.2015.07.050.
(本文编辑:吕芳萍)
MRI molecular imaging targeting P selectin in severity grading of acute pancreatitis in rats
TianBing,LiuRi,ChenShiyue,LiuFang,JiaGuorong,LiJing,ChenLuguang,WangLi,LuJianping.
DepartmentofRadiology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
LuJianping,Email:cjr.lujianping@vip.163.com
Objective To investigate the application of MRI targeting contrast agent (P-Gd-Probe) for P selectin in evaluating the severity grades of acute pancreatitis(AP). Methods L-arginine solution (100mg/100kg) were intraperitoneally injected for 3 times once an hour to establish AP model in SD rats. Control group was injected with normal saline in a equal volume. All rats were divided into acute edematous pancreatitis (AEP) group (6 h and 12 h after model establishment)and acute necrotizing pancreatitis (ANP) group (24 h and 48 h after model establishment) based on the pathology. The rats were examined by T1WI plain and enhanced scanning at 6 h, 12 h, 24 h and 48 h after injection, and P-Gd-probe was as the enhanced contrast agent. The signal noise ratio (SNR) of the pancreas were measured before and after enhancement. Then the pancreas tissues were harvested for pathological examination and P selectin expression in pancreatic tissue was detected using immunohistochemical analysis. Results Inflammation was observed in pancreatic tissue at 6h after establishment, and became more serious as the modeling time extended. P selectin expression was increased as pancreatitis inflammation became more serious. The SNR of control group was stable before and after enhancement. The SNR before and after enhancement was 17.22±1.35 and 37.38±1.66 in AEP group,and 16.29±1.39 and 58.18±1.03 in ANP group. The SNR after enhancement was higher than that before enhancement, and the differences were significantly different (t=-49.59 and -86.09,P<0.001). Conclusions Monoclonal antibody MRI contrast agent targeting P selectin is helpful in evaluating the severity of AP.
Pancreatitis, acute necrotizing; P-selection; Targeted contrast agent; Magnetic resonance imaging
10.3760/cma.j.issn.1674-1935.2016.06.008
200433 上海,第二军医大学附属长海医院影像医学科(田冰、刘日、陈士跃、刘芳、李晶、陈录广、王莉、陆建平),核医学科(贾国荣)
陆建平,Email: cjr.lujianping@vip.163.com
国家自然科学基金(81300366)
2016-07-18)
