太芪培元颗粒体外抗HIV-1病毒活性研究
2016-12-21马秀兰马建萍张颖艾合买提阿不都热依木李静茹曾琳郑永唐杨柳萌马丽雪
马秀兰,马建萍,张颖,艾合买提·阿不都热依木,李静茹,曾琳,郑永唐,杨柳萌,马丽雪
1.新疆医科大学附属中医医院,国家中医临床研究基地艾滋病研究室,新疆 乌鲁木齐 830000;2.中国科学院昆明动物研究所分子免疫药理学实验室,云南 昆明 650223
太芪培元颗粒体外抗HIV-1病毒活性研究
马秀兰1,马建萍1,张颖1,艾合买提·阿不都热依木1,李静茹1,曾琳1,郑永唐2,杨柳萌2,马丽雪2
1.新疆医科大学附属中医医院,国家中医临床研究基地艾滋病研究室,新疆 乌鲁木齐 830000;2.中国科学院昆明动物研究所分子免疫药理学实验室,云南 昆明 650223
目的 评价太芪培元颗粒体外对HIV-1病毒的抑制活性。方法 MTT法检测太芪培元颗粒细胞毒性;通过细胞病变法检测太芪培元颗粒对HIV-1急性感染的抑制活性;应用HIV-1 p24抗原ELISA检测太芪培元颗粒对HIV-1急性感染细胞中病毒复制的抑制活性,并计算药物治疗指数。结果 太芪培元颗粒细胞毒性实验CC50为(3.761±0.370)mg/mL;合胞体抑制实验EC50为(0.454 5±0.204 6)mg/mL,治疗指数为5.84~12.97;p24抑制实验EC50为(0.56±0.27)mg/mL,治疗指数为5.30~8.74。结论 太芪培元颗粒体外抗HIV-1活性较弱。
太芪培元颗粒;人类免疫缺陷病毒;体外抗病毒活性;免疫机制
艾滋病又称获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS),是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)引起的传染性疾病,以严重损害全身免疫系统为特征。目前,抗HIV药物依然是AIDS防治的主要手段。太芪培元颗粒是新疆医科大学附属中医医院院内制剂,其主要功效为益气养阴、补益脾肾,临床主要用于治疗AIDS证属气阴两虚、肺肾不足者。经长期临床观察发现,该制剂可明显改善AIDS患者症状,提高其生存质量,对患者CD4+T淋巴细胞水平有提高作用[1-6]。本实验通过太芪培元颗粒体外抗HIV-1病毒活性的研究,为该药作用机制研究提供参考。
1 实验材料
1.1 细胞和病毒
人T淋巴细胞系C8166和HIV-1实验株HIV-1ⅢB,英国Medical Research Council AIDS Reagent Project惠赠。按常规方法制备HIV-1ⅢB,滴定并计算病毒半数组织培养感染剂量(TCID50)。将病毒贮存液进行分装,-70 ℃保存。实验过程中细胞和病毒按照常规方法进行冻存及复苏。
1.2 药物
太芪培元颗粒,新疆华世丹药业股份有限公司,批号130808。叠氮胸苷(3'-Azido-3'-deoxythymidine,AZT),Sigma公司。
1.3 主要试剂与仪器
HEPES、MTT、DMF、青霉素、硫酸链霉素、谷氨酰胺,Sigma公司;2-巯基乙醇,Bio-Rad公司;RPMI-1640和胎牛血清,Gibco公司。酶标仪ELX-800(BIO-TEK),微量移液器(Gilson),二级生物安全柜Froma ClassⅡ、CO2细胞培养箱(Thermo Fisher)。
2 实验方法
2.1 HIV-1感染性滴定
HIV-1ⅢB按Johnson&Byington所述方法改良进行滴定,按Reed&Muench方法计算病毒的TCID50[7]。
2.2 C8166细胞毒性实验
将100 μL C8166细胞悬液(4×105/mL)与不同浓度待测药物溶液混合,设3个重复孔。同时设置不含任何药物的对照孔,MTT法检测细胞毒性。于酶标仪570 nm波长处测定光密度(OD)值(参考波长630 nm),计算得到对50%细胞产生毒性时的化合物浓度(CC50),即对50%正常T淋巴细胞系C8166细胞产生毒性时的药物浓度。计量资料以±s表示,按Reed&Muench法计算CC50。
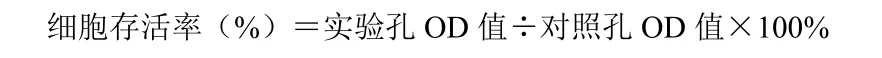
2.3 HIV-1ⅢB致细胞病变抑制实验
按100 μL/孔梯度倍比加稀释药物于96孔培养板,再将8×105/mL C8166细胞50 μL/孔接种至培养板,加50 μL HIV-1ⅢB稀释上清液,1300 TCID50/孔。设置重复孔3个,同时以不含任何药物正常细胞作为对照孔。阳性药物对照为AZT。37 ℃、5%CO2培养3 d,100倍倒置显微镜下对合胞体形成计数。50%有效浓度(EC50)为抑制合胞体形成50%时的药物浓度。计量资料以±s表示,按Reed&Muench法计算EC50。

2.4 HIV-1ⅢB急性感染C8166细胞中病毒复制抑制实验
将4×105个/mL C8166细胞与HIV-1ⅢB(MOI=0.04)、HIV-1RF(MOI=0.4)37 ℃感染2 h,1500 r/min离心,PBS洗涤3次,去除游离的病毒离子,取100 μL细胞接种至含100 μL不同稀释度待测化合物96孔板,37 ℃、5%CO2培养3 d。将培养上清液3000 r/min离心后收集,用终浓度0.5%Triton X-100裂解灭活。采用捕获p24抗原ELISA检测。2 μL/板抗鼠IgG-Fc抗体4 ℃铺板过夜;5%脱脂奶粉4 ℃封板过夜;加自制的鼠抗p24单抗100 μL/孔,置37 ℃温育60 min;加100 μL/孔裂解感染细胞培养上清,37 ℃、2 h;加100 μL/孔1∶100稀释的自制兔抗p24多抗,置37 ℃温育;加100 μL/孔1∶20 000稀释的羊抗兔IgG-HRP,置37 ℃温育;加OPD底物反应液。10 min后,2 mol/L硫酸终止反应。ELISA测定OD值,测定波长为490 nm,参考波长630 nm。计量资料以±s表示,计算p24抗原抑制率。
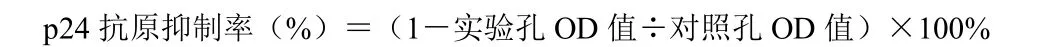
3 结果
3.1 太芪培元颗粒的细胞毒性作用
太芪培元颗粒组CC50值为(3.761±0.370)mg/mL,明显高于AZT组(1371.37 µg/mL)。结果见表1。
表1 2组不同浓度C8166细胞毒性比较(±s)
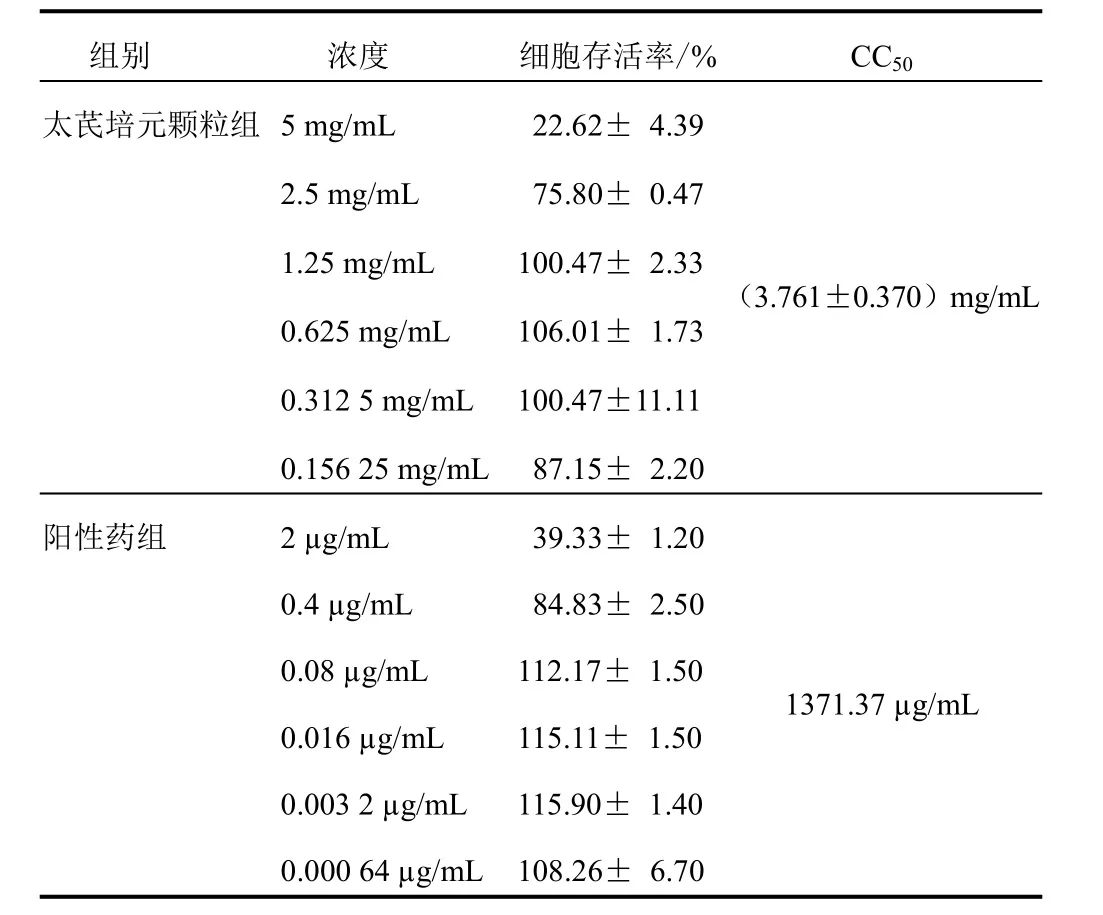
表1 2组不同浓度C8166细胞毒性比较(±s)
组别 浓度 细胞存活率/% CC50太芪培元颗粒组5 mg/mL 22.62± 4.39 2.5 mg/mL 75.80± 0.47 1.25 mg/mL 100.47± 2.33 0.625 mg/mL 106.01± 1.73 0.312 5 mg/mL 100.47±11.11 0.156 25 mg/mL 87.15± 2.20阳性药组 2 µg/mL 39.33± 1.20(3.761±0.370)mg/mL 0.4 µg/mL 84.83± 2.50 0.08 µg/mL 112.17± 1.50 0.016 µg/mL 115.11± 1.50 0.003 2 µg/mL 115.90± 1.40 0.000 64 µg/mL 108.26± 6.70 1371.37 µg/mL
3.2 太芪培元颗粒对HIV-1ⅢB诱导C8166细胞病变的抑制作用
太芪培元颗粒组EC50值为(0.454 5±0.204 6)mg/mL与AZT组(0.458 5±0.371 6)mg/mL比较差异不明显。结果见表2。
表2 2组不同浓度HIV-1ⅢB诱导C8166细胞病变抑制作用比较(±s)
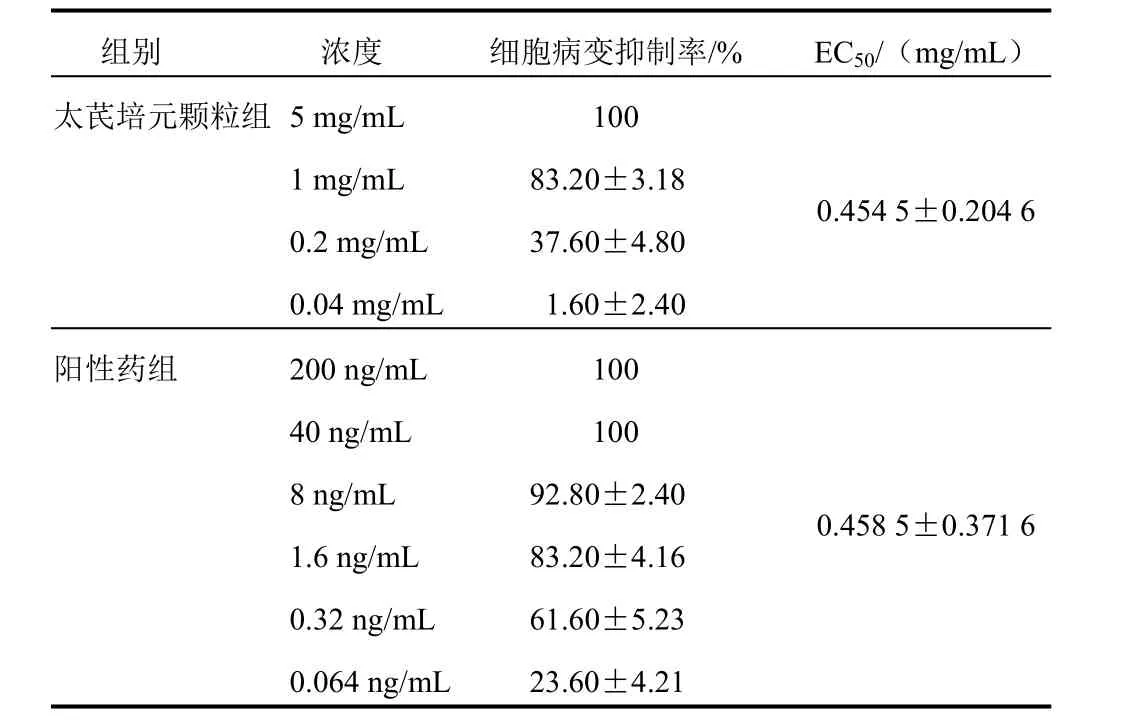
表2 2组不同浓度HIV-1ⅢB诱导C8166细胞病变抑制作用比较(±s)
组别 浓度 细胞病变抑制率/% EC50/(mg/mL)太芪培元颗粒组5 mg/mL 100 1 mg/mL 83.20±3.18 0.2 mg/mL 37.60±4.80 0.04 mg/mL 1.60±2.40阳性药组 200 ng/mL 100 0.454 5±0.204 6 40 ng/mL 100 8 ng/mL 92.80±2.40 1.6 ng/mL 83.20±4.16 0.32 ng/mL 61.60±5.23 0.064 ng/mL 23.60±4.21 0.458 5±0.371 6
3.3 太芪培元颗粒对HIV-1ⅢB感染C8166细胞p24表达的抑制作用
太芪培元颗粒对HIV-1复制表达p24抗原的抑制率随药物浓度的增加而升高,而对照药AZT的趋势与其相同,见表3。
表3 2组不同浓度HIV-1ⅢB感染C8166细胞后p24表达抑制作用比较(±s)

表3 2组不同浓度HIV-1ⅢB感染C8166细胞后p24表达抑制作用比较(±s)
组别 浓度 p24抗原抑制率/% EC50太芪培元颗粒组 5 mg/mL 100.44± 0.62 1 mg/mL 74.73±13.56 0.2 mg/mL 23.20±19.38 0.04 mg/mL 9.68±23.07 0.008 mg/mL 11.55±16.48 0.001 6 mg/mL -阳性药组 200 µg/mL 100.32± 0.39(0.56±0.27)mg/mL 40 µg/mL 100.10± 0.22 80 µg/mL 98.62± 1.66 1.6 µg/mL 91.88± 3.18 0.32 µg/mL 7.70±14.12 0.064µ g/mL -1.92±15.95(0.43±0.29)ng/mL
3.4 太芪培元颗粒对HIV-1活性治疗指数的影响
根据实验数据及公式(治疗指数=CC50÷EC50),太芪培元颗粒合胞体抑制实验治疗指数为5.84~12.97,对照药AZT治疗指数为1 902 038~6 996 785;p24抑制实验中,太芪培元颗粒治疗指数为5.30~8.74,对照药AZT治疗指数为1 904 680~9 795 500。表明太芪培元颗粒体外抗HIV-1病毒活性较弱。
4 讨论
太芪培元颗粒用于治疗气阴两虚、肺肾不足型AIDS,以太子参、生地黄为君药。太子参味甘、微苦,归脾、肺经,功效为补气健脾、生津润肺;生地黄味甘、苦,性寒,归心、肝、肾经,功效为清热凉血、养阴生津。本方重用二药,以达益气养阴之功效。该药在临床应用中可改善患者症状体征,提高免疫力,但本研究体外抗HIV-1病毒结果显示其抗HIV活性较弱。
近年来,中医药对AIDS的防治研究成果初显,但其作用机制的研究依然是难点,尤其是中药复方的作用机制研究。在药物体外抗HIV病毒研究中,筛选了大量中药及其有效成分均有体外抗病毒活性。大量临床研究表明,中药复方在AIDS治疗的各个领域均有所长,例如对带状疱疹的中西医结合治疗,对高效抗逆转录病毒治疗相关血脂异常的研究,对患者免疫重建的研究等,均取得较好的疗效[8-11]。与此同时,研究者也指出,中医药治疗的疗效可能是通过改善患者免疫功能低下等机制起到缓解临床症状的作用,但具体作用机制及如何确定中药介入的指征和时机等问题需要深入研究[12]。
目前研究中可见小样本观察提出中药治疗不仅可以提高CD4+水平,同时还可以降低病毒载量[13],但是缺乏大样本规范研究的数据。有学者提出运用中医免疫观,从防治、养生的多方面入手,调整HIV/AIDS患者的免疫平衡,发挥中医药在诊治过程中微观调节与宏观辨证相结合的优势,通过进行相应的免疫调理达到提高免疫能力的治疗目的[14]。
综上,中医药防治AIDS要找准切入点,不可盲目以抗病毒为目标,偏离了中医药临床疗效的实际意义。
[1] 马建萍,刘建国,马秀兰,等.中维医结合治疗艾滋病临床观察[J].辽宁中医杂志,2011,38(8):1584-1586.
[2] 张颖,马建萍,马秀兰,等.中药治疗HIV感染疗效观察[J].中华中医药学刊,2011,29(12):2628-2630.
[3] 曾琳,马建萍,艾合买提•阿不都热依木,等.平艾合剂1号方改善AIDS/HIV感染者生存质量的研究[J].新中医,2012,44(8):60-61.
[4] 李静茹,马建萍,马秀兰,等.平艾合剂I号方治疗HIV/AIDS患者107例临床研究[J].世界科学技术-中医药现代化,2013,15(5):877-880.
[5] 艾合买提•阿不都热依木,马秀兰,张颖,等.中药对20例HIV/AIDS患者免疫功能影响的临床观察[J].中华中医药学刊,2013,31(3):491-492.
[6] 艾合买提•阿不都热依木,马建萍,马秀兰,等.平艾合剂治疗41例HIV/AIDS患者临床观察[J].世界科学技术-中医药现代化,2013,15(7):1611-1615.
[7] 龙晶,侯晓敏,长高宏,等.八棱丝瓜蛋白1的体外抗HIV-1活性[J].中国天然药物,2008,6(5):372-376.
[8] 潘菊华,黄世敬,吴巍,等.艾滋病带状疱疹中西医结合临床研究探讨[J].世界科学技术-中医药现代化,2011,13(2):244-247.
[9] 倪量,王融冰,郭会军,等.中药治疗HAART相关血脂异常的临床研究[J].中国中药杂志,2015,38(15):2443-2447.
[10] 吴欣芳,王阶,李勇.免疫1号联合HAART对HIV/AIDS患者免疫功能重建的干预研究[J].中国中药杂志,2015,38(15):2453-2457.
[11] 刘震,王阶,林洪生,等.中药免疫2号方对艾滋病患者免疫重建的研究[J].中国中药杂志,2015,38(15):2458-2462.
[12] 岑玉文,谭行华,张坚生,等.中西医结合疗法改善艾滋病合并肺部感染患者中医症候的随机对照研究[J].中国中药杂志,2015,38(15):2448-2452.
[13] 梁杰,徐刚.中医药对HIV/AIDS患者的CD4+细胞及病毒载量影响的研究[J].云南中医药杂志,2012,33(10):30-31.
[14] 王丹妮,郭会军.从中医免疫观调节HIV/AIDS患者免疫平衡[J].中国中医基础医学杂志,2012,18(10):1140-1141.
Study on Vitro Anti-HIV-1 Activity of Taiqi Peiyuan Granules
MA Xiu-lan1, MA Jian-ping1,
ZHANG Ying1, ABUDUREYIMU Aihemaiti1, LI Jing-ru1, ZENG Lin1, ZHENG Yong-tang2, YANG Liu-meng2, MA Li-xue2(1. Traditional Chinese Medicine Hospital of Xinjiang Medical University, AIDS Lab of National Clinical Research Base of Traditional Chinese Medicine, Urumqi 830000, China; 2. Laboratory of Molecular Immunopharmacology, Kunming Institute of Zoology, Chinese Academy of Sciences, Kunming 650223, China)
Objective To evaluate the vitro anti-HIV-1 activity of Taiqi Peiyuan Granules. Methods MTT was used to detect cytotoxicity of Taiqi Peiyuan Granules; cytopathy method was used to detect the inhibitory activity of Taiqi Peiyuan Granules on acute infection of HIV-1; HIV-1 p24 antigen ELISA detection was used to detect inhibitory activity of Taiqi Peiyuan Granules for virus replication of HIV-1 acute infection cells, and count the medical therapeutic indexes. Results CC50of Taiqi Peiyuan Granules in cytotoxicity test was 3.761±0.370 mg/mL; the EC50of inhibition syncytial test was 0.454 5±0.204 6 mg/mL; the therapeutic index was between 5.84 and 12.97; p24 of Taiqi Peiyuan Granules in inhibition experiments was 0.56±0.27 mg/mL, and the therapeutic index was between 5.30 and 8.74. Conclusion Anti-HIV-1 activity of Taiqi Peiyuan Granules is relatively weak.
Taiqi Peiyuan Granules; human immunodeficiency virus; vitro antiviral activity; immunologic mechanism
10.3969/j.issn.1005-5304.2016.04.016
R285.5
A
1005-5304(2016)04-0061-03
2015-05-08;编辑:华强)
国家科技重大专项(2014ZX10005003);新疆医科大学科研创新基金项目(XJC201181)
马建萍,E-mail:majianpingm@163.com
