TmAFP抗冻蛋白与冰面结合的稳定因素的研究
2016-12-21李鹏,王岩
李 鹏,王 岩
(石河子大学 医学院,新疆 石河子 832000)
TmAFP抗冻蛋白与冰面结合的稳定因素的研究
李 鹏,王 岩*
(石河子大学 医学院,新疆 石河子 832000)
抗冻蛋白能特异的结合到冰晶的表面,抑制冰晶的生长和聚合,从而保护有机体不受大冰晶的伤害。基于蛋白质与冰晶之间的结构匹配关系和识别行为的研究,抗冻蛋白与冰面结合的相对稳定,依靠抗冻蛋白的特定氨基酸序列组成的空间结构恰好与冰面的空间结构能良好的相互匹配,并且又通过氢键作用,使抗冻蛋白与冰面结合得更加稳定,从而使蛋白质与冰面结合不易脱落。
昆虫;抗冻蛋白;空间结构匹配;氢键;稳定
0 引言
抗冻蛋白(antifreeze protein,AFP)是Devries发现南极硬骨鱼体内有抗冷冻物质时提出的概念[1],抗冻蛋白的另一名字是热滞蛋白,是有机体为适应过冷环境,在体内生成的一类蛋白质[2]。抗冻蛋白具有很高的抗冻活性,即使在较低的浓度下也会产生高效的抗冻活性,比较乙二醇、NaCl等化学抗冻试剂时,生物抗冻物质的抗冻活性要高出20~500倍,从而使有机体具有更高的防冻性能[3]。抗冻蛋白可用于长期保存细胞[4]。现今已在细菌、植物体、昆虫、鱼类等体内发现众多种抗冻蛋白[5,6]。抗冻蛋白的作用原理基本是相同的[7-10],抗冻蛋白与冰面结合,来抑制冰晶的生长速率和冰晶的重聚合。
昆虫抗冻蛋白主要包括甲虫(Dendroides canadensis AFP,DcAFP)、云杉卷夜蛾(Choristoneura Fumiferana AFP,CfAFP)和黄粉虫(Tenebrio molitor AFP,TmAFP)。昆虫抗冻蛋白的分子量大都在7~20kDa之间,昆虫抗冻蛋白可以把水的凝结点降低5℃左右,而鱼类抗冻蛋白只能把水凝结点降低1.4℃左右,昆虫抗冻蛋白比大多数已发现的其它抗冻蛋白的活性都要强[11]。
冰晶中存在很多种不同结构的冰面[12]。不同的冰面有不同的晶格参数和氧原子排列方式,不同的生物能产生不同的抗冻蛋白来适应不同的冰面结构,不同的冰面也就会被不同的抗冻蛋白所结合[13,14]。
黄粉甲抗冻蛋白(TmAFP),每个单体的分子量为8.4kDa。它是一种富含半胱氨酸和苏氨酸的净百个氨基酸残基的抗冻蛋白[15]。它是具有右手平行β螺旋结构的小分子蛋白质,并且蛋白质分子中还有多个二硫键。它的β螺旋结构是由12个连续重复的氨基酸残基(TCTXSXXCXXAX)[16](C-半胱氨酸,T-苏氨酸,S-丝氨酸,A-丙氨酸)组成7股螺旋折叠呈柱状,在螺旋的一侧,由三个保守氨基酸残基T-C-T形成一个非常有规则的平坦β层面。在TCT面上,T羟基上的氧原子都指向环外,而C的残基指向环内构成8个二硫键,维持着分子的形态(见图1a)。
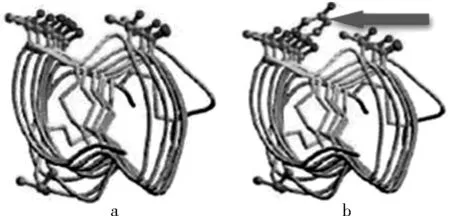
(a)螺旋内的黄颜色的短线就是二硫键,该图也表示在没改变氨基酸的初始结构(绿红色表示苏氨酸);(b)表示一个苏氨酸突变为酪氨酸(红色箭头指的是酪氨酸)图1 氨基酸结构Fig.1 The structure of amino acid
1 结合面的测定
科学家们假设了TmAFP的TCT面是与冰面的结合面,并且采用定位突变技术[17]。将TmAFP的β片层面中的T(苏氨酸)变为Y(酪氨酸)(见图1b)或将T(苏氨酸)变为L(亮氨酸)结果表明:将T(苏氨酸)变为Y(酪氨酸),抗冻蛋白活性降低约90%。说明Y(酪氨酸)大的空间结构阻碍了冰面与其他残基的结合从而使蛋白质的活性降低,而将T(苏氨酸)变为Y(酪氨酸),抗冻蛋白活性只降低了25%。由此说明TmAFP抗冻活性与β片层中的氨基酸残基的体积大小有关[18,19]。
通过诱变,证实了科学家的假设:TmAFP的TCT面就是蛋白质与冰相互作用的结合面。
2 TmAFP与冰面的相互作用
2.1 TmAFP与冰面相互识别
TmAFP的结合面与冰面的结合面有很高的相似性,所以二者能很好的相互识别,这一点在“冰蚀”实验中完美的揭示了这一观点[20],这个观点也已被科学家们认可。此图(见图2a)是TmAFP与其结合的冰面模型,冰{0100}冰面为TmAFP的冰最佳约束面,构建抗冻蛋白与冰的作用体制[12]。
冰晶中的氧原子是被固定了的,所以跟踪蛋白质苏氨酸羟基上的氧原子之间的距离变化,可以反映出蛋白质与冰晶之间的结构匹配关系和识别行为[21]。
先对TmAFP的同一侧相邻两股螺旋的苏氨酸上的氧原子间的距离进行跟踪分析,位于同一侧相邻的第4股和第5股螺旋上苏氨酸羟基上的氧原子O453-O600(氧原子后的数字表示氧原子的位置如图2b,下同)之间的距离进行跟踪分析,从500Ps动态过程中的变化情况来看,O453-O600之间的平均距离基本保持在4.55Å左右(见图3a);同样分析O283-O453之间的平均距离在4.39Å左右;O600-O766的平均距离为4.76Å。由于氧原子之间的距离是一个动态变化的过程,所以相邻两个氧原子之间的距离与冰晶延a轴方向上两氧原子之间的距离基本维持在4.5Å,说明TmAFP在冰面a轴方向上具有良好的匹配性。
在对TmAFP同一个环上的苏氨酸羟基氧原子之间的距离变化作分析,以第5股螺旋相邻两个苏氨酸羟基氧原子O600-O624之间的距离为例(见图3b),从500Ps动态过程中的变化情况来看,O600-O624之间的平均距离在7.44Å左右,同理O283-O307,O453-O477,O766-O790的平均距离分别为6.69Å,7.07Å,7.13Å。由于氧原子之间的距离是一个动态变化的过程,所以相邻两个氧原子之间的距离与冰晶延c轴方向上两氧原子之间的距离基本维持在7.35Å。以上说明TmAFP的结合面在冰面c轴方向上有很好的匹配能力。

图2 (a)左侧显示的是TmAFP在冰面的结合类型,右侧是描述空间的坐标系;(b)标示了苏氨酸残基上的氧原子的位置Fig.2 (a) Left image shows the ice TmAFP binding type, the right is to describe the spatial coordinate system; (b) Icon showing the location of the oxygen atoms of the threonine residues
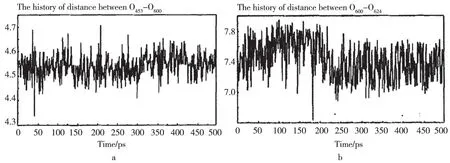
图3 (a)O453-O600之间的距离随时间的变化图;(b)O600-O624之间的距离随时间的变化图。横轴表示时间(ps),纵轴表示距离(Å)Fig.3 The distance between the O453-O600 at any time (a); The distance between the O600-O624 with the time changed. The horizontal axis represents time (ps), the vertical axis represents the distance (Å)
进一步跟踪TCT面上4个氨基酸羟基上的氧原子O453-O600-O624-O477组成的平面发现,这4个氧原子组成的平面始终在0°左右震荡,说明在水溶液中TmAFP的苏氨酸残基基本保持在同一平面上。通过跟踪监测对TmAFP与冰面的识别特性分析,TmAFP的TCT面与冰面形成了很好的结构匹配,这样的匹配有利于它们的相互作用(氢键,范德华力)更加稳定进行。
2.2 抗冻蛋白与冰面结合产生相互作用力[22]
Devries提出了“氢键匹配”模型[23]。在这个特异的冰晶结合棱面被认证后[14],发现这种“氢键匹配”模型也可适用于一些其它的冰晶表面上[23]。
Knight是“晶格占有”模型的提出者[17],他是在Devries的基础上演变来的,AFPs中的部分基团“占有”了冰晶表面上的位置,从而与临近的水分子能形成更多的氧键,可以使得氢键的数量大大增加,继而使AFPs与冰面之间形成了不可逆结合,变得更加稳定。
TmAFP的TCT面与冰面发生相互作用时,苏氨酸的残基会与冰面形成氢键来稳固蛋白质与冰面的结合。由于苏氨酸的残基上有氢(-H),羟基(-OH),还有甲基(-CH3),3种不同的基团,所以就会有3种不同大小的键或力。
2.2.1 强氢键
由TmAFP接合面的苏氨酸残基的羟基上的氧原子与冰面中的水分子的氢原子形成氢键或苏氨酸残基的羟基上的氢原子与冰面中的水分子的氧原子形成氢键,像这一类的结合都属于强氢键。按照重叠电荷密度值的大小,结合蛋白与冰面作用的几何构型,将满足图4A的结合方式找出。TmAFP与冰面的接合面上有9个苏氨酸,所以就可以形成9个强的氢键,并算得强氢键电荷密度占整个体系的36.16%。
2.2.2 弱氢键
由TmAFP接合面中的苏氨酸残基的-CH上的氢与冰面中的水分子上的氧原子结合生成的氢键(见图4B)。C478与冰晶上的氧Oice之间的距离为2.89Å,键角为167°,说明C478-H485…Oice满足形成氢键的条件。但是重叠电荷密度数值较小(0.003),不足以形成强氢键,因此把这类氢键称为弱氢键。计算得弱氢键电荷密度占整个体系的32.29%。
2.2.3 范德华力
由除了强弱氢键以外的相互作用称为范德华作用力。苏氨酸残基上的甲基上的碳原子与冰面上水分子上的氧原子相互作用为范德华力(见图4C)。计算得相互作用力占整个体系的31.55%。
TmAFP与冰面相互作用方式中,氢键占据主导作用。强弱氢键对整个体系相互作用贡献了68.45%,而范德华力作用占31.55%。相互作用力的产生使冰面与TmAFP的结合变得稳定。
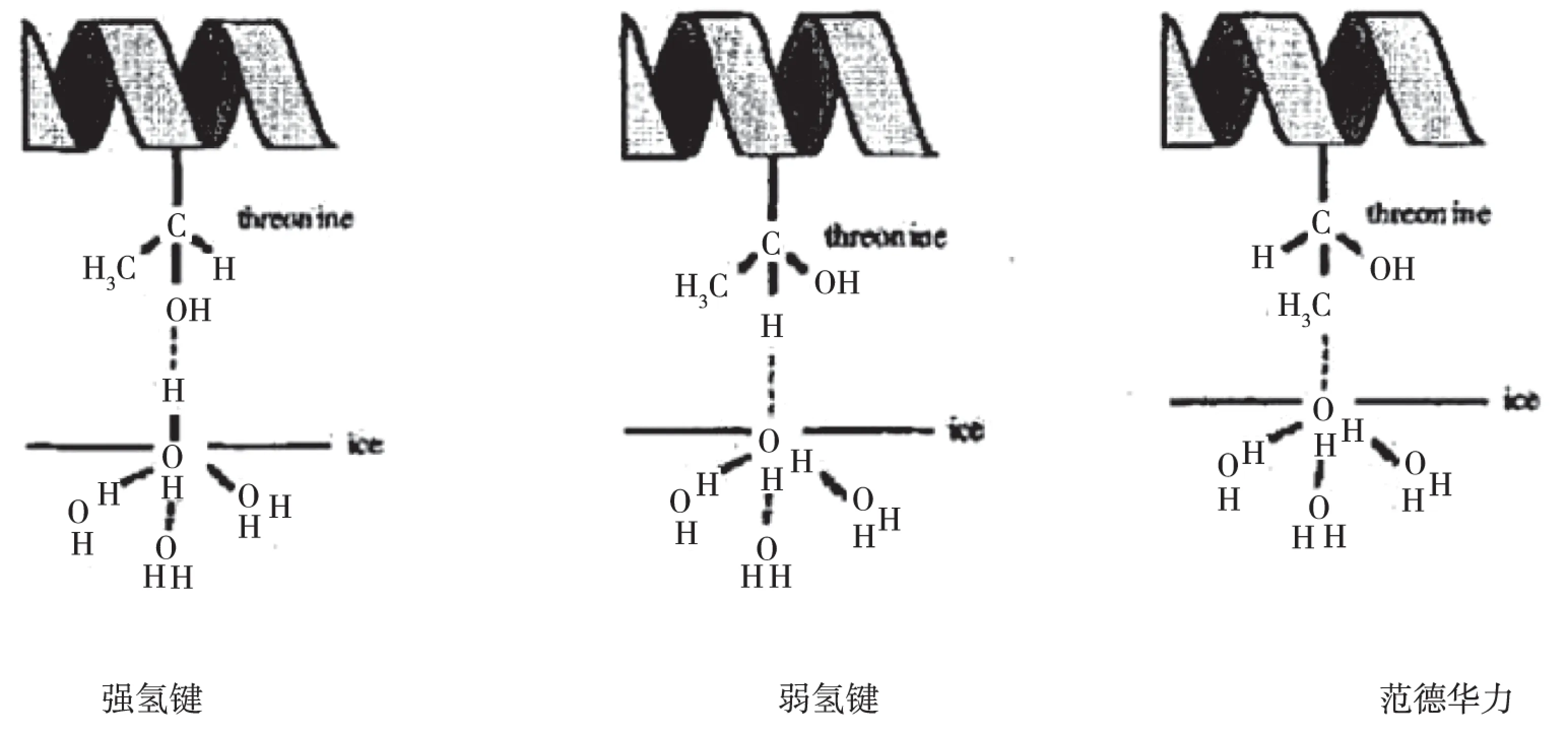
图4 抗冻蛋白与冰面的相互作用类型A图表示苏氨酸上的残基中的羟基与冰面上的水分子的氢原子所生成的强氢键,记作C-O…Hice;B图表示苏氨酸的残基中的氢原子与冰面上的水分子的氧原子所生成的弱氢键,记作C-H…Oice;C图表示苏氨酸的残基中的甲基与冰面中的水分子氧原子产生的范德华力,记作C-C…Oice。Fig.4 The interaction diagram type between antifreeze proteins and ice indicatesA for antifreeze proteins and ice indicates strong hydrogen bonding hydrogen atoms of water molecules on threonine residues of the hydroxyl group with the ice generated, referred to as C-O…Hice. B for the representation of an oxygen atom of the water molecule threonine residues of hydrogen atoms with the ice generated by weak hydrogen bonds, referred to as C-H…Oice. C for the diagram showing threonine residues methyl Van der Waals forces with ice water molecule oxygen atoms produced, referred to as C-C…Oice.
3 总结
抗冻蛋白(TmAFP)分子在与冰面的相互作用过程中,TmAFP的与冰面有很高的匹配性,空间的匹配为TmAFP能与冰面形成氢键打下一个稳定的基础,氢键的形成使TmAFP的结合更加稳定,这些都可以提高TmAFP与冰面结合的稳定性,有效的提高了抗冻活性。
[1] DEVRIES A L,KOMATSU S K,FEENEY R E.Chemical and physical properties of freezing point-depressing glycoprotein from Antarctic fishes[J].J Biol Chem,1970,245(11):2901-2908.
[2] DENG C,CHENG C H C,YE H,et al.Evolution of an antifreeze protein by neofunctionalization under escape from adaptive conflict[J].Proceedings of the National Academy of Sciences,2010,107(50):21593-21598.
[3] 张晖,张艳杰, 王立, 等. 抗冻蛋白在食品工业中的应用现状及前景[J].食品与生物技术学报,2012,31(9):897-903.
[4] ZACHARIASSEN K E,KRISTIANSEN E.Ice nucleation and antinucleation in nature[J].Cryobiology,2000,41(4):257-279.
[5] GILBERT J A,HILL P J,DODD C E,et al.Demonstration of antifreeze protein activity in Antarctic lake bacteria[J].Microbiology,2004,150(Pt 1):171-80.
[6] GRAETHER S P,SYKES B D.Cold survival in freeze-intolerant insects:the structure and function of beta-helical antifreeze proteins[J].European Journal of Biochemistry,2004,271(16):3285-3296.
[7] KRISTIANSEN E,ZACHARIASSEN K E.The mechanism by which fish antifreeze proteins cause thermal hysteresis[J].Cryobiology,2005,51(3):262-280.
[8] YEH Y,FEENEY R E.Antifreeze Proteins: Structures and Mechanisms of Function[J].Chemical Reviews,1996,96(2):601-617.
[9] EWART K V,LIN Q,HEW C L.Structure, function and evolution of antifreeze proteins[J].Cellular & Molecular Life Sciences Cmls,1999,55(2):271-283.
[10]谢文静.第一类鱼抗冻蛋白对冰晶生长界面层结构的影响[D/OL].呼和浩特:内蒙古大学,2011:66-76.(2012-06-23)[2016-05-25].http://xueshu.baidu.com/s?wd=paperuri%3A%28df160024ce8affef3e060a955c4c2528%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_vurl=http%3A%2F%2Fwww.docin.com%2Fp-195710557.html&ie=utf-8&sc_us=9380004131514190095.
[11]YANG Z,ZHOU Y,LIU K, et al.Computational Study on the Function of Water within a β -Helix Antifreeze Protein Dimer and in the Process of Ice-Protein Binding[J].Biophysical Journal,2003,85(4):60.
[12]BRENT WATHEN,MICHAEL KUIPER,VIRGINIA WALKER A,et al.A new model for simulating 3-D crystal growth and its application to the study of antifreeze proteins[J].Journal of the American Chemical Society,2003,125(3):729-737.
[13]HOBBS P V.Ice physics[J].Oxford Clarendon Press,1974,1(11):71-72.
[14]GRAETHER S P,KUIPER M J,GAGNE S M,et al.Beta-helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect[J].Nature,2000,406(6793):325-328.
[15]LIOU Y C,THIBAULT P,WALKER V K,et al.A complex family of highly heterogeneous and internally repetitive hyperactive antifreeze proteins from the beetle Tenebrio molitor[J].Biochemistry,1999,38(35):11415-11424.
[16]ÖKKES ATICI,NALBANTOGLU B.Antifreeze proteins in higher plants[J].Phytochemistry,2003,64(7):1187-1196.
[17]KNIGHT C A,DRIGGERS E,Al D V.Adsorption to ice of fish antifreeze glycopeptides 7 and X[J].Biophysical Journal,1993,64(1):252-259.
[18]DANIEL D,TYSHENKO M G,KUIPER M J,et al.Structure-function relationships in spruce budworm antifreeze protein revealed by isoform diversity[J].European Journal of Biochemistry,2000,267(19):6082-6088.
[19]MARSHALL C B,DALEY M E,GRAHAM L A,et al.Identification of the ice-binding face of antifreeze protein from Tenebrio molitor[J].Febs Letters,2002,529(2-3):261-267.
[20]HEW C L,WANG N C,JOSHI S,et al.Multiple genes provide the basis for antifreeze protein diversity and dosage in the ocean pout,Macrozoarces americanus[J].Journal of Biological Chemistry,1988,263(24):12049-12055.
[21]MADURA J D,BARAN K,WIERZBICKI A.Molecular recognition and binding of thermal hysteresis proteins to ice[J].Journal of Molecular Recognition,2000,13(2):101-113.
[22]刘恺.抗冻蛋白与冰晶相互作用本质的理论研究[D/OL].北京:中国科学院理化技术研究所,2005:16-18. (2005-12-01)[2016-05-22]. http://xueshu.baidu.com/s?wd=paperuri%3A%28849d8f6d84207db8e96fc7ed598b9afc%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_vurl=http%3A%2F%2Fd.wanfangdata.com.cn%2FThesis%2FY796887&ie=utf-8&sc_us=8082405857330202996.
[23]DEVRIES A L.Antifreeze peptides and glycopeptides in cold-water fishes[J].Annual Review of Physiology,1983,45(45):245-260.
Study on the stable factors of TmAFP antifreeze proteins combined with ice bound
LI Peng,WANG Yan*
(School of Medicine,Shihezi University,Shihezi,Xinjiang 832000,China)
Antifreeze proteins can specifically bind to the surface of ice crystals to inhibit the growth of ice crystals and inhibit polymerization of ice to protect the organism against large ice damage. On the basis of the study of the structure matching relation and recognition behavior between protein and ice crystals, antifreeze proteins combined with ice is relatively stable. The spatial structure of a particular amino acid sequence consisting of antifreeze protein can match exactly with the spatial structure of the ice, and then through hydrogen, the antifreeze protein combined with the ice surface can be more stable. So, the protein and won’t easily fall off the ice surface.
insects; antifreeze protein; the complementary spatial structure; hydrogen bonding; stability
1004—5570(2016)06-0088-05
2016-06-17
李 鹏(1997-),男,研究方向:蛋白质结构,E-mail:1343559619@qq.com.
*通讯作者:王 岩(1984-),男,博士,副教授,研究方向:昆虫分子生物学,E-mail:2272772511@qq.com.
TS201.2
A
