核酸适配子探针对转移性大肠癌细胞的多靶点成像及其靶标的定量分析
2016-12-21李婉明
李婉明, 方 瑾
(中国医科大学卫生部细胞生物学重点实验室, 医学细胞生物学教育部重点实验室,细胞生物学教研室, 沈阳 110122)
核酸适配子探针对转移性大肠癌细胞的多靶点成像及其靶标的定量分析
李婉明, 方 瑾
(中国医科大学卫生部细胞生物学重点实验室, 医学细胞生物学教育部重点实验室,细胞生物学教研室, 沈阳 110122)
利用核酸适配子对肿瘤细胞的高亲和力靶向识别功能以及量子点的高荧光发射强度和光稳定性等特性, 制备了识别不同靶点的核酸适配子探针, 将其联合使用实现了对肿瘤细胞的多靶点成像及其靶标的定量分析. 使用通过Cell-SELEX 技术筛选得到的可特异性识别转移性大肠癌细胞系LoVo的7个核酸适配子, 分别与量子点QD605偶联制备分子探针. 基于流式细胞术的竞争实验结果表明, 7个探针可特异性识别靶细胞的不同靶点, 相互之间无识别干扰. 对靶细胞的荧光成像表明, 与单一探针相比, 多个探针联合使用可明显提高细胞表面的荧光信号强度, 且阳性细胞检出率明显增多, 显示出更高的检测灵敏度. 使用流式细胞术及荧光成像定量方法分析了7个探针对不同转移特性大肠癌细胞系的识别能力, 结果表明, 多个探针联合使用可有效评价大肠癌细胞的转移潜能. 本研究证实通过多个核酸适配子探针的联合使用可有效提高对靶细胞识别的灵敏度和准确性, 为核酸适配子的广泛应用及大肠癌的靶向诊断提供了新的思路和手段.
核酸适配子; 转移性大肠癌; 多靶点; 量子点; 靶向成像
目前, 肿瘤已成为威胁人类健康的重大疾病, 肿瘤侵袭和转移是病人的主要死亡原因. 大肠癌是常见的消化道恶性肿瘤, 就诊时50%以上的患者已发生转移, 预后较差[1]. 转移性大肠癌临床早期诊断面临的主要瓶颈是分子探针的匮乏[2]. 核酸适配子(Aptamer)的发现, 尤其是对癌细胞和肿瘤标记物具有特异性结合作用的核酸适配子, 为设计更高效、 更灵敏的探针提供了有效的解决方法[3~5].
核酸适配子于1990年被首次报道[6~8], 是经SELEX(Systematic evolution of ligands by exponential enrichment) 技术筛选得到的短的寡核苷酸序列(DNA或RNA序列), 其自身能折叠成特定的空间结构并与靶标特异性结合, 常被称为“分子抗体”. 由于其具有靶分子广泛、 特异性和亲和力强、 稳定性好、 易于合成和修饰标记等一系列的优良性能, 在实际应用方面远远优于蛋白类抗体[9~11]. Cell-SELEX[12]筛选方法是以活细胞为靶标进行体外筛选, 所获得的核酸适配子能特异性识别细胞表面的某些标记物, 进而与细胞发生特异性结合. 此外, 消减策略的引入显著提高了获得高特异性核酸适配子的可能, 使得基于核酸适配子的分子探针能够更有效地区分正常细胞与肿瘤细胞之间或肿瘤细胞之间的分子差异, 为准确进行临床诊断提供高效的分子工具[13].
肿瘤转移是一个多基因、 多步骤和多个信号通路调节的复杂过程, 而且肿瘤组织/细胞通常具有异质性[14]. 基于单个分子标记物的检测通常容易造成假阳性或假阴性的检测结果, 导致无法准确、 灵敏地诊断出早期的癌症疾病. 多种肿瘤标记物同时检测将有效提高早期癌症疾病检测的准确性. 采用Cell-SELEX筛选技术可以实现一次性获得一组与靶细胞结合的核酸适配子[15], 利用这些核酸适配子对同一靶细胞进行同时检测可以实现多靶点应用, 而蛋白类抗体则难以实现同时针对同一靶细胞的检测. Cao等[16]联合使用5个识别细胞表面不同靶点的适配子对黄色葡萄球菌进行鉴定, 获得了比单个适配子鉴定时更高的检出率.
前文[15]利用消减Cell-SELEX技术针对转移性大肠癌细胞系LoVo进行筛选, 获得一组7个可与转移性大肠癌LoVo细胞高亲和性结合的核酸适配子(W1, W3, W6, W9, W14, W17和W22). 研究结果表明, 7个核酸适配子均不与正常细胞结合, 但可与具有侵袭转移倾向的不同组织来源的肿瘤细胞特异性结合, 表现出转移性肿瘤细胞的结合特异性. 由于这些核酸适配子可结合同一靶肿瘤细胞, 本文探讨了这些核酸适配子是否存在对转移性大肠癌细胞进行多靶点应用的潜力, 以期为核酸适配子的广泛应用及转移性大肠癌的成像和定量分析提供新的方法和手段.
1 实验部分
1.1 试剂与仪器
链霉亲和素标记的量子点605(QD-SA, 武汉珈源量子点技术有限公司); 核酸适配子序列和原文库(Library)序列(上海生工生物公司, 序列如表1所示); DMEM培养基和RPMI1640培养基(Gibco公司); 胎牛血清(FBS公司)和胰蛋白酶(HyClone 公司); 牛血清白蛋白(BSA, Biosharp公司); 鲱鱼精DNA(Sigma公司); 其它试剂均为国产分析纯; 实验用水为电阻率18.2 MΩ·cm的纯净水.
FACScalibur型流式细胞仪(美国BD公司); 荧光显微镜(日本Olympus公司).

Table 1 DNA sequences used in experiments
1.2 细胞培养
对LoVo, HCT116和SW620细胞用含10% 胎牛血清的RPMI1640培养基, 对CL187和HEK293细胞用含10%胎牛血清的DMEM培养基, 在37 ℃, 5% CO2培养箱中培养至对数生长期后进行实验.
1.3 核酸适配子的前处理
将合成的核酸适配子溶于结合缓冲液(PBS+10%BSA+1%鲱鱼精DNA)中, 于95 ℃加热变性5 min, 然后置于冰上10 min, 于-20 ℃保存待用.
1.4 流式细胞术检测核酸适配子与细胞的特异性结合
取对数生长期大肠癌细胞或正常细胞, 用无酶细胞消化液消化细胞, 吹打成单细胞悬液. 加入FITC标记的各核酸适配子或7个核酸适配子混合液, 终浓度为250 nmol/L, 与细胞于4 ℃共孵育30 min; 以1000 r/min转速离心5 min, 弃去上层清液; 加入0.3 mL PBS重悬细胞, 采用流式细胞术检测每组细胞的荧光信号强度, 利用FlowJo软件计算荧光信号强度值.
1.5 流式细胞术分析不同核酸适配子对靶细胞结合的相互竞争
取对数生长期LoVo细胞, 用无酶细胞消化液消化细胞, 吹打成单细胞悬液. 分别加入各个核酸适配子作为抑制剂, 终浓度为2500 nmol/L, 与细胞于4 ℃孵育30 min; 以1000 r/min转速离心5 min, 弃去上层清液; 然后加入FITC标记的核酸适配子, 终浓度为250 nmol/L, 与细胞于4 ℃共孵育30 min, 以1000 r/min转速离心5 min, 弃去上层清液; 加入0.3 mL PBS重悬细胞, 利用流式细胞术检测每组细胞的荧光信号强度.
1.6 荧光显微镜观察核酸适配子的特异性成像
取对数生长期LoVo细胞接种于六孔板中(内置盖玻片), 过夜培养. 用PBS缓冲液洗涤细胞2次, 加入生物素标记核酸适配子, 终浓度为250 nmol/L, 与细胞于4 ℃共孵育30 min. 再用PBS缓冲液洗涤细胞, 加入QD-SA(1∶200稀释)于室温反应20 min; 用PBS缓冲液洗涤细胞, 用荧光显微镜观察细胞的荧光信号, 并利用显微图像分析系统对每个图像的荧光信号进行半定量分析.
1.7 统计学分析
采用SPSS15.0统计软件进行分析, 结果用x±s表示, 采用单因素方差分析和T检验方法进行统计, 以P<0.05为有显著性差异.
2 结果与讨论
2.1 核酸适配子与LoVo细胞的特异性结合
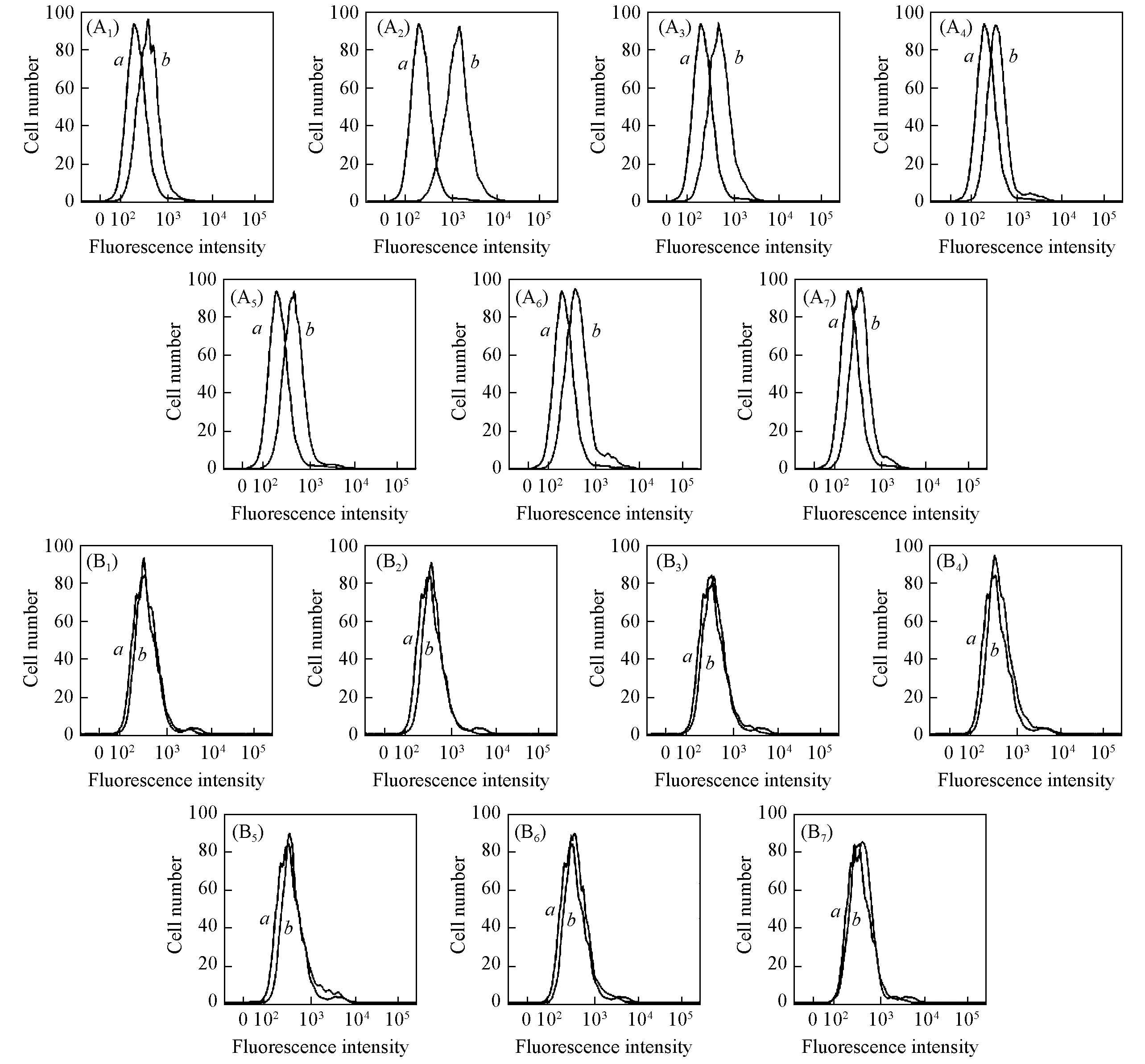
Fig.1 Flow cytometry for the binding of FITC-labeled aptamers to LoVo(A1—A7) and HCT-8(B1—B7) cells a. Library; b. aptamer. (A1, B1) W1; (A2, B2) W3; (A3, B3) W6; (A4, B4) W9; (A5, B5) W14; (A6, B6) W17; (A7, B7) W22.
首先合成5′端FITC标记的核酸适配子(W1, W3, W6, W9, W14, W17和W22), 将它们和Library分别与细胞LoVo和HCT-8共孵育, 然后测定结合荧光强度. 通常, 与Library相比, 如果荧光信号的平均值超过10%即可认为是与靶细胞结合. 流式细胞术结果(图1)显示, 与Library(曲线a)相比, 7个核酸适配子与靶细胞LoVo共孵育后荧光峰(曲线b)发生不同程度的右移, 表明核酸适配子均与LoVo相结合. 同时, 各核酸适配子与消减细胞HCT-8的结合峰与Library峰基本重合, 未发生明显的右移, 表明7个核酸适配子与HCT-8未发生结合. 进一步对检测到的荧光强度进行定量分析, 结果(图2)显示, 核酸适配子与LoVo细胞均有不同程度的结合, 而与HCT-8细胞均不结合, 表明这7个核酸适配子均具有良好的靶细胞特异性.
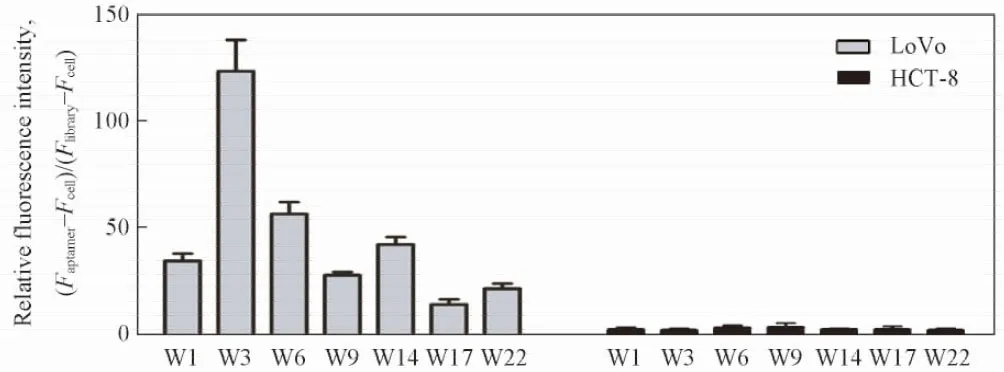
Fig.2 Quantitative results based on flow cytometry Data were presented as the mean±standard deviation.
2.2 核酸适配子具有不同的细胞表面识别靶点
肿瘤组织/细胞具有高度异质性, 且肿瘤转移是涉及多个阶段、 多个步骤的复杂过程, 其中包括多个信号通路及多种分子的改变[17]. 基于单一标志物的检测和分析会导致假阴性判断, 而多个标志物联合检测可有效避免单一指标造成的遗漏, 有助于转移性肿瘤的正确诊断[16,18].
为了探讨所得核酸适配子能否进行多靶点应用, 利用流式细胞术进行了7个核酸适配子与靶细胞的结合竞争实验. 先分别向细胞中加入未荧光标记的各核酸适配子, 与细胞孵育30 min后, 再分别加入FITC标记的各核酸适配子. 结果(图3)显示, 以FITC-W1为例, 当加入W1作为竞争抑制剂时, FITC-W1与LoVo细胞的结合荧光峰与Library组相比无明显移动, 表明由于存在竞争抑制, FITC-W1与LoVo细胞的结合率降低. 相反, 当加入其它核酸适配子(W3, W6, W9, W14, W17, W22)进行竞争时, FITC-W1与LoVo细胞的结合荧光峰与Library组相比发生明显右移, 表明核酸适配子W1与靶细胞的结合未受到影响, 说明其它核酸适配子与W1均不存在竞争抑制. 其它流式细胞术分析结果进一步证实了这一推测, 即7个核酸适配子与靶细胞的结合之间均没有竞争关系, 不存在相互干扰, 表明这些核酸适配子结合的细胞表面靶分子不同, 提示其具有潜在的多靶点应用功能.
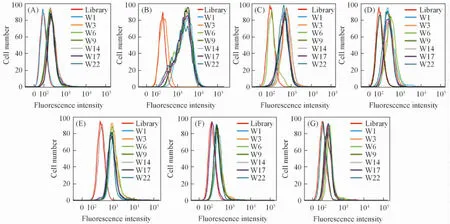
Fig.3 Mutual effects of aptamers on the recognition of targets by competitive experiment
2.3 多个核酸适配子联合使用对靶细胞LoVo进行多靶点成像
核酸适配子作为肿瘤识别分子结合荧光染料能够对肿瘤细胞进行靶向成像, 但是由于有机染料存在信号强度低、 灵敏度有限以及光稳定性不足等缺点, 在临床应用中受到了极大的限制. 随着纳米技术的发展, 核酸适配子结合纳米材料量子点用于肿瘤的靶向成像备受关注, 相对于传统的有机荧光染料, 量子点具有很好的光化学稳定和宽而连续的激发光谱, 更有利于成像检测[19].

Fig.4 Fluorescence(A1—A9) and optical(B1—B9) images of LoVo cells stained by aptamers-QD

Fig.5 Quantitative results based on QD-cells
实验筛选得到的7个核酸适配子结合的靶分子不同, 然而它们又可识别共同的靶细胞, 因此可利用结合不同靶分子的多个核酸适配子进行靶肿瘤细胞的多靶点检测. 首先, 选取靶细胞LoVo联合量子点进行多靶点成像, 荧光显微镜结果(图4)显示, 采用7个核酸适配子混合并偶联QD后对靶细胞LoVo进行同时成像时, 可获得更强的荧光信号强度, 而且视野下几乎所有靶细胞的细胞表面均被染成红色荧光; 相反, 采用单个核酸适配子对靶细胞进行成像时, 荧光强度明显较低且部分靶细胞未被成像. 如核酸适配子W17和W22组, 视野下仅有个别靶细胞被染成红色, 绝大部分细胞未被成像; 即使是7个核酸适配子中结合能力最强的W3组, 虽然视野下绝大部分靶细胞已经被染成红色, 但是与混合核酸适配子组相比, 荧光信号明显较弱. 分别对核酸适配子染色的细胞数和荧光信号强度进行了统计分析, 结果(图5)显示, 与W3组相比, 多个核酸适配子联合成像时的阳性细胞检出率和荧光强度明显提高, 差异有统计学意义(P<0.05), 此结果提示同时运用多个核酸适配子对肿瘤细胞进行成像可以增加成像的灵敏度, 以及提高阳性检出率.
2.4 核酸适配子联合使用定量评价肿瘤细胞转移潜能
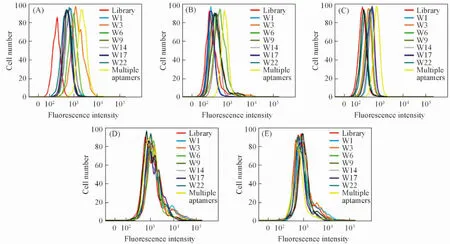
Fig.6 Flow cytometry assays of the binding of aptamers with cells

Fig.7 Relative fluorescence intensities of aptamers-cells
为了验证多个核酸适配子联合检测能够更准确地评价肿瘤细胞的转移潜能, 进一步选择其它大肠癌细胞系进行了检测. 流式细胞术(图6)结果显示, 多个核酸适配子联合检测时, 具有转移侵袭潜能的大肠癌细胞系LoVo, SW620和HCT116的荧光结合峰与单个核酸适配子相比明显发生右移, 而没有侵袭转移潜能的大肠癌细胞系CL187和正常人胚肾细胞系HEK293的荧光结合峰未发生改变, 提示核酸适配子联合使用仍然体现了很好的转移性肿瘤细胞的特异性. 统计学分析结果(图7)显示, 核酸适配子联合使用与使用单个核酸适配子相比, 对肿瘤细胞检测灵敏度上的差异具有统计学意义(P<0.05). 此外, 当核酸适配子联合使用检测时, 荧光强度顺序为LoVo>SW620>HCT116>CL187, 与已报道[20]的大肠癌细胞系本身的转移侵袭潜能一致, 此结果提示多个生物标志物同时检测可更全面地反映肿瘤细胞的转移侵袭潜能.
3 结 论
以多个结合不同靶分子的具有转移性大肠癌特异性的核酸适配子作为靶向识别分子, 连接QDs形成特异性成像探针, 通过多个核酸适配子探针的联合使用可有效提高对靶细胞识别的灵敏度和准确性, 为核酸适配子的广泛应用及大肠癌的靶向诊断提供了新的研究思路和手段.
[1] Siegel R., Naishadham D., Jemal A.,CACancerJ.Clin., 2013, 63(1), 11—13
[2] Lech G., Slotwinski R., Slodkowki M., Krasnodebski I. W.,WorldJ.Gastroenterol., 2016, 22(5), 1745—1755
[3] Li X., AN Y., Jin J., Zhu Z., Hao L., Liu L., Shi Y., Fan D., Ji T., Yang C. J.,Anal.Chem., 2015, 87(9), 4941—4948
[4] Chen M. Y., Chen Z. Z., Wang W., Zhu L., Tang H. W., Pang D. W.,ChineseJ.Anal.Chem., 2014, 42(3), 326—331(陈敏艳, 陈泽忠, 王维, 朱链, 唐宏武, 庞代文. 分析化学, 2014, 42(3), 326—331)
[5] Liu Z. C., Zhao L. J., Liu L. P., Zhang Y. F., Wang N. N., Chen Y., Wang X. H.,Chem.J.ChineseUniversities, 2015, 36(4), 638—645(刘中成, 赵丽健, 刘利鹏, 张艳芬, 王南南, 陈瑶, 王向欢. 高等学校化学学报, 2015, 36(4), 638—645)
[6] Ellington A. D., Szostak J. W.,Nature, 1990, 346(6287), 818—822
[7] Robertson D. L., Joyce G. F.,Nature, 1990, 344(6265), 467—468
[8] Tuerk C., Gold L.,Science, 1990, 249(4968), 505—510
[9] Li W. M., Chen H., Yu M., Fang J.,Anat.Rec.(Hoboken), 2014, 297(12), 2280—2288
[10] Wang S., Kong H., Gong X., Zhang S., Zhang X.,Anal.Chem., 2014, 86(16), 8261—8266
[11] Fang X., Tan W.,Acc.Chem.Res., 2010, 43(1), 48—57
[12] Tang J. L., Shi H., He X. X., Wang K. M., Li D., Yan L. A., Lei Y. L., Liu J. B.,Chem.J.ChineseUniversities, 2014, 35(10), 2093—2099(汤进录, 石慧, 何晓晓, 王柯敏, 李朵, 颜律安, 雷艳丽, 刘剑波. 高等学校化学学报, 2014, 35(10), 2093—2099)
[13] Zhao Z., Xu L., Shi X., Tan W., Fang X., Shangguan D.,Analyst, 2009, 134(9), 1808—1814
[14] Molloy T., van’t Veer L.,CurrentOpin.Genet.Dev., 2008, 18(1), 35—41
[15] Li W. M., Bing T., Wei J. Y., Chen Z. Z., Shangguan D. H., Fang J.,Biomaterials, 2014, 35(25), 6998—7007
[16] Cao X., Li S., Chen L., Xu H., Huang Y., Li J., Liu N., Cao W., Zhu Y., Shen B., Shao N.,NucleicAcidsRes., 2009, 37(14), 4621—4628
[17] Hoon D. S., Wang Y., Dale P. S., Conrad A. J., Schmid P., Garrison D., Kuo C., Foshag L. J., Nizze A. J., Morton D. L.,J.Clin.Oncol., 1995, 13(8), 2109—2116
[18] Chen G., Mclver C. M., Texler M., Lloyd J. M., Rieger N., Hewett P. J., Sen Wan D., Hardingham J. E.,Dis.ColonRectum, 2004, 47(5), 679—686
[19] Kang W. J., Chae J. R., Cho Y. L., Lee Y. L., Kim S.,Small, 2009, 5(22), 2519—2522
[20] Zheng H., Ma R., Wang Q., Zhang P., Li D., Wang Q., Wang J., Li H., Liu H., Wang Z.,Oncotarget, 2015, 6(29), 27805—27815
(Ed.: N, K)
Quantitative Multi-targeted Imaging of Metastatic Colorectal Cancer Cells Using Aptamer Probes in Combination†
† Supported by the National Natural Science Foundation of China(Nos.21375149, 81502703) and the Foundation of Shenyang Municipal Science & Technology Bureau, China(No.F13-220-9-29).
LI Wanming, FANG Jin*
(DepartmentofCellBiology,KeyLaboratoryofCellBiology,MinistryofPublicHealth,andKeyLaboratoryofMedicalCellBiology,MinistryofEducation,ChinaMedicalUniversity,Shenyang110122,China)
We developed seven aptamer probes towards metastatic colorectal cancer cells by conjugating the aptamers to quantum dots(QD605) for multi-targeted cancer cell imaging. The results of competitive assay showed that the seven aptamers could recognize their individual targets on the same cell without any mutual interference, revealing that they may be applied in combination for multi-target cancer cell imaging. The results of quantitative assay of the fluorescence images showed that compared with a single probe, the seven probes in combination can significantly increase the fluorescent intensity on the cell surface, and the detection rate of positive cells increased significantly, resulting in a higher detection sensitivity. Further, the probes were used to detect several colorectal cancer cell lines using flow cytometry. The results showed that seven probes used in combination could effectively evaluate colorectal cancer metastatic potential. This study demonstrated that usage of multiple aptamer probes in combination could effectively improve the sensitivity and accuracy of target imaging which provides a novel approach for targeted diagnosis of colorectal cancer.
Aptamer; Metastatic colorectal cancer; Multi-target; Quantum dot; Molecular imaging
2016-04-18.
日期: 2016-06-15.
国家自然科学基金(批准号: 21375149, 81502703)和沈阳市科技局资助项目(批准号: F13-220-9-29)资助.
10.7503/cjcu20160254
O657.3
A
联系人简介: 方 瑾, 女, 博士, 教授, 博士生导师, 主要从事肿瘤标志物的筛选及鉴定方面的研究. E-mail: jfang61@netease.com
