梨麦消食咀嚼片安全性的毒理学研究*
2016-12-21兰燕宇郑鲁平李勇军王永林
兰燕宇, 伍 萍, 宋 菲, 郑鲁平, 李勇军, 王永林**
(1.贵州医科大学 药学院, 贵州 贵阳 550004; 2.贵州华南理工生物工程有限公司, 贵州 贵阳 550001)
梨麦消食咀嚼片安全性的毒理学研究*
兰燕宇1, 伍 萍1, 宋 菲1, 郑鲁平2, 李勇军1, 王永林1**
(1.贵州医科大学 药学院, 贵州 贵阳 550004; 2.贵州华南理工生物工程有限公司, 贵州 贵阳 550001)
目的: 探讨梨麦消食咀嚼片的安全性。方法:采用小鼠急性经口毒性试验、遗传毒性试验(Ames试验、小鼠骨髓细胞微核试验和小鼠精子畸形试验)和大鼠30 d喂养试验,评价梨麦消食咀嚼片的安全性。结果:雌、雄性小鼠急性经口最小中毒量(MTD)>15 g/kg,根据急性毒性剂量分级标准,梨麦消食咀嚼片属无毒级;3项遗传毒性试验均为阴性,30 d 喂养试验未见大鼠的生长发育、血液学指标、生化指标、脏器/体质量比值比及组织病理学有异常变化。结论:毒性试验未见梨麦消食咀嚼片产生明显毒副作用。
毒理学; 小鼠; 急性毒性试验; 遗传毒性试验; 梨麦消食咀嚼片
消化不良是消化系统疾病的一种常见症状,分为器质性和功能性消化不良,病因复杂,对于发病率较高的功能性消化不良的病理机制尚未阐明,亦无特异治疗手段[1-2]。目前,以中医为主要措施治疗功能性消化不良已取得较好的效果,其治疗后复发率较西药低[3-6]。梨麦消食咀嚼片配方是以贵州民间用于治疗和预防消化不良及积食饱胀的山楂、刺梨、麦芽为主,辅以陈皮、莱菔子和茯苓,具有补脾益肺、消积化食的作用,能促进小肠蠕动及排便,无明显毒副作用。本实验室通过加辅料糊精、柠檬酸、蔗糖,将该方制备成服用方便的咀嚼片,拟开发成健胃消食的相关营养保健品。为了确保食用安全,对梨麦消食咀嚼片的毒性进行了研究,为该产品后期进一步的开发奠定基础,报道如下。
1 材料与方法
1.1 材料
1.1.1 样品 梨麦消食咀嚼片,1 g/片,成人推荐剂量9 g/d。因人体推荐量大,由贵州医科大学提供去辅料的棕色粉末作为本次实验受试样品,该受试样品的成人推荐剂量为3.87 g/d(去辅料,成人体质量按60 kg计)。
1.1.2 实验动物 清洁级ICR小鼠由扬州大学比较医学中心提供,生产许可证号SCXK(苏)2012-0004,用于急性毒性实验、微核试验及精子畸形试验小鼠的合格证编号分别为0025888、0025744、0026877;SPF级SD大鼠由上海西普尔-必凯实验动物有限公司提供,生产许可证号SCXK(沪)2013-0016,合格证编号2008001637865。
1.1.3 主要试剂及仪器 鼠伤寒沙门菌突变型菌株TA97、TA98、TA100、TA102购于复旦大学公共卫生学院,S9(大鼠肝匀浆经 9 000 r/min 低温离心得到的上清液,其主要有效成分为混合功能氧化酶系统,具有活化氧分子和与底物结合的双重功能,是许多体外实验常用的体外代谢活化系统)购于复旦大学公共卫生学院。主要仪器有JJ-100电子天平、AL104型电子天平、JA-2003电子天平、DT-1000电子天平,SX-700高压灭菌器、OLYMPUS显微镜、电热恒温培养箱、BAKER SG-603生物安全柜及KYC-100C型恒温摇床。
1.2 方法
1.2.1 急性经口毒性试验 选雌雄小鼠各 10 只,体质量18.0~22.0 g,实验前禁食16 h、不禁水。设计最大耐受剂量为15 g/kg,受试样品用无菌水配制,最大配制浓度为0.75 g/mL,按20 mL/kg 1次灌胃给样,灌胃后4 h给食,连续观察14 d,记录小鼠中毒表现及死亡情况,判定小鼠对梨麦消食咀嚼片的最大耐受量(MTD),按毒性分级标准评价其急性毒性。1.2.2 遗传毒性试验
1.2.2.1 Ames试验 受试药物设5 000、1 000、200、40和8 μg/皿5个剂量组,用2,4,7-三硝基芴铜、甲基磺酸甲酯、2-氨基芴、1,8-二羟基蒽醌作为阳性对照,同时设未处理对照组和溶剂对照组(5%DMSO),以S9混合液作为体外代谢活化系统。鼠伤寒沙门菌突变型菌株TA97、TA98、TA100、TA102采用掺入法分别进行加入和不加入S9的回复诱变试验[7]。37 ℃培养48 h,计数每皿回变菌落数。如果受试样品组的回变菌落数为阴性对照组回变菌落数的2倍以上,并具有剂量-反应关系则为Ames试验阳性。在相同条件下整个试验重复做一次。
1.2.2.2 小鼠骨髓细胞微核试验 选ICR小鼠50只(25~30 g),随机分成5组,雌雄各半。设梨麦消食咀嚼片10、5、2.5 g/kg 3个剂量组、阴性对照组(无菌水)、阳性对照组(环磷酰胺,40 mg/kg腹腔注射)。灌胃给药2次(灌胃容量20 mL/kg),间隔24 h,于末次给药后6 h处死动物,取胸骨常规制片、镜检,每鼠计数1 000个骨髓嗜多染红细胞(PCE),观察含微核的PCE数并计算微核发生率,以千分率计。结果采用Poisson分布U检验进行统计处理。每鼠计数200个PCE,同时计数观察到的成熟红细胞(RBC)数,并计算(PCE/RBC)比值。
1.2.2.3 小鼠精子畸形试验 选雄性ICR小鼠25只,体质量25~35 g,设梨麦消食咀嚼片10、5、2.5 g/kg 3个剂量组,同时设阴性对照组(无菌水)和阳性对照组(腹腔注射环磷酰胺40 mg/kg),每组5只小鼠。每天灌胃给药1次,灌胃容量20 mL/kg,连续5 d。于首次给药后的第35天处死小鼠,取两侧附睾精子滤液常规制片、镜检。每鼠计数1 000个结构完整的精子,计算精子畸形率(以百分率计)。
1.2.3 30 d喂养实验 取SD大鼠80只,雌雄各半,雌性动物初始体质量为69~83 g;雄性动物初始体质量为75~87 g。将实验动物随机分为对照组、低剂量组、中剂量组、高剂量组4组,每组20只,雌、雄各半。3个剂量组分别给予1.94、4.19、6.45 g/(kg·d)梨麦消食咀嚼片受试样品(相当于人体推荐量的30、65和100倍),另设一个空白对照组0 g/(kg·d)。高、中、低剂量组梨麦消食咀嚼片在饲料中的含量分别为6.45%,4.19%及1.94%,对照组给予基础饲料。连续喂养30 d。每天观察大鼠的一般状况、有无中毒表现和死亡情况;每周称大鼠体质量和饲料重量,计算增重、进食量和食物利用率;实验结束对大鼠白细胞、红细胞计数、血红蛋白水平及白细胞分类计数等血液学指标,肝、肾功能、血脂、血糖等血液生化指标,及肝、肾、性腺等脏器系数进行测定,并行病理学检查。
1.3 统计学方法

2 结果
2.1 急性经口毒性试验
经口给予梨麦消食咀嚼片后小鼠未见明显中毒表现,对小鼠体质量增长无明显影响,观察期内无小鼠死亡,雌、雄性小鼠经口急性MTD>15 g/kg,根据急性毒性剂量分级标准 ,该样品属无毒级。
2.2 Ames试验
梨麦消食咀嚼片各剂量组的TA97、TA98、TA100和TA102试验菌株,在加与不加S9时,回变菌落数均未超过阴性对照组的2倍,亦无剂量-反应关系,表明梨麦消食咀嚼片Ames实验结果为阴性。
2.3 小鼠骨髓细胞微核试验
各剂量梨麦消食咀嚼片组的微核率与阴性对照组相比,差异无统计学意义(P>0.05),而阳性对照组则显著高于阴性对照组,差异有统计学意义(P<0.01)。未见梨麦消食咀嚼片对小鼠骨髓嗜多染红细胞微核形成及PCE/RBC比值有影响。
2.4 小鼠精子畸形试验
给药35 d处死小鼠,各剂量梨麦消食咀嚼片组精液中精子畸形率与阴性对照组比较差异无统计学意义 (P>0.05),而阳性对照组小鼠精子畸形率较阴性对照组升高(P<0.01)。梨麦消食咀嚼片对小鼠精子畸形率无明显影响。见表1及表2。
表1 梨麦消食咀嚼片对小鼠精子畸形率的影响
Tab.1 The effect of Limai Xiaoshi chewable tablet on mice sperm shape abnormality rate
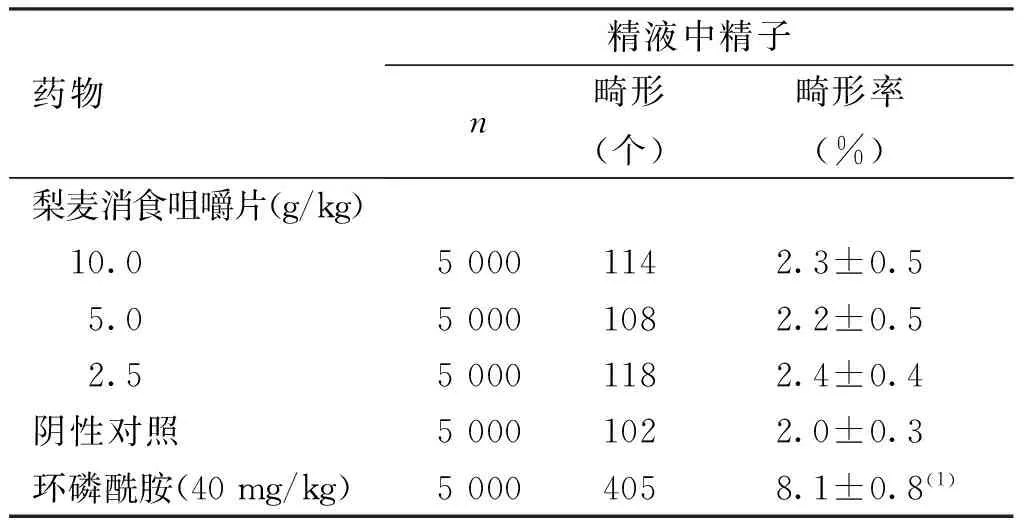
(1)与阴性对照组比较,P<0.01
表2 梨麦消食咀嚼片对小鼠精子畸形类型及比例的影响
Tab.2 The effect of Limai Xiaoshi chewable tablet on mice sperm shape abnormality type and ratio

药物精子畸形类型(n,%)无钩无定形胖头香蕉形双头双尾尾折叠总畸形数(n)梨麦消食咀嚼片(g/kg) 10.021(18.4)89(78.1)3(2.6)0(0.0)0(0.0)0(0.0)1(0.9)114 5.020(18.5)84(77.8)3(2.8)1(0.9)0(0.0)0(0.0)0(0.0)108 2.523(19.5)89(75.4)4(3.4)1(0.8)0(0.0)0(0.0)1(0.8)118阴性对照17(16.7)80(78.4)3(2.9)1(1.0)0(0.0)0(0.0)1(1.0)102环磷酰胺(40mg/kg)75(18.5)270(66.7)21(5.2)13(3.2)6(1.5)6(1.5)14(3.5)405
2.5 30 d喂养实验
按人体推荐剂量3.87 g/d的100倍、65倍、30倍所设定的剂量分别为6.45、4.19、1.94 g/(kg·d),将受试样品掺入饲料中喂养大鼠,摄食量按体质量的10%折算,喂养30 d后,根据大鼠平均体质量和平均摄食量,计算实际剂量雌性为7.59、4.98、2.24 g/(kg·d),相当于人体推荐量的118倍、77倍、35倍;雄性为7.20、4.67、2.20g/(kg·d),相当于人体推荐量的112倍、72倍、34倍。各剂量组大鼠喂养过程中进食、活动均正常,生长发育良好,无中毒症状及死亡。实验期间,各剂量梨麦消食咀嚼片组大鼠体质量、增重量、进食量及食物利用率与阴性对照比较,差异均无统计学意义(P>0.05),表明梨麦消食咀嚼片对大鼠的体质量增长和食物利用率无明显影响,见表3。各剂量组的血液指标和生化指标与阴性对照组比较,差异均无统计学意义(P>0.05),表明受试物对大鼠的血液学指标和血清生化指标无明显影响,见表4、表5和表6。受试物对大鼠的肝、脾、肾、睾丸和卵巢的脏器/体质量比值与阴性对照组比较,差异均无统计学意义(P>0.05),表明受试物对大鼠的脏器/体质量比值无影响,见表7和表8。解剖检查未发现各脏器异常,病理组织学检查,肝、脾、肾、睾丸和卵巢等未见有病理学改变,表明该受试物对大鼠的脏器无损害作用。
Tab.3 The effect of Limai Xiaoshi chewable tablet on growth of body weight and food utilization rate
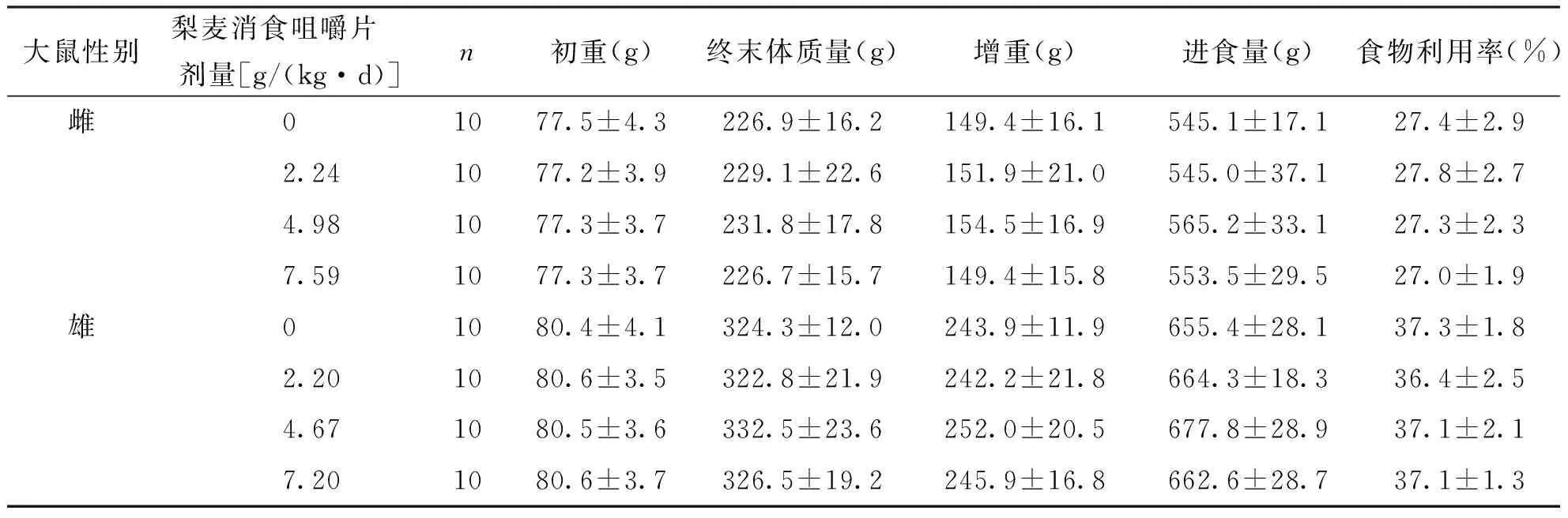
大鼠性别梨麦消食咀嚼片 剂量[g/(kg·d)]n初重(g)终末体质量(g)增重(g)进食量(g)食物利用率(%)雌01077.5±4.3226.9±16.2149.4±16.1545.1±17.127.4±2.92.241077.2±3.9229.1±22.6151.9±21.0545.0±37.127.8±2.74.981077.3±3.7231.8±17.8154.5±16.9565.2±33.127.3±2.37.591077.3±3.7226.7±15.7149.4±15.8553.5±29.527.0±1.9雄01080.4±4.1324.3±12.0243.9±11.9655.4±28.137.3±1.82.201080.6±3.5322.8±21.9242.2±21.8664.3±18.336.4±2.54.671080.5±3.6332.5±23.6252.0±20.5677.8±28.937.1±2.17.201080.6±3.7326.5±19.2245.9±16.8662.6±28.737.1±1.3
Tab.4 The effect of Limai Xiaoshi chewable tablet on rat hematologic indexes
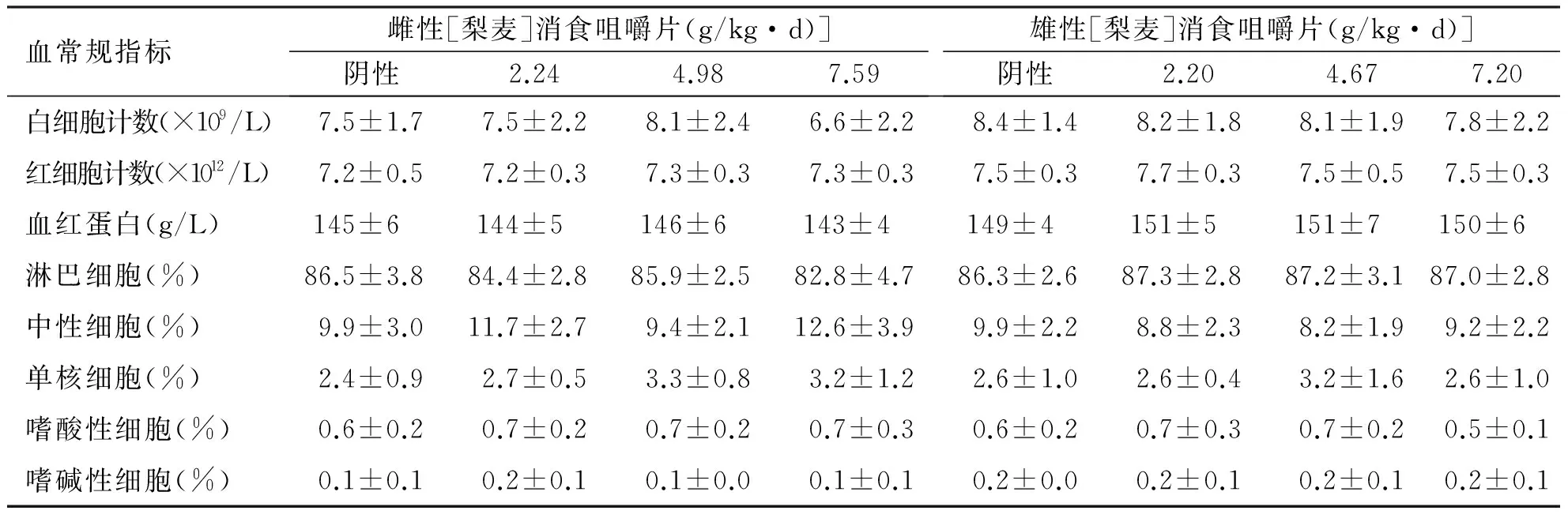
血常规指标雌性[梨麦]消食咀嚼片(g/kg·d)]阴性2.244.987.59雄性[梨麦]消食咀嚼片(g/kg·d)]阴性2.204.677.20白细胞计数(×109/L)7.5±1.77.5±2.28.1±2.46.6±2.28.4±1.48.2±1.88.1±1.97.8±2.2红细胞计数(×1012/L)7.2±0.57.2±0.37.3±0.37.3±0.37.5±0.37.7±0.37.5±0.57.5±0.3血红蛋白(g/L)145±6 144±5 146±6 143±4 149±4 151±5 151±7 150±6 淋巴细胞(%)86.5±3.8 84.4±2.8 85.9±2.5 82.8±4.7 86.3±2.6 87.3±2.8 87.2±3.1 87.0±2.8 中性细胞(%)9.9±3.011.7±2.7 9.4±2.112.6±3.9 9.9±2.28.8±2.38.2±1.99.2±2.2单核细胞(%)2.4±0.92.7±0.53.3±0.83.2±1.22.6±1.02.6±0.43.2±1.62.6±1.0嗜酸性细胞(%)0.6±0.20.7±0.20.7±0.20.7±0.30.6±0.20.7±0.30.7±0.20.5±0.1嗜碱性细胞(%)0.1±0.10.2±0.10.1±0.00.1±0.10.2±0.00.2±0.10.2±0.10.2±0.1
Tab.5 The effect of Limai Xiaoshi chewable tablet on rat liver function

(1)与0 g/kg·bw/d组比较,P<0.05
表6 梨麦消食咀嚼片对大鼠肾功能、血脂和血糖的影响
Tab.6 The effect of Limai Xiaoshi chewable tablet on rat renal function, blood fat and blood sugar
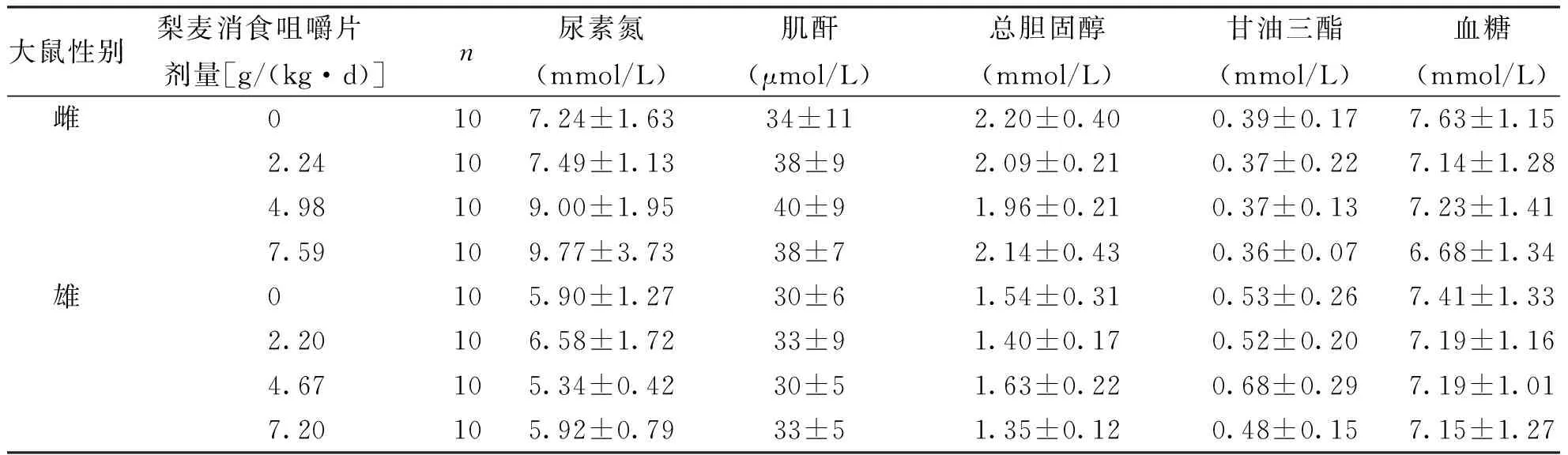
大鼠性别梨麦消食咀嚼片 剂量[g/(kg·d)]n尿素氮(mmol/L)肌酐(μmol/L)总胆固醇(mmol/L)甘油三酯(mmol/L)血糖(mmol/L)雌0107.24±1.6334±112.20±0.400.39±0.177.63±1.152.24107.49±1.1338±92.09±0.210.37±0.227.14±1.284.98109.00±1.9540±91.96±0.210.37±0.137.23±1.417.59109.77±3.7338±72.14±0.430.36±0.076.68±1.34雄0105.90±1.2730±61.54±0.310.53±0.267.41±1.332.20106.58±1.7233±91.40±0.170.52±0.207.19±1.164.67105.34±0.4230±51.63±0.220.68±0.297.19±1.017.20105.92±0.7933±51.35±0.120.48±0.157.15±1.27
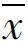
Tab.7 The effect of Limai Xiaoshi chewable tablet on rat's liver and spleen weight
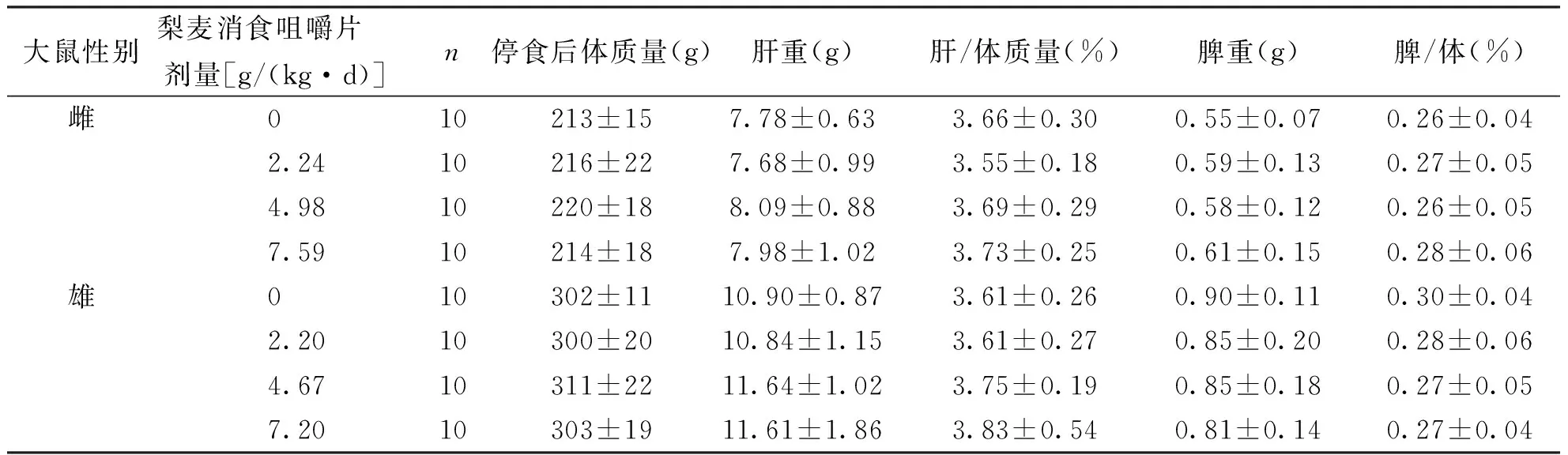
大鼠性别梨麦消食咀嚼片 剂量[g/(kg·d)]n停食后体质量(g)肝重(g)肝/体质量(%)脾重(g)脾/体(%)雌010213±157.78±0.633.66±0.300.55±0.070.26±0.042.2410216±227.68±0.993.55±0.180.59±0.130.27±0.054.9810220±188.09±0.883.69±0.290.58±0.120.26±0.057.5910214±187.98±1.023.73±0.250.61±0.150.28±0.06雄010302±1110.90±0.873.61±0.260.90±0.110.30±0.042.2010300±2010.84±1.153.61±0.270.85±0.200.28±0.064.6710311±2211.64±1.023.75±0.190.85±0.180.27±0.057.2010303±1911.61±1.863.83±0.540.81±0.140.27±0.04
Tab.8 The effect of Limai Xiaoshi chewable tablet on rat's renal and sex gland weight
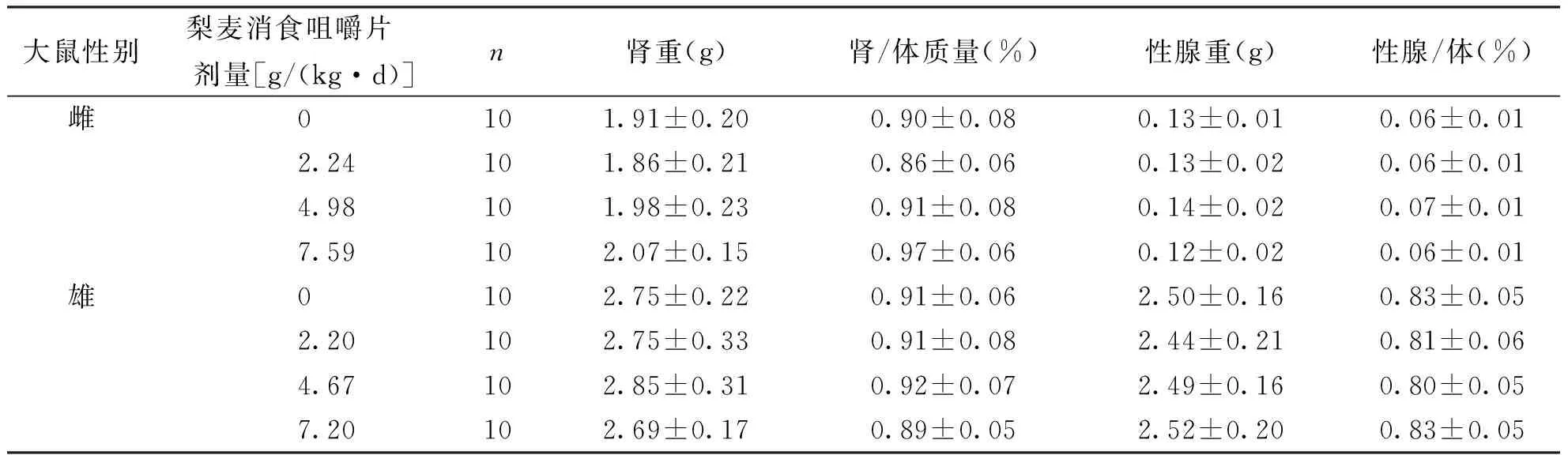
大鼠性别梨麦消食咀嚼片 剂量[g/(kg·d)]n肾重(g)肾/体质量(%)性腺重(g)性腺/体(%)雌0101.91±0.200.90±0.080.13±0.010.06±0.012.24101.86±0.210.86±0.060.13±0.020.06±0.014.98101.98±0.230.91±0.080.14±0.020.07±0.017.59102.07±0.150.97±0.060.12±0.020.06±0.01雄0102.75±0.220.91±0.062.50±0.160.83±0.052.20102.75±0.330.91±0.082.44±0.210.81±0.064.67102.85±0.310.92±0.072.49±0.160.80±0.057.20102.69±0.170.89±0.052.52±0.200.83±0.05
3 讨论
梨麦消食咀嚼片配方以山楂、刺梨、麦芽为主,辅以陈皮、莱菔子和茯苓,2002年卫生部发布的《关于进一步规范保健食品原料管理的通知》(卫法监发〔2002〕51号)指出山楂、麦芽、陈皮、莱菔子和茯苓既是食品又是药品,1998年卫生部发布的《关于1998年全国保健食品市场整顿工作安排的通知》(卫监法发〔1998〕第9号)指出刺梨属于新资源食品,本品辅料糊精、柠檬酸、蔗糖,均属于国家食品药品监督管理局公布的可作为保健食品的原料和辅料,卫生部公布或者批准可以食用的以及作为普通食品的原料和辅料。
为确保梨麦消食咀嚼片食用安全,依据卫生部《保健食品检验与评价技术规范》[8]的规定,考察了梨麦消食咀嚼片的急性毒性、遗传毒性和无损害作用剂量,为后期的实验奠定基础。结果表明,雌、雄性小鼠梨麦消食咀嚼片经口急性MTD均大于15 g/kg,根据急性毒性剂量分级标准,梨麦消食咀嚼片属无毒级;Ames试验、小鼠精子畸形试验、小鼠骨髓微核试验结果均为阴性;30 d喂养试验显示大鼠体质量、总食物利用率、血液学指标、血液生化指标、脏体比以及肝、脾、肾、睾丸和卵巢的病理组织学检查均未见明显改变。综上所述,在本研究剂量范围内梨麦消食咀嚼片毒理学是安全的,可对该产品进一步的开发。
[1] 仝甲钊, 曲波, 王蓓蓓, 等. 功能性消化不良的发病机制[J]. 世界华人消化杂志, 2013(9):785-790.
[2] 吴柏瑶, 张法灿, 梁列新. 功能性消化不良的流行病学[J]. 胃肠病学和肝病学杂志, 2013(1): 85-90.
[3] 安丽, 曹国强, 张照兰. 张照兰教授治疗功能性消化不良临床经验[J]. 中国实验方剂学杂志, 2011(24): 278-280.
[4] 冷本家. 中医经验方加减治疗功能性消化不良的临床疗效[J]. 中国社区医师, 2015(26): 75.
[5] 柳秀真. 中医对脾胃气虚型功能性消化不良疗效观察[J]. 中西医结合心血管病杂志, 2015(15): 117-118.
[6] 陈苏宁, 史业东, 马丽. 中医为主要措施治疗功能性消化不良复发率的Meta分析[J]. 世界华人消化杂志, 2010(27): 2938-2941.
[7] 许雷鸣, 胡燕平, 武谷, 等. 现行药物、保健食品和化妆品 Ames 试验方法的比较分析[J]. 安徽医药, 2013(9): 1595-1597.
[8] 卫生部卫生法制与监督司. 保健食品检验与评价技术规范(2003版)[S]. 北京: 人民卫生出版社, 2003.
(2016-08-01收稿,2016-10-22修回)
中文编辑: 周 凌; 英文编辑: 赵 毅
Study on the Toxicology of Limai Xiaoshi Chewable Tablet
LAN Yanyu1, WU Ping1, SONG Fei1, ZHENG Luping2, LI Yongjun1, WANG Yonglin1
(1.CollegeofPharmacy,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China;2.GuizhouSouthChinaBiologicalEngineeringCo.Ltd,Guiyang550001,Guizhou,China)
Objective: To investigate the safety of Limai Xiaoshi chewable tablet. Method: Adopting acute oral toxicity test, Genotoxicity test (Ames test, the micronucleus calculation of mouse bone marrow cells, mice sperm shape abnormality test) and 30 days feeding tests to evaluate safety of Limai Xiaoshi chewable tablet. Results: For the ICR mice (female and male), acute oral toxicity MTD exceed the amount of 15 g/kg; Limai Xiaoshi chewable tablet could be categorized as non-toxic according to the acute toxicity dose classification standard. In the experiment of Ames test, the micronucleus calculation of mouse bone marrow cells and mice sperm shape abnormality test showed negative results. There were no adverse influence on growth and development, haematological indexes, biochemical indexes, organ-body ratios and histopathological changes of rats by 30d feeding test. Conclusion: This study demonstrated that Limai Xiaoshi chewable tablet toxicity test did not have obvious poisonous effects.
toxicology; mice; acute toxicity test; genotoxicity test; Limai Xiaoshi chewable tablet
贵州省中药现代化[黔科合中药字(2011)5031]; 贵阳市科学技术计划项目筑科合同(2012204)13号]; 贵州省教育厅项目[黔教合协同创新字(2013)04]
�� E-mail:gywyl@gmc.edu.cn
时间:2016-11-15 网络出版地址:http://www.cnki.net/kcms/detail/52.1164.R.20161115.1757.001.html
R965.3
A
1000-2707(2016)11-1274-05
10.19367/j.cnki.1000-2707.2016.11.008
