IL- 15 mutant/Fcγ2a融合蛋白对溃疡性结肠炎模型小鼠的治疗作用及其机制研究
2016-12-21陈尧蒋小华郑萍陶庆松
陈尧,蒋小华,郑萍,陶庆松
(1.东南大学 医学院,江苏 南京 210009; 2.同济大学附属东方医院 胃肠外科,上海 200120;3.东南大学附属中大医院 普通外科,江苏 南京 210009; 4.同济大学附属东方医院 消化内科,上海 200120)
·论 著·
IL- 15 mutant/Fcγ2a融合蛋白对溃疡性结肠炎模型小鼠的治疗作用及其机制研究
陈尧1,蒋小华2,3,郑萍4,陶庆松3
(1.东南大学 医学院,江苏 南京 210009; 2.同济大学附属东方医院 胃肠外科,上海 200120;3.东南大学附属中大医院 普通外科,江苏 南京 210009; 4.同济大学附属东方医院 消化内科,上海 200120)
目的:探讨IL- 15 mutant/Fcγ2a融合蛋白(IL- 15 mutant/Fc)对溃疡性结肠炎(UC)小鼠模型的治疗作用及其可能的作用机制。 方法:5%葡聚糖硫酸钠(DSS)连续饮用制成UC模型,随机将30只小鼠分为对照组、IL- 15 mutant/Fc治疗组、IgG2a治疗组,观察小鼠一般体重情况。造模完成后取结肠行大体病理观察,并行伊红染色,查看其病理学损伤水平。ELISA分析小鼠眼球血的IL- 10、IL- 15、TNF- α炎症因子的含量,RT- PCR测定结肠组织STAT3和STAT5 mRNA的表达,蛋白质印迹法测定磷酸化STAT5(p- STAT5)以及磷酸化AKT(p- AKT)蛋白的表达。结果:除对照组小鼠外,其他两组均出现一般情况及体重改变。而IL- 15 mutant/Fc组小鼠的症状以及组织病理学评分均轻于IgG2a组。IL- 15 mutant/Fc可改善IL- 10、IL- 15、TNF- α的分泌情况。IL- 15 mutant/Fc抑制STAT5 mRNA、STAT3 mRNA表达以及p- STAT5、p- AKT蛋白的表达。结论:IL- 15 mutant/Fc在体内具有改善模型UC小鼠病情的作用,它可能通过特异性的拮抗IL- 15受体来干预STAT、AKT信号通路的信号转导而发挥其治疗作用。
融合蛋白; 模型溃疡性结肠炎; 白细胞介素15; 小鼠
溃疡性结肠炎(ulcerative colitis,UC)又称非特异性溃疡性结肠炎,是炎症性肠病(inflammatory bowel disease,IBD)的一种类型。病变多数累及直肠和乙状结肠。近几年来,UC的发病率逐渐上升。目前UC的治疗以药物控制为主,氨基水杨酸及类固醇激素等传统药物对UC的治愈效果有限,外科手术也只限于病情严重者和并发症的处理[1- 2],因此寻找更有效的药物在UC治疗研究中具有十分关键的作用。白介素15(interleukin- 15,IL- 15)1994年由Grabstein等[3]发现,其对众多免疫细胞的发生发展、增殖分化都起到重要的调控作用,近年来,关于IL- 15与IBD发病的研究逐渐增多,已经证明IL- 15及其受体在IBD时表达明显高于正常[4- 5]。IL- 15 mutant/Fcγ2a融合蛋白(IL- 15 mutant/Fc)是将点突变的IL- 15基因与鼠IgG2a恒定区融合构建的。IL- 15 mutant/Fc与IL- 15受体以极高的亲和力特异性结合,从而起到IL- 15受体特异性拮抗剂的作用。研究表明IL- 15 mutant/Fc可以有效逆转葡聚糖硫酸钠(dextran sulphate sodium,DSS)小鼠模型中促炎和抑炎因子的比例[6],并改善肠黏膜固有层组织病理学表现。本实验通过构建UC小鼠模型,评价IL- 15 mutant/Fc对实验性UC的治疗效果,并进一步研究其对UC模型的治疗机制。
1 材料与方法
1.1 实验动物、试剂及仪器
6~8周龄Balb/c雌性小鼠,体重16~21 g,购自南京沐涂医疗科技有限公司,DSS购自上海前尘生物公司,IL- 15 mutant/Fc融合蛋白由东方医院转化医学平台构建。ELISA试剂盒购自eBioscience公司,Multiskan MK3酶标仪购自美国Thermo公司。ECL发光液购自美国Thermo公司。Trizol试剂购自TaKaRa公司。多聚酶链反应引物由南京墨迹公司合成。磷酸化STAT5(p- STAT5)抗体以及磷酸化AKT(p- AKT)抗体均产自R&D公司,定量PCR仪为ABI Stepone plus 荧光定量PCR系统。
1.2 实验方法
1.2.1 动物分组及处理 随机将30只小鼠分为对照组、IL- 15 mutant/Fc治疗组和IgG2a治疗组各10只,对照组以正常饮用水连续饮用10 d,IL- 15 mutant/Fc治疗组和IgG2a治疗组按文献[7]描述的以5%的DSS饮用水连续饮用7 d制备实验性UC模型,造模3 d后IL- 15 mutant/Fc治疗组和IgG2a治疗组每只小鼠分别予IL- 15 mutant/Fc 5μg·(100μl·d)-1和IgG2a 5μg·(100μl·d)-1连续腹腔注射7 d。
1.2.2 小鼠结肠炎症评价 察看并记录小鼠每天的状态及活动情况,观察其粪便颜色及性状等,记录体重。于造模开始的第10天取完眼球血后全部处死并取距肛门1~5 cm处结肠,将取下组织行伊红染色评估炎症情况。根据Neurath等[8]的评分标准行组织病理评分,积分越高表明黏膜炎症的严重程度越重。
1.2.3 ELISA检测 眼球血中炎症细胞因子IL- 10、IL- 15和TNF- α浓度的测定用ELISA法[9]。眼球血样品室温放置2 h后离心。取上清检测,并以2倍法稀释。同时分成空白孔、标准孔以及待测样品孔。先在3组孔中注入稀释液50μl。空白孔和另外两孔中分别加入标准品和待检测的样品各50μl。所有组孔中加入生物素化的抗体50μl。37 ℃温度下孵育2 h后将所有孔内液体甩干,并洗板3次,每孔加酶结合物100μl,盖覆膜37 ℃温浴1 h。将所有孔内液体甩干,洗板5次后加底物显色液(TMB)100μl。37 ℃避光孵育30 min左右后所有孔中均加入终止试剂100μl。立即测量各孔的光密度。
1.2.4 RT- PCR检测结肠组织STAT3及STAT5 mRNA的表达 Trizol法提取细胞总RNA,并用紫外分光光度计检测其浓度。按逆转录试剂盒说明书逆转录合成cDNA后取2μl cDNA加入PCR体系中进行扩增,扩增条件为:50 ℃ 2 min,95 ℃ 10 min,40个循环;95 ℃ 5 s,60 ℃ 1 min。PCR引物序列见表1。扩增完成后将各样品两个不同的基因进行实时荧光定量PCR,再对各样品所测得的基因量进行分析后得出基因相对含量。
表1 目的基因引物序列及大小

基 因引物序列片段大小/bpSTAT3F⁃GCCACGTTGGTGTTTCATAATC97R⁃TTCGAAGGTTGTGCTGATAGAGSTAT5F⁃CCGAAACCTCTGGAATCTGAA100R⁃GGTCTGGGAACACGTAGATAAGGAPDHF⁃GGTGTGAACCACGAGAAATATGAC127R⁃TCATGAGCCCTTCCACAATG
1.2.5 蛋白质印迹法检测结肠组织p- STAT5和p- AKT蛋白的表达 提取蛋白完成后并测定其含量后进行电泳。电泳结束后进行转膜,准备4张比膜稍小或一样大的滤纸和1张PVDF膜,并将该膜置于甲醇溶液中活化1 min。在转膜仪上,首先将已经泡好的两层滤纸叠放在转膜仪平台上,并赶走中间的气泡,然后将PVDF膜放于滤纸上。在PVDF膜上放置好分离胶以及2层滤纸后在0.32 mA的电流下转膜2 h。将膜取出放置于一有封闭液的平皿中,室温封闭4 h。弃封闭液,加入1∶1 000稀释的多抗,4 ℃培养过夜。室温下以TBST脱色摇床反复清洗3次。加入二抗,室温下培养2 h后继续清洗次数同上。加入增强化学发光(ECL)显色液,于Tanon凝胶成像仪下拍照,获取图片。以β- 肌动蛋白作为内参。
1.3 统计学处理
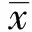
2 结 果
2.1 一般情况及体重变化
IL- 15 mutant/Fc治疗组和IgG2a治疗组的小鼠在UC诱导当天即出现精神不振、活动减少等表现。第3天大便多为黏液型稀便,上述表现于第5天达到顶峰。IL- 15 mutant/Fc治疗组部分小鼠第8天开始好转,第1、5号小鼠分别于造模第8、9天死亡。IgG2a治疗组症状未见明显好转,第1、2、6号小鼠于第8天死亡,实验第10天后各组小鼠每天体重变化见图1,统计分析显示IL- 15 mutant/Fc治疗组体重降低幅度小于IgG2a治疗组(P<0.05)。
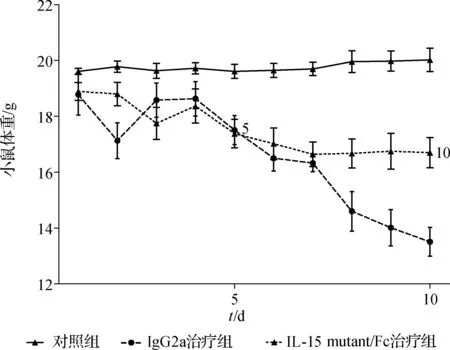
图1 各组小鼠每天体重变化
2.2 结肠组织病理评分
对照组小鼠结肠组织未见病理学改变;IgG2a治疗组小鼠结肠标本切片在光镜下可见肠道增厚,黏膜及黏膜下层出现充血水肿,上皮细胞坏死脱落,黏膜层、黏膜下层甚至肌层内有大量炎症细胞的浸润,淋巴组织大量增生。隐窝损伤甚至消失;IL- 15 mutant/Fc治疗组亦表现出黏膜充血、水肿,上皮细胞坏死脱落等改变,但病变程度明显轻于IgG2a治疗组,愈合较好(图2)。3组的组织病理评分显示:IL- 15 mutant/Fc治疗组结肠炎病变评分为3.10±2.31,与对照组(0.00±0.00)比较结肠病变严重程度增加(P<0.05);IgG2a治疗组结肠炎病变评分为10.17±4.58,病变程度显著重于对照组(P<0.01);IL- 15 mutant/Fc治疗组病变程度显著低于IgG2a治疗组(P<0.05)。
2.3 眼球血的IL- 10、IL- 15、TNF- α炎症因子的表达
眼球血样品于室温放置2 h,取上清液经ELISA分析发现,细胞因子IL- 10、IL- 15、TNF- α均有表达。IL- 15 mutant/Fc融合蛋白组和IgG2a治疗组IL- 15和TNF- α的表达均高于对照组(均P<0.05),两组IL- 10的表达均低于对照组(均P<0.05);IL- 15 mutant/Fc融合蛋白治疗组IL- 15和TNF- α的表达均低于IgG2a治疗组(均P<0.05),IL- 10的表达高于IgG2a治疗组(P<0.05)。见表2。
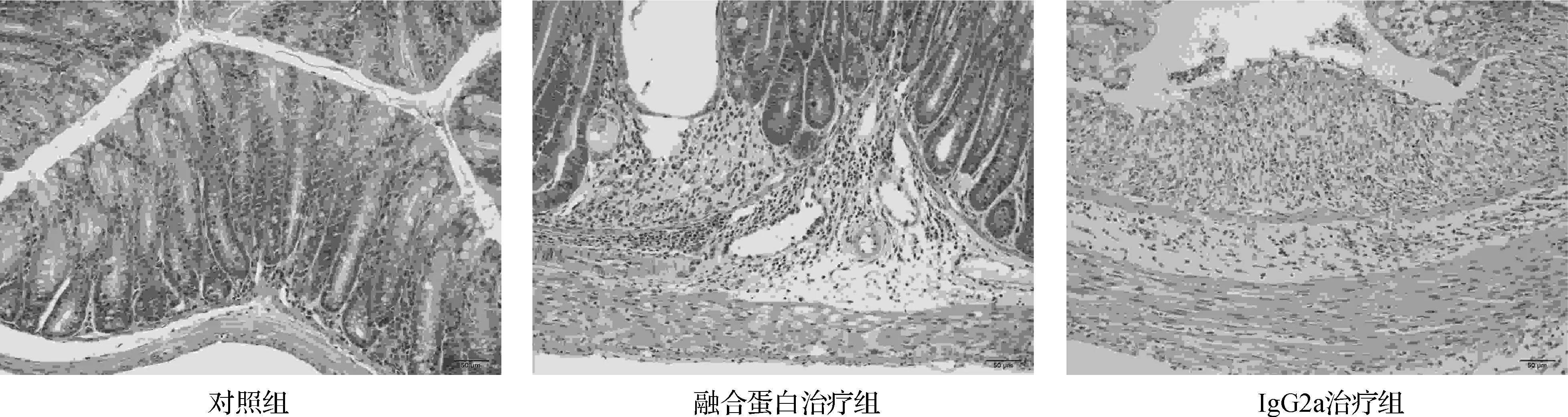
图2 各组小鼠结肠组织HE染色 ×200
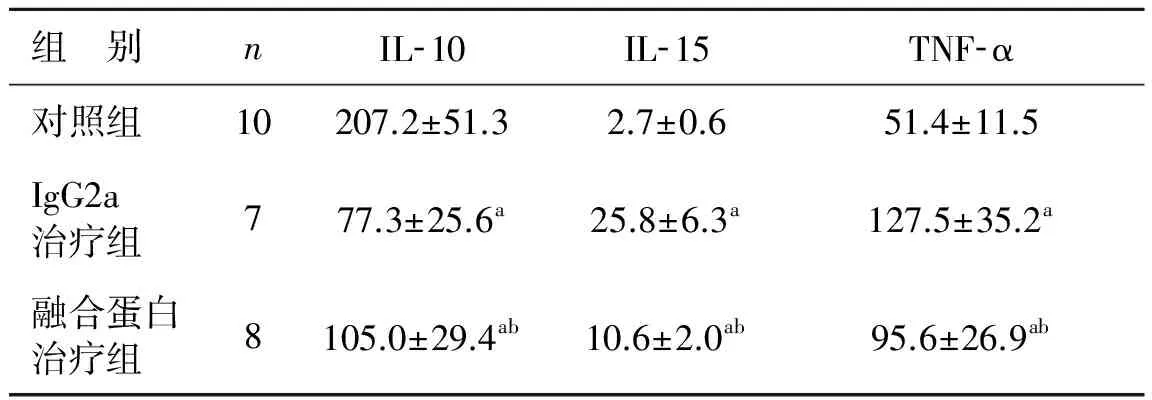
表2 3组细胞因子的表达 pg·ml-1
a 与对照组比较,P<0.05; b 与IgG2a治疗组比较,P<0.05
2.4 STAT3 mRNA、STAT5 mRNA、p- STAT5及p- AKT蛋白的表达
STAT3 mRNA表达水平IL- 15 mutant/Fc治疗组低于IgG2a治疗组(P<0.05)而略高于对照组(P>0.05),IgG2a治疗组高于对照组(P<0.05)(图3A)。STAT5 mRNA表达水平IL- 15 mutant/Fc治疗组低于IgG2a治疗组(P<0.05),IL- 15 mutant/Fc治疗组及IgG2a治疗组均高于对照组(均P<0.05)(图3B)。p- AKT和p- STAT5蛋白表达水平IL- 15 mutant/Fc治疗组低于IgG2a治疗组及对照组(均P<0.05)(图4A、B)。
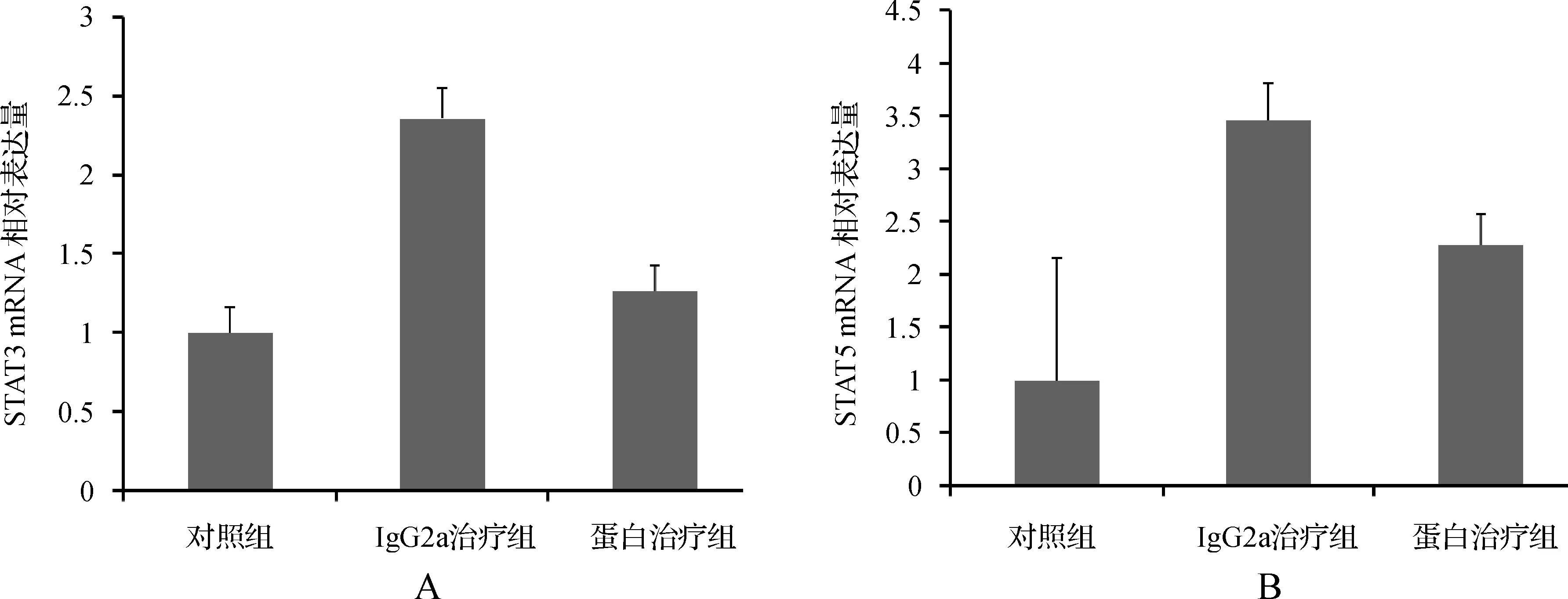
A.STAT3 mRNA 相对表达量; B.STAT5 mRNA 相对表达量
图3 各组小鼠结肠组织STAT3、STAT5 mRNA 相对表达量
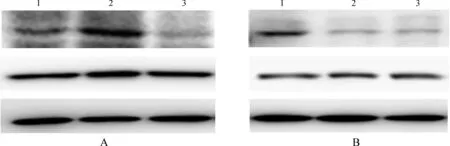
A.p- AKT、AKT及β- 肌动蛋白的表达; B.p- STAT5、STAT5及β- 肌动蛋白的表达; 1.对照组; 2.IgG2a治疗组; 3.IL- 15 mutant/Fc治疗组
图4 各组小鼠结肠标本p- AKT、AKT、p- STAT5、STAT5及β- 肌动蛋白的表达
3 讨 论
对小鼠一般精神状态、活动情况、体重、结肠组织的病理分析比较表明,IL- 15 mutant/Fc对UC有较好的治疗作用,对其肠道改变也有一定的改善作用。IL- 15是一种炎症促进因子和T细胞生长因子,主要由上皮细胞、内皮细胞等多种细胞产生,对许多细胞如单核/巨噬细胞、淋巴细胞等免疫细胞的发生发展、增殖分化都起到重要的调控作用[6]。IL- 15与IL- 2具有相似生物学活性,它们都是T淋巴细胞生长的激活者、细胞毒效应细胞的诱导者,是T细胞的化学引诱物、NK细胞活化的刺激者,并且是IFN- γ和TNF- α产生的促进者[10]。所以IL- 15被认为不仅与固有性免疫有关,同时还兼顾着适应性免疫的发生发展[11- 12]。IL- 15 mutant/Fc是将点突变的IL- 15基因与鼠IgG2a恒定区融合,成功构建的IL- 15 mutant/Fcγ2a融合蛋白。Fc融合蛋白具有诸多明显优势[13- 14],完整地保留了目标分子的全部生物活性,完全是自体的基因产物,抗原性极低,免疫球蛋白半衰期长,血浆浓度高,且具有潜在的引发免疫杀伤功能的特性,针对目标靶点的特异性强,亲和力高。本实验IL- 15 mutant/Fc治疗组相较于IgG2a治疗组促炎症细胞因子IL- 15及TNF- α的分泌下降,而相关的炎症抑制因子IL- 10的分泌上升。上述结果可以证明IL- 15 mutant/Fc或许对UC时炎症细胞因子分化失衡起到了十分重要的干预作用。IL- 15 mutant/Fc治疗组中IL- 15信号通路上的p- STAT5、p- AKT分子蛋白水平及STAT3、STAT5 mRNA的水平相较于IgG2a组显著下降,IL- 15可与其受体相结合,激活STAT的信号通路,从而促进T细胞以及炎症因子产物的增殖以及活化[15- 16]。而激活AKT这一通路后可以调整细胞发育生长中的增殖、分化和迁移[17- 18]。这些可能是UC发病的重要原因。本研究中,IL- 15 mutant/Fc治疗组的STAT5 mRNA、STAT3 mRNA表达水平均低于IgG2a治疗组,而p- STAT5及p- AKT蛋白表达水平低于IgG2a治疗组。IL- 15 mutant/Fc抑制了STAT5、STAT3 mRNA及p- STAT5、p- AKT蛋白的表达,从而可能抑制了T细胞和炎症因子产物的增殖及活化,减轻了黏膜的充血水肿情况,同时也就减轻了炎症反应。
本实验结果表明,IL- 15 mutant/Fc对UC小鼠有较好治疗作用,其机制可能是参与下调IL- 15信号通路中发挥重要作用的信号分子STAT3、STAT5核酸或p- STAT5、p- AKT蛋白的表达,干预IL- 15下游重要通路的信号传导,从而发挥治疗作用。鉴于融合蛋白相较传统单克隆抗体类生物制剂的明显优势,以及我们本实验中显示出的对UC动物模型炎症因子表达谱紊乱及肠道炎症的有效干预作用,这势必进一步为融合蛋白应用于UC临床靶向治疗提供有力的理论和实验支持。
[1] HANCOCK L,WINDSOR A C,MORTENSEN N J.Inflammatory bowel disease: the view of the surgeon[J].Colorectal Dis,2006,8(Suppl 1):10- 14.
[2] 中国炎症性肠病协作组.3 100例溃疡性结肠炎住院病例回顾分析[J].中华消化杂志,2006,26(6):368- 372.
[3] GRABSTEIN K H,EISENMAN J,SHANEBECK K,et al.Cloning of a T cell growth factor that interacts with the beta chain of the interleukin- 2 receptor[J].Science,1994,264(5161):965- 968.
[4] BOUCHAUD G,MORTIER E,FLAMANT M,et al.interleukin- 15 and its soluble receptor mediate the response to infliximab in patients with Crohn’s disease[J].Gastroenterology,2010,138(7):2378- 2387.
[5] PERRIER C,ARIJS I,STAELENS D,et al.interleukin- 15 receptor alpha expression in inflammatory bowel disease patients before and after normalization of inflammation with infliximab[J].Immunology,2013,138(1):47- 56.
[6] BROUNAIS- LE ROYER B,PIERROZ D D,VELIN D,et al.Effects of an interleukin- 15 antagonist on systemic and skeletal alterations in mice with DSS- induced colitis[J].Am J Pathol,2013,182(6):2155- 2167.
[7] MURANO M,MAEMURA K,HIRATA I,et al.Therapeutic effect of intracolonically administered nuclear factor kappa B(p65)antisense oligonucleotide on mouse dextran sulphate sodium(DSS)- induced colitis[J].Clin Exp Immunol,2000,120(1):51- 58.
[8] NEURATH M F,FUSS I,KELSALL B L,et al.Antibodies to interleukin- 12 abrogate estabilished experimental colitis in mice[J].J Exp Med,1995,182(5):1281- 1290.
[9] 谢琼.IL- 10基因- 627C/A多态性与儿童哮喘病之间的相关性研究[J].现代医学,2012,40(1):51- 53.
[10] KIM Y S,MASLINSKI W,ZHENG X X,et al.Targeting the IL- 15 receptor with an antagonist IL- 15 mutant/Fcγ2a protein blocks delayed- type hypersensitivity[J].J Immunol,1998,160(12):5742- 5748.
[11] CHENG S F,HO J W,CHAN K Y,et al.IL- 15 and macrophage secretory factors facilitate immune activation of neonatal natural killer cells by lipoteichoic acid[J].Cytocine,2013,61(2):499- 505.
[12] PAGLIARI D,CIANCI R,FROSALI S,et al.The role of IL- 15 in gastrointestinal diseases:a bridge between innate and adaptive immune response[J].Cytokine Growth Factor Rev,2013,24(5):455- 466.
[13] ORTIZ- SANCHEZ E,HELGUERA G,DANIELS T R,et al.Antibody- cytokine fusion protein:applications in cancer therapy[J].Expert Opin Biol Ther,2008,8(5):609- 632.
[14] KONTERMANN R E.Antibody- cytokine fusion proteins[J].Arch Biochem Biophys,2012,526(2):194- 205.
[15] LIN J X,MIGONE T S,TSENG M,et al.The role of shared receptor motifs and common Stat proteins in the generation of cytokine pleiotropy and redundancy by IL- 2,IL- 4,IL- 7,IL- 13,and IL- 15[J]. Immunity,1995,2(4):331- 339.
[16] LIN J X,LEONARD W J.The role of Stat5a and Stat5b in signaling by IL- 2 family cytokines[J].Oncogene,2000,19(21):2566- 2576.
[17] 孙晓杰,黄常志,PI3K- Akt 信号通路与肿瘤[J].世界华人消化杂志,2006,14(3):306- 311.
[18] SHENOY A R,KIRSCHNEK S,HACKER G.IL- 15 regulates Bcl- 2 family members Bim and Mcl- 1 through JAK/STAT and PI3K/AKT pathways in T cells[J].Eur J Immunol,2014,44(8):2500- 2507.
Therapeutic effect and mechanisms of IL- 15 mutant/Fcγ2a fusion protein in mice with ulcerative colitis
CHEN Yao1, JIANG Xiao- hua2,3,ZHENG Ping4,TAO Qing- song3
(1.School of Medicine,Southeast University,Nanjing 210009,China; 2.Department of Gastrointestinal Surgery,EastHospital,TongjiUniversity,Shanghai200120,China; 3.DepartmentofGeneralSurgery,ZhongdaHospital,SoutheastUniversity,Nanjing210009,China; 4.DepartmentofGastroenterology,EastHospital,TongjiUniversity,Shanghai200120,China)
Objective: To investigate the therapeutic effect and mechanisms of IL- 15 mutant/Fcγ2a fusion protein(IL- 15 mutant/Fc)in mice with ulcerative colitis(UC). Methods: Thirty mice were randomly divided into control group, IL- 15 mutant/Fc treatment group and IgG2a treatment group.UC model was induced in the latter two groups by giving 5% dextran sulphate sodium in drinking water for 7 consecutive days. In the experiment, the general condition and weight of the mice were observed,and the protective effects were evaluated by macroscopic and pathologic examinations. Hematoxylin- eosin(HE)staining of the distal colon mucosa of mice in each group was performed to study the histopathological injury and histological scores. The concentration of inflammatory cytokines(IL- 10,IL- 15,TNF- α) in ocular blood of mice was determined by ELISA assay. Expression of STAT3 and STAT5 mRNA and expression of p- STAT5 and p- AKT protein were detected by reverse transcriptase polymerase chain reaction(RT- PCR) and Western Blot respectively. Results: Compared with the control group, mice in other two groups showed poor general conditions and changes in body weight,but the general conditions and histopathological score of mice in IL- 15 mutant/Fc treatment group were better than those in IgG2a treatment group. The secretion disorder of pro- inflammatory cytokines and anti- inflammatory cytokine could be partially alleviated by injection of IL- 15mutant/Fc demonstrated by increasing IL- 10 and decreasing IL- 15 and TNF- α. The levels of STAT3 and STAT5 mRNA, and of p- STAT5 and p- AKT protein in IL- 15 mutant/Fc treatment group were obviously lower than those in IgG2a treatment group(P<0.05). Conclusion: As a specific IL- 15 receptor antagonist, IL- 15 mutant/Fc can achieve its therapeutic effect on UC by intervening the signaling pathway through regulating the mRNA or protein expressions of key signal molecules, such as STAT and AKT.
fusion protein; ulcerative colitis model; interleukin- 15; mice
2016- 01- 20
2016- 03- 04
陈尧(1990-),男,江苏苏州人,在读硕士研究生。E- mail:cyssforever@126.com
蒋小华 E- mail:jxh@medmail.com.cn
陈尧,蒋小华,郑萍,等.IL- 15 mutant/Fcγ2a融合蛋白对溃疡性结肠炎模型小鼠的治疗作用及其机制研究[J].东南大学学报:医学版,2016,35(4):559- 564.
R574.62; R- 33
A
1671- 6264(2016)04- 0559- 06
10.3969/j.issn.1671- 6264.2016.04.020
