miRNA145介导骨髓间充质干细胞膜微粒减少血管平滑肌细胞迁移
2016-12-21黄若兰张忠陈铭泰王玲常晓乔秋杰
黄若兰,张忠,陈铭泰,王玲,常晓,乔秋杰
(1.深圳市中医院 重症医学科,广东 深圳 518033; 2.深圳市中医院 心血管科,广东 深圳 518033; 3.广州中医药大学,广东 广州 518000)
·论 著·
miRNA145介导骨髓间充质干细胞膜微粒减少血管平滑肌细胞迁移
黄若兰1,张忠2,陈铭泰3,王玲1,常晓1,乔秋杰1
(1.深圳市中医院 重症医学科,广东 深圳 518033; 2.深圳市中医院 心血管科,广东 深圳 518033; 3.广州中医药大学,广东 广州 518000)
目的:探讨骨髓间充质干细胞(MSC)膜微粒对血管平滑肌细胞(VSMC)增殖迁移的影响及其机制。方法:诱导MSC凋亡释放膜微粒(MSC- MPs)用于实验,实验分为对照组(A组)、膜微粒组(B组)、miRNA145组(C组)、膜微粒加抗miRNA145组(D组)及膜微粒加miRNA145组(E组)5组。细胞迁移实验评价VSMC的迁移能力,免疫印迹法检测蛋白表达水平,流式细胞术、四甲基偶氮唑盐比色法(MTT法)等比较各组VSMC凋亡水平。以实时定量聚合酶链反应检测miRNA145表达水平。结果:E组VSMC迁移数量最少[(40.4±3.0)个],D组最多[(69.0±5.6)个],差异具有统计学意义(P<0.05);miRNA145的表达水平E组最高,A组与D组最低(P<0.05);MTT结果提示E组VSMC增殖抑制率及凋亡率最高,D组最低(P<0.05);半胱氨酸蛋白酶- 3免疫印迹法结果也类似。结论:MSC- MPs可减少VSMC凋亡,抑制VSMC迁移,而miRNA145参与了这一过程。
骨髓间充质干细胞; 膜微粒; 血管平滑肌细胞; 迁移; 凋亡
动脉粥样硬化性疾病在我国发病率及死亡率都高居首位。由血管功能失衡和损伤修复引起的血管重构,是众多血管疾病的关键病理环节[1]。血管平滑肌细胞(vascular smooth muscle cells,VSMC)作为维持血管壁结构稳定的主要成分,与多种血管性疾病如动脉粥样硬化斑块、冠脉介入术后再狭窄等密切相关[2- 4]。抑制VSMC的增殖和迁移可能会给此类疾病的治疗带来新的希望。
VSMC的功能受到多因素调节,有报道称微小RNA(miRNA)145抑制VSMC的增殖、凋亡、迁移,与心肌祖细胞存活、损伤修复及缺氧耐受性有关,间接对VSMC起保护作用[5]。miRNAs通过调节VSMC功能影响血管疾病的发生发展已经得到多方验证[6]。此外,有研究发现,许多干细胞,包括骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM- MSCs)移植具有巨大应用潜力[7],能在应激或凋亡时通过旁分泌机制产生膜微粒(microparticles,MPs),实现细胞间的信息传递,发挥与来源细胞类似的作用[8- 9]。干细胞通过旁分泌机制释放的外泌体含有促进受损组织修复的miRNAs,说明干细胞的功能与miRNAs调控存在相关性[10]。本研究采用血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)诱导的VSMC迁移模型,以MSCs- MPs与VSMC共培养,慢病毒转染干预miRNA145表达或抑制确认其作用机制。
1 材料与方法
1.1 实验材料及试剂
1.1.1 细胞 雄性SD大鼠4只,鼠龄4~6周,体重60~80 g,由常州卡文斯实验动物有限公司提供。大鼠颈椎脱臼处死后,提取股骨和胫骨骨髓腔中的干细胞,详细方法见参考文献[11- 12]。
1.1.2 主要试剂 洛斯维培养基(RPMI 1640)购自美国GIBCO公司,胎牛血清(fetal bovine serum,FBS)、Dulbecco’s改良培养基(Dulbecco minimum essential medium,DMEM)、胰蛋白酶及乙二胺四乙酸(EDTA)等细胞培养常规试剂均购自美国Hyclone公司,AngⅡ购自赛默飞世尔生物化学制品公司,总RNA抽提试剂(Trizol)提取液购自美国Invitrogen公司,细胞迁移实验小室(transwell)购自美国Corning公司,逆转录试剂盒、实时定量聚合酶链反应(PCR)检测试剂盒购自日本TaKaRa公司,四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT)购自美国Sigma公司,特殊化学修饰的miRNA145拮抗剂(antago- miRNA145)及其阴性对照(null- miRNA)购自广州优迪生物科技有限公司。其他试剂为分析纯,购自广州化学制剂总厂。
1.2 实验方法
1.2.1 MSC的提取及鉴定 将MSC接种于10%FBS、DMEM培养基,置于饱和湿度、37 ℃、体积分数5%CO2的细胞培养箱中培养传代。收集在对数生长期的细胞进行后续干预和实验。第4代MSC培养至80%融合时,改变培养条件为无血清、低氧(体积分数94%N2、5%CO2和1%O2),72 h后收集细胞培养的上清液,低速离心5 min,将上清液分装入超速离心管,提取方法见文献[9]。
1.2.2 VSMC分离与培养 无菌条件下分离SD大鼠胸主动脉,小心去除内膜和外膜,取中层平滑肌切成1 mm3左右的组织块,以含20% FBS的DMEM培养液行组织贴壁法原代培养。于37 ℃、体积分数5%CO2条件下静置培养,3 d后更换培养液。待单层细胞覆盖培养皿约80%时,取出组织块传代。用0.25%胰蛋白酶消化细胞,含10%FBS、2 mmol·L-1谷氨酰胺、100 U·ml-1青霉素、100 μg·ml-1链霉素的DMEM培养液行传代培养。实验采用融合度90%左右的第3~5代VSMC。
1.2.3 miRNA145的过表达与敲除实验 VSMC更换无FBS、无抗生素DMEM进行培养,当细胞密度达到30%~50%时进行转染,以不含血清培养基的无血清培养基(Opti- MEM)准备miRNA145(或者antago- miRNA145)和脂质体2000(lipo2000)的混合液。100 μl Opti- MEM中加入1 μl lipo2000以及50 nmol·L-1(低浓度组)或100 nmol·L-1(高浓度组)的miRNA145(5′- GUCCAGUUUUCCCAGGAAUCCCU- 3′),或者抗miRNA145(5′- AGGGAUUCCUGGGAAAACUGGAC- 3′),然后加入到以400 μl不完全DMEM培养基培养的VSMC中,柔和混匀后孵育24 h,用于后续实验。
1.2.4 实验分组及干预 A组为对照组(VSMC+AngⅡ):Ang诱导的VSMC迁移模型;B组为膜微粒组(MSC- MPs+VSMC+AngⅡ):MSC- MPs与Ang诱导的血管平滑肌共培养;C组为miRNA145组(过表达miRNA145+VSMC+AngⅡ):构建过表达miRNA145转染VSMC,AngⅡ诱导迁移模型;D组为膜微粒加抗miRNA145组(MSC- MPs+抗miRNA145+VSMC+AngⅡ):MSC膜微粒与抗miRNA145转染的VSMC共培养,AngⅡ诱导迁移;E组为膜微粒加miRNA145组(MSC- MPs+miRNA145- VSMC+AngⅡ):MSC膜微粒与miRNA145过表达的VSMC共培养,观察AngⅡ诱导的VSMC迁移。
1.2.5 细胞迁移实验 各组VSMC按每孔0.5×105个细胞接种于迁移实验小室6孔共培养板上层(底部为聚酯透明滤膜),培养过夜,细胞贴壁后向培养液中加入100 nmol·L-1的AngⅡ作用6 h,建立VSMC迁移模型。各组VSMC按每孔1×105个细胞接种于迁移实验小室6孔共培养板下层。每个样品设3个复孔,共培养72 h。取出迁移实验小室上室,以磷酸缓冲盐溶液(PBS)冲洗,用棉签小心擦去微孔膜上层细胞,甲醇室温固定30 min。0.05%结晶紫染色10 min,PBS冲洗3次,轻轻撕下基底膜,倒扣至载玻片,风干后用中性树胶封片,在200倍显微镜下选取5个不重叠区域计算迁移的细胞数。
1.2.6 MTT法检测细胞活性水平 收集VSMC,调整细胞浓度为5×104个·ml-1,每孔加入100 μl,体积分数5%CO2、37 ℃培养过夜,于每孔待测细胞中加入MTT溶液20 μl(5 mg·ml-1),继续培养4 h,小心吸去孔内培养液,每孔加二甲基亚砜150 μl,摇床低速振荡10 min,在酶联免疫检测仪490 nm处测量各孔的吸光值(A值)。每组设置3个复孔,取平均值为该组A值。
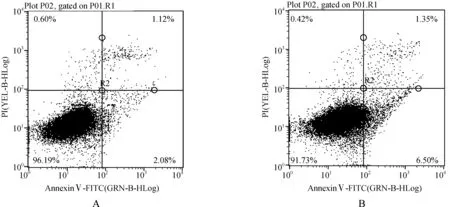
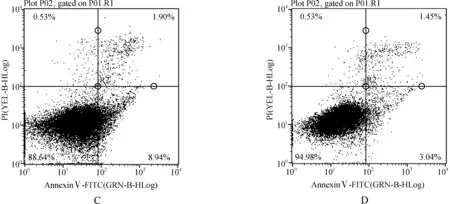
1.2.7 流式细胞术检测VSMC凋亡率 按照细胞凋亡检测试剂盒(Annexin Ⅴ- FITC)操作说明检测细胞凋亡。把细胞培养液转移离心管内,PBS洗涤贴壁细胞1次,加入适量胰酶消化细胞,室温孵育至适当时机,吸除胰酶细胞消化液,将细胞转移到新离心管内,1 000 r·min-1离心5 min,弃上清,收集细胞,用PBS轻重悬细胞并计数。取5~10万重悬的细胞,1 000 r·min-1离心5 min,弃上清,加入100 μl 1倍 Annexin Ⅴ缓冲液轻轻重悬细胞,加入5 μl荧光素(AnnexinⅤ- FITC)和 5 μl 碘化丙啶染色液(PI),轻轻混匀。20~25 ℃避光孵育15 min,随即进行流式细胞仪检测,Annexin Ⅴ- FITC为绿色荧光,PI为红色荧光。
1.2.8 免疫印迹法检测各组半胱氨酸蛋白酶- 3活性 收集上述各组VSMC,向每管沉淀细胞中加入100 μl放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解液,混匀后移入1.5 ml离心管。加入苯甲基磺酰氟(phenylmethyl sulfonylfluoride,PMSF,1∶100),在4 ℃冰箱中静置30 min后,于4 ℃离心20 min,按照蛋白定量试剂盒使用说明书进行操作。以50 μl上样,经10%SDS聚丙酰胺凝胶电泳后,将蛋白转移至硝酸纤维素膜上,用5%脱脂奶粉封闭2 h后,与半胱氨酸蛋白酶- 3(1∶1 000)常温摇床振荡孵育2 h。加入辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗(博士德公司,1∶2 500稀释),常温孵育1 h,ECL发光液显影,曝光。以β- 肌动蛋白作为内参,利用Image- Pro Plus 6.0 成像系统分析蛋白质印迹条带的积分光密度(IOD)值,并计算各组半胱氨酸蛋白酶- 3的IOD值与内参IOD值的比值。以上实验重复3次。
1.2.9 实时定量聚合酶链反应法检测miRNA145的表达水平 Trizol法提取VSMC总RNA后,在紫外分光光度计仪上测A260/A280值,计算RNA纯度和浓度,选择介于1.8~2.1者为合格样品,可用于实验。采用miRNA145特异性逆转录引物及逆转录试剂盒合成cDNA(TaKaRa)。miRNA145茎环结构逆转录引物:5′- GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACGACAGGGATTC- 3′;实时定量PCR上下游引物序列如下:正向,5′- GAAGGTCCAGTTTTCCCAGG- 3′;反向,5′- CAGTGCGTGTCGTGGAGT- 3′。定量PCR反应条件如下:95 ℃ 30 s;95 ℃ 3 s,60 ℃ 34 s(收集荧光信号),40个循环。融解曲线分析:温度60~95 ℃,每分钟读1次。RNU6B作为实验的内源性参照。miRNA145的相对表达量采用经典的2-ΔCt来表示(ΔCt=Ct miRNA-CtU6)。每个标本重复实验3次。
1.3 统计学处理
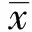
2 结 果
2.1 MSC凋亡时释放膜微粒的鉴定
低氧低营养条件下培养72 h的BM- MSCs,凋亡率为10%,将细胞培养上清液超速离心后得到沉淀,经过流式细胞仪对这些结构的表型进行检测,发现其可表达CD29、CD44和CD73,而不表达CD31和CD45,与MSC的表型一致,说明来自MSC,即MSC- MPs。
2.2 VSMC的培养、转染及鉴定
培养的VSMC呈典型“峰- 谷”样生长;同一视野下明光观察病毒转染后细胞体积无改变,细胞分泌物无增加。
2.3 VSMC迁移情况
迁移实验小室实验结果显示,E组VSMC迁移数量最少[(40.4±3.0)个],D组[(69.0±5.6)个]与A组[(71.4±2.3)个]之间差异无统计学意义(P>0.05),而多于B组[(50.8±2.6)个]以及C组[(42.4±3.3)个](P<0.05)。
2.4 VSMC转染后miRNA145的表达
RT- PCR测定miRNA145的表达水平:A组 2.5 MTT检测VSMC增殖抑制率 MTT法检测不同分组对VSMC增殖抑制率的影响,各组结果见图1。E组增殖抑制率(24.71%±3.20%)最高,D组(4.97%±4.17%)最低(P<0.05)。 图1 各组间VSMC增殖抑制率差异 Fig 1 Differences of VSMC proliferation rate in each group 2.6 流式细胞术检测VSMC凋亡率结果 E组凋亡率(13.03%±0.75%)最高,D组(4.12%±0.40%)最低(P<0.05),与A组(2.87%±0.40%)相比差异无统计学意义(P>0.05),见图2。 2.7 VSMC的半胱氨酸蛋白酶- 3表达 与A组相比,E、C、B组的半胱氨酸蛋白酶- 3蛋白表达量差异有统计学意义(P<0.05),D组差异无统计学意义(P>0.05)。见图3。 膜微粒是在细胞损伤、激活或者凋亡时从细胞膜上脱落的直径<1 μm的膜性囊泡,从其形成及产生方式的不同,膜微粒主要分为两类:(1)外排体(exosomes),为均质的膜微粒,直径40~100 nm,是由细胞的内吞噬而储存于细胞质多泡体中,并通过胞吐作用释放至内环境中,其标志物包括CD9、CD63、Alix、flotillin- 1和Tsgl01等;(2)膜微囊(microvesicles),为不均质的膜微粒,直径50~1 000 nm,由细胞质膜直接出芽、分裂而产生,其没有特定的标志物,有报道称标志物与来源干细胞类似[13]。目前国内外对BM- MSCs的研究认为:许多细胞包括干细胞能在激活或者凋亡时通过旁分泌机制产生MPs[14- 15],其携带表面受体、生物活性分子实现细胞间的信息传递,发挥与来源细胞类似的作用。 miRNA发现于真核生物中,是由18~25个核苷酸组成的单链非编码RNA,可通过与特定miRNA的3′非翻译区(3′- untranslated region,3′UTR)结合,促使miRNA降解或抑制miRNA的翻译,从而调控基因表达。近年来,对miRNA与干细胞的研究发现,在多种干细胞中均存在各自特异的miRNA表达,对干细胞的生物学活动具有重要的调控作用。以往研究显示几种miRNAs家族成员可维持胚胎干细胞的多能性[16- 17],此外,干细胞通过旁分泌机制释放的外泌体含有促进受损组织修复的miRNAs,说明干细胞的功能与miRNAs调控存在相关性。Collino等[18]发现,一些miRNAs同时存在于膜微粒及其来源的MSC中,然而有一部分miRNAs却选择性地仅存在于膜微粒。而另一部分miRNAs仅存在于MSC。由此可见,间充质干细胞能旁分泌产生膜微粒。同时膜微粒携带的RNA为其发挥疾病治疗作用的主要组分之一。 本研究通过建立VSMC迁移模型,采用MSC- MPs与VSMC共培养的方式,明确MSC- MPs能抑制AngⅡ诱导的VSMC迁移,减少VSMC迁移率以及增加VSMC凋亡,采用miRNA145干预后,过表达miRNA145加强MSC- MPs的这一作用,而抑制miRNA145减弱MSC- MPs对VSMC的作用,提示MSC- MPs的抑增殖、抑凋亡作用与miRNA145正相关。miRNA145具有抑制血管平滑肌细胞增殖、迁移等作用,而MSC- MPs与血管平滑肌细胞共培养也有抑制血管平滑肌细胞增殖、凋亡的作用[5,19],说明MSC- MPs对VSMC的作用与miRNA有关,MSC- MPs影响VSMC的增殖、迁移及凋亡有可能通过miRNA145来实现。 图2 流式细胞术检测各组凋亡率结果 Fig 2 Apoptosis rate of VSMC in each group detected by flow cytometry 图3 各组VSMC的半胱氨酸蛋白酶- 3表达 Fig 3 Expression of caspase- 3 in VSMC in each group detected by Western blot VSMC参与多种疾病的病理过程,VSMC的增殖、迁移和黏附引起血管内膜增生,导致动脉粥样硬化和再狭窄,对心血管性疾病的发生发展有重要作用[20]。对于终末期心血管病,采用干细胞治疗曾被寄予厚望,然而由于损伤组织的缺血缺氧环境,90%以上的MSC移植入体内后72 h内死亡,在存活的干细胞中,通过旁分泌机制产生的膜微粒有可能在修复及再生损伤组织的过程中起关键作用[21]。我们的实验提示这一作用有可能通过miRNA来实现。然而转染miRNA145后VSMC的迁移减少,凋亡也明显增加,VSMC适当的凋亡率是维持血管结构及形态的影响因素之一,过度凋亡也会导致血管壁变薄,是动脉粥样硬化斑块易损性的干预靶点之一。本实验中观察到的VSMC凋亡是否有利于改善动脉粥样硬化和血管狭窄性疾病,需要动物模型或者其他实验的进一步验证。抑制miRNA145后MSC- MPs抑制VSMC迁移及增加凋亡率的作用减少,提示miRNA145有可能起关键调控作用。但干细胞膜微粒并非通过单一机制实现细胞调控,仍有待继续深入研究,以期为心血管疾病的干细胞治疗带来进展及突破。 [1] 王凤,章怡祎,刘萍.动脉粥样硬化动物模型的研究进展[J].东南大学学报:医学版,2014,33(2):235- 238. [2] 刘晶,马坤岭,倪杰,等.动脉粥样硬化模型小鼠血管平滑肌细胞原代培养及鉴定[J].东南大学学报:医学版,2011,30(4):537- 540. [3] MARX S O,TOTARY- JAIN H,MARKS A R.Vascular smooth muscle cell proliferation in restenosis[J].Circ Cardiovasc Interv,2011,4(3): 104- 111. [4] 吴校林,江洪,陈静,等.Kindlin- 2对血管平滑肌细胞迁移和黏附的影响及其机制的实验研究[J].中华心血管病杂志,2014,42(11):938- 943. [5] 金杰,廖明芳,王亮,等.微小RNA调节血管平滑肌细胞增殖及其参与心血管疾病病理形成的研究进展[J].中华心血管病杂志,2015,43(9): 837- 840. [6] 蒋珽,项阳.MicroRNA 在冠心病中的作用研究[J].东南大学学报:医学版,2012,31(5):639- 643. [7] 黎叶飞,盛祖龙,姚玉宇,等.两种骨髓间充质干细胞移植途径治疗急性心肌梗死的比较研究[J].东南大学学报:医学版,2011,30(5):687- 691. [8] CHEN L,WANG Y,PAN Y,et al.Cardiac progenitor- derived exosomes protect ischemiac myocardium from acute ischemia/reperfusion injury[J].BBRC,2013,431(4):566- 571. [9] van BERLO J H,KANISICAK O,MAILLET M,et al.C- kit+cells minimally contribute cardiomyocytes to the heart[J].Nature,2014,509(3):337- 345. [10] 王艳,石蓓.微小核糖核酸与干细胞移植治疗心肌梗死的研究进展[J].中国循环杂志,2015,30(207):916- 918. [11] ELLISON G M,VICINANZA C,SMITH A J,et al.Adult c- kitpos cardiac stem cells are necessary and sufficient for functional cardiac regeneration and repair[J].Cell,2013,8(3):827- 842. [12] 吴原波,尹琪,金培峰,等.SDF- 1α在体内对骨髓间充质干细胞的保护作用及其对缺血心脏修复的影响[J].温州医学院学报,2011,41(2):136- 140. [13] 耿志敏,王珏,范鸿洋,等.骨髓间充质干细胞膜微粒促进大鼠心肌梗死后血管新生[J].中国病理生理杂志,2015,8(3):1371- 1375. [14] NIEUWLAND R,STURK A.Why do cells release vesicles[J].Thromb Res,2010,125(1):49- 51. [15] MAYERS J R,AUDHYA A.Vesicle formation within endosomes∶an ESCRT marks the spot[J].Commun Integr Biol,2012,5(1):50- 56. [16] HEINRICH E M,DIMMELER S.MicroRNAs and stem cells: control of pluripotency,reprogramming,and lineage commitment[J].Circ Res,2012,110(3):1014- 1022. [17] LEONARDO T R,SCHULTHEISZ H L,LORING J F,et al.The functions of microRNAs in pluripotency and reprogramming[J].Nat Cell Biol,2012,14(3):1114- 1121. [18] COLLINO F,DEREGIBUS M C,BRUNO S,et al.Microvesicles derived from adult human bone marrow and tissue specific mesenchymal stem cells shuttle selected pattern of miRNAs[J].PLoS One,2010,5(7):11803- 11803. [19] 龙仙萍,崔璨,陈攀科,等.降钙素基因相关肽和受体活性修饰蛋白1对血管平滑肌细胞迁移的影响及机制[J].中华心血管病杂志,2015,43(6):537- 541. [20] LI T S,TAKAHASHI M,OHSHIMA M,et al.Myocardial repair achieved by the intramyocardial implantation of adult cardiomyocytes in combination with bone marrow cells[J].Cell Transplant,2008,17(6):695- 703. [21] GATTI S,BRUNO S,DEREGIBUS M C,et al.Microvesicles derived from human adult mesenchymal stem cells protect against ischaemia- reperfusion- induced acute and chronic kidney injury[J].Nephrol Dial Transplant,2011,26(5):1474- 1484. Bone marrow mesenchymal stem cell microparticles reduce the migration of vascularsmooth muscle cells through miRNA145 HUANG Ruo- lan1,ZHANG Zhong2,CHEN Ming- tai3,WANG Ling1,CHANG Xiao1,QIAO Qiu- jie1 (1.Department of Intensive Care Unit,Shenzhen Traditional Chinese Medicine Hospital,Shenzhen 518033,China;2.DepartmentofCardiology,ShenzhenTraditionalChineseMedicineHospital,Shenzhen518033,China;3.GuangzhouUniversityofChineseMedicine,Guangzhou510000,China) Objective: To investigate the impact and mechanism of microparticles derived from bone marrow mesenchymal stem cells (MSC- MPs) on migration and apoptosis of vascular smooth muscle cells(VSMCs).Methods: The bone marrow mesenchymal stem cells were induced to release microparticles(MSC- MPs) through apoptosis for the experiment.Five experimental groups were listed as follows: control group(A group); microparticles group(B group); miRNA145 group(C group); microparticles+antago- miRNA145 group(D group); microparticles+miRNA145 group(E group). Transwell assay was applied to detect the migration of smooth muscle cells, Western blot was used to determine the expression of protein, and flow cytometry and MTT were employed to examine the level of apoptosis in each group.The expression of miRNA145 was determined by real- time polymerase chain reaction(RT- PCR).Results: The number of VSMC migration was significantly lower in E group(40.4±3.0) than that in D group (69.0±5.6)(P<0.05).The MTT and flow cytometry showed that the expression of miRNA145, VSMC proliferation inhibition rate and apoptosis rate were highest in E group and lowest in D group(P<0.05).The result of caspase-3 expression evaluated by Western blot showed the same tendency. Conclusion: MSC- MPs could reduce the apoptosis of VSMC and inhibit the migration of VSMC, while miRNA145 is involved in the process. bone marrow mesenchymal stem cell; microparticle; vascular smooth muscle cell; migration; apoptosis 2016- 03- 01 2016- 04- 15 国家自然科学基金资助项目(81573922);广东省中医药局建设中医药强省科研项目(20151076);广东省科技厅-广东省中医药科学院联合项目(2014A020221002) 黄若兰(1981-),女,广东饶平人,主治医师,医学硕士。E- mail:46743509@qq.com 张忠 E- mail:zzicu@126.com 黄若兰,张忠,陈铭泰,等.miRNA145介导骨髓间充质干细胞膜微粒减少血管平滑肌细胞迁移[J].东南大学学报:医学版,2016,35(4):475- 481. R329.2 A 1671- 6264(2016)04- 0475- 07 10.3969/j.issn.1671- 6264.2016.04.001
3 讨 论