顶空气相色谱在阳离子醚化剂合成过程中的应用
2016-12-21占正奉陶正毅刘忠陈学萍
占正奉 陶正毅, 刘忠 陈学萍
(1.安徽山鹰纸业股份有限公司 博士后科研工作站,安徽 马鞍山 243021;2.天津科技大学 天津制浆造纸重点实验室,天津 300457;)
顶空气相色谱在阳离子醚化剂合成过程中的应用
占正奉1陶正毅1,2刘忠2陈学萍1
(1.安徽山鹰纸业股份有限公司 博士后科研工作站,安徽 马鞍山 243021;2.天津科技大学 天津制浆造纸重点实验室,天津 300457;)
通过顶空气相色谱技术测定了季铵型阳离子醚化剂合成过程中反应物环氧氯丙烷及副产物1,3-二氯-2-丙醇的实时含量变化。通过称量取样并用15.8%Na2SO4及0.1%AgNO3的水溶液大比例稀释的方式快速制备了用于顶空气相色谱分析的样品。通过物料衡算结合色谱峰面积与所测物质浓度的线性关系,提出了由样品质量及色谱峰面积计算阳离子醚化剂的转化率公式。结果显示此方法便捷、准确,可用于指导阳离子醚化剂合成工艺的研究。
醚化剂、顶空气相色谱、转化率
3-氯-2-羟丙基三甲基氯化铵是由环氧氯丙烷与三甲胺盐酸盐反应制得的一种具有广泛用途的季铵型阳离子醚化剂[1,2],可用作絮凝、助染、相转移催化及淀粉等天然高分子的改性,已在造纸、纺织、石油开采及环保等领域展现了很好的应用效果。其合成原理、英文名称及缩写为:

目前,它的最大用途是与淀粉反应后用于造纸湿部[3-6],此类阳离子淀粉除能改善纸浆的留着及滤水外,还赋予了成纸更好的强度,加之对pH值更宽的适用范围,在造纸湿部环境向中碱性发展的趋势下,其应用也将更加广泛。
为保证产品质量,国内主要变性淀粉厂多使用进口醚化剂,如陶氏化学公司的产品,其有效物含量为69%,外观为无色透明的水溶液,而国内的部分产品有效物含量及颜色差别则较大。当CHPTAC粗产物中环氧氯丙烷及副产物1,3-二氯-2-丙醇含量较高时,后期纯化难度及成本将大大提高,这些有机杂质同时也会影响下游产品的质量,如环氧氯丙烷在碱性条件下会与淀粉发生交联反应影响改性淀粉的溶解及分散性能。因此,除采用经济高效的提纯工艺外,减少合成过程中副产物的生成及反应物残留对提高CHPTAC的品质至关重要。Dow公司对CHPTAC粗产物中主要物质的测定方法做了比较详细的介绍[7],刘付芳[8]、周维义[9]据此方法分别用氯仿及苯甲酸甲酯多次萃取样品结合气相色谱对合成产物中有机杂质进行了分析。上述方法能分析终产物中主要挥发性有机杂质,但样品预处理相对复杂耗时,萃取效率的高低也会影响准确的定量。因此,建立一种快速、准确的分析方法对合成过程进行监测,尽可能多地掌握反应体系内多种物质的变化规律,对改善合成工艺以减少粗产物中有机杂质的生成具有重要的意义。
顶空气相色谱 (HS-GC,headspace gas chromatographic)技术可较大限度地减少体系中非挥发性物质对分析检测造成的影响[10-16],它的优势在于无需/极少的样品预处理过程。此研究通过简单快捷的制样方式,针对阳离子醚化剂合成体系中各物质的特点,采用HS-GC实现了CHPTAC合成过程中主要有机挥发物环氧氯丙烷及副产物1,3-二氯-2-丙醇的快速检测,并通过实时数据采集推导了CHPTAC的转化率公式,以期针对性调整合成条件以助于降低主反应物残留并尽可能减少副反应的发生。
1 实验试剂
AgNO3:分析纯,广东光华化学品有限公司;环氧氯丙烷(ECH,epichlorohydrin):分析纯,上海凌峰化学试剂有限公司;Na2SO4、乙醇、三甲胺盐酸盐(TMAC,trimethylammonium chloride):分析纯,国药集团化学试剂有限公司;1,3-二氯-2-丙醇 (DCP,1,3-dichloro-2-propanol):色谱纯,阿拉丁试剂有限公司
2 仪器
低温恒温槽:DYF-5L/40型,巩义市予华仪器有限公司;乳液剪切机:JRJ-300-I型,上海标本模型厂;数显恒速搅拌器:Senco S-312型,上海申生科技有限公司;顶空进样器:DANI HS 86.50,Italy;气相色谱仪:GC-2010, Shimadzu,Japan
3 实验方法
3.1 CHPTAC的合成
采用水溶剂法合成CHPTAC:将准确质量的ECH加入水中,加入十六烷基三甲基溴化铵,用乳液剪切机高速打散10min,将乳液转移至烧瓶中,记录加入烧瓶的液体总质量;开启搅拌器及低温恒温槽,调节反应体系温度至设定值,加入TMAC水溶液,继续搅拌至反应结束后倾出粗产物。以上各物质的质量均以差量法计算。
3.2 合成过程中待测样品的制备及分析
3.2.1 样品的制备
通过250倍比例稀释调整分析精度,并避免合成样品分析待测过程中后续反应的发生。稀释介质为15.8%Na2SO4与0.1%AgNO3(质量浓度)的混合水溶液。采取称量取样避免由于样品粘度变化造成的取样量不确定性干扰[11],具体步骤如下:
以TMAC加入ECH为反应初始时刻(t0),各组分在高速搅拌下迅速达到均匀,用吸管从体系中取少量反应溶液并滴加0.2g(精确至0.0001g)至50ml容量瓶中,用稀释溶液迅速定容,待沉淀完全后取2ml上层清液转移至顶空瓶中,(不要将样品挂壁),用压盖器密封后上机分析。反应过程中不同时刻的样品制备均按此方法进行。
3.2.2 仪器操作条件
顶空进样器:恒温箱平衡温度90℃,平衡时间10min,振动条件为强烈;顶空瓶加压时间12s;取样管取样时间1min,样品在管内平衡时间3s;取样间隔时间2min
气相色谱仪:柱温:50℃,毛细管型号:DB-5(30 m×0.35 mm,i.d.0.1μm); 载 气 及 流 量 : 高 纯N2,4.3ml/min;检测器:氢离子火焰检测器;燃气及助燃气:高纯 H2,40 ml/min;高纯空气,400 ml/min
4 实验结果
4.1 HS-GC对CHPTAC合成过程中主要挥发性物质的定性与定量
图1为HS-GC分析得到的气相色谱图,可看出,当所选顶空进样条件为恒温箱75℃,平衡时间8min,即可实现ECH和DCP在气相色谱中的分离,但两者在该条件下测得的信号强度差异较大,这种现象与它们在水中的挥发性质相关,也将影响在同一反应体系中同时测定两种物质的极值范围。

图1 顶空气相色谱对ECH及DCP的定性
配制不同浓度ECH和DCP的标准溶液,按3.2.2中所述HS-GC条件测定不同浓度下ECH及DCP对应的峰面积,建立两种物质浓度及峰面积的关系,结果如图2所示。可以看出,样品中ECH及DCP在较大浓度范围内各自的峰面积与浓度之间存在着很好的线性关系。
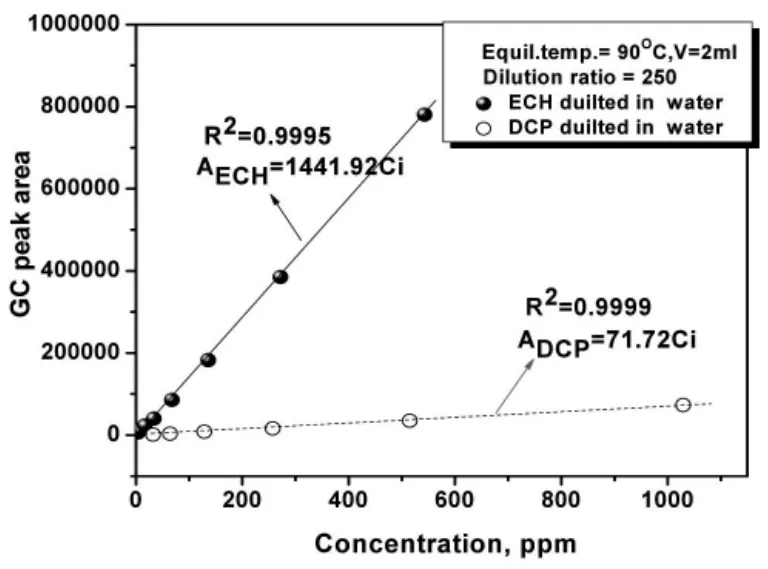
图2 各物质浓度与色谱峰面积的线性关系
因此,运用顶空气相色谱能对合成样品中挥发性有机反应物及主要副产物进行准确定量。然而,由于初始时刻ECH浓度远大于DCP(初始时刻反应体系中副产物DCP理论含量为零),加之DCP响应系数仅为ECH的1/20,因此,实现在CHPTAC合成的全程同时测定两物质的浓度变化的难度较大,需调整制样方式及顶空进样条件,既增加DCP信号又不造成ECH信号过大而超出合理的线线性响应范围。
4.2 稀释倍数对待测物质分析的影响
制样时的稀释倍数是影响顶空气相色谱准确定量的重要因素,倍数过大,低挥发性物质不易被检测到;倍数过小,势必增大分析误差,降低分析精度,此外,稀释倍数小,合成过程中所取的样品会在待测时发生后续反应。图3为同一时刻反应溶液按不同倍数稀释后,ECH及DCP峰信号随样品存放时间的变化情况。
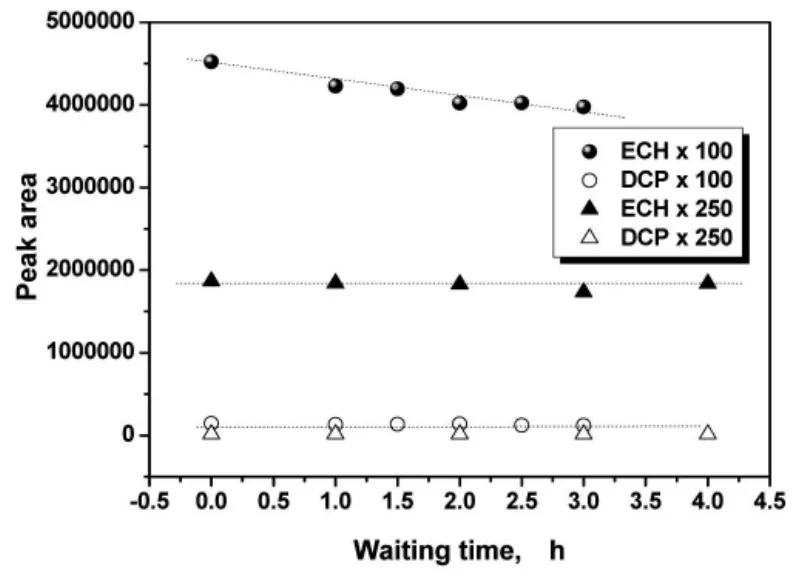
图3 存样时间及稀释倍数对样品分析的影响
可以看出,反应溶液按100倍稀释时,检测到的ECH随样品存放时间延长而减少,说明其在稀释溶液中仍会与TMAC反应;当稀释至250倍后,所测ECH含量没有发生变化。在此研究中,两样品的进样间隔设定为2min,因此待测时间内样品中主要物质的量不会发生明显变化。
4.3 盐析效应在分析中的应用
通过上述分析发现,250倍稀释比例并不能较好解决DCP信号较弱的问题,而降低稀释倍数又可能造成样品待测过程中后续反应的发生。通过换用粗长取样管(顶空进样器内部零件)、减小分流比、提高平衡温度、增加样品体积,均可增强样品在色谱中的响应,然而DCP信号强度仍不能达到理想范围。盐析效应[14]可降低物质在水溶液中的溶解度,具体方法为配制近饱和Na2SO4水溶液,将其作为待测样品稀释介质,表1列举了ECH及DCP分别以H2O和Na2SO4作为稀释液时,按平衡温度90℃、平衡时间10min,采用HS-GC测定得到的浓度与各自峰面积的线性关系。
以上数据表明,采用饱和Na2SO4作为稀释溶剂时,DCP线性系数增加了3倍,而ECH变化并不大。在此条件下,既实现反应物ECH含量的检测,也可同步检测DCP的微量变化,达到了同时对合成反应全过程溶液中两种主要有机挥发物同时检测的目的。
4.4 平衡时间对分析的影响
样品经加热后,挥发性物质由液相转移至气相,最终在气液两相中达到平衡往往需要一定时间,样品由顶空进样器注入气相色谱之前,须在恒温箱中完成气液两相平衡的过程。根据样品溶液的粘度、物质挥发性质的不同,不同样品的平衡时间往往差别较大。
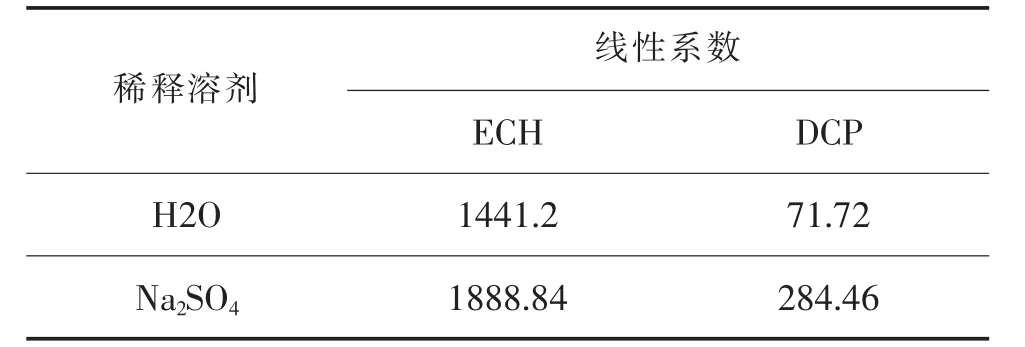
表1 不同稀释溶剂中ECH和DCP各自色谱峰面积与浓度的关系
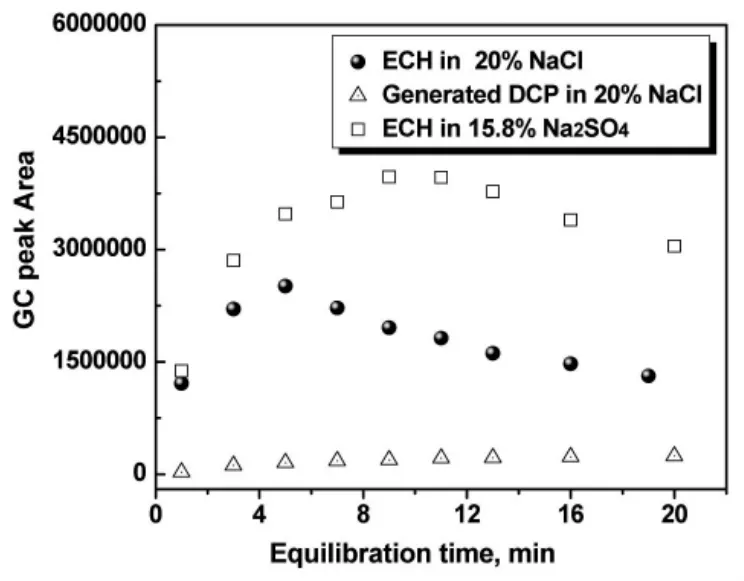
图4 平衡时间对色谱峰面积的影响
图4为选用饱和Na2SO4溶液作为稀释溶剂时,样品中ECH信号强度与平衡时间的关系,从图中可以看出,稀释样品经过在90℃下加热后,有更多的挥发性有机物从液相转移至气相中,而GC测定得到的ECH峰面积也会不断增大,当平衡时间为10min左右时,ECH峰面积达到最大,更长时间的加热会导致峰面积迅速减小,因此推断样品在加热过程中ECH发生了反应。为增强DCP信号,此研究选择将平衡温度从75℃提高至90℃,但同时也造成了ECH在更高温度下长时间加热而发生水解生成了2,3-环氧-1-丙醇[1];若降低温度,DCP 信号强度将明显降低,如图1所示。尽管如此,选择90℃、10min作为样品达到气液两相的平衡条件,仍可以得到ECH及DCP峰面积与各自浓度间很好的线性关系,如表1。
4.5 氯离子对样品分析的影响
盐析效应可增强HS-GC测定挥发性物质的响应值,NaCl与Na2SO4具有同样的作用,只是对信号增强的效果不同,如图4所示。此外,在NaCl饱和溶液中,ECH峰信号较早出现降低的趋势,且在分析时发现有DCP的生成,如图4。随加热时间的延长,DCP含量在不断增长,因此推断在NaCl饱和溶液的稀释体系中,ECH不仅自身会发生上述的水解反应,也极有可能与氯离子反应生成DCP。在对合成样品检测的过程中,发现在反应初期有大量的DCP生成,如图5所示,验证了在90℃高温条件下,合成溶液的稀释样品中发生了ECH与氯离子的反应,生成了DCP,这就对同时分析样品中反应物ECH及副产物DCP带来了极大的干扰。为排除氯离子干扰,此研究在稀释溶液中预添加质量浓度为0.1%的AgNO3,其用量刚好微大于初始时刻样品中TMAC物质的量,用以提前沉淀反应体系中含有的氯离子,避免在后续分析时造成干扰。
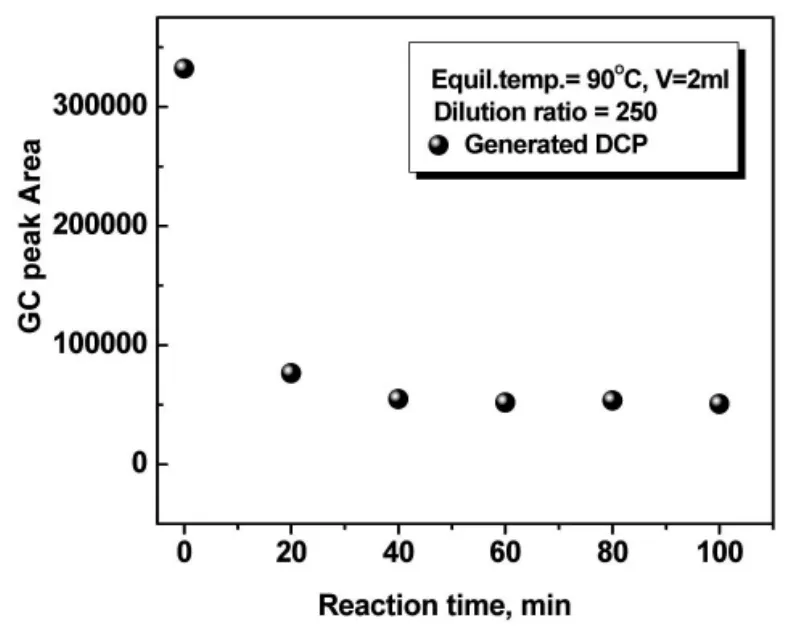
图5 两相平衡过程中氯离子对分析检测的影响
4.6 应用:合成CHPTAC过程中转化率的计算
在阳离子醚化剂CHPTAC合成过程中,两种副反应产物即DCP及双季铵盐的存在都会严重影响产品的质量。DCP生成途径如下:

当体系中游离过量的三甲铵时,在碱性条件下CHPTAC可能会与之继续反应生成双季铵盐。当然适当控制反应条件:如物料比、pH值、反应温度等因素都会大大减小副产物的产生,尤其对于双季铵盐而言,在其他反应条件适当的前提下,改变TMAC和ECH的物料比即可减少CHPTAC向其转化[17-20],因此在本研究中,可以通过ECH物料衡算推导CHPTAC的物质的量,进而得出CHPTAC产率公式。根据ECH在反应体系中几种可能的存在及转化方式,得出如下关于ECH物料衡算公式:
NECH0=NECHt+NCHPTtAC+NDCPt
其中 分别为反应初始时刻及反应中某时刻反应体系中ECH物质的量,NCHPTtAC为ECH参与主反应生成CHPTAC物质的量,ND为ECH参与副反应生成DCP物质的量;
准确记录反应不同时刻的取样量mt及气相色谱分析样品得到的各物质的峰面积,建立峰面积与物质浓度的线性关系,结合化学衡量计算得到CHPTAC的产率公式如下:

式中,m0为反应初始时刻取样质量,AECH、ADCP分别代表不同时刻样品中环氧氯丙烷与1,3-二氯-2-丙醇对应的峰面积。φ为固定顶空气相操作条件得到的常数,值为4.763。

图6 CHPTAC和DCP的生成规律反应体系总质量为 100g,NECH:NTMAC=1.1:1,NTMAC为0.2mol
从图中可以看出,随着反应温度的提高,反映明显变快,在以上条件下,20℃时反应210min,反应物ECH转化率为94.62%,其中有1.69%的ECH生成了DCP,CHPTAC的产率为92.93%;而当反应温度为30℃时,反应195min,ECH转化率为95.64%,而生成的DCP占其中的3.83%,CHPTAC产率为91.81%。从反应效果来看,20~30℃范围内CHPTAC产率均能达到92%左右,若反应温度继续升高,势必会产生更多的DCP,CHPTAC产率也会降低。而当温度降低时,如图6反应时间会延长至5h左右,粗产物中残留的ECH含量也很高。因此从反应历程来看,反应初始阶段温度不宜过高,避免在高浓度下生成更多的副反应产物,而当反应进行一段时间后,体系中反应物浓度下降,这时温度对副反应影响较小,可以适当升高温度促进剩余反应物的进一步反应,减少ECH的残留、提高产率[2]。从以上分析不难发现,通过HS-GC的分析方法不仅可以便捷的掌握不同时刻反应物及主要产物的准确含量,同时对合成工艺的改善具有重要的指导作用。
5.结论
采用顶空气相色谱对3-氯-2-羟丙基三甲基氯化铵合成过程中主要挥发性组分实现了快速、准确的检测。通过称量式取样及大比例稀释的方式分别避免了体积取样和样品待测过程中的影响分析准确性的不确定性因素。采用15.8%Na2SO4选择性提高了副产物1,3-二氯-2-丙醇的色谱信号强度,采用0.1%AgNO3水溶液消除了样品在分析过程中的氯离子干扰。结果表明,该方法制样简便、分析准确快速,可由取样质量及样品峰面积间接计算醚化剂合成产率及副反应杂质的生成量。
[1]衣洪筑,辛峰.阳离子醚化剂CHPTMAC合成工艺的研究[D].天津:天津大学,2004.
[2]丁峰,辛峰.微乳条件下ECH和TMAC的合成反应及反应动力学研究[D].天津:天津大学,2004.
[3]V.Haack,T.Heinze,G.Oelmeyer,Macromol.Mater.Eng.2002,287:495.
[4]H.Q.Yu,Y.H.Huang,H.Ying,C.B.Xiao,Carbo hydr.Polym.2007,69:29.
[5]A.Tara,F.Berzin,L.Tighzert,B.Vergnes,J.Appl.Polym.Sci.2004,93:201.
[6]L.L.Wang,W.Ma,S.F.Zhang,Carbohydr.Polym.2009,78:602.
[7]L.J.Deavenport,B.I.Lopez,Process for preparation of halohydroxypropyl-trialkylammonium halides[P].US:5463127.
[8]刘付芳,孙洁,孙惠莲.气相色谱法分析3-氯-2-羟丙基三甲基氯化铵中的微量有机物质[J].色谱,2002,20(4):362.
[9]周维义,范国梁,姜东峰.气相色谱法分析阳离子醚化剂中残存的环氧氯丙烷和1.3-二氯丙醇 [J].色谱,2004,22(6):650.
[10]B.Y.Ioffe.,A.G.Vitenberg,Wiley-VCH,New York,1984.
[11]X.S.Chai,Q.X.Hou,F.J.Schork,J.Chromatogr.A 2004,1040:163.
[12]H.L.Li,H.Z.Zhan,X.S.Chai,J.Chromatogr.A 2007,1175:133.
[13]X.S.Chai,Q.X.Hou,F.J.Schork,J.Appl.Polym.Sci.2006,99:392.
[14]J.F.Zhong,X.S.Chai,S.Y.Fu,J.Instrum.Anal2009,28:1111.
[15]X.S.Chai,J.Y.Zhu,Anal.Chem.1998,70(16):3481.
[16]A.S.Teja,Ankur K.Gupta a,Kerry Bullock,X.S.Chai,J.Y.Zhu,Fluid Phase Equilib.2001,185:265.
[17]Eugene F.Paschall,Orland Park.Starch ethers containing nitrogen and processformakingthesame[P].US:2876217,1959
[18]Arthur M.Goldstein,Plainview,Erwin M.Heckman,et al.Process for making starch ethers[P].US:3649616,1972.
[16]游霞,杨漫波.盐酸返滴定测定3-氯-2-羟丙基三甲基氯化铵含量的方法研究[J].四川化工,2009,12(4):37.
[17]Sten I.Falkehag,Peter Dilling.Process for producing cationic lignin amines[P].US:3718639,1973.
[18]松富徹,武田静雄,文野森幸成.3-氯-2-羟丙基三甲基氯化铵的合成方法[P].JP:145054,1992.
[19]杨锦宗,张永华,菅秀君.3-氯-2-羟丙基三甲基氯化铵的合成方法[P].CN:1187484A,1998.
[20]张永华,杨锦宗.相转移催化合成3-氯-2-羟丙基三甲基氯化铵[J].化学试剂,1998,20(5):306.
制浆造纸国家重点实验室开发基金(201451)
*通讯作者:陶正毅(1984.2),男,讲师,博士,主要从事造纸湿部化学、生物基新材料的研究.E-mail:taozyi@tust.edu.cn
