Ca(ClO)2消毒剂对高羊茅种子的消毒效果
2016-12-21文昭竹龚梨霞张志飞
尚 丹,文昭竹,龚梨霞,穆 麟,张志飞,2*
(1 湖南农业大学农学院,长沙 410128; 2 湖南农业大学草业科学研究所,长沙 410128)
Ca(ClO)2消毒剂对高羊茅种子的消毒效果
尚 丹1,文昭竹1,龚梨霞1,穆 麟1,张志飞1,2*
(1 湖南农业大学农学院,长沙 410128; 2 湖南农业大学草业科学研究所,长沙 410128)
为研究Ca(ClO)2对高羊茅种子作为外植体诱导培养愈伤组织时的消毒效果,以3种不同的前处理方式配合Ca(ClO)2溶液不同浓度(3%、20%)和不同消毒时间(15、30、45、60 min)进行高羊茅种子消毒处理,以升汞消毒剂处理的高羊茅种子为对照。愈伤组织诱导培养结果表明:仅用Ca(ClO)2搅拌的前处理的感菌率显著高于其余两种前处理;Ca(ClO)2高浓度处理比低浓度处理的出愈率低;Ca(ClO)2处理的出愈率和愈伤总数均优于升汞处理;最佳的消毒组合是无菌环境下用Ca(ClO)2搅拌+3% Ca(ClO)2浸泡60 min,该消毒处理方式可降低种子感菌率、缩短出愈时间、提高出愈系数,为建立高羊茅高效再生体系奠定实验基础。
高羊茅;组织培养;消毒;次氯酸钙
高羊茅(FestucaarundinaceaSchreb)是多年生禾本科羊茅属(Festuca)草本植物,在我国广泛用于低成本的水土保持及草坪绿化[1]。基因工程是高羊茅遗传改良的重要方向,再生体系的建立是基因工程研究的基础。高羊茅茎尖培养[2],愈伤组织[3]、原生质体[4]、胚性悬浮培养细胞获得再生植株[5]和直接用高羊茅花药进行培养获得再生植株的研究已初具成效[6,7]。目前以种子为外植体诱导愈伤组织构建再生体系是高羊茅组织培养的主要方法。愈伤组织培养体系中防止污染是首要克服的问题,在保证熟练操作和提高培养室洁净度的前提下,外植体消毒方法成为影响愈伤组织诱导成功的关键因素[8]。
升汞(HgCl2)是较常用的外植体消毒剂,常用的组合是75%乙醇加0.1%升汞[9,10],但处理完的Hg2+难以彻底清除,对种子发育相关酶产生毒害,导致出愈率低下、出愈时间延长[11]。Ca(ClO)2常温下保存较稳定,遇水生成具有强氧化性的次氯酸,处理后容易清除且残留消毒液易挥发,是一种较好的消毒剂。本实验设计3种不同前处理方式结合后期Ca(ClO)2溶液不同的消毒时间和浓度,以升汞处理为对照,探讨最佳Ca(ClO)2消毒组合,为快速高效构建高羊茅再生体系提供技术支持。
1 材料与方法
1.1 实验材料
4个高羊茅品种:猎狗5号(Houndog 5)、水城(Shuicheng)、斗牛Ⅱ(Endeavor Ⅱ)、埃斯卡拉迪(Easycare)。水城为贵州省草业研究所提供,其他为百绿公司提供。
采用MS培养基(Murashige and Skoog,1962)为基本培养基,并添加10 mg/L 2,4-D。
1.2 实验方法
1.2.1 消毒处理方法
(1)种子消毒处理方式
A处理(仅用Ca(ClO)2搅拌):完整的高羊茅‘猎狗5号’种子用3%Ca(ClO)2溶液室温磁力搅拌3 h(78HW-1数显恒温磁力搅拌器,1800 rpm,下同),无菌水冲洗,4℃过夜;用无菌水搓种至无外稃脱落。次日在无菌环境下将前处理完的种子分成3份进行消毒处理。1)3%Ca(ClO)2处理:用3%Ca(ClO)2浸泡种子进行表面消毒,时间分别为15、30、45、60 min;2)20%Ca(ClO)2处理:用20%Ca(ClO)2(饱和次氯酸钙)浸泡,时间分别为15、30、45、60 min;3)对照:75%乙醇浸泡5 min,0.1%升汞浸泡15 min。
B处理(温水浸泡加Ca(ClO)2搅拌):完整的高羊茅‘猎狗5号’种子在50℃温水中浸泡4 h,无菌水冲洗,再用3%Ca(ClO)2溶液室温磁力搅拌3 h,无菌水冲洗,4℃过夜;用无菌水搓种至无外稃脱落。次日在无菌环境下将前处理完的种子分成3份进行消毒处理。1)3%Ca(ClO)2处理:用3%Ca(ClO)2浸泡,时间分别为15、30、45、60 min;2)20%Ca(ClO)2处理:用20%Ca(ClO)2浸泡,时间分别为15、30、45、60 min;3)对照:75%乙醇浸泡5 min,0.1%升汞浸泡15 min。
C处理(无菌环境下Ca(ClO)2搅拌):完整的高羊茅‘猎狗5号’种子用3%Ca(ClO)2溶液在室温无菌环境下磁力搅拌3 h,无菌水冲洗,4℃过夜。次日在无菌环境下将前处理完的种子分成3份进行消毒处理。1)3%Ca(ClO)2处理:分别用3%Ca(ClO)2溶液室温无菌环境下磁力搅拌15、30、45、60 min;2)20%Ca(ClO)2处理:分别用20%Ca(ClO)2溶液室温无菌环境下磁力搅拌15、30、45、60 min;3)对照:75%乙醇浸泡5 min,0.1%升汞浸泡15 min。
(2)愈伤组织培养
消毒处理后的种子分别接种于愈伤诱导培养基(MS+10 mg/L 2,4-D)中,每个处理接种20个培养皿,每个培养皿30粒种子,25±1℃,24 h暗培养。20 d后统计感菌率、出愈率、发芽率Ⅰ和愈伤总数。
1.2.2 不同品种高羊茅验证最优消毒处理方式
(1)不同品种高羊茅种子发芽实验。4个高羊茅品种种子进行滤纸发芽实验,每个处理4次重复,每个重复30粒种子,于人工气候箱中(25℃,16 h光照/18℃,8 h黑暗)培养,逐日观察记录发芽种子数,期间滤纸保持湿润状态。9 d后统计发芽率Ⅱ、发芽势、发芽指数。
(2)最优消毒处理方式的验证。根据上面的消毒实验结果选择最优组合,选取4个品种的高羊茅种子,每品种接种20个培养皿,每个培养皿30粒种子,25±1℃,24 h暗培养。20 d后统计感菌率、出愈率、发芽率Ⅰ和愈伤总数。
1.3 测定指标
感菌率=[接种20 d后感菌的培养皿数/接种的培养皿数]×100%
发芽率Ⅰ=[接种后20 d发芽的高羊茅种子数/接种的高羊茅种子数]×100%
出愈率=[20 d后产生的愈伤组织的高羊茅种子数/接种的高羊茅种子数]×100%
发芽率Ⅱ=[发芽实验第9天的发芽种子数/总种子数]×100%
发芽势=[发芽实验第5天的发芽种子数/总种子数]×100%
发芽指数=ΣGt/Dt
式中:Gt为不同时间(d)的发芽量;Dt为相应的发芽实验天数。
所有数据均采用SPSS19.0统计分析软件进行处理。对3种不同前处理方式,4个品种种子的发芽率Ⅰ、出愈率分别进行最小显著差数法多重比较(LSD);以降序排列各发芽率Ⅰ、出愈率和愈伤总数,以升序排列感菌率来对不同处理的消毒效果进行秩和比(RSR)排序。
2 结果与分析
2.1 不同前处理方式的种子消毒效果
2.1.1 A前处理方式的消毒效果
最小显著差数法多重比较结果表明:Ca(ClO)2溶液在不同的浓度和处理时间下的发芽率Ⅰ和出愈率均有显著差异(p<0.05)。A1、A3、A4的发芽率Ⅰ显著高于A2,也显著高于A5~A8及A-CK。A1~A4处理间的出愈率无显著差异,但显著高于A5~A8处理的出愈率;A5~A8处理和A-CK的出愈率无显著差异。A+3%Ca(ClO)2处理的种子感菌率普遍高于A+20%Ca(ClO)2处理和A对照(表1)。
综合评价(RSR)表明,A+Ca(ClO)2处理的综合效果均优于A-CK;A处理最佳组合是A7,即A +20%Ca(ClO)2浸泡45 min。
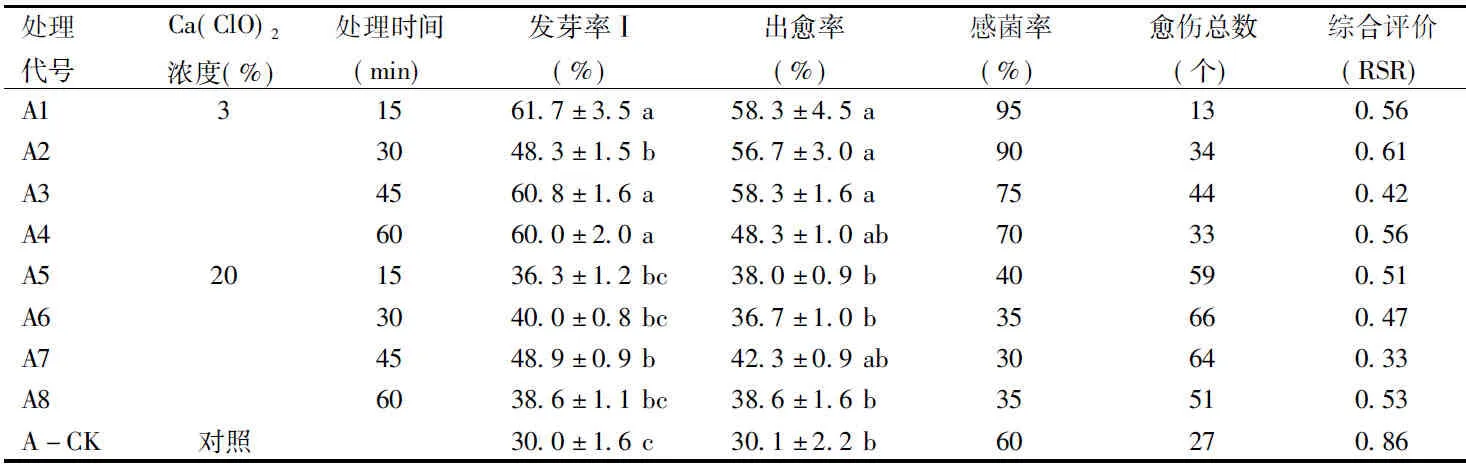
表1 A前处理的消毒效果Table 1 Disinfection effect of A pre-treatments
2.1.2 B前处理方式的消毒效果
由表2可知,B前处理下各组的发芽率Ⅰ和出愈率间均存在显著差异(p<0.05)。B1~B4处理的种子发芽率Ⅰ间无显著差异,但都显著高于B7、B8和B-CK的发芽率Ⅰ。B+3%Ca(ClO)2浸泡处理的出愈率显著高于B+20%Ca(ClO)2浸泡处理和B对照。B前处理下的感菌率得到了稳定控制,除B2、B7、B-CK外,其余处理的感菌率均小于或等于20%。B+3%Ca(ClO)2浸泡处理的愈伤总数明显高于B前处理下其他两种处理。
综合评价结果,B+Ca(ClO)2处理的消毒方法明显优于B对照,且低浓度Ca(ClO)2处理优于高浓度处理;B前处理最佳组合是B1,即B+3%Ca(ClO)2浸泡15 min。

表2 B前处理的消毒效果Table 2 Disinfection effect of B pre-treatments

(续表2)
2.1.3 C前处理的消毒效果
由表3可知,C5、C6处理的发芽率Ⅰ显著高于其他处理(p<0.05);C1、C2、C4处理的出愈率显著高于其他处理(p<0.05),其中C4处理的愈伤总数最多;C-CK的发芽率Ⅰ和出愈率都显著低于C+Ca(ClO)2处理;C+3%Ca(ClO)2处理和C-CK的感菌率略高于C+20%Ca(ClO)2处理,但总体都优于A、B两种前处理,维持在25%以下。
综合评价结果,C+Ca(ClO)2处理的消毒方法明显优于C对照的消毒方法,且Ca(ClO)2低浓度处理获得的愈伤总数高于高浓度处理;C处理最佳组合是C4,即C+3%Ca(ClO)2浸泡60 min。
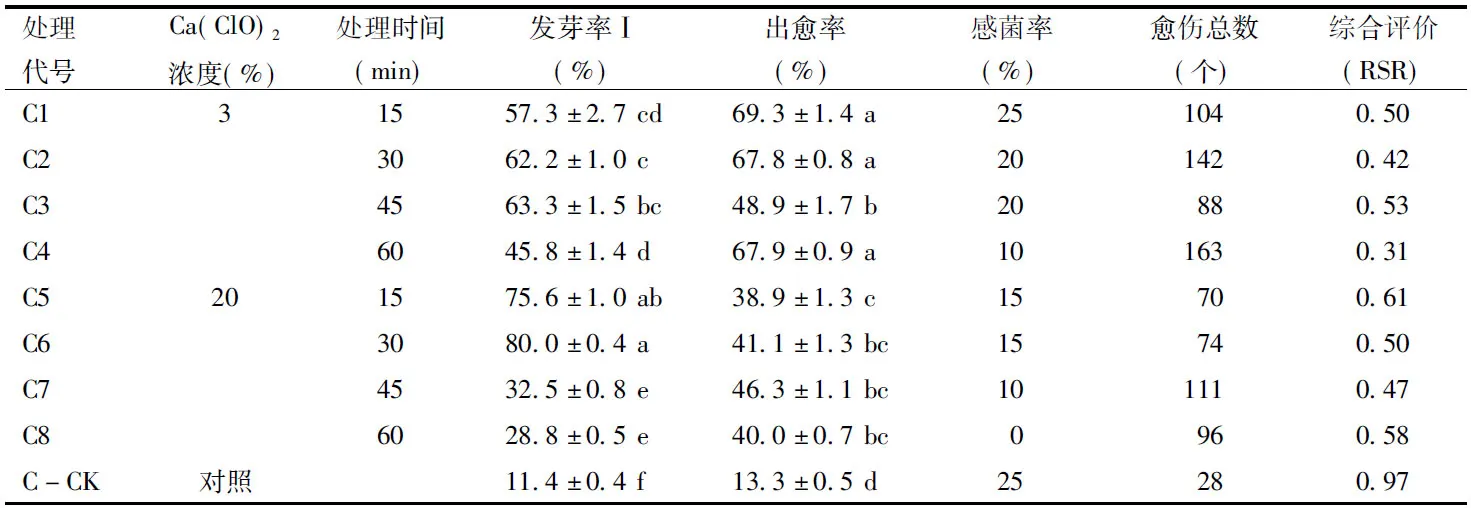
表3 C前处理的消毒效果Table 3 Disinfection effect of C pre-treatments
2.1.4 三种不同前处理方式对高羊茅种子消毒效果的综合评价
根据以上3种不同前处理方式的消毒结果发现,3种前处理+Ca(ClO)2处理的综合评价都优于各自对照处理。A前处理方式的感菌率明显高于B、C前处理方式,而C前处理方式在出愈率、愈伤总数和感菌率上整体优于A、B前处理方式。根据组织培养实验的基本要求:操作简便、药品毒性小、处理时间短、可快速获得愈伤并建立高效的再生体系等,最终选择C+3%Ca(ClO)2浸泡60 min为最佳处理方式。
2.2 不同品种高羊茅种子的发芽实验
随机选择实验室保存的4个高羊茅品种用于消毒处理方法的验证。如表4所示,猎狗5号和斗牛Ⅱ种子的发芽率Ⅱ高于80%,发芽势超过60%,发芽指数超过15。而埃斯卡拉迪和水城的发芽率Ⅱ、发芽势、活力指数显著低于猎狗5号和斗牛Ⅱ(p<0.05)。发芽实验结果表明,4个品种的种子在相同实验条件下活力差异较大,可以保证种子选择的多样性。
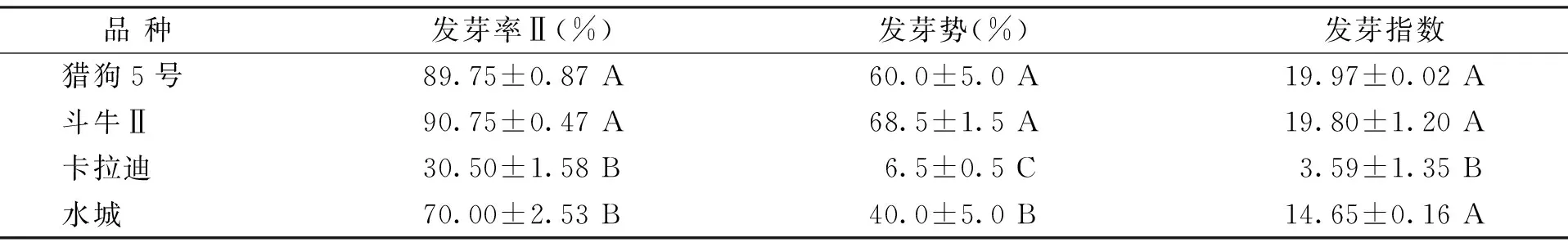
表4 不同品种高羊茅种子的发芽率、发芽势和发芽指数Table 4 Seed germination percentage,germination potential and germination index of different tall fescue varieties
2.3 最优消毒处理下不同品种高羊茅种子的表现
4种高羊茅种子在C+3%Ca(ClO)2浸泡60 min消毒后接种,进行愈伤组织诱导培养,结果表明:不同品种种子间感菌率都维持在30%以下(表5),整体的消毒效果较好。因为基因型差异,消毒处理后的4种高羊茅种子间的发芽率Ⅰ和出愈率差异显著(p<0.05),造成出愈总数有较大的差异。
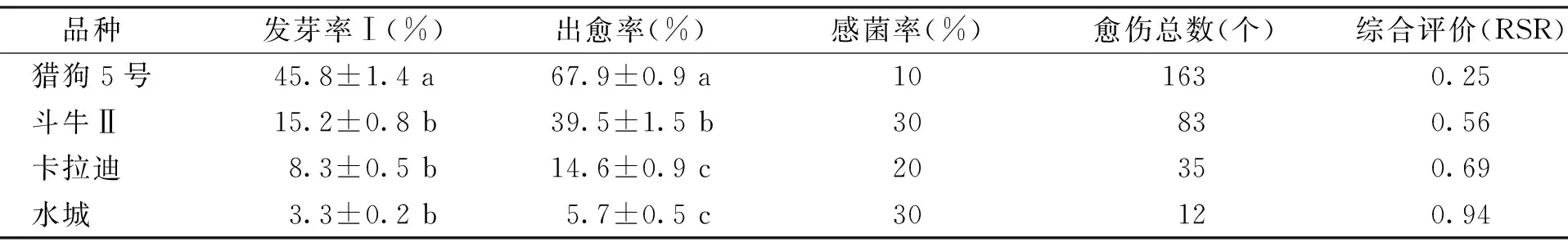
表5 C+3%Ca(ClO)2浸泡60 min下不同品种的高羊茅种子消毒效果比较Table 4 Comparison about the disinfection effect of different tall fescue variety seeds under C+3% Ca(ClO)2 60 min
3 讨论与结论
在愈伤组织培养中外植体消毒是为了获得无菌外植体用于诱导愈伤,感菌率是种子消毒效果最直接的反映[12,13]。种子消毒中常用的消毒剂有次氯酸钙、次氯酸钠、升汞、溴水、过氧化氢、抗生素等[14~16],其中75%乙醇加0.1%升汞被广泛使用。张付远等[17]研究表明,0.1%升汞在消毒野生凤仙花时感菌率仅为10%;张瑞越等[18]、郭丽等[19]也证明在油菜和鸡冠花种子中升汞的消毒效果最好。乙醇具有杀菌力和穿透力,有利于其他消毒剂的渗入,但残留的汞离子渗入种子不仅难洗净而且会抑制愈伤生长,废液还会给环境造成较大污染[20]。次氯酸钙和次氯酸钠的消毒原理相同,都是用产生的氯气消毒,残留消毒液易挥发,毒性小,对环境的污染也比较小。但根据本实验室前期的实验结果发现,次氯酸钠消毒后的高羊茅愈伤容易产生毛状根,导致继代时操作困难,甚至无法继代。另外,由于次氯酸钠属于挥发性液体,贮存过程中浓度变化较大,开封后不能久置,较难保证消毒效果的稳定。因此,本实验选择用次氯酸钙来代替升汞和次氯酸钠,对其消毒浓度和时间进行调整,以摸索出最适的条件,同时根据发芽实验下测得不同品种高羊茅的发芽率Ⅱ、发芽势、发芽指数与最适宜处理下测得发芽率Ⅰ、感菌率、出愈率、愈伤总数等7个指标,进行两两相关性分析发现:感菌率与其他指标间没有相关关系,仅与消毒方法密切相关,因此不同的高羊茅品种可以通用一种较好的消毒处理方式。
高羊茅种子较小且具有外稃,消毒过程中容易漂浮于消毒液的表面,导致消毒不彻底,而且高羊茅种子共生着枝顶孢霉属真菌(Acremoniumspp.),不易被杀灭[21],诱导愈伤组织时容易感菌。本实验在选择适宜消毒剂的情况下,利用磁力搅拌方法将种子完全浸泡于消毒液中,使种子与消毒液完全接触,并配合搓去种皮,将感菌率控制到最低。
本实验结果表明,灭菌环境下Ca(ClO)2打种+3%Ca(ClO)2浸泡60 min的消毒方法可以将感菌率控制在30%以下,诱导获得的健康愈伤组织可用于再生体系构建的进一步研究。
[1] 支大英,韩晓光,赵军胜,等.8种基因型的高羊茅的组织培养与植株再生[J].山东大学学报(理学版),2004(4):109-114.
[2] Kasperbauer MJ,Buckner RC,Springer WD.Haploid plants by Anther-panicle culture of tall fescue[J].Crop Science,1980,20:103-107.
[3] Lowe KW,Conger BV.Root and shoot formation from callus cultures of tall fescue[J].Crop Science,1979,19:397-400.
[4] Dalton SJ.Plant regeneration from cell suspension protoplasts ofFestucaarundinaceaSchreb.(tall fescue) andLoliumperenneL.(perennial ryegrass)[J].Journal of Plant Physiology,1988,132(2):170-175.
[5] Takamizo T,Suginobu KI,Ohsugi R.Plant regeneration from suspension culture derived protoplasts of tall fescue (FestucaarundinaceaSchreb.) of a single genotype[J].Plant Science,1990,72:125-131.
[6] 唐小艳,易自力,蒋建雄,等.高羊茅愈伤组织再生体系研究进展[J].四川草原,2006(5):8-11.
[7] 张志飞,饶力群,陈信波,等.高羊茅再生体系构建的基因型比较研究[J].中国草地学报,2009(5):102-106.
[8] 易自力,陈智勇,蒋建雄,等.三种冷季型草坪草愈伤组织再生体系的建立[J].中南林学院学报,2005(1):25-28.
[9] 刘卫东,刑伟一,文冬才,等.高羊茅组织培养基的选择[J].中南林学院学报,2005(6):116-119.
[10]栾博宇,耿 慧,王志锋,等.公农1号紫花苜蓿离体培养中最佳消毒方式和外植体种类的筛选研究[J].山东农业科学,2011(12):35-37.
[11]杨云贵,王红俊,杨雪娇,等.消毒处理对高羊茅种子发芽的影响[J].草地学报,2014,22(2):380-385.
[12]刘明稀,郭振飞.不同消毒方式对假俭草种子愈伤诱导的影响[J].草地学报,2012,20(2):383-388.
[13]董文科,马晖玲,陈春艳.不同消毒剂对甘肃红豆草种子消毒效果及萌发的影响[J].草原与草坪,2015(4):80-83.
[14]王维飞,韩烈保,曾会明.高羊茅愈伤组织诱导及植株再生的研究[J].草业科学,2006,23(6):99-103.
[15]金忠民,沙 伟,张艳馥,等.羊茅种子愈伤组织诱导及再生体系的建立[J].草业科学,2010,27(10):60-63.
[16]鲁黎明,安 影.不同消毒剂对烟草种子消毒效果及萌发的影响[J].种子,2012,31(4):93-95.
[17]张付远,李丹丹,廖忠明,等.不同消毒剂及激素对江西省野生白花凤仙花组培诱导的影响[J].现代农业科技,2015(15):164-165.
[18]张瑞越,季 勤,朱阳阳.不同消毒剂对油菜种子消毒效果的比较[J].淮阴师范学院学报(自然科学版),2011,10(2):127-129.
[19]郭 丽,徐 荣.不同消毒方式对接种鸡冠花种子影响的研究[J].现代农业,2015(4):62-63.
[20]黄作喜,邱 超,曾桢迦,等.植物组织培养中消毒剂的应用研究进展[J].内江师范学院学报,2013(6):26-30.
[21]梁蕊芳,黄丛林,于 荣,等.高羊茅植株再生体系的研究与建立[J].生物技术通报,2005(3):37-40.
[22]代 亮.草地早熟禾组织培养体系构建及转化探究[D].北京:北京林业大学硕士学位论文,2012.
Disinfectant Effect of Ca(ClO)2on Tall Fescue Seeds
SHANG Dan1,WEN Zhaozhu1,GONG Lixia1,MU Lin1,ZHANG Zhifei1,2*
(1 College of Agronomy,Hunan Agricultural University,Changsha,Hunan 410128,China;2 Grassland Science Institute,Hunan Agricultural University,Changsha,Hunan 410128,China)
To study the disinfection effect of Ca(ClO)2on tall fescue seeds as explant for callus induction,three different kinds of pre-treatments combined with Ca(ClO)2in different concentrations (3% and 20%) and different times (15,30,45,60 min) were performed in this experiment,with 0.1% HgCl2as control.The results of callus culture showed that infection rate of only Ca(ClO)2was significantly higher than that of other treatments.The callus rate of the treatment with high concentration of Ca(ClO)2was lower than that of low concentration Ca(ClO)2.The callus formation rate and total callus of Ca(ClO)2treatments was higher than that of 0.1% HgCl2treatment.The optimization disinfection treatment was that the tall fescue seeds was stirred in solution of Ca(ClO)2in sterile environment and soaking in the solution of 3% Ca(ClO)260 min,it will reduce seed infection rate,shorten the time and improve the callus numbers,also offer experimental basis for the construction of tall fescue regeneration system.
tall fescue (FestucaarundinaceaSchreb.);ttissue culture;disinfection;calcium hypochlorite
2016-04-19
尚 丹(1991-),女,回族,硕士研究生,Email:563167080@qq.com。*通信作者:张志飞,副教授,博士,研究方向为牧草及草坪草遗传改良,Email:zzf0917@aliyun.com。
中国博士后科学基金项目(2014M560643);湖南省教育厅优秀青年基金(14B083)。
Q943.1
A
1001-5280(2016)05-0563-06
10.16848/j.cnki.issn.1001-5280.2016.05.19
