低氧预处理BMSCs对大鼠AKI修复能力的影响及其机制研究
2016-12-21刘红丁小强王华陈洪宇俞小芳
刘红 丁小强 王华 陈洪宇 俞小芳
低氧预处理BMSCs对大鼠AKI修复能力的影响及其机制研究
刘红 丁小强 王华 陈洪宇 俞小芳
目的 探讨低氧预处理大鼠骨髓间充质干细胞(BMSCs)移植对大鼠缺血-再灌注(I/R)急性肾损伤(AKI)的修复作用及其可能机制。方法 采用200μmol/L氯化钴(CoCl2)低氧预处理大鼠BMSCs。夹闭双侧肾蒂40min建立大鼠I/R AKI模型,按随机数字表法分为颈动脉注射细胞培养基组(control组)、常氧培养BMSCs移植组(normoxia+BMSCs组)及低氧预处理BMSCs移植组(Co+BMSCs组),每组24只。BMSCs移植再灌注后24、48、72h及1周时每组各处死大鼠6只,采用开胸心腔内采血方法采集血样检测血清尿素氮(BUN)和血肌酐(Scr)水平,取肾脏组织观察形态学变化和肾小管间质损伤程度并评分;采用ELISA法和RT-PCR法检测再灌注后24h大鼠肾脏组织中血管内皮生长因子(VEGF)、碱性成纤维母细胞生长因子(bFGF)、肝细胞生长因子(HGF)、胰岛素样生长因子-1(IGF-1)的表达水平。 结果 (1)再灌注后24h,Co+BMSCs组、normoxia+BMSCs组大鼠BUN、Scr水平均低于control组(均P<0.05),且Co+BMSCs组低于normoxia+BMSCs组(P<0.05);肾小管间质损伤程度以control组最重,normoxia+BMSCs组次之,Co+BMSCs组最轻;再灌注后48h,Co+BMSCs组大鼠肾小管上皮细胞修复最明显,normoxia+BMSCs组次之;再灌注后1周,Co+BMSCs组大鼠BUN、Scr水平仍低于normoxia+BMSCs组和control组(均P<0.05),normoxia+BMSCs组和control组出现了明显的肾小管上皮细胞萎缩及间质纤维化等慢性改变,而Co+BMSCs组无此改变。(2)再灌注后24h,normoxia+BMSCs组大鼠 bFGF表达水平高于 control组(P<0.05),而 Co+BMSCs组的 bFGF表达水平明显高于normoxia+BMSCs组(P<0.05);normoxia+BMSCs组大鼠HGF表达水平高于control组,但差异无统计学意义(P>0.05),而Co+BMSCs组的bFGF表达水平均高于normoxia+BMSCs组和control组(均P<0.05);3组大鼠VEGF和IGF-1表达水平比较差异均无统计学意义(均P>0.05)。结论 与常氧培养BMSCs移植相比,低氧预处理后的BMSCs移植能更有效改善I/R大鼠肾功能、修复肾脏组织损伤,其作用机制可能与低氧预处理能更有效地促进BMSCs旁分泌HGF和bFGF等有关。
骨髓间充质干细胞 低氧 急性肾损伤 旁分泌
急性肾损伤(acute kidney injury,AKI)是临床常见的危重症,发病率和病死率非常高。以血液净化为主的治疗措施虽使AKI的疗效有了很大改进,但临床上尚未发现能有效促进肾小管损伤修复的治疗方法。骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)不仅具有干细胞多向分化潜能、支持造血、调节免疫等功能,还具有低免疫源性、易于获取、来源丰富等特点,被认为是最有希望能用于AKI临床治疗的首选干细胞[1]。但从动物实验和早期的临床试验结果来看,BMSCs对肾脏损伤修复作用不尽如人意。目前体外扩增BMSCs大多在常氧条件下进行,而生理状况下BMSCs在骨髓内的生长环境是低氧的,体外常氧培养可能导致BMSCs的迁移、分泌功能下降。本研究采用化学低氧剂氯化钴(CoCl2)模拟低氧环境,研究低氧预处理后BMSCs移植对大鼠肾脏缺血-再灌注(ischemia repeffusion,I/R)AKI修复作用的影响,并探讨低氧预处理后BMSCs旁分泌相关因子血管内皮生长因子(VEGF)、碱性成纤维母细胞生长因子(bFGF)、肝细胞生长因子(HGF)、胰岛素样生长因子-1(IGF-1)的表达在其中的可能作用,从而为优化BMSCs移植治疗AKI提供参考。
1 材料和方法
1.1 材料 100~130 g(细胞移植供体)及350~400 g(细胞移植受体)清洁级雄性SD大鼠(复旦大学上海医学院实验动物中心),LG-DMEM培养基、0.25%胰蛋白酶、胎牛血清(美国GIBCO公司),CoCl2、VEGF检测试剂盒、bFGF检测试剂盒、HGF检测试剂盒、IGF-1检测试剂盒(武汉优尔生科技股份有限公司),Power SYBRR Green PCR Master Mix(日本TAKARA公司),引物合成(上海生物工程有限公司)。Transwell板(美国Corning公司),二氧化碳恒温培养箱(美国Thermo Forma公司),倒置相差显微镜(美国Olympus公司),超净工作台(苏州净化设备厂),流式细胞仪(美国Beckman Coμlter公司)。
1.2 方法
1.2.1 BMSCs的分离、培养及鉴定 取100~130 g雄性SD大鼠为细胞供体,采用全骨髓贴壁法分离培养BMSCs,取P3代细胞采用流式细胞术鉴定其表面标志物,具体操作参考文献[2]。
1.2.2 低氧预处理BMSCs 采用化学低氧剂CoCl2(浓度200 μmol/L)预处理大鼠BMSCs(培养24h),具体操作参考文献[2]。
1.2.3 建立I/R AKI模型 4%戊巴比妥钠(40mg/kg体重)腹腔注射麻醉大鼠,暴露肾脏,分离双侧肾蒂,无创伤动脉夹持续夹闭双侧肾蒂40min,夹闭5min后可观察到肾脏明显瘀血呈紫色,40min后恢复再灌注,可看到肾脏很快由紫黑色逐渐转为鲜红色,表明再灌注成功。
1.2.4 制备细胞悬液及细胞移植 将P3代细胞消化传代后随机分成常氧培养组(normoxia组)和低氧预处理组(Co组),消化洗涤后用不含FBS的LG-DMEM重悬细胞,调整细胞密度为1×106个/ml。大鼠再灌注成功后即刻再次麻醉,结扎颈动脉远心端,向颈动脉注入细胞悬液,注射完毕后结扎近心端。
1.2.5 动物实验分组 将大鼠I/R AKI模型采用随机数字表法分为3组,分别为颈动脉注射细胞培养基组(control组)、常氧培养BMSCs移植组(normoxia+BMSCs组)及低氧预处理BMSCs移植组(Co+BMSCs组),每组24只。各组大鼠移植成功后24、48、72h和1周时分别处死6只,采用开胸心腔内采血方法采集血样5ml,分离血清,应用尿素酶-GLDH法检测血清尿素氮(BUN)浓度,应用酶标法检测血清肌酐(Scr)浓度,并取肾脏组织制备石蜡切片后行HE染色。
1.2.6 肾脏组织形态学观察 采用盲法原则由病理科医师在光镜下观察切片中肾脏组织的形态学变化,并进行肾小管间质损伤程度分级(采用Jablonski评分法)。每例切片200倍光镜下随机选取皮髓交界处10个不重叠视野,正常计0分,受损肾小管间质<25%计1分,25%~50%计2分,51%~75%计3分,>75%计4分,以此作半定量分析计算其平均值,评分值越高代表损伤程度越重。
1.2.7 旁分泌相关因子及肾功能指标检测 用双抗体夹心ELISA方法检测移植24h后I/R大鼠肾脏组织中VEGF、bFGF、HGF及IGF-1水平,操作方法参照试剂盒说明书。
1.2.8 RT-PCR检测旁分泌相关因子mRNA表达 按TAKARA试剂盒说明书用Trizol试剂提取移植24h后I/R大鼠肾脏组织总RNA。将总RNA用逆转录试剂盒进行反转录得到cDNA。取1 μl进行20μl体系的RTPCR反应,反应条件为:95℃预变性30s;95℃变性5s,60℃复制20s,72℃延伸30s,共40个循环。在PCR循环中,当荧光强度大于仪器软件计算出的循环阈(Ct)值时,样本被认为是阳性。利用检测到的Ct值,以βactin mRNA为内参照,计算目的基因mRNA相对表达量。所有样本重复测定3次。各基因上、下游引物序列见表1。

表1 各基因引物序列
1.3 统计学处理 应用SPSS 18.0统计软件;计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果
2.1 3组I/R大鼠各时点BUN、Scr水平比较 见表2。

表2 3组I/R大鼠各时点BUN、Scr水平比较
由表2可见,3组I/R大鼠BUN和Scr水平均在24h时达到峰值。在24h及1周时,3组I/R大鼠BUN、Scr水平比较有统计学差异(均P<0.05);两两比较,24h时,Co+BMSCs组、normoxia+BMSCs组大鼠BUN、Scr水平均低于control组(均P<0.05),且Co+BMSCs组大鼠BUN、Scr水平均低于normoxia+BMSCs组(P< 0.05);1周时,Co+BMSCs组大鼠BUN、Scr水平仍均低于normoxia+BMSCs组和control组(均P<0.05),而normoxia+BMSCs组与control组比较差异均无统计学意义(均P>0.05)。3组I/R大鼠48、72h时的BUN、Scr水平比较均无统计学差异(均P>0.05)。
2.2 3组I/R大鼠各时点肾脏组织形态学比较 见图1。
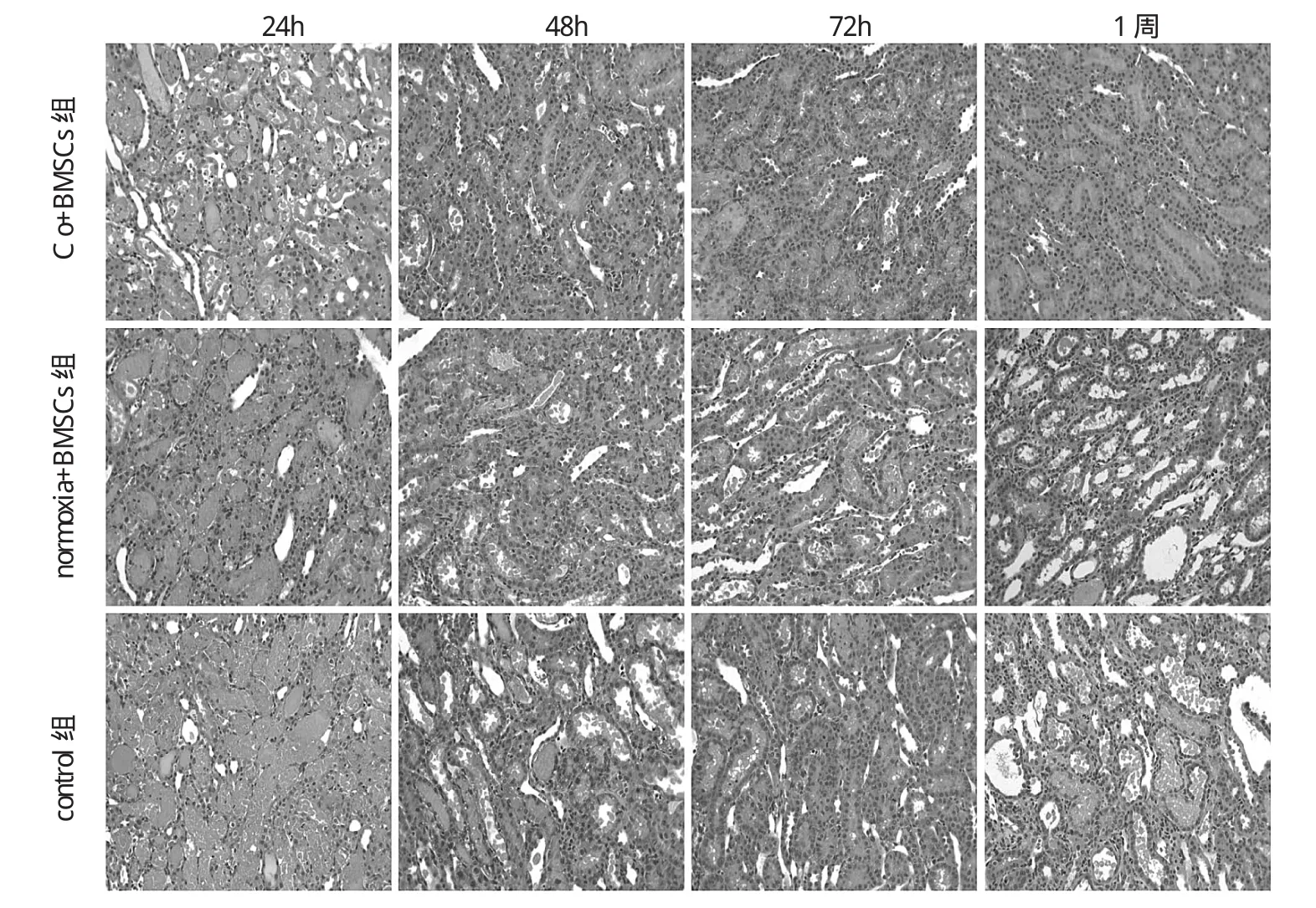
图1 3组I/R大鼠各时点肾脏组织形态学比较(HE染色,×200)
由图1可见,再灌注后24h,肾小管上皮细胞坏死、脱落、大量管型形成,以control组损伤最重,normoxia+ BMSCs组次之,Co+BMSCs组损伤最轻;再灌注48h后上皮细胞增生修复,其中Co+BMSCs组修复最明显,normoxia+BMSCs组次之,control组修复最差;再灌注1周后control组和normixa+BMSCs组出现不同程度的慢性化改变,如肾小管上皮细胞萎缩、管腔扩张、间质炎症细胞浸润等,而Co+BMSCs组无明显上述慢性化改变。
2.3 3组I/R大鼠各时点肾小管间质损伤程度评分比较 见表3。
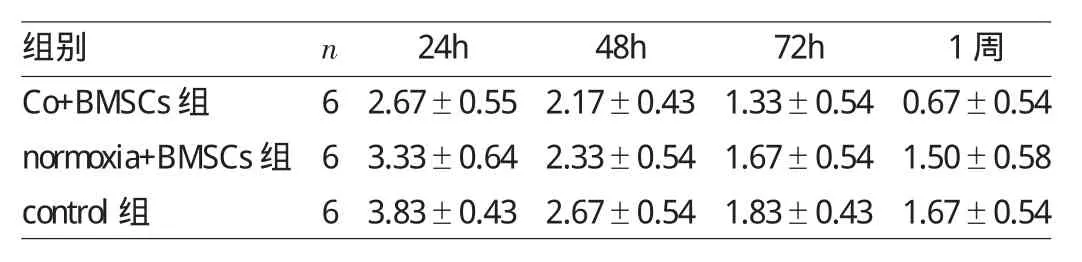
表3 3组I/R大鼠各时点肾小管间质损伤程度评分比较(分)
由表3可见,再灌注后24h时,control组大鼠肾小管间质损伤程度评分高于normixa+BMSCs组及Co+BMSCs组(均P<0.05),而Co+BMSCs组大鼠肾小管间质损伤程度评分低于normixa+BMSCs组(P<0.05);随着时间的延长,各组大鼠肾小管间质损伤程度逐渐减轻,在48、72h及1周时,肾小管间质损伤程度评分仍以control组最高(均P<0.05),Co+BMSCs组最低(均P<0.05)。
2.4 3组 I/R大鼠再灌注后 24hVEGF、bFGF、HGF、IGF-1蛋白、mRNA表达水平比较 见表4。
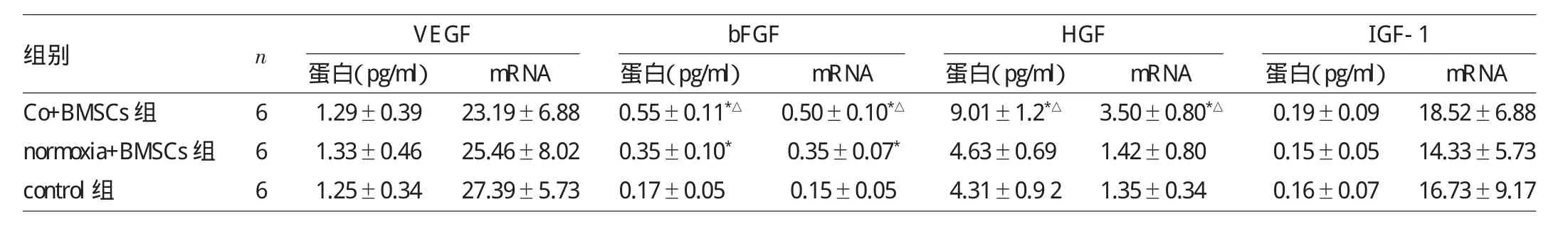
表4 3组I/R大鼠再灌注后24hVEGF、bFGF、HGF、IGF-1蛋白、mRNA表达水平比较
由表4可见,再灌注后24h,Co+BMSCs组I/R大鼠bFGF和HGF蛋白、mRNA表达水平均高于normixa+ BMSCs组和control组(均P<0.05),normixa+BMSCs组I/R大鼠bFGF蛋白、mRNA表达水平均高于control组(均P<0.05);3组I/R大鼠VEGF和IGF-1蛋白、mRNA表达水平比较均无统计学差异(均P>0.05)。
3 讨论
I/R是AKI常见病因,已有多项研究表明,在缺血性AKI动物模型中直接输注BMSCs可以改善肾功能,促进肾脏修复。Herrera等[3]发现经尾静脉注射BMSCs可以促进AKI大鼠的肾功能恢复,随后Semedo等[4]动物实验亦发现输注BMSCs可以保护急性缺血性肾损伤,减少肾间质炎症细胞浸润,加速肾小管上皮细胞增生。但也有研究表明,单纯的BMSCs在缺血微环境中存活和分化能力十分有限,da Silva等[5]研究发现直接输注BMSCs治疗AKI时,由于到达受损区域的细胞数量有限、细胞活力下降,导致治疗效果甚微;Brunswig-Spickenheier等[6]研究表明BMSCs移植治疗不能改善猪的I/ R损伤。因此,常规的BMSCs移植对AKI的治疗作用仍然存在质疑。
事实上,由于肾脏发生I/R后受损区域内存在严重的缺氧、剧烈的氧化应激和炎症反应,BMSCs对移植区域内的这一微环境变化非常敏感,极易发生细胞死亡从而直接影响BMSCs移植的治疗效果。低氧预处理是目前发现的最强有力的内源性保护机制,通过预先短暂的低氧刺激启动机体对随后长时间缺氧损伤的保护反应。目前已有研究证实低氧预处理BMSCs移植可加速促进大鼠心肌梗死后心功能的恢复[7]。
本研究结果表明Co+BMSCs组I/R大鼠相较于normixa+BMSCs组,肾功能明显改善,肾小管上皮细胞及间质损伤明显减轻,损伤肾脏明显修复,再灌注后24h时改善作用最为明显,且在移植后1周时Co+BMSCs组I/R大鼠肾脏亦未出现肾小管上皮细胞萎缩等慢性化改变,说明与常氧培养BMSCs相比,低氧预处理BMSCs移植能够明显增强对急性损伤肾脏的保护作用。
目前关于移植BMSCs肾脏保护作用的机制尚未明确,有研究认为BMSCs可直接转分化为肾小管上皮细胞参与损伤修复[3],但目前这一研究结果仍存在较大争议;更多的研究认为BMSCs到达受损区域后通过迅速旁分泌一系列细胞因子和生长因子减轻缺血区域内肾小管上皮细胞凋亡、促进其再生,即BMSCs的旁分泌作用[8]。BMSCs释放的最常见的旁分泌相关细胞因子和生长因子包括HGF、VEGF、bFGF、IGF-1、基质源因子-1 (SDF-1)、转化生长因子-β(TGF-β)、IL-6、血管生成素-1(Ang-1)及血小板起源的生长因子(PDGF)和粒细胞集落刺激因子(GCSF)等[9]。目前多数研究认为,在AKI肾小管修复过程中,移植的BMSCs在局部炎症细胞和因子的刺激下分泌上述细胞因子,这些细胞因子通过旁分泌作用的方式下调损伤肾脏局部CD4+T细胞、CD8+T细胞、NK细胞、B细胞、巨噬细胞和树突状细胞等多种促炎细胞数量,而上调调节性T细胞等抗炎细胞数量,并降低局部促炎因子表达,进而抑制AKI相关炎症反应,促进肾功能恢复[10]。而在AKI病程早期,此时BMSCs尚不可能分化为肾小管上皮细胞,旁分泌功能被认为是其早期肾脏保护作用的主要机制。Togel等[11]研究发现BMSCs移植治疗肾脏I/R后24h时,受损肾脏组织中高表达一些抗炎递质和肾脏保护因子如IL-10、bFGF、TGF和IGF-1,从而证实旁分泌作用在急性缺血性肾损伤修复中起到主要作用。在众多细胞因子中,bFGF、HGF具有促使新生血管重建、促进细胞增殖、抑制细胞凋亡等作用[11],VEGF是重要的促血管生成因子,可促进内皮细胞增殖,延缓细胞凋亡、减轻炎症反应[12],IGF-1能够促进细胞有丝分裂,加速细胞分化、增殖,提高细胞成熟速度[13]。
本研究检测了再灌注后24h I/R大鼠肾脏组织中VEGF、bFGF、HGF和IGF-1的表达水平,结果显示低氧预处理BMSCs可明显促进bFGF和HGF的表达,从而增强BMSCs旁分泌作用,促进损伤肾脏组织修复。但本研究中Co+BMSCs组I/R大鼠相较于normixa+BMSCs组VEGF和IGF-1的表达水平无统计学差异,考虑化学低氧预处理的干预可能未达到两者的有效低氧浓度,其机制仍需进一步研究。
综上所述,本研究结果显示低氧预处理BMSCs移植能够更好地减轻I/R大鼠肾损伤,促进损伤肾脏修复,其作用机制可能与低氧预处理促进BMSCs旁分泌相关因子bFGF和HGF的表达有关。低氧预处理BMSCs移植也许是一种有前景的AKI细胞治疗方法。
[1] Bianco P,Riminueei M,Gronthes S,et al.Bone marrow stromal stem cells:nature,biology,and potential applications[J].Stem Cells,200l,19(3):180-192.
[2] 刘红,俞小芳,丁小强,等.低氧预处理对大鼠骨髓间充质干细胞迁移能力的影响[J].中华医学杂志,2012,92(10):709-711.
[3] Herrera M B,Bussolati B,Bruno S,et al.Mesenchymal stem cells contribute to the renalrepair of acute tubular epithelial injury[J].Int J MolMed,2004,14(6):1035-1041.
[4] Semedo P,Wang P M,Andreucci T H,et al.Mesenchymal stem cells ameliorate tissue damages triggered by renal ischemia and reperfusion injury[J].Transplant Proc,2007,39(2):421-423.
[5] da Silva LB,Palma P V,Cury P M,et al.Evaluation ofstem celladministration in a modelof kidney ischemia-reperfusion injury[J].Int Immunopharmacol,2007,7(13):1609-1616.
[6] Brunswig-Spickenheier B,Boche J,Westenfelder C,et al.Limited immune-modulating activity of porcine mesenchymal stromal cells abolishes their protective efficacy in acute kidney injury[J]. Stem Cells Dev,2010,19(5):719-729.
[7] Volkmer E,Kallukalam B C,Maertz J,et al.Hypoxic preconditioning of hMSC overcomes hypoxia-induced inhibition of osteogenic differentiation[J].Tissue Eng Part A,2010,16(1):153-164.
[8] Lindoso R S,Araujo D S,Adao-Novaes J,et al.Paracrine interaction between bone marrow-derived stem cells and rena epithelial cells[J].CellPhysiolBiochem,2011,28(2):267-278.
[9] Samper E,Diez-Juan A,Montero J A,et al.Cardiac Cell Therapy:Boosting Mesenchymal Stem Cells Effects[J].Stem Cell Rev, 2013,9(3):266-280.
[10] Bassi E J,de Almeida D C,Moraes-Vieira P M,et al.Exploring the role of soluble factors associated with immune regulatory properties of mesenchymal stem cells[J].Stem Cell Rev,2012,8 (2):329-342.
[11] Togel F,Weiss K,Yang Y,et al.Vasculotropic,paracrine actions ofinfused mesenchymalstem cells are important to the recovery from acute kidney injury[J].Am J PhysiolRenalPhysiol,2007,292 (5):1626-1635.
[12] Zhang Q,Chang Q,Cox R A,et al.Hyperbaric oxygen attenuates apoptosis and decreases inflammation in an ischemic wound mode[J].J Invest Dermatol,2008,128(8):2102-2112.
[13] Togel F,Cohen A,Zhang P,et al.Autologous and allogeneic marrow stromal cells are safe and effective for the treatment of acute kidney injury[J].Stem Cells Dev,2009,18(3):475-485.
Effects of hypoxia-preconditioning of bone marrow derived mesenchymal stem cells on rat acute kidney injury
LIU Hong,DING Xiaoqiang,WANG Hua,et al.Department of Nephrology,Hangzhou Hospital of TCM,Hangzhou310007,China
【 Abstract】 Objective To investigate the effects and mechanism of hypoxia-preconditioning of bone marrow derived mesenchymal stem cells(BMSCs)on acute ischemia/reperfusion(I/R)injury of rat kidney.Methods Hypoxia-preconditioning was performed on BMSCs by treatment with 200μmol/L CoCl2for 24h.I/R model was induced by cross-clasped for 40min followed by reperfusion in 72 SD rats and the animals were divided into 3 groups with 24 in each group.Rats in control group received carotid injection of cell culture medium,rats in normoxic BMSCs group received carotid injection of normoxia-cultured BMSCs and rats in hypoxic BMSCs group received carotid injection of hypoxia-preconditioned BMSCs.The renal function was estimated by measurement of serum creatinine(Scr)and blood urea nitrogen(BUN),and histological changes were observed by hematoxylin and eosin(HE)staining at 24h,48h,72h and 1wk after injection.The protein and mRNA expressions of VEGF,bFGF,HGF and IGF-1 in kidney were detected by ELISA and real-time PCR,respectively. Results At 24h after reperfusion,the BUN and Scr levels in both two BMSCs groups were significantly lower than those in control group(P<0.05),and the levels in hypoxic BMSCs group was even lower than those in normoxic BMSCs group(P<0.05),the renal tubulointerstitial damage of hypoxic BMSCs group was significantly lower than that of the normoxic BMSCs group and the control group(P<0.05).at 48h after reperfusion,the renal tubular epithelial cells of the hypoxic BMSCs group recovered earlier than other two groups at 1 week after reperfusion,the BUN and Scr levels of hypoxic BMSCs group was still significantly lower than those of other two groups(P<0.05),and there were nochronic changes in the hypoxic BMSCs group.The protein and mRNA levels of HGF and bFGF of hypoxic BMSCs group were significantly higher than those of the other two groups(P<0.05),and the levels of HGF and bFGF in normoxic BMSCs group was higher than those in the control group. Conclusion Infusion of hypoxia-preconditioned BMSCs can enhance the recovery of IR injure of rat kidney,which may be attributable to the up-regulation of paracrine factors of HGF and bFGF after hypoxia preconditioning in BMSCs.
Mesenchymalstem cells Hypoxia Acute kidney injury Paracrine
2015-12-15)
(本文编辑:李媚)
国家自然科学基金(81570600);上海青年医师培养资助计划(20141089);复旦大学附属中山医院优秀青年计划(2015ZSYX QN23)
310007 杭州市中医院肾内科(刘红、王华、陈洪宇);复旦大学附属中山医院肾内科(丁小强、俞小芳)
俞小芳,E-mail:yu.xiaofang@zs-hospital.sh.cn
