连续血液净化治疗内毒素诱导的急性呼吸窘迫综合征的研究
2016-12-21蒋永泼林荣海徐颖鹤余方宇朱敏崔可李爱琴杨伟英
蒋永泼 林荣海 徐颖鹤 余方宇 朱敏 崔可 李爱琴 杨伟英
连续血液净化治疗内毒素诱导的急性呼吸窘迫综合征的研究
蒋永泼 林荣海 徐颖鹤 余方宇 朱敏 崔可 李爱琴 杨伟英
目的 通过观察连续血液净化治疗对内毒素诱导急性呼吸窘迫综合征(ARDS)猪的呼吸力学、血流动力学、炎症因子及心、肺、肾的病理组织学和NF-κB蛋白含量的影响,探讨其对ARDS猪的治疗作用。方法 12只健康雄性猪按照随机数字法分为实验组和对照组,每组6只,采用静脉注射内毒素(20μg/kg)制备ARDS猪模型,造模成功后,给予常规镇痛、镇静、血流动力学监测、呼吸机辅助通气等治疗;实验组常规支持治疗的同时,给予连续性静脉-静脉血液滤过治疗。观察并记录Ba、0、2、4、6h两组动态肺顺应性(Cdyn)、氧合指数(PaO2/FiO2)、血流动力学、每小时尿量等变化,ELISA法测定血清及支气管肺泡灌洗液的TNF-α、IL-6、IL-10水平。6h后处死猪取心、肺、肾组织,观察组织形态学的改变,Western blot检测组织NF-κB p65蛋白含量。结果 实验组6h Cdyn、PaO2/FiO2均优于对照组(均P<0.05);实验组4、6h心率减慢、平均动脉压(MAP)升高、血管外肺水指数减少(P<0.05);实验组心指数、6h时尿量优于对照组(均P<0.05);实验组6h时血清TNF-α、IL-10水平均低于对照组,实验组4、6h时IL-6水平均低对照组(均P<0.05)。实验组6h时支气管肺泡灌洗液IL-6、TNF-α水平均低于对照组(均P<0.05)。实验组心、肺、肾组织结构均损伤轻,炎症细胞浸润不明显;对照组肺泡间隔增宽,纤维组织增生,散在淋巴细胞、浆细胞及中性粒细胞浸润,肾小球少许瘀血,小灶坏死,心肌间质散在淋巴细胞、浆细胞浸润。结论 连续血液净化治疗对内毒素诱导的ARDS猪器官有一定的保护作用。
急性呼吸窘迫综合征 连续血液净化治疗 猪 器官保护
【 Abstract】 Objective To evaluate the effect of continuous veno-venous hemofiltration(CVVH)on LPS-induced acute respiratory distress syndrome (ARDS)in pigs. Methods Twelve male pigs were randomly divided into control group(n=6)and treatment group(n=6).ARDS was induced by injection of endotoxin 20μg/kg.After the ARDS was induced,all animals received analgesic and sedation;then were mechanically ventilated.The animals in control group received supportive treatment and the animals in treatment group received CVVH.The dynamic compliance(Cdyn),blood oxygen partial pressure/inhale oxygen volume fraction(PaO2/FiO2)and hemodynamics were measured,the volume of urine was recorded at baseline,0h,2h,4h and 6h after ARDS induced.The levels of TNF-α,IL-6 and IL-10 in serum and bronchoalveolar lavage fluid(BALF)were measured by ELISA.The histology of heart,lung and kidney were examined after animals were sacrificed.The expression of NF-κB in tissue was detected by Western blot. Results There were significant differences in dCdyn,PaO2/FiO2between two groups at 6h after ARDS induced(P<0.05).The heart rate was decreased,mean arterial pressure was increased,extravascular lung water index was reduced in animals of treatment group at 4h and 6h after ARDS induced(P<0.05).Compared to control group the cardiac index(CI)and the amount of urine in treatment group at 6h was significantly lower(P<0.05).Compared to control group the serum TNF-α and IL-10 levels at 6h and IL-6 level at 4h and 6h in treatment group were significantly lower(P<0.05).Compared to control group the inflammation markers TNF-α and IL-6 in BALF at 6h in treatment group was significantly lower(P<0.05). Histopathological examination showed that there were alveolar septum broadening or fiber hyperplasia and inflammatory infiltration in issues;glomerular congestion,small focal necrosis,lymphocytes and plasma cells scattered in myocardial interstitial were observed in control group;while there was alveolar septum slightly broadening and less lymphocytic infiltrates in treatment group;heart and kidney were normal. Conclusion The results indicate that continuous blood purification therapy has an organ protective effect for LPS-induced ARDS pig.
【Key words】 Acute respiratory distress syndrome(ARDS)Continuous blood Purifieatio Pigs Organ protection
急性呼吸窘迫综合征(ARDS)是ICU患者常见的灾难性综合征,是肺部炎症失控的结果,也是多脏器功能障碍的肺部表现,病死率高达27%~45%[1],其主要特征是肺组织大量中性粒细胞、炎症因子浸润和肺泡-毛细血管屏障损伤所致的肺水肿、顽固性低氧血症[2]。目前认为促炎消退介质不足和促炎介质的过度释放导致炎症失控是ARDS的主要发病机制之一[3]。连续性血液净化(CBP)具有非选择性清除炎症介质,稳定血流动力学等特点,广泛应用于脓毒症、多器官功能障碍、充血性心力衰竭等疾病[4-6]。笔者将CBP用于内毒素诱导的ARDS猪,观察其对器官的保护作用。
1 材料和方法
1.1 材料 健康猪12只 [泰州泰和生物科技有限公司提供,动物合格证号:SCKK(苏)2011-0002],体重11~ 15kg;内毒素(美国Sigma公司),TNF-α、IL-6、IL-10(加拿大Hermes Criterion Biotechnology公司),血气分析仪(美国雅培公司,型号i-STAT 300),PICCO监护仪(德国Pulsion公司),血滤机(金宝血滤机;M60膜),呼吸机(美国纽邦公司,型号e360)。
1.2 动物分组及处理
1.2.1 动物模型建立 健康猪在实验前禁食8h,麻醉诱导采用咪达唑仑针3mg/kg肌肉注射,肺部CT检查后,开放左侧颈内静脉补液10~15ml/(kg·h)、右侧股动脉连接PICCO监护仪、左侧股静脉连接小儿血滤管、B超定位下膀胱穿刺尿液引流,镇静、镇痛采用枸橼酸芬太尼针(0.2mg加入0.9%氯化钠溶液至50ml,速度10ml/h)联合丙泊酚针(50ml,速度10ml/h)微泵维持,予气管插管,接呼吸机辅助通气,呼吸模式为SIMV+ PSV模式,按照小潮气量肺保护通气策略[7],呼吸参数:吸氧浓度为25%,通气频率15次/min,吸呼比1∶2,调整潮气量为6ml/kg,呼气末正压为5cmH2O,调节吸入氧浓度、呼吸频率,维持血氧饱和度>95%,呼末二氧化碳浓度30~40mmHg。猪在外科操作后稳定30min,为动物造模前基础状态,记作“Ba”时间点,内毒素20μg/ kg静脉注射制备ARDS模型。造模成功后按照随机数字法分为实验组、对照组,每组6只,两组动物均给予镇静、镇痛、补液、呼吸机辅助、肝素抗凝等治疗,实验组另辅以连续性静脉-静脉血液滤过治疗。两组活化凝血时间(ACT)均维持在180~250s。血滤参数:血流50ml/h,置换液速度300ml/h,超滤 20ml/h[8]。
1.2.2 造模成功标准 根据柏林定义[1],监测血气分析氧合指标下降至300mmHg以下,再行肺部CT检查提示有双侧肺部可见弥漫性浸润影及肺不张表现(图1)。造模成功记为“0”时间点。
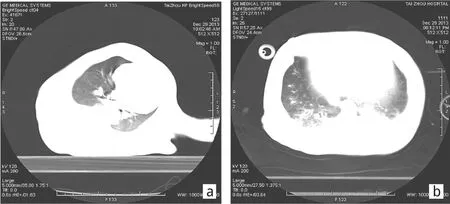
图1 肺部CT检查(a:造模前;b:造模后)
1.3 动态肺顺应性(Cdyn) 分别于Ba及0、2、4、6h时点记录潮气量、气道峰压、呼气末正压。Cdyn=潮气量(VT)/[气道峰压-呼气末正压]。
1.4 氧合指数(PaO2/FiO2) 分别于Ba及0、2、4、6h时点用预先已经肝素化的采血注射器,从置好的股动脉导管抽取2ml动脉血,橡皮塞密封隔绝空气,行血气分析。
1.5 血流动力学及尿量 根据PICCO监护仪,分别于Ba及0、2、4、6h时点记录心率(HR)、平均动脉血压(MAP)变化,标定采用10ml 4℃水,10s内进行颈内静脉注射,根据热释波形,计算出心脏指数(CI)、肺毛细血管通透指数(PVPI)、血管外肺水指数(EVLWI)。
1.6 每小时尿量 在造模成功,即“0”时开始记尿量,分别在2、4、6h时点记录每只猪的总尿量,根据体重换算成每小时尿量[ml/(kg·h)]。
1.7 血清和肺泡灌洗液TNF-α、IL-6、IL-10水平的测定 分别于Ba及0、2、4、6h时点行支气管肺泡灌洗检查,方法:通过支气管镜进入肺左右支气管,分别注入0.9%氯化钠注射液20ml,待5min后给予大部分回收,回收液取5ml,在4℃下离心后,取上清液分装后-80℃保存;分别于Ba及0、2、4、6h时点抽取4ml血在4℃下离心后,取上清液分装后-80℃保存待检。TNF-α、IL-6、IL-10采用ELISA试剂盒进行检测,严格按照试剂盒说明书步骤进行操作,应用酶标仪测出标准品和样品吸光度(OD值),描绘出标准曲线图和对应回归方程,计算出各样品的相应浓度。
1.8 病理学检测 观察6h后采用10%氯化钾20ml静脉注射处死,取心、肺、肾等脏器组织,经甲醇固定后,脱水、石蜡包埋切片,采用HE染色,在光学显微镜下(× 100倍)观察病理改变。
1.9 Western blot法检测心、肺、肾组织中NF-κB p65表达 取100mg新鲜肺组织经液氮速冻研磨成粉,加入1ml裂解液,提取总蛋白,BCA法测定蛋白浓度。取10μg蛋白质进行10%SDS-PAGE电泳。15V,35min半干转印至PVDF膜;5%脱脂奶粉室温封闭2h,PBST洗涤7min,4次,NF-κBp65猪单克隆抗体(英国Abcam公司)工作液(稀释比例为1∶1 000)孵膜,4℃过夜;PBST洗膜4次后,用辣根过氧化物酶HRP标记抗猪IgG工作液(稀释比例为1∶10 000)孵膜,37℃下2h;PBST洗膜4次,ECL显影,曝光并作成像分析。采用Quantity One 4.31测定Western blot各NF-κB结合条带与 GAPDH条带灰度比值。
基于扩展IEC 61970 CIM的园区蒸汽供热系统标准化建模//张少卿,王彬,符杨,郭庆来,盛同天,孙宏斌//(4):70
1.10 统计学处理 应用SPSS16统计软件。计量资料以表示,两组间比较采用t检验,组内不同时点比较采用方差分析,计数资料组间比较采用χ2检验。
2 结果
2.1 两组猪不同时点Cdyn、PaO2/FiO2的比较 造模成功后,两组猪Cdyn、PaO2/FiO2均明显下降,但组间比较差异无统计学意义(P>0.05)。在治疗6h后,实验组猪Cdyn、PaO2/FiO2均好于对照组(均P<0.05),详见表1。

表1 两组猪不同时点Cdyn、PaO2/FiO2的比较
2.2 两组猪不同时点血流动力学指标的比较 输注内毒素后,两组猪Ba、0h HR、MAP、CI、PVPI、EVLWI比较差异均无统计学意义(均P>0.05)。与对照组比较,实验组4、6h HR减慢、MAP升高、EVLWI减少,差异均有统计学意义(均P<0.05);CI造模成功后持续下降,但是在6h实验组优于对照组,组间差异有统计学意义(P<0.05);PVPI造模成功后升高明显,之后变化不大,差异无统计学意义(P>0.05);实验组4、6h EVLWI少于对照组,差异均有统计学意义(均P<0.05),详见表2。
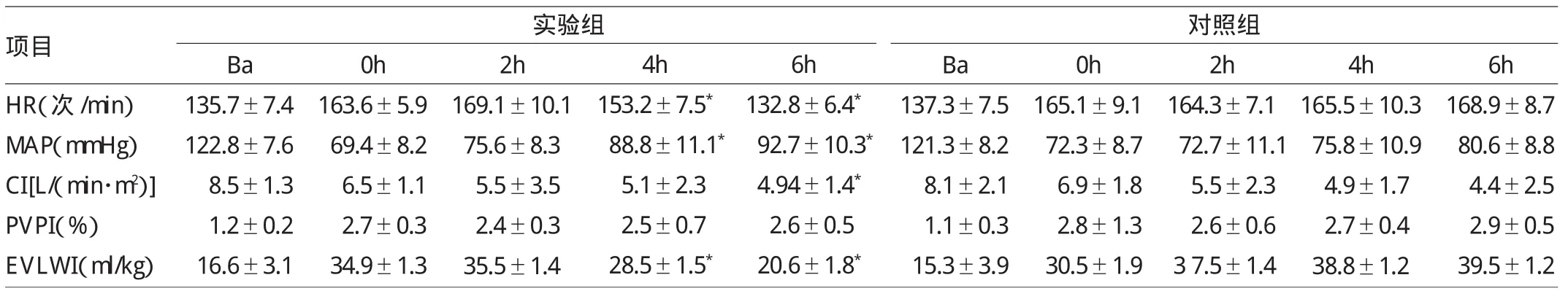
表2 两组猪不同时点血流动力学指标的比较
2.3 两组猪每小时尿量的比较 实验组猪6h尿量多于对照组,差异有统计学意义(P<0.05),其余时点两组猪尿量比较差异均无统计学意义(均P>0.05),详见表3。

表3 两组猪每小时尿量的比较[ml/(kg·h)]
2.4 两组猪血清及支气管肺泡灌洗液炎症因子水平的比较 实验组6h血清及支气管肺泡灌洗液TNF-α水平低于对照组,差异有统计学意义(P<0.05);实验组4、6h血清IL-6水平低于对照组,差异有统计学意义(P<0.05);实验组6h血清 IL-10水平低于对照组,差异有统计学意义(P<0.05)。实验组6h支气管肺泡灌洗液IL-6水平低于对照组,差异有统计学意义(P<0.05);两组不同时点支气管肺泡灌洗液IL-10水平比较差异均无统计学意义(均P>0.05),详见表4、5。

表4 两组猪血清TNF-α、IL-6、IL-10水平的比较

表5 两组猪支气管肺泡灌洗液TNF-α、IL-6、IL-10水平的比较
2.5 两组猪组织病理学检查结果 实验组病理图片可见组织结构基本正常,无明显炎症细胞浸润(见图2a、2c、2e);对照组病理图片可见肺泡间隔增宽,纤维组织增生,散在淋巴细胞、浆细胞及中性粒细胞浸润;肾小球少许瘀血,小灶坏死;心肌间质散在淋巴细胞、浆细胞浸润(见图2b、2d、2f)。

图2 两组猪肺、肾、心脏组织病理图(a:实验组肺组织;b:对照组肺组织;c:实验组肾组织;d:对照组肾组织;e:实验组心脏组织;f:对照组心脏组织;HE染色,×100)
2.6 两组猪心、肺、肾组织NF-κB p65蛋白水平的比较 组织提取物Western blot检测NF-κB p65蛋白水平显示,心、肺、肾组织均含有NF-κB p65蛋白,但是实验组与对照组比较差异无统计学意义(P<0.05),详见图3。

图3 Western blot检测心、肺、肾组织NF-κB蛋白含量(1、3、5分别是对照组心、肺、肾组织NF-κB;2、4、6分别是实验组心、肺、肾组织NF-κB)
3 讨论
ARDS是危重病领域中救治的难点和重点之一,目前尚无特效药物治疗,主要以小潮气量、高PEEP、最小驱动压、俯卧位通气等支持治疗为主[9]。而炎症失调可能是脓毒症相关ARDS的主要发病机制,控制炎症反应可以帮助稳定患者病情和脏器康复,是患者最后是否生存的关键[10]。连续性血液净化可以通过弥散、对流和吸附非选择性清除各大中小分子炎症介质,进而为治疗ARDS提供新的思路。
本实验采用内毒素诱导ARDS模型模拟临床ARDS患者的特点,发现静脉注射内毒素后,动物呼吸急促,PaO2/FiO2下降,Cdyn下降,MAP下降明显,血浆及肺泡液中的TNF-α、IL-6水平明显升高,经过持续血液净化治疗后,实验组Cdyn和PaO2/FiO2明显改善,这与Ullrich等[11]内毒素诱导急性肺损伤的家猪行CBP时发现结果相似。同时,许多临床研究也发现急性肺损伤的患者行CBP,发现治疗期间患者的PaO2/FiO2有明显升高,肺泡动脉氧分压差也有明显的降低,本研究的结果与其相似[12-13]。CBP对血流动力学的改善是明显有效的,目前研究认为可能是降低了炎症反应水平,减轻了炎症介质对心血管功能的抑制;直接清除了具有扩血管作用或抑制心肌收缩功能的内源性物质如一氧化氮(NO)、心钠素等物质;调节了儿茶酚胺等正性物质与负性物质的平衡;改善PaO2/FiO2,恢复心血管系统代谢等因素相关。本研究发现,CBP可以清除血及支气管肺泡灌洗液中TNF-α、IL-6、IL-10等炎症因子,说明CBP可以非选择性的清除炎症介质,这与之前的研究相似[14-15]。目前普遍认为肺水含量高低与肺水肿和ARDS患者的生存率有关[16],本研究发现CBP可以很好的减少肺水含量,这一点对ARDS的治疗非常有益,可以减轻肺损伤动物肺泡内水肿和肺泡间质水肿,同时恢复肺泡内表面活性物质浓度,减轻肺泡萎陷,促进氧合。通过对心、肺、肾组织的病理检查发现,CBP减少了组织的损伤,说明其不但对肺的保护作用,同时对心、肾等肺外器官也有保护作用,这与本研究发现一样,CBP不但减少肺水含量,同时对肺外组织如心、肾都有保护作用,尿量和血流动力学均改善明显,病理检查发现损伤比对照组减轻,炎症浸润减少。虽然CBP用于ARDS患者没有被写入指南,但是其有清除炎症介质,降低机体促炎和抑炎反应水平,稳定血流动力学,改善器官功能等作用,在这十几年有不少采用CBP治疗ARDS患者的报道[12-13,17]。总之,目前对CBP治疗ARDS的主要机制可能:超滤液体、低温减少氧耗、减少血管外肺水含量、清除炎症因子等相关,同时早期行血液进化控制炎症反应治疗效果更佳,这也比较符合预防和早期治疗肺损伤的策略[9-10,18]。
由于血液净化非选择性清除炎症介质,对促炎症消退介质也有清除作用,研究发现IL-10也被清除,同时经过6h CBP,各组织的NF-κB p65水平并没有减少,所以CBP可以清除炎症介质,减轻炎症反应,对促炎症消退的介质也有一定清除作用,从而维持炎症/抗炎症的平衡,达到免疫治疗作用。同时有研究发现CBP可能通过TOLL/NF-κB信号通路,减少炎症反应,但是本实验条件下没有发现,可能与血滤的时间有关,需进一步研究。
综上所述,CBP可以改善内毒素诱导的ARDS猪的心、肺、肾等器官功能,有一定的保护作用,其保护机制可能与清除炎症介质,改善循环,减轻肺水肿,促进PaO2/FiO2有关。
[1] ARDS Definition Task Force.Acute respiratory distress syndrome: the Berlin Definition[J].JAMA,2012,307(23):2526-2533.
[2] Ware L B,Matthay M A.The acute respiratory distress syndrome [J].N EnglJ Med,2000,342(18):1334-1339.
[3] Blondonnet R,Constantin J M,Sapin V,et al.A Pathophysiologic Approach to Biomarkers in Acute Respiratory Distress Syndrome [J].Dis Markers,2016,2016(21):1-20.
[4] Ueno T,Ikeda T,Yokoyama T,et al.Reduction in circulating level of HMGB-1 following continuous renal replacement therapy in sepsis[J].Cytokine,2016,83:206-209.
[5] Abdo A A,Castellanos R,Rocha M,et al.Continuous venovenous hemodiafiltration in patients with multiple organ dysfunction syndrome in an intensive care unit[J].MEDICC Rev,2012,14(3):26-30.
[6] GiglioliC,SpiniV,LandiD,et al.Congestive heart failure and decongestion ability oftwo different treatments:continuous renalreplacement and diuretic therapy:experience of a cardiac step down unit[J].Acta Cardiol,2013,68(4):355-364.
[7] The Acute Respiratory Distress Syndrome Network.Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome[J]. N EnglJ Med,2000,342(18):1301-1308.
[8] He C,Yang S,Yu W,et al.Effects of continuous renalreplacement therapy on intestinal mucosal barrier function during extracorporealmembrane oxygenation in a porcine model[J].J Cardiothorac Surg,2014,23:9:72.
[9] Hager D N.Recent Advances in the Management of the Acute Respiratory Distress Syndrome[J].Clin Chest Med,2015,36(3): 481-496.
[10] Trager K,Sch tz C,Fischer G,et al.Cytokine Reduction in the Setting of an ARDS-Associated Inflammatory Response withMultiple Organ Failure[J].Case Rep Crit Care,2016,2016(2): 1-4.
[11] Ullrich R,Roeder G,Lorber C,et al.Continuous venovenous hemofiltratio-n improves arterial oxygenation in endotoxin-induced lung injury in pigs[J].Anesthesiologists,2001,95(2): 428-436.
[12] Yang W,Hong J,Zeng Q,et al.Improvement of Oxygenation in Severe A-cute Respiratory Distress Syndrome With High-Volume ContinuousVeno-ven-ous Hemofiltration[J].Glob Pediatr Health,2016,3:2333794X16645699.
[13] CuiH X,Xu J Y,LiMQ.Efficacy of continuous renalreplacement therap-y in the treatment ofsevere acute ancreatitis associated acuterespiratory distress syndrome[J].Eur Rev Med Pharmacol Sci,2014,18(17):2523-2526.
[14] Matsuda K,Moriguchi T,Oda S,et al.Efficacy of continuous hemodiafiltr ation with a cytokine-adsorbing hemofilter in the treatment of acute respiratory distresssyndrome[J].Contrib Nephrol,2010,166:83-92.
[15] Davenport A.Can modication of renal replacement therapy improve the outcome of patients with systemic in ammatory response syndrome?[J].Blood Purif,2006,24(3):317-318.
[16] Sznajder J I.Alveolar edema must be cleared for the acute respiratory distress syndrome patient to survive[J].Am J Respir Crit Care Med,2001,163(6):1293-1294.
[17] Grasselli G,Foti G,Patroniti N,et al.A case of ARDS associated with in uenza AH1N1 infection treated with extracorporealrespiratory support[J].Minerva Anestesiol,2009,75(12):741-745.
[18] Han F,Sun R,Ni Y,et al.Early initiation of continuous renal replacemen-t therapy improves clinical outcomes in patients with acuterespiratory distr-ess syndrome[J].Am J Med Sci,2015, 349(3):119-205.
Continuous blood purification in treatment for LPS-induced acute respiratory distress syndrome in pigs
JIANG Yongpo,LIN Ronghai, XU Yinghe,et al.Department of Critical Care Medicine,Taizhou Hospital,Taizhou 317000,China
2016-06-07)
(本文编辑:严玮雯)
浙江省医药卫生科学研究基金(2009B167)、恩泽基金(15EZB5)
317000 台州医院重症医学科(蒋永泼、林荣海、徐颖鹤、余方宇、崔可、李爱琴、杨伟英)、公共科研平台(朱敏)
林荣海,E-mail:tylinrh@163.com
