平陆百合脱毒苗的生根培养
2016-12-20任建宏王鹏丽殷丽娜赵娟
任建宏,王鹏丽,殷丽娜,赵娟
(山西农业大学 农学院,山西 太谷 030801)
平陆百合脱毒苗的生根培养
任建宏,王鹏丽,殷丽娜,赵娟*
(山西农业大学 农学院,山西 太谷 030801)
[目的]建立高效的平陆百合脱毒苗生根系统。[方法]以百合再生小鳞茎为材料,研究了无机盐使用量、不同种类和浓度生长素、不同蔗糖浓度对其生根的影响。[结果]适当降低无机盐用量更适于百合的生根培养;NAA比IBA更利于诱导百合生根,且浓度为0.8 mg·L-1时最佳;蔗糖浓度为90 g·L-1时百合生根效果最好,过高或过低都会抑制其生根。[结论]平陆百合生根的最佳培养基为:1/2(大量、微量元素)MS+ NAA0.8 mg·L-1+蔗糖90 g·L-1,生根率达100%,且生根健壮,适合移栽。
平陆百合; 生长素; 生根培养
平陆百合(Liliumbrownievar.viridulum)为百合科百合属多年生草本球根植物,是山西省平陆县特有的食用百合品种,具有较高营养价值和经济价值,有“中条参”的美称[1]。近年来,随着生活水平不断提高,食用百合作为特种蔬菜愈来愈受到消费者的喜爱,其需求数量不断增大[2~4]。我国虽有悠久的百合栽培历史和种植经验,但受到气候、繁殖技术等多方面因素的限制,生产中出现种质退化、繁殖系数低、产量不高、不能大规模生产等问题。建立一个程序简单、适于大规模生产的百合离体快繁体系,可解决上述问题,为其高品质、规模化生产提供有效途径[5~7]。
诱导试管苗生根是建立高效离体快繁体系的关键环节之一,生根质量直接影响到试管苗移栽成活率的高低,也是脱毒试管苗能否成功应用于生产实践的关键[8~10]。虽然近年来已开展一些对食用百合组织培养的相关研究,但在不定根形成方面还未见系统的研究报道。本文以平陆百合再生小鳞茎为材料,研究了MS培养基不同无机盐用量、不同种类和浓度生长素、不同蔗糖浓度对百合生根的影响,建立了高效的百合试管苗生根系统,为平陆百合脱毒苗的快速繁殖及工厂化生产提供了理论基础和技术支持。
1 材料与方法
1.1 试验材料
平陆百合(Liliumbrowniivar.viridulum)脱毒试管苗由山西农业大学农学院植物组织培养实验室前期试验获得。
1.2 试验方法
1.2.1 外植体处理
以继代培养获得的健壮鳞茎为外植体,接种到不同培养基中,每个处理接种8瓶,每瓶接种5个鳞茎,重复3次,接种30 d后,统计其生根率、根长、根数及生长情况。
1.2.2 无机盐用量对生根的影响
在添加不同无机盐用量的MS培养基中附加NAA 0.5 mg·L-1、蔗糖80 g·L-1、琼脂6 g·L-1,接种百合鳞茎后筛选适宜诱导生根的基本培养基。
1.2.3 不同种类和浓度生长素对生根的影响
以筛选出的最适无机盐用量的MS培养基为基本培养基,添加不同浓度的NAA和IBA,并附加蔗糖30 g·L-1、琼脂6 g·L-1,筛选适合诱导百合鳞茎生根的生长素种类及浓度。
1.2.4 不同蔗糖浓度对平陆百合生根的影响
以筛选出的最适无机盐用量的MS培养基为基本培养基,附加NAA 0.8 mg·L-1,添加不同浓度的蔗糖,琼脂6 g·L-1,筛选适合诱导百合鳞茎生根的蔗糖浓度。
1.2.5 培养条件
培养温度(25±2) ℃,光照14 h·d-1,光照强度1 000~2 000 lx。
1.3 数据统计及分析方法
生根率=生根的鳞茎数/接种的鳞茎数×100%;
试验采集的数据均由DPS7.05软件进行数据分析。
2 结果与分析
2.1 无机盐用量对平陆百合生根的影响
由表1可知,在MS培养基中添加不同用量的无机盐,均能诱导平陆百合生根。接种后7 d,鳞茎底部有根尖突出,15~18 d根变长且粗壮,28 d左右可进行炼苗后移栽。方差分析结果表明,各处理间差异达到显著水平(P<0.05); 对各处理进行多重比较,A9与其他处理差异达显著水平,即基本培养基为1/2(大量、微量元素)MS时,百合诱导生根最佳,生根率达96.67%,根黄白,粗壮,长势好,球茎大(图1中1、2)。
表1 不同无机盐用量对平陆百合生根的影响
Table 1 Effect of different inorganic salt concentration on rooting of Lilium
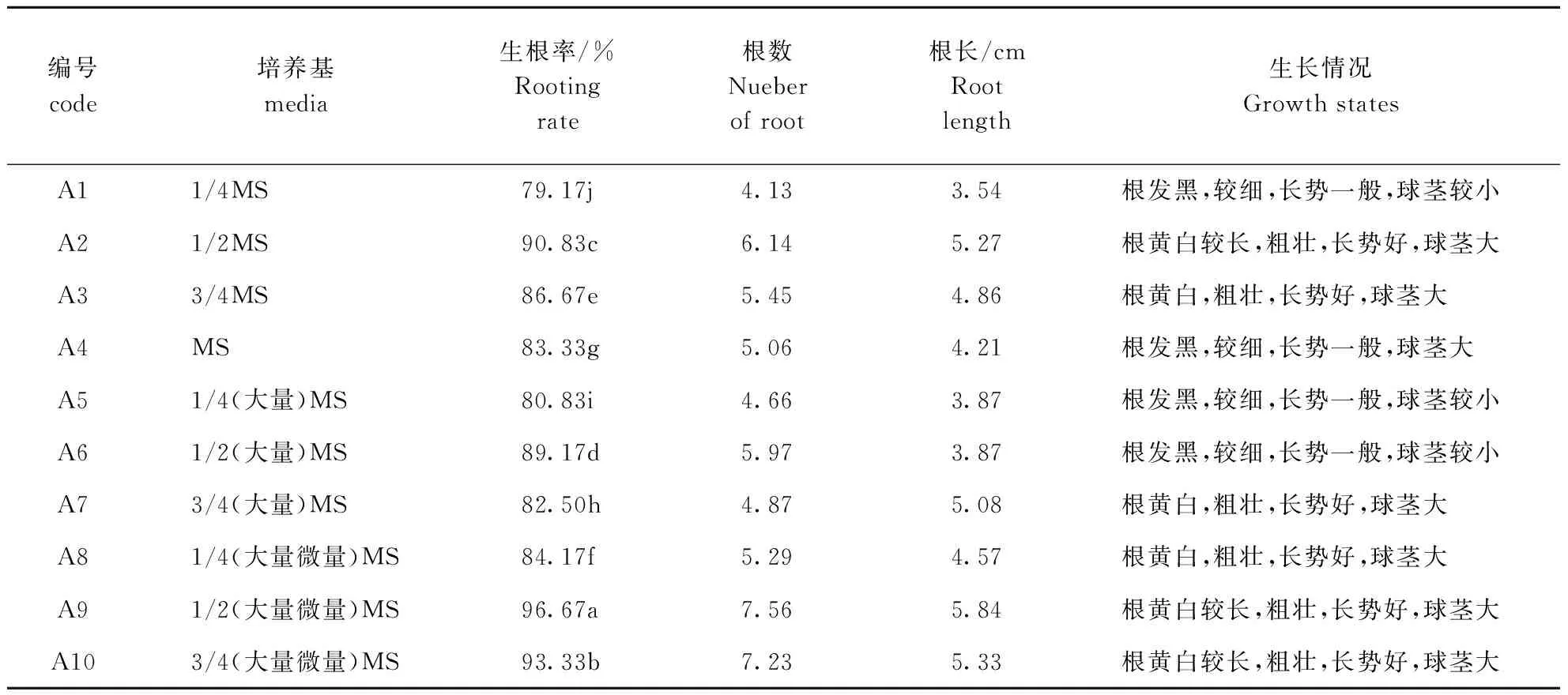
编号code培养基media生根率/%Rootingrate根数Nueberofroot根长/cmRootlength生长情况GrowthstatesA11/4MS79.17j4.133.54根发黑,较细,长势一般,球茎较小A21/2MS90.83c6.145.27根黄白较长,粗壮,长势好,球茎大A33/4MS86.67e5.454.86根黄白,粗壮,长势好,球茎大A4MS83.33g5.064.21根发黑,较细,长势一般,球茎大A51/4(大量)MS80.83i4.663.87根发黑,较细,长势一般,球茎较小A61/2(大量)MS89.17d5.973.87根发黑,较细,长势一般,球茎较小A73/4(大量)MS82.50h4.875.08根黄白,粗壮,长势好,球茎大A81/4(大量微量)MS84.17f5.294.57根黄白,粗壮,长势好,球茎大A91/2(大量微量)MS96.67a7.565.84根黄白较长,粗壮,长势好,球茎大A103/4(大量微量)MS93.33b7.235.33根黄白较长,粗壮,长势好,球茎大
注:同列不同小写字母表示差异显著(P<0.05)。下同
Note:Different lowercase letters show significant difference at the 0.05 level in the same column.The same as follows

图1 不同无机盐浓度、生长素、蔗糖浓度对平陆百合生根影响Fig.1 Effect of different inorganic salt, auxin and sucrose concentration on rooting of Lilium 注:1培养基:1/2(大量、微量元素)MS+NAA 0.5 mg·L-1 +蔗糖80 g·L-1;2培养基:1/2MS+NAA 0.5 mg·L-1 +蔗糖80 g·L-1 ;3培养基:1/2(大量、微量元素)MS+NAA 0.8 mg·L-1 +蔗糖80 g·L-1;4培养基:1/2(大量、微量元素)MS+ IBA 1.0 mg·L-1 +蔗糖80 g·L-1 ;5培养基:1/2(大量、微量元素)MS+NAA 0.8 mg·L-1 +蔗糖90 g·L-1 ;6培养基:1/2(大量、微量元素)MS+NAA 0.8 mg·L-1 +蔗糖100 g·L-1 Note:1 medium :1/2(macroelements、microelements) MS+0.5 NAA mg·L-1+80 g·L-1 sucrose;2 medium :1/2 MS+0.5 NAA mg·L-1+80 g·L-1 sucrose; 3 medium: 1/2(macroelements、microelements) MS+0.8NAA mg·L-1+80 g·L-1 sucrose;4 medium:1/2(macroelements、microelements) MS+1.0IBA mg·L-1+80 g·L-1 sucrose; 5 medium:1/2(macroelements、microelements)MS+0.8 NAAmg·L-1+90 g·L-1 sucrose;6 medium:1/2(macroelements、microelements) MS+0.8NAA mg·L-1+100 g·L-1 sucrose
2.2 不同种类生长素对平陆百合生根的影响
2.2.1 不同浓度NAA对平陆百合生根的影响
由表2可知,在1/2(大量、微量元素)MS基本培养基上添加不同浓度的NAA,均能诱导平陆百合生根;与添加NAA的处理相比,在不添加任何激素的培养基(处理B1)上,百合的生根效果差:表现为根发黑,较细,长势较差,球茎小;随着NAA浓度的不断升高,其生根率先升高后降低;根数、根长等均伴随变化;方差分析结果表明,各处理间差异达到显著水平(p<0.05);对各处理进行多重比较,B4与其他处理差异达显著水平,即NAA浓度为0.8 mg·L-1时,平陆百合诱导生根最佳,生根率达100%,根黄白较长,粗壮,长势好,球茎大(图1中3)。
表2 不同浓度NAA对平陆百合生根的影响
Table 2 Effect of different NAA concentration on rooting of Lilium

编号CodeNAAmg·L-1生根率/%Rootingrate根数Nueberofroot根长/cmRootlength生长情况GrowthstatesB1050.83g4.133.24根发黑,较细,长势较差,球茎小B20.287.50d5.634.81根发黑,粗壮,长势一般,球茎小B30.596.67b7.565.84根黄白较长,粗壮,长势好,球茎大B40.8100.00a8.126.05根黄白较长,粗壮,长势好,球茎大B51.092.50c7.135.59根黑黄细长,长势好,球茎大B61.282.50e5.084.21根发黑,粗壮,长势一般,球茎小B71.578.33f5.574.13根发黑,粗壮,长势一般,球茎小
2.2.2 不同浓度IBA对平陆百合生根的影响
除NAA外,IBA也常用来诱导生根。为了探究哪种生长素更有利于平陆百合生根,设计了单因素试验。由表3可知,在最适无机盐用量的MS基本培养基上添加不同浓度的IBA,均能诱导平陆百合生根;与添加NAA的处理相比,添加IBA的处理生根效果较差;随着IBA浓度的不断升高,其生根率先升高后降低;根数、根长等均伴随变化;方差分析结果表明,各处理间差异达到显著水平(P<0.05);对各处理进行多重比较,B5与其他处理差异达显著水平,即IBA浓度为1.0 mg·L-1时,百合诱导生根最佳,生根率达94.17%,根黄白较长,粗壮,长势好,球茎大(图1中4)。
表3 不同浓度IBA对平陆百合生根的影响
Table 3 Effect of different IBA concentration on rooting of Lilium

编号CodeIBAmg·L-1生根率/%Rootingrate根数Nueberofroot根长/cmRootlength生长情况GrowthstatesB1046.67g3.973.05根发黑,较细,长势较差,球茎小B20.282.50e4.964.09根发黑,粗壮,长势一般,球茎小B30.586.67c6.075.12根黑黄细长,长势好,球茎大B40.890.83b6.825.39根黄白较长,粗壮,长势好,球茎大B51.094.17a7.965.77根黄白较长,粗壮,长势好,球茎大B61.283.33d5.284.08根发黑,粗壮,长势一般,球茎小B71.574.17f4.573.87根发黑,粗壮,长势一般,球茎小
2.3 不同蔗糖浓度对平陆食用百合生根的影响
平陆食用百合属于喜糖植物,蔗糖的浓度对试管苗鳞茎增大及生根有明显促进作用;但蔗糖浓度应在一定范围内,对其生根有积极作用,大于或小于该浓度会呈现抑制作用。在1/2(大量微量)MS基本培养基上附加相同激素浓度的NAA 0.8 mg·L-1,不同浓度的蔗糖,诱导生根情况差异明显见表4。随着蔗糖浓度的升高,平陆百合的生根率呈现先升高后降低的变化趋势。方差分析结果表明,各处理间差异达到显著水平(P<0.05);对各处理进行多重比较,D4与其他处理差异达显著水平,即蔗糖浓度为90 g·L-1时,最适诱导百合生根(图1中5、6)。
表4 不同蔗糖浓度对平陆食用百合生根的影响
Table 4 Effect of different sucrose concentration on rooting of Lilium
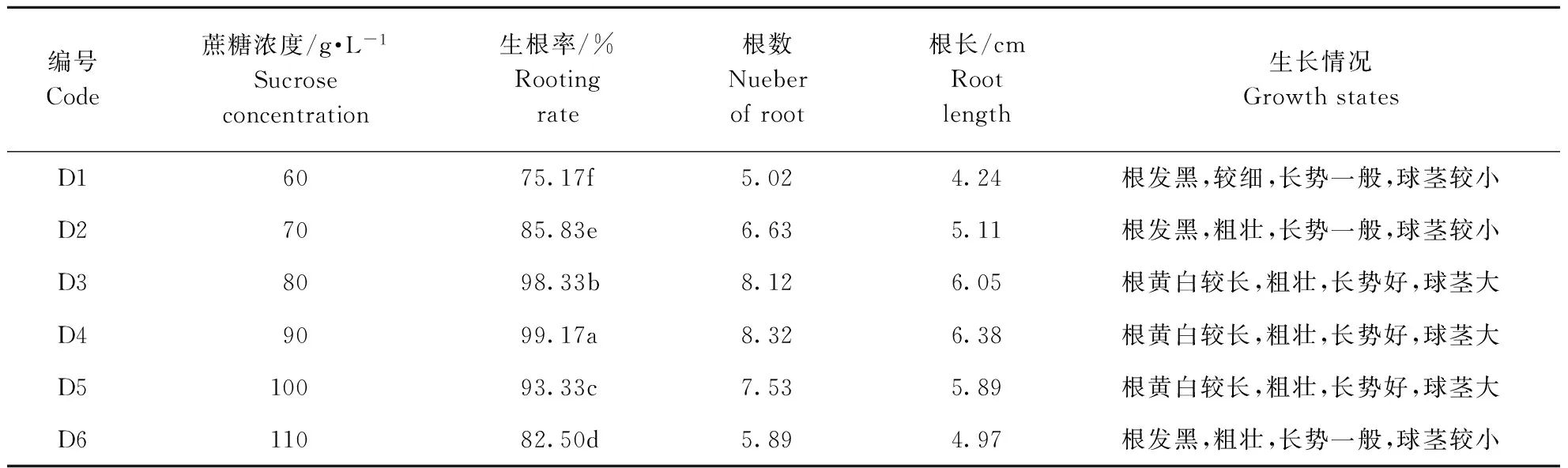
编号Code蔗糖浓度/g·L-1Sucroseconcentration生根率/%Rootingrate根数Nueberofroot根长/cmRootlength生长情况GrowthstatesD16075.17f5.024.24根发黑,较细,长势一般,球茎较小D27085.83e6.635.11根发黑,粗壮,长势一般,球茎较小D38098.33b8.126.05根黄白较长,粗壮,长势好,球茎大D49099.17a8.326.38根黄白较长,粗壮,长势好,球茎大D510093.33c7.535.89根黄白较长,粗壮,长势好,球茎大D611082.50d5.894.97根发黑,粗壮,长势一般,球茎较小
3 讨论与结论
影响百合试管苗生根的因素是多方面的,如无机盐用量、激素种类及其质量浓度、蔗糖浓度等[11~13]。在试验中,培养基无机盐浓度过高或过低均不利于组培苗的生根。减少培养基中某种营养成分对诱导生根有促进作用,可刺激其生根,可能是由于高浓度的无机盐促进地上部优先生长,顶端优势进一步加强,低浓度的无机盐则使地下部优先生长,促进生根且根部健壮,以保证吸收更多的养分供应地上部生长。刘静等[14]在兰州百合快速繁殖研究中得出最佳生根基本培养基为 1/2MS;潘理云等[15]在宜兴百合组培快繁技术的研究中也得出相同的结论;这些与本试验结果相比较,稍有出入,本试验中,当基本培养基为1/2(大量微量)MS时,诱导百合生根最佳,生根率达96.67%,根黄白,粗壮,长势好,球茎大。这可能与百合品种等相关。
IBA也常用来诱导试管苗生根,在某些植物的离体培养中,IBA较NAA更有利于不定根的诱导。罗晓波等[16]在宜昌百合离体培养快繁技术研究中发现最适宜生根生长素为IBA,其浓度为0.5 mg·L-1,但在本实验中,NAA的生根效果最佳,其次是IBA。在进行平陆百合的不定根诱导时,NAA浓度偏高或偏低都会降低小鳞茎生根的能力;张红岩等[17]在兰州百合组织培养及快速繁殖技术研究中得出最适NAA浓度0.6 mg·L-1;代建丽等[18]在宜兴百合鳞茎不定芽的诱导及增殖的研究中得出最佳NAA浓度1.0 mg·L-1;本试验中当NAA浓度为0.8 mg·L-1,与其他处理差异达显著水平,生根率达100%,根数达8.12条,根长有6.05 cm。推测这可能与百合品种基因型有关[19]。
在组织培养过程中,糖类是能够提供碳源的重要能量物质,还可以调节培养基的渗透压,对组培苗形态发生有特殊作用[20]。平陆食用百合属于喜糖植物,蔗糖的浓度对试管苗鳞茎增大及生根影响较大。该研究结果表明,最适宜的生根培养基蔗糖浓度为90 g·L-1,生根率为99.17%,平均生根数达8.32条,平均根长6.38 cm。但继续提高蔗糖浓度,会呈现抑制作用。
综合考虑,平陆食用百合生根的最佳培养基为:1/2(大量微量)MS+ NAA 0.8 mg·L-1+蔗糖90 g·L-1。
[1]周春华,尤超,陈凝华.百合组织培养研究进展[J].北方园艺,2013(14):193-195.
[2]仙鹤,任向荣,孙美乐,等.食用百合组培苗移栽应用技术[J].农村科技,2015(6):59-61.
[3]阮瑶瑶,丁健,杨懋勋.药用、食用、观赏用百合组培快繁研究进展[J].深圳职业技术学院学报. 2011,10(1):10-11.
[4]吴青青,窦云,张朝君,等.两个百合商业品种的组培快繁技术研究[J].北方园艺,2015(12):96-99.
[5]Hoshi Y, Kondo M, Mori S, et al. Production of transgenic lily plants by agrobacterium-mediated transformation[J]. Plant Cell Rep, 2004,22:359-364.
[6]周晓波,吴艺飞,丁茁荑.卷丹百合脱毒快繁技术研究[J].中国农学通报,2012,28(31):201-205.
[7]高博,郝永丽,胡海波,等.麝香百合组织培养快繁体系建立[J].北方农业学报,2016,44(1):52-55.
[8]张彦妮,张艳波.毛百合鳞片组织培养再生体系的建立[J].江苏农业科学,2012,40(8):63-64.
[9]刘婕,刘雅莉,贾敏,等.亚洲百合试管苗生根的研究[J].中国农学通报,2011,27(28):163-166.
[10]向地英,薛木易,邹丽红.铁炮百合离体再生体系的建立[J].江苏农业科学,2015,43(2):55-57.
[11]张传海,葛自兵,白雪峰,等.食用百合卷丹离体培养再生体系的建立[J].皖西学院学报,2012,28(2):1-3.
[12]Laura F, Giuseppina F, Claire K, et al. Adventitious rooting is enhanced by methyljasmonate in tobacco thin cell layers[J]. Planta, 2009,231:155-168.
[13]Zhu Z G. Affecting factors on the proliferation of test-tube Lily Bulb[J]. Chinese Journal of Tropical Crops,2013b,34(10):1961-1965.
[14]刘静.兰州百合快速繁殖研究[J].南方农业学报,2011,42(8):839-842.
[15]潘理云,张海洋.宜兴百合组培快繁技术的研究[J].安徽农业科学,2012,40(10):5748-5750.
[16]罗晓波,齐良富,耿研会.宜昌百合离体培养快繁技术研究[J].四川林业科技, 2015,36(5):75-78.
[17]张红岩,周兴,莫勇生,等.兰州百合组织培养及快速繁殖技术研究[J].广西科学院学报, 2015,31(1):49-53.
[18]代建丽,吴兴超,刘梦婷,等.宜兴百合鳞茎不定芽的诱导及增殖[J].湖北农业科学, 2014,53(21):5282-5284.
[19]HOU Jing-wei, GUO Su-juan, WANG Gui-yun. Effects of in vitro subculture on the physiological characteristics of adventitious root formation in microshoots of Castanea mollissima cv.‘yanshanhong’ [J]. Journal of Forestry Research,2010,21(2):155-160.
[20]王蒂.植物组织培养[M].北京:中国农业出版社,2010:21-23.
(编辑:武英耀)
Rooting culture ofLiliumbrowniivar.viridulumvirus-free plants
Ren Jianhong, Wang Pengli, Yin Li’na, Zhao Juan*
(CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]In order to establish an efficient rooting protocol in vitro ofLiliumbrownievar.viridulum, [Methods]With the regenerated bulbs ofLiliumas materials,the effect of inorganic salt, auxin and sucrose concentration on root formation ofLiliumwere studied. [Results]Lower inorganic salt concentration was much better for rooting ofLilium;NAA in comparison with IBA, were more suit able for roots formation ofLilium, the optimum concentration was 0.8 mg·L-1, The best induction results were obtained at the concentration of 90 g·L-1.Too high or too low sucrose concentration had some restrainable effect on root formation.[Conclusion]The optimal rooting media ofLiliumbrowniivar.viridulumwas 1/2(macroelements、 microelements) MS+0. 8 NAA mg·L-1+90 g·L-1sucrose. The rooting rate was 100% and roots were suitable for transplanting.
Liliumbrownievar.viridulum, Auxin, Rooting culture
2016-07-10
2016-07-27
任建宏 (1991-),男(汉),硕士研究生,研究方向:植物组织培养
*通讯作者:赵娟,博士,副教授。Tel:13834836658;E-mail:sxndzhaojuan@163.com
山西省科技攻关项目(20130311014-1) ;山西农业大学引进人才科研启动项目(2012YJ13)
S644.1
A
1671-8151(2016)11-0800-05
