不同矿质胶体对镉的吸附动力学及热力学研究
2016-12-20李丽宁阳李朝丽
李丽,宁阳,李朝丽
(云南农业大学 资源与环境学院,云南 昆明 650201)
不同矿质胶体对镉的吸附动力学及热力学研究
李丽,宁阳,李朝丽*
(云南农业大学 资源与环境学院,云南 昆明 650201)
[目的]为探讨镉在不同矿质胶体中的吸附机理,以期为镉的土壤环境行为提供科学依据。[方法]本文采用一次平衡法研究了4种矿质胶体(蒙脱石、高岭石、针铁矿和三水铝石)对镉的吸附动力学与热力学特征,并采用Lagergren一级动力学方程、Lagergren二级动力学方程、颗内扩散模型、Elovich 模型对试验数据进行拟合。[结果]4种温度下矿质胶体对镉的吸附分为快反应和慢反应2个阶段,0~30 min为快速反应阶段,4种矿质胶体吸附量达到饱和吸附量的90%以上,此后为慢反应阶段。随温度升高,4种矿质胶体对镉的吸附量减少。当温度由10 ℃升到40 ℃,蒙脱石、高岭石、针铁矿和三水铝石对镉的吸附量分别减少了:31.6%、58.5%、31.8%、72.4%。4种矿质胶体的吸附动力学均符合Lagergren二级动力学方程,吸附过程以化学吸附为主,且是由2个或多个过程控制。[结论]4种矿质胶体对镉的吸附均为放热反应,反应能自发进行。
矿质胶体;镉;吸附动力学;热力学
镉是一种有毒的环境重金属污染物,对人体与动物来说是一种非必需且蓄积性强、毒性持久的剧毒元素[1]。土壤受到大量镉污染后,农作物吸收镉并通过食物链危害人体健康,且镉通过径流迁移还会危及水生生态系统。因此,镉进入环境中的行为已引起众多研究者的关注[2~4]。
土壤矿物质是土壤固相的主体物质,其中层状硅酸盐矿物(蒙脱石、高岭石、蛭石和伊利石)和铁、铝氧化物及氢氧化物等是土壤矿质胶体的主要组成成分[5]。镉进入土壤后,与土壤中各固相组分发生物理、化学及生物反应,主要包括吸附解吸、沉淀溶解、氧化还原等作用。吸附反应是影响镉环境归宿及镉污染控制的关键过程,其影响镉的生物有效性及其在环境中的迁移转化和循环。土壤对镉的吸附主要取决于土壤固相的组成、种类、含量和形态。我国不同地带土壤矿质胶体含量及分布不同,其特点为从南到北蒙脱石逐渐增多,高岭石逐渐减少[6,7]。不同类型矿质胶体对重金属镉的吸附特性有较大差异。何宏平[8]、朱霞萍[9]等研究了蒙脱石、高岭石等几种粘土矿物对镉的吸附行为,结果表明几种粘土矿物对镉的饱和吸附量均有较大差异。以往大多研究都是利用平衡吸附法研究镉在不同矿质胶体上的吸附特征[10,11 ],而通过镉的吸附热力学与动力学特征来研究镉在不同矿质胶体的吸附行为的文献报道相对较少。因此研究不同类型矿质胶体对镉的吸附热力学与动力学有助于揭示镉的吸附机理。本研究分别以2种层状硅酸盐矿物:高岭石(1:1型粘土矿物)、蒙脱石(2:1型粘土矿物)及2种氧化物:针铁矿(铁氧化物)和三水铝石(铝氧化物)作为土壤矿质胶体的代表,来探讨不同矿质胶体对镉的吸附动力学与热力学特征,探讨镉在不同矿物中的吸附机理,以期为镉的土壤环境行为提供科学依据。
1 材料与方法
1.1 供试材料
试验所用层状硅酸盐类粘土矿物有高岭石,产自广东茂名,300目;蒙脱石,产自四川绵阳,300目。
蒙脱石、高岭石胶体的制备(沉降法):取50 g 60目筛的风干土壤矿物(蒙脱石、高岭石)于高型烧杯中,加适量去离子水,搅拌均匀,超声分散2 h后,加NaOH调节pH到8.5左右,再进行超声分散。然后用沉降虹吸法分离出<2 μm的组分(即为胶体)。然后加水搅拌再用沉降虹吸法分离,如此反复多次,直至加水搅拌沉降了规定时间后上层溶液基本澄清无胶体为止。向稀的胶体中加入几滴盐酸使其絮凝,倾去上层清液,如此反复浓缩后电析,风干,磨细过60目筛备用[12]。
氧化物类粘土矿物有针铁矿和三水铝石,其制备采用化学合成法。
针铁矿的制备:称取50 g Fe(NO3)3·9H2O于5 000 mL大烧杯中,加水大约是Fe(NO3)3·9H2O 17倍体积搅动使其充分溶解,在搅拌下均匀地滴加2.5 mol·L-1NaOH直至溶液pH稍高于12(用pH电极测定)即可,然后将此溶液放入恒温箱中60 ℃老化24 h,期间搅动几次;弃去上清液后用蒸馏水洗几次,后电渗析处理,检验合格后,60 ℃红外灯下烘干,磨细过60目筛备用[13]。
三水铝石的制备:称取100 gAlCl3·6H2O于5 000 mL刻度大烧杯中,加适量水(此时溶液浓度为1 mol·L-1),溶解后在搅动下均匀地滴加4 mol·L-1NaOH直至pH稳定在4.6,然后放入恒温箱内40 ℃老化2 h取出,然后进行电渗析处理;检验合格后风干,磨细过60目筛备用。
供试矿质胶体的基本性质见表1,矿质胶体扫描特征见图1。
表1 供试矿质胶体基本理化性质
Table 1 Physical and chemical properties of the studied minerals

矿质胶体Colloids比表面积/m2·g-1Surfacearea阳离子交换量/cmol·kg-1CEC电荷零点Zeropointcharge粒径/nmparticalsize蒙脱石110.9133.81.63764高岭石47.415.42.12552.6针铁矿125.1157.522159三水铝石10.31.06.012536
1.2 试验药品
试验所用药品:Cd(NO3)2·2.5H2O(优级纯),NaNO3均为分析纯。
1.3 实验方法
分别称取0.05 g 高岭石、蒙脱石、针铁矿和三水铝石于50 mL 聚乙烯塑料离心管中,加入25 mL初始浓度为100 mg·L-1的Cd(NO3)2溶液(pH 5.5),以0.01 mol·L-1的NaNO3溶液作为支持电解质,用0.1 mol·L-1的HCl或NaOH调节体系pH为5.5左右。分别于1、3、5、10、15、30、60、90、120、180、240 min 时取样,在4 000 r·min-1下离心10 min,过0.45 μm滤膜,用ICP-OES法测定滤液中Cd2+浓度。用差减法计算重金属的吸附量。试验设10 ℃、20 ℃、30 ℃、40 ℃ 4个温度处理。
1.4 计算方法
不同时刻矿质胶体对镉的吸附量计算公式如下:
(1)

图1 高岭石(a)、蒙脱石(b)、针铁矿(c)与三水铝石(d)的扫描电镜图Fig.1 SEM micrographs of kaolinite(a) montmorillonite(b) goethite(c) and gibbsite
式中:qt为平衡时单位质量的矿质胶体吸附镉的质量/mg·g-1;C0为初始溶液Cd的质量浓度/mg·L-1,Ct为第t时刻溶液中Cd的质量浓度/mg·L-1,V为溶液体积/L,m为土壤矿质胶体质量/g。
1.5 数据处理
采用Microsoft Excel 软件对数据进行处理,用origin 8.0作图并拟合方程。
2 结果与分析
2.1 镉在不同矿质胶体上的吸附动力学特征
不同温度下不同矿质胶体对镉的吸附量随时间变化的动力学曲线如图2。由图2可以看出:在不同温度下蒙脱石、高岭石、针铁矿和三水铝石对镉的吸附动力学曲线具有共性:在30 min内,吸附量随时间的增加而迅速增加,吸附量均达到饱和吸附量的90%以上。30 min后,其吸附量增加缓慢并逐渐趋于平衡。因此,可以把镉的吸附动力学过程分为2个阶段:吸附开始的快速反应阶段和此后的慢反应阶段。
另外,4种矿质胶体对镉的吸附量随温度的变化一致。随温度的升高,各矿质胶体对镉的吸附量均降低。10 ℃时,蒙脱石、高岭石、针铁矿和三水铝石对镉的饱和吸附量分别为:23.704、6.803、10.043、5.370 mg·g-1;温度增加到20 ℃时,饱和吸附量分别减少到:20.521、 5.498 、8.282 、4.576 mg·g-1,分别减少了:13.4%、19.2%、17.5%、14.8%。当温度增加到30 ℃时,饱和吸附量分别减少到:17.254 、4.875 、7.378 、2.842 mg·g-1,分别减少了:27.2%、28.3%、26.5%、47.0%。温度增加到40 ℃时,饱和吸附量分别减少到:16.214 、2.822 、6.851 、1.483 mg·g-1,分别减少了:31.6%、58.5%、31.8%、72.4%。显然,升高温度不利于各矿质胶体对镉的吸附。
2.2 吸附动力学模型
为了定量描述矿质胶体对镉的吸附动力学特征,将不同矿质胶体对镉的吸附量与时间的关系用以下模型进行拟合。
Lagergren一级动力学模型:
log(qe-qt)=logqe-k2t/2.303
(2)
Lagergren二级动力学模型:
(3)
颗粒内扩散模型:
qt=ktdt1/2+1
(4)
Elovich模型:
qe-qt=-k2lnt/2.303+qe
(5)
式中:qe和qt分别为饱和吸附量和t时刻的吸附量/mg·g-1;K1为一级吸附速率常数/min-1;K2为二级吸附速率常数/g·mg-1·min-1;kid为粒内扩散速率常数/mg·g-1·min-0.5。
由表2相关系数R2可知:二级动力学方程最适合描述镉在矿质胶体上的吸附过程,一级动力学方程和Elovich方程的拟合相关性不好,且所得的吸附量与实验结果差距较大,所以矿质胶体对镉的吸附不符合一级动力学方程和Elovich方程。在所有情况下,二级动力学相关系数R2>0.999 2,且用Lagergren二级动力学模型计算得到的饱和吸附量与试验所得值相接近,说明不同温度下,4种矿质胶体对镉的吸附均遵循二级动力学反应。且吸附过程以化学吸附为主。
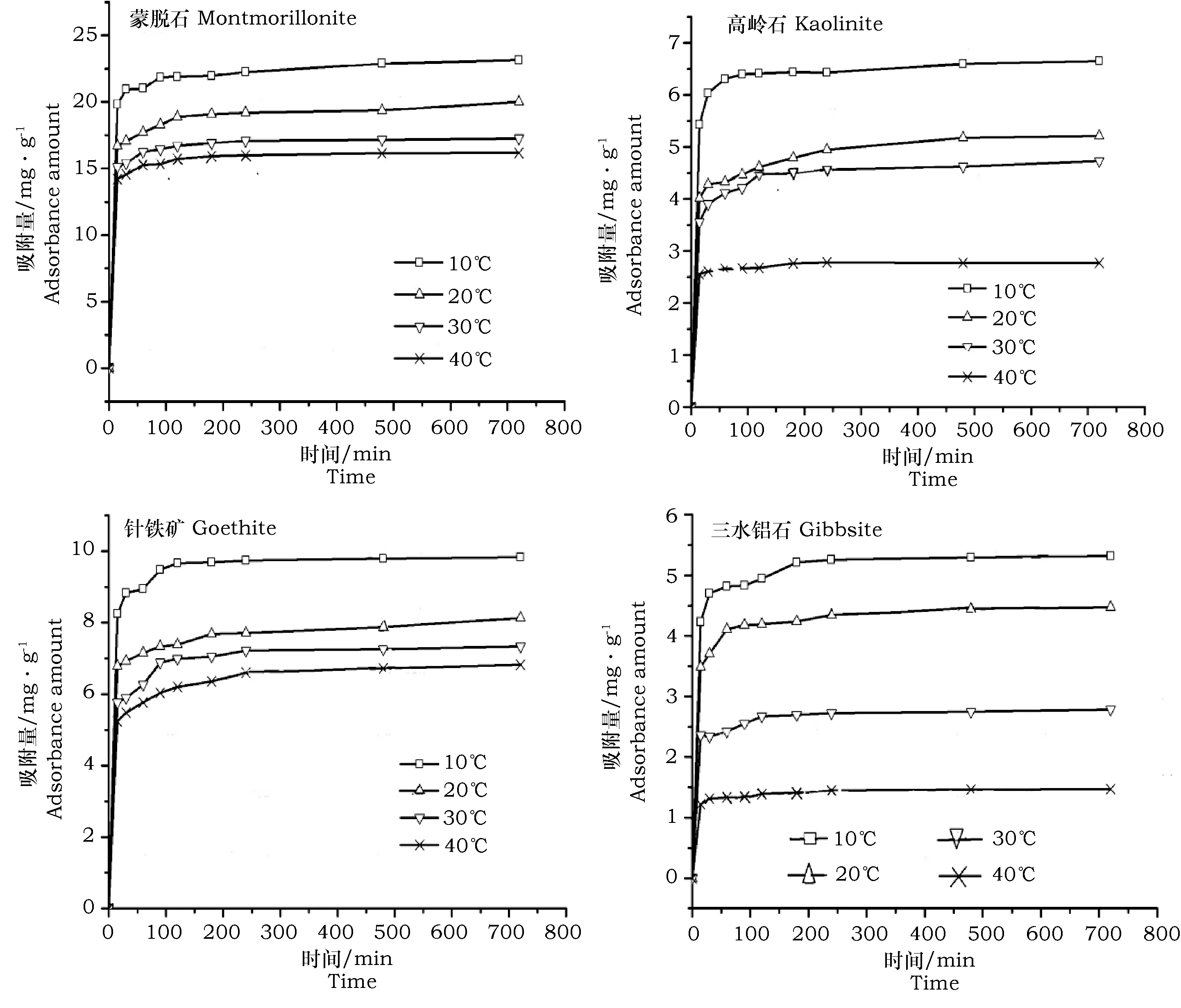
图2 4种矿质胶体对镉的吸附动力学曲线Fig.2 Kinetic plots of Cadmium sorption by the soil colloid at 10 ℃、20 ℃、30 ℃ and 40 ℃
Table 2 Kinetic parameters for cadmium adsorption by the four soil colloids

矿质胶体Soilcolloids温度/KTemperature试验饱和吸附量/mg·g-1Maximumadsorption一级动力学常数Fistorderkineticconstant二级动力学常数SecondorderkineticconstantElovich方程Elovichequationqe/mg·g-1K1/min-1R2qe/mg·g-1K2/g·mg-1·min-1R2qe/mg·g-1K3R2蒙脱石高岭石针铁矿三水铝石28323.702.8700.00250.913223.751303.9580.99985.751.8320.968229320.522.9770.00250.851520.56700.1390.99966.121.9650.966330317.251.6090.00700.950117.301425.10813.211.1550.858131316.211.3490.00580.921116.261136.90213.021.0800.86982836.801.4650.00230.70146.8137.9590.99981.680.5620.80432935.501.2560.00240.90235.527.8710.99922.440.7630.96893034.870.8340.00270.79044.898.4980.99971.900.6360.93043132.820.1690.00240.52522.824.7280.99990.410.1360.899928310.040.9010.00250.563210.05148.8170.99992.460.8440.83082938.281.3280.00300.94978.3144.6690.99972.500.8000.98603037.381.0590.00490.85477.4252.14112.550.9060.84013136.851.3610.00510.96526.9029.8540.99992.600.8980.94632835.370.6550.00410.80305.3921.25211.710.6250.89492934.580.6580.00300.80654.599.1130.99991.650.5810.89793032.840.3760.00300.78632.852.3680.99990.880.3050.87593131.480.1770.00410.87021.490.4460.99960.380.1310.9182
重金属离子从液相吸附到固相的过程可以分为4步[ 14]:溶剂扩散、膜扩散、颗粒间扩散、溶质在表面的吸附,其吸附过程是由一个或多个步骤控制。用qt对t1/2作图,若呈线性关系,则吸附过程仅被颗粒间扩散控制。从图3可以看出:qt与t1/2不存在线性关系,说明吸附过程不仅仅有颗粒扩散过程,而是由2个或多个过程控制。0~15 min内呈陡峭的直线,接着出现直线,然后出现平台期。该陡峭直线部分说明该过程有非常高的吸附速率。接着出现的直线部分为颗粒间扩散,平台期表示达到吸附平衡状态。因此,颗粒间扩散过程可能为吸附过程中的主要限速步骤。

图3 颗粒间扩散模型对矿质胶体吸附动力学的模拟Fig.3 The plot of qt vs.t1/2 for the intraparticle of Cd2+ on the colloids at 10 ℃、20 ℃、30 ℃ and 40 ℃
2.3 吸附热力学研究
吸附过程中,4种矿质胶体的吸附热力学参数[15]可通过下列公式进行计算:
Ka=ca/ce
ΔG=-RTlnKc
ΔG=ΔH-ΔST
式中:Kc为平衡常数;Ce为平衡浓度/mg·L-1;Ca为吸附剂浓度/mg·L-1;ΔG为吸附过程的自由能变/kJ·mol-1;ΔH为吸附过程的焓变/kJ·mol-1;ΔS为吸附熵变/kJ·mol-1·K-1;T为绝对温度/K;R为气体常数。
用lnKc对1/T作图,由直线的斜率和截距即可求得ΔH和ΔS。具体热力学参数见表3,结果表明:10~40 ℃过程中,ΔH<0,说明3种矿质胶体对镉的吸附为放热反应。ΔG<0,说明吸附过程是自发进行的。ΔS>0,说明镉被吸附到矿质胶体后其混乱度增加。
表3 矿质胶体吸附镉热力学参数
Table 3 Thermodynamic parameters for the adsorption of Cd2+on soil colloids

矿质胶体Soilcolloids温度/KTempretureΔKcΔG/kJ·mol-1ΔH/kJ·mol-1ΔS/kJ·mol-1·K-1蒙脱石高岭石针铁矿三水铝石28338.46-8.5929336.24-8.7530332.37-8.7631330.27-8.8728323.16-7.3929322.89-7.6330322.38-7.8331321.23-7.9528325.23-7.6029323.72-7.7130323.62-7.9731323.41-8.2128322.45-7.3229321.73-7.5030321.31-7.7131320.64-7.88-6.128.80-2.0718.90-1.7120.67-2.0018.80
3 讨论
研究结果表明,矿质胶体吸附镉的吸附动力学过程分为2个阶段:吸附开始的快速反应阶段和此后的慢反应阶段。类似的现象在以往的研究中有报道[16~18]。产生这种现象的原因可能是:矿质胶体表面镉的吸附位点数一定,开始反应时,吸附位点数较多,所以吸附反应快。随时间的延长,未被吸附的位点数逐渐减少,吸附速率显著降低,表现为缓慢上升的过程。镉被吸附到矿质胶体后其混乱度增加,这可能是由于镉在矿质胶体上置换下了更活泼的离子[14,15,19],或者是由于羟基上被置换的氢离子引起的熵的增加大于离子吸附所引起的熵值的降低,也可能是Cd2+与矿质胶体表面羟基生产内圈络合物,会释放或生成大量水分子,而引起混乱度增加,体系熵增加[20]。
4 结论
(1)4种温度下蒙脱石、高岭石、针铁矿和三水铝石对镉的吸附可分为快反应和慢反应2个阶段。在快反应阶段内,矿质胶体对镉的吸附量均达到饱和吸附量的90%以上。
(2)4种矿质胶体对镉的吸附更遵循二级动力学反应,且吸附过程以化学吸附为主。吸附过程的限速步骤可能为颗粒间扩散。
(3)热力学研究表明4种矿质胶体对镉的吸附为放热反应,反应自由能变为负,反应能自发进行。
[1]杜丽娜,余若祯,王海燕,等.重金属镉污染及其毒性研究进展[J].环境与健康杂志,2013,30(2):167-174.
[2]SHAO Xiaohou,HU Ait ang,QIN Huaiying.Research on the adsorption-desorption of cadmium on soil[J].Environmental Chemistry,2000,10(1):76-80。
[4]Unuabonah E I,Adebowale K O,Olu-Owolabi B I,et al.Adsorption of Pb (II) and Cd (II) from aqueous solutions onto sodium tetraborate-modified Kaolinite clay:equilibrium and thermodynamic studies[J].Hydrometallurgy,2008,93(1):1-9.
[5]李学恒.土壤化学[M].北京:高等教育出版社,2001:116-139.
[6]吴宏海,胡勇有,黎淑平.有机酸与矿物间界面作用研究评述[J].岩石矿物学杂志,2001,20(4):309-404.
[7]滕飞,李福春,吴志强,等.高岭石和蒙脱石吸附胡敏酸的对比研究[J].中国地质,2009,36(4):892-898.
[8]何宏平,郭九皋,朱建喜,等.蒙脱石、高岭石、伊利石对重金属离子吸附容量的实验研究[J].岩石矿物学杂志,2001,20(4):573-578.
[9]朱霞萍,白德奎,李锡坤,等.镉在蒙脱石等粘土矿物上的吸附行为研究[J].岩石矿物学杂志,2015(6):143-148.
[10]Bhattacharyya K G,Gupta S S.Adsorption of a few heavy metals on natural and modified kaolinite and montmorillonite: a review[J].Advances in colloid and interface science,2008,140(2):114-131.
[11]Granados-Correa F,Corral-Capulin N G,Olguín M T,et al.Comparison of the Cd (II) adsorption processes between boehmite (γ-AlOOH) and goethite (α-FeOOH)[J].Chemical engineering journal,2011,171(3):1027-1034.
[12]熊毅,陈家坊.土壤胶体(第二册)[M].北京:科学出版社,1985:21-40.
[13]Alkinson R J,Posner A M,Quirk J P.Adsorption of potential-determining ions at the ferric oxide aqueous electrolyte interface[J].Journal of physical chemistry,1967,71:550-558.
[14]Unlu N,Ersoz M.Adsorption characteristics of heavy metal ions onto a low cost biopolymeric sorbent from aqueous solution[J].Journal of Hazardous Materials,2006,136(2):272-280.
[15]Agrawal A,Sahu K K.Kinetic and isotherm studies of cadmium adsorption on manganese nodule residue[J].Journal of Hazardous Materials,2006,137(2):915-924.
[16]张增强,张一平,朱兆华.镉在土壤中吸持的动力学特征研究[J].环境科学学报,2000,20(3):370-375.
[17]Strawn D G,Sparks D L.Effects of soil organic matter on the kinetics and mechanisms of Pb(Ⅱ)sorption and desorption in soil[J].Soil SciSoc Am J,2000(64):144-156.
[18]孟昭福,邓晶,杨淑英,等.有机修饰(土娄)土对苯酚的吸附动力学[J].环境科学,2009,30(1):191-199.
[19]宋恩军,张东,徐亮子,等.有机皂土的PAN修饰及其对水中镉离子的吸附行为[J].离子交换与吸附,2010(1):16-23.
[20]方临川.重金属与细菌—土壤活性颗粒微界面互作的分子机制[D].武汉:华中农业大学,2011.
(编辑:武英耀)
Kinetics and thermodynamics of Cd(Ⅱ) adsorption on to soil colloids
Li Li, Ning Yang, Li zhaoli*
(CollegeofResourcesandEnvironmentalSciences,YunnanAgriculturalUniversity,Kunming650201,China)
[Objective] This study aimed to study the adsorption mechanism of cadmium on different mineral colloids,so as to provide scientific basis for environment behaviors of cadmium. [Methods]In this experiment, batch techniques were used to investigate kinetics and thermodynamics of Cd adsorption on 4 colloids, The adsorption data were fitted using Lagergren fist-order kinetic equation、second-order equation and Elovich equation . [Results]The results showed that the the reaction of adsorption can be devided into two types: a fast reaction in the fist 30min and a slow reaction in the later reaction course. The amounts of Cd2+adsorbed by the fast reaction exceed 90% of the adsorption capacity. As the temperature increased from 10 ℃ to 40 ℃,the adsorption capacity of montmorillonite 、kaolinite 、goethite and gibbsite respecially decrese by 31.6%、58.5%、31.8%、72.4%. process for Cd2+onto the four colloids were found to follow second order type adsorption kinetics.The adsorption process was attributed to chemical adsorption and was controlled by two or more steps.[Conclusion]It indicated the adsorption processes to be exothermic and adsorption reaction was a spontaneous process.
Soil mineral colloids, Cadmium, Adsorption Kinetics, Thermodynamics
2016-04-13
2016-05-31
李丽(1988-),女(汉),山西长治人,硕士研究生,主要研究方向:土壤污染化学
*通讯作者:李朝丽,讲师, 硕士生导师。 Tel:15096689656;E-mail: lizhaoli527@163.com
土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所)开放基金课题(0812201229)
P619.25+9
A
1671-8151(2016)11-0786-07
