凡纳滨对虾黏着斑激酶基因克隆与合并感染条件下的免疫应答
2016-12-20孙成波
王 刚,孙成波,2
( 1.广东海洋大学 水产学院,广东 湛江 524025;2.广东高校热带海产无脊椎动物养殖工程技术研究中心,广东 湛江 524025 )
凡纳滨对虾黏着斑激酶基因克隆与合并感染条件下的免疫应答
王 刚1,孙成波1,2
( 1.广东海洋大学 水产学院,广东 湛江 524025;2.广东高校热带海产无脊椎动物养殖工程技术研究中心,广东 湛江 524025 )
采用RACE技术克隆凡纳滨对虾黏着斑激酶基因,利用相关软件工具拼接、比对其序列,构建进化树,同时利用荧光定量技术分析了该基因的组织分布和合并感染下的免疫应答。试验结果显示,凡纳滨对虾黏着斑激酶基因 cDNA序列全长4919 bp,ORF片段长3036 bp,编码1012个氨基酸。凡纳滨对虾黏着斑激酶基因具有蛋白激酶特征结构域PTK和C端的对虾黏着结构域。荧光定量结果表明,凡纳滨对虾黏着斑激酶基因表达无组织特异性,眼部表达量最高,肌肉中表达量最低,可以被副溶血弧菌与白斑综合症病毒以及二者的合并感染诱导表达,表达量先升再降,整个试验过程中合并感染组斑激酶表达量总是高于白斑综合症病毒单独感染组。酶活测定结果表明,合并感染组酸性磷酸酶活力变化最活跃;试验后期,弧菌单独感染组碱性磷酸酶活力始终高于合并感染组,合并感染组过氧化物酶活力总是高于白斑综合症病毒单独感染组;整个试验过程中,弧菌单独感染组超氧化物歧化酶活力始终高于其他两个感染组。
凡纳滨对虾;副溶血弧菌;白斑综合症病毒;黏着斑激酶;合并感染;酶活力
凡纳滨对虾(Litopenaeusvannamei)是中国对虾养殖业重要的养殖对象。白斑综合症病毒是对虾养殖业病害频繁爆发最重要的病原之一,感染后对虾的死亡率可达90%~100%[1]。除病毒病外,弧菌(Vibrio)也是水产养殖中最常见的病原体,通常是继发感染中机会性感染者[2]。研究表明,不同密度的鳗弧菌(V.anguillarum)与一定含量白斑综合症病毒合并感染凡纳滨对虾,合并感染条件下死亡率总是高于白斑综合症病毒单独感染,且病毒携带量高于白斑综合症病毒单独感染条件下的病毒携带量[3]。这与笔者前期的研究及Corteel等[4]研究的一定含量的弧菌与白斑综合症病毒合并感染可以抑制白斑综合症病毒爆发的结果有所不同。此类现象在果蝇的研究中也有发现,感染了沃尔巴克氏体细菌(Wolbachia)的黑腹果蝇(Drosophilamelanogaster)可以抑制果蝇C型病毒的爆发[5]。此外Glaser等[6-7]也发现,感染了沃尔巴克氏体细菌的果蝇与埃及伊蚊(Aedesaegypti)具有更强的抗病毒感染能力,可以抑制西尼罗病毒与基孔亚热病毒在机体内的增殖。目前,在对虾养殖中,细菌与病毒合并感染的研究较少,对于副溶血弧菌(V.prahaemolyticus)与白斑综合症病毒合并感染条件下对虾免疫机制的研究尚未见报道。
面对水环境中各种病原体的威胁,对虾通过各种免疫反应来阻止和抑制病原的入侵感染。非特异性免疫是甲壳动物的第一道防线,非特异性免疫系统可以通过信号转导途径激活体液和细胞免疫反应[8],发生吞噬作用,释放各类抗菌因子,激活酚氧化酶原系统[9]。其中对虾黏着斑激酶在信号转导过程中发挥着重要的作用[10]。斑激酶是一种非受体酪氨酸激酶,为integrin信号转导途径的下游信号分子,对虾在白斑综合症病毒感染早期,通过提高血细胞斑激酶蛋白表达和磷酸化水平增强细胞黏附能力,促进细胞免疫能力来抵抗病毒入侵[11]。本研究中,笔者克隆了凡纳滨对虾黏着斑激酶基因cDNA的全长,探讨了在副溶血弧菌与白斑综合症病毒单独、合并感染条件下凡纳滨对虾黏着斑激酶基因的表达和各种免疫相关酶活力变化,以期为病毒病和弧菌病的防治提供理论基础。
1 材料与方法
1.1 材料
试验在广东海洋大学无脊椎动物工程中心完成。健康凡纳滨对虾取自广东海洋大学东海岛生物研究基地,体长(7.66 ± 0.82) cm。对虾取回后暂养于温度(26 ± 1) ℃、盐度25 ± 1的沙滤海水中,7 d后进行试验。
RNA提取试剂盒为上海生物工程有限公司产品;RNA反转录试剂盒、质粒pMD-18、荧光定量QuantiFast SYBR Green PCR试剂盒为QIAGEN公司产品;RACE试剂盒、琼脂糖胶回收试剂盒均为Clontech公司产品;酶活力测定试剂盒购于南京建成公司;白斑综合症病毒来源于本实验室保存于- 80 ℃的病毒粗提液;副溶血弧菌由广东海洋大学水产品加工与安全重点实验室赠予。
1.2 方法
1.2.1 RACE模板制备
提取健康凡纳滨对虾鳃和肠部RNA,混合后按照说明书方法制备RACE模板。根据美国国立生物技术信息中心NCBI日本囊对虾(Marsupenaeusjaponicus)基因序列设计引物斑激酶 1R、斑激酶 1F,以获得凡纳滨对虾黏着斑激酶基因中间片段,经克隆后送上海生物工程有限公司测序。3′、5′均采用巢式PCR方法扩增。引物设计见表1。

表1 试验引物序列
1.2.2 序列分析
利用DNAMAN软件拼接凡纳滨对虾黏着斑激酶基因cDNA全长。利用美国国立生物技术信息中心BLASTP(http://blast.ncbi.nlm.nih.gov/Blast.cgi)在线工具鉴定获得的cDNA全长属于斑激酶基因。使用在线工具ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)分析基因ORF,利用ProtParam工具(http://web.expasy.org/cgi-bin/protparam/protparam)对蛋白质序列的理化性质和保守位点进行分析。利用在线工具InterPro工具(http://www.ebi.ac.uk/interpro/)比对其保守功能结构域。利用BLASTP搜索同源蛋白,Clustal X 2.0进行序列比对,采用MEGA4.0软件的邻接法构建系统进化树。
1.2.3 荧光定量
解剖健康凡纳滨对虾,取不同组织用于凡纳滨对虾黏着斑激酶基因组织表达分析。采集感染白斑综合症病毒与副溶血弧菌后不同时间的凡纳滨对虾鳃,提取RNA反转录后作为RT-PCR模板。反应体系为:10 μL,每个样品3个重复,以引物斑激酶 1R、斑激酶 1F作为凡纳滨对虾黏着斑激酶基因荧光定量引物,以β-actin作为内参基因。采用2-ΔΔCT法计算目的基因的相对表达量。
1.2.4 白斑综合症病毒与副溶血弧菌合并感染
试验设3个试验组和一个磷酸盐缓冲液对照组,每组3个平行,每个平行对虾40尾。试验组分为白斑综合症病毒 (104倍稀释液)和副溶血弧菌单独感染组(1.22×106cfu/mL)及二者合并感染组,合并感染组病原液中白斑综合症病毒与弧菌密度与单独感染组相同。在对虾第二腹节肌肉处注射50 μL病原液或磷酸盐缓冲液。感染后第0、3、6、12、24、48、72、96 h取样。
1.2.5 酶液制备及酶活力测定
取0.2 g肝胰腺组织,加入1.8 mL 磷酸盐缓冲液冰浴匀浆,4500 r/min低温离心15 min,取上清液于-80 ℃保存。肝胰腺粗酶液按照试剂盒说明书规定的比例稀释后,按照试剂盒说明书测定蛋白浓度、酸性磷酸酶、碱性磷酸酶、超氧化物歧化酶、过氧化物酶活力。
1.2.6 数据分析
数据用SPSS 21软件,进行单因素方差分析和多重比较检验,P< 0.05时差异显著;利用Excel 2003软件做图。
2 结 果
2.1 凡纳滨对虾黏着斑激酶基因氨基酸序列特征
通过分段克隆及DNAMAN软件拼接,得到凡纳滨对虾黏着斑激酶基因cDNA序列全长为4919 bp,其中ORF片段长3036 bp,编码1012个氨基酸,分子量113677.5 Da,理论等电点为9.48。Interpro工具分析表明,凡纳滨对虾黏着斑激酶氨基酸序列包含一个蛋白激酶结构域蛋白酪氨酸激酶(398~652 aa)和C端的对虾黏着斑激酶结构域(852~973 aa)(图1)。

图1 凡纳滨对虾斑激酶基因氨基酸序列PTK结构域用下划线标记,对虾黏着结构域用灰色标记.
2.2 凡纳滨对虾黏着斑激酶基因氨基酸进化树分析
采用邻接法构建基于氨基酸序列系统进化树,不同物种对虾黏着斑激酶被聚合成几支,包括甲壳动物、昆虫、鱼类、两栖类、哺乳动物和棘皮动物。红丽鱼(Pundamilianyererei)、尾罗罗非鱼(Oreochromisniloticus)等聚成鱼类分支,家鼠(Rattusnorvegicus)、蝙蝠(Myotislucifugus)等聚成哺乳动物分支,绿海胆(Lytechinusvariegatus)、非洲爪蟾(Xenopuslaevis)形成棘皮动物和两栖动物两单独分支,蝇蛹金小蜂(Nasoniavitripennis)和黑腹果蝇聚成昆虫分支,凡纳滨对虾与日本囊对虾(Marsupenaeusjaponicus)聚成甲壳动物分支,豌豆蚜(Acyrthosiphonpisum)以其特殊蛋白结构单独成支(图2)。
2.3 凡纳滨对虾黏着斑激酶基因的组织表达
分别从健康凡纳滨对虾胃、眼、心脏、肝胰腺、肌肉、鳃和肠提取总RNA,通过RT-PCR定量了凡纳滨对虾黏着斑激酶基因在各组织中的相对表达量。结果表明,对虾黏着斑激酶在凡纳滨对虾各组织中均有分布,眼部的相对表达量最高,肌肉中表达量最低(图3)。
2.4 副溶血弧菌与白斑综合症病毒单独、合并感染对凡纳滨对虾黏着斑激酶基因表达量的影响
整个试验过程中,磷酸盐缓冲液对照组的凡纳滨对虾鳃组织中对虾黏着斑激酶相对表达量未见明显的变化,而3个感染组对虾黏着斑激酶表达量先升后降。试验前期,弧菌单独感染组对虾黏着斑激酶表达量水平总是高于白斑综合症病毒单独感染组,感染6 h时出现最大值,且显著高于白斑综合症病毒单独感染组与合并感染组(P< 0.05)。白斑综合症病毒单独感染组与合并感染组对虾黏着斑激酶在感染24 h有最大值,96 h出现最低表达量,白斑综合症病毒单独感染组对虾黏着斑激酶相对表达量显著高于合并感染组(P< 0.05)。感染6、12、24、48 h时各处理组对虾黏着斑激酶表达量相对磷酸盐缓冲液组有明显上调(图4)。

图2 凡纳滨对虾黏着斑激酶基因进化树分析
凡纳滨对虾(Litopenaeusvannamei);伯氏朴丽鱼(Haplochromisburtoni);红丽鱼(Pundamilianyererei);半滑舌鳎(Cynoglossidaesemilaevis);尾罗罗非鱼(Oreochromisniloticus);非洲爪蟾(Xenopuslaevis);蝙蝠(Myotislucifugus);人类(Homosapiens);褐家鼠(Rattusnorvegicus);绿海胆(Lytechinusvariegatus);豌豆蚜(Acyrthosiphonpisum);日本囊对虾(Marsupenaeusjaponicus);蝇蛹金小蜂(Nasoniavitripennis);黑腹果蝇(Drosophilamelanogaster).
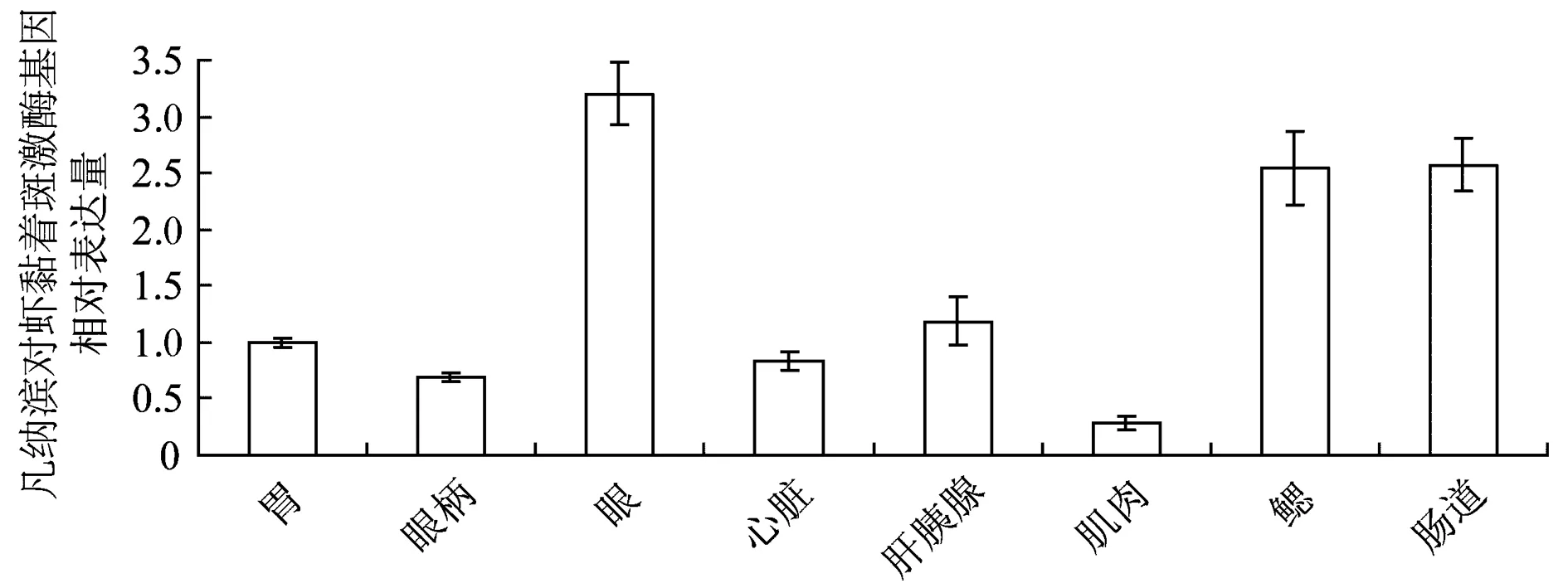
图3 凡纳滨对虾黏着斑激酶基因在凡纳滨对虾不同组织中的表达量
2.5 副溶血弧菌与白斑综合症病毒单独、合并感染对凡纳滨对虾免疫相关酶活力的影响
12 h时弧菌和白斑综合症病毒单独感染组酸性磷酸酶活力最大,而后各组均降低;合并感染组酸性磷酸酶活力先升后降,在24 h时出现最大值。试验后期,合并感染组酸性磷酸酶活力总是高于白斑综合症病毒单独感染组,在48、96 h差异显著(P< 0.05); 96 h时弧菌单独感染组酸性磷酸酶活力显著高于白斑综合症病毒单独感染组和合并感染组(P<0.05)。比较各处理组的离散程度可以看出,合并感染组酸性磷酸酶活力变化最活跃,离散系数(0.50)高于磷酸盐缓冲液组(0.12)、弧菌感染组(0.35)和白斑综合症病毒感染组(0.45)(图5)。
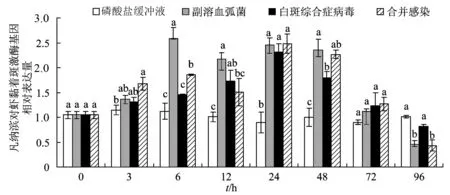
图4 单独和合并感染后不同时间凡纳滨对虾黏着斑激酶基因的表达含不同字母表示在同一时间点,不同处理组之间存在显著性差异 (P < 0.05),下同.

图5 合并感染对凡纳滨对虾酸性磷酸酶活力的影响

图6 合并感染对凡纳滨对虾碱性磷酸酶活力的影响
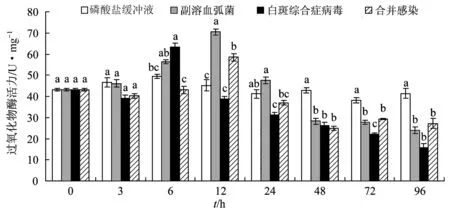
图7 合并感染对凡纳滨对虾过氧化物酶活力的影响
试验12 h 时磷酸盐缓冲液组与合并感染组过氧化物酶活力最大;6 h时弧菌与白斑综合症病毒单独感染组超氧化物歧化酶活力最大。试验48、72、96 h,白斑综合症病毒单独感染组超氧化物歧化酶活力与合并感染组差异不显著(P>0.05);整个试验过程中,弧菌单独感染组超氧化物歧化酶活力始终高于其他2个感染组,试验48 h和72 h差异显著(P<0.05)。72、96 h时磷酸盐缓冲液组超氧化物歧化酶活力高于病原处理组,72 h差异显著(P<0.05)。弧菌单独感染组超氧化物歧化酶活力离散程度(0.32)最高,磷酸盐缓冲液组最低(0.22)(图8)。
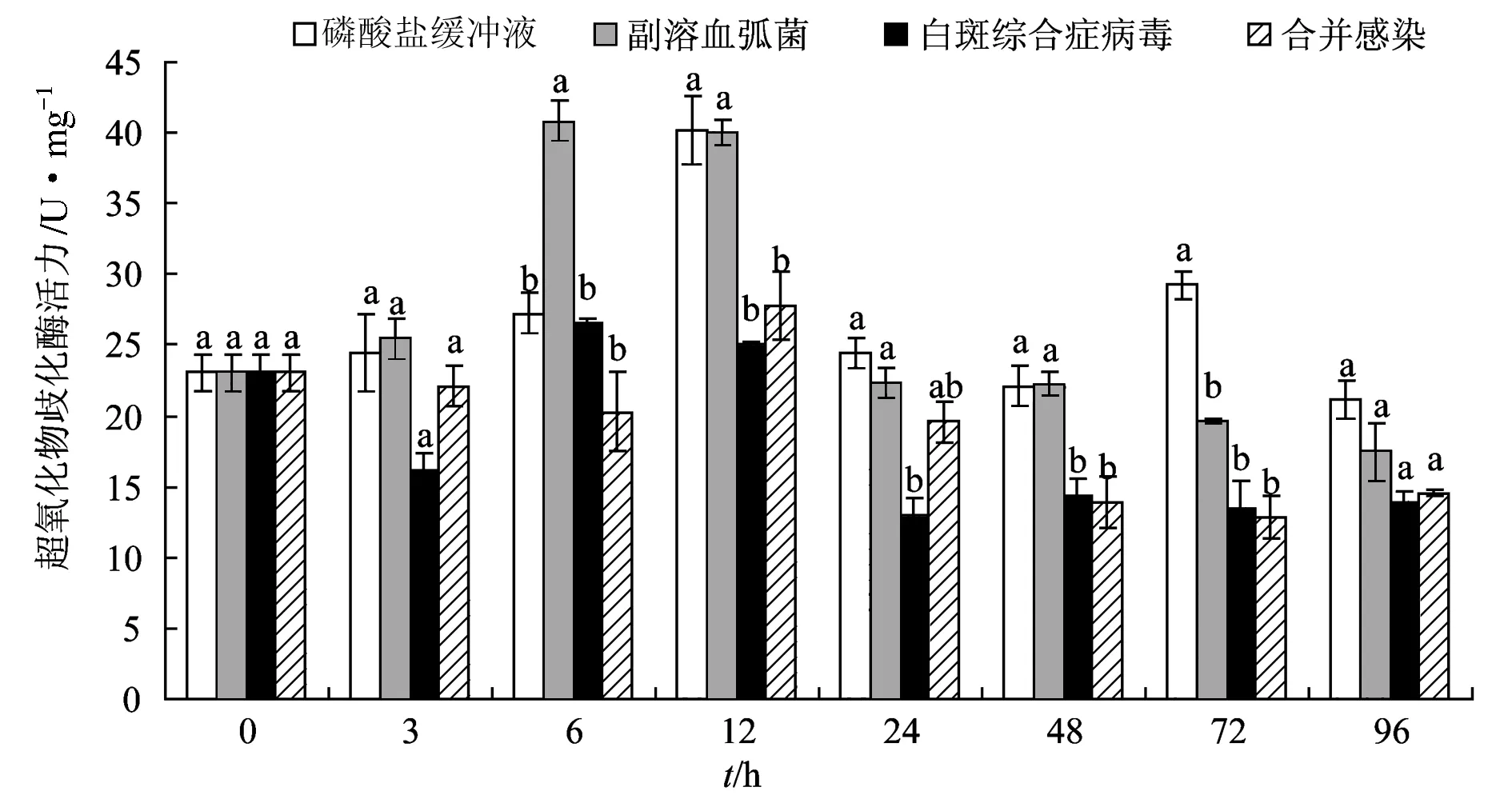
图8 合并感染对凡纳滨对虾超氧化物歧化酶活力的影响
3 讨 论
3.1 副溶血弧菌与白斑综合症病毒单独、合并感染对凡纳滨对虾黏着斑激酶基因表达量的影响
凡纳滨对虾是世界上重要的养殖虾类之一。随着世界水环境的污染和破坏,病毒病、弧菌病成为对虾养殖业健康发展的主要制约因素[12-13],而弧菌与病毒的合并感染又是虾病爆发的重要形式。前期的试验结果表明,副溶血弧菌的感染可以抑制白斑综合症病毒的爆发,降低对虾死亡率。起初笔者认为,这是由于白斑综合症病毒感染细胞后,需要利用细胞中代谢产物来合成自身核酸和蛋白质,来完成自身大分子的合成,而副溶血弧菌的合并感染可能通过减缓细胞新陈代谢速度和争夺细胞代谢产物两种途径,使被感染细胞不能够及时为病毒的复制提供所需要的能量和材料,从而抑制白斑综合症病毒在对虾体内增殖。后有研究发现,被沃尔巴克氏体细菌感染的埃及伊蚊,组织中活性氧含量较高,从激活相关免疫基因及抗氧化剂的大量表达,抑制病毒增殖[14]。本研究中,笔者克隆了凡纳滨对虾黏着斑激酶基因,并研究在副溶血弧菌与白斑综合症病毒合并感染形式下免疫基因与免疫相关酶的应答情况。
凡纳滨对虾黏着斑激酶基因cDNA全长4919 bp,编码1012个氨基酸,包含一个蛋白激酶结构域蛋白酪氨酸激酶和C端对虾黏着结构域,这与Zhang等[11]克隆日本囊对虾黏着斑激酶基因结构相似。黏着斑激酶是一类酪氨酸激酶,C端对虾黏着结构域可通过其他基因结构域相互作用,将斑激酶定位到黏着斑中。蛋白酪氨酸激酶结构域是蛋白激酶特征结构域,蛋白酪氨酸激酶可以从ATP中转运磷酸盐到酪氨酸残基。不同物种构建的斑激酶进化树显示,凡纳滨对虾黏着斑激酶基因与日本囊对虾有高度同源性,二者斑激酶基因相似度可达96%,与人类斑激酶基因相似度达48%。
斑激酶可以通过多条信号通路参与细胞黏附、侵袭、迁移、增殖以及凋亡等活动。在副溶血弧菌与白斑综合症病毒单独、合并感染条件下,凡纳滨对虾黏着斑激酶基因相对表达量呈现了先上调后下降的变化趋势,这可能与3种病原感染激活了斑激酶的表达有关。研究表明,感染白斑综合症病毒的日本囊对虾血细胞中的斑激酶蛋白表达量升高[11],机体感染病原后,需要通过多种方式增强细胞黏附能力,抵御病原感染,这与本试验的研究结果相似。副溶血弧菌和白斑综合症病毒的入侵可以调控斑激酶的表达及磷酸化水平[15]。本研究中,副溶血弧菌单独感染组斑激酶表达量总是高于白斑综合症病毒单独感染组,试验前期,合并感染条件下斑激酶表达量也高于白斑综合症病毒单独感染组,这可能与副溶血弧菌对斑激酶具有较强的诱导作用有关。试验后期,各感染组凡纳滨对虾黏着斑激酶基因表达量明显下降,可能是机体长时间感染病原细胞活力下降导致的。
3.2 副溶血弧菌与白斑综合症病毒单独、合并感染对凡纳滨对虾免疫相关酶活力的影响
酸性磷酸酶和碱性磷酸酶是溶酶体酶的重要组成部分,磷酸酶活力水平可作为评价对虾免疫水平的重要指标[16],酸性磷酸酶在机体免疫反应中起清除和水解微生物的作用[17]。在本研究中,试验12、24 h各病原感染组酸性磷酸酶活力均明显上调,而后活力下降,这与感染白斑综合症病毒的中国明对虾(Fenneropenaeuschinensis)酸性磷酸酶活力变化结果相似[18],这可能是机体免疫机能在病理条件下急性激活反应的体现。碱性磷酸酶是重要的生物调控酶[19],在本文中碱性磷酸酶活力先升后降,这与感染了螺原体罗氏沼虾(Macrobrachiumrosenbergii)[20]碱性磷酸酶的变化相似。试验后期,合并感染组酸性磷酸酶、碱性磷酸酶活力均普遍高于白斑综合症病毒单独感染组,副溶血弧菌单独感染组高于白斑综合症病毒单独感染组,这可能是弧菌感染诱导机体产生更强的免疫反应导致。依酸性磷酸酶、碱性磷酸酶离散程度推测,酸性磷酸酶对合并感染最敏感,而碱性磷酸酶对白斑综合症病毒单独感染最敏感。
非特异性免疫策略是对虾抵御病原感染的第一道防线[21]。当外界水环境改变或病原入侵感染等发生时,机体将通过有氧代谢途径产生过多的氧化剂,导致氧应激反应[22]。过多的活性氧将损伤机体的蛋白质等,机体的防御策略是产生超氧化物歧化酶、过氧化物酶等抗氧化剂消除活性氧,保证机体内抗氧化与呼吸爆发机能的动态平衡[23]。
过氧化物酶体可以产生多种抗氧化酶,包括过氧化物酶、过氧化氢酶等[24]。过氧化物酶活力是评价甲壳动物免疫能力的指标之一[25]。本研究中,白斑综合症病毒单独感染6 h时过氧化物酶活力最大,弧菌单独感染组与合并感染12 h过氧化物酶活力最高,这与Wang等[24]发现感染了白斑综合症病毒的红螯螯虾(Cheraxquadricarinatus)过氧化物酶活力12 h达到最大值的结果相似。试验后期,各感染组过氧化物酶活力均显著低于正常水平,这与病原的长期感染降低了机体的免疫机能有关。试验72、96 h合并感染组肝胰腺组织中过氧化物酶活力高于白斑综合症病毒单独感染组,这说明合并感染组对虾具有更强抗病原免疫能力。各处理组的离散系数表明,弧菌单独感染组过氧化物酶活力最活跃,对副溶血弧菌较白斑综合症病毒更为敏感。
“你选择雪萤的哥哥作为车祸的受害者,原来是为了破坏我和雪萤之间的关系?你太卑鄙、太残忍了。”一杭愤愤地说。
超氧化物歧化酶是关键的抗氧化酶之一,具有将氧化自由基转化成水分子,清除超氧化物自由基的作用,保护机体免受氧化损伤[26]。研究表明,超氧化物歧化酶在保护机体抗病毒、细菌、寄生虫以及物理化学应激方面具有重要作用[27]。本研究中,磷酸盐缓冲液组超氧化物歧化酶活力在试验12 h最大,这可能与机体应激反应有关。试验72、96 h,各处理组超氧化物歧化酶活力均低于磷酸盐缓冲液组,这与感染了白斑综合症病毒的印度明对虾(F.indicus)[28]和凡纳滨对虾[29]超氧化物歧化酶活力明显下降结果相似。张涛等[30]认为,这可能由于感染对虾氧化自由基的急剧增长使抗氧化系统机能异常导致。笔者在试验中发现,弧菌单独感染组超氧化物歧化酶活力离散程度最高,说明其活力更易受副溶血弧菌感染的诱导。参考文献:
[2] Saulnier D,Haffner P,Goarant C,et al.Experimental infection models for shrimp vibriosis studies:a review[J]. Aquaculture,2000,191(1):133-144.
[3] Jang I K,Qiao G,Kim S K. Effect of multiple infections with white spot syndrome virus andVibrioanguillarumon Pacific white shrimpLitopenaeusvannamei(L.):mortality and viral replication [J]. Journal of Fish Diseases,2014,37(10):911-920.
[4] Corteel M,Thanh N C,Nauwynck H,et al. Effect of dose and challenge routes ofVibriospp. on co-infection with white spot syndrome virus inPenaeusvannamei[J]. Aquaculture,2009,290(1):61-68.
[6] Glaser R L,Meola M A. The nativeWolbachiaendosymbionts ofDrosophilamelanogasterandCulexquinquefasciatusincrease host resistance to west Nile virus Infection [J]. Plos One,2010,5(8):11977.
[7] Van den Hurk A F,Hall-Mendelin S,Pyke A T,et al.Impact ofWolbachiaon infection with chikungunya and yellow fever viruses in the mosquito vectorAedesaegypti[J]. PLoS Neglected Tropical Diseases,2012,6(11):1892.
[8] Li F H,Xiang J H. Signaling pathways regulating innate immune responses in shrimp [J]. Fish & Shellfish Immunology,2013,34(4):973-980.
[9] Lan J F,Zhou J,Zhang X W,et al. Characterization of an immune deficiency homolog (IMD) in shrimp (Fenneropenaeuschinensis) and crayfish (Procambarusclarkii)[J]. Developmental & Comparative Immunology,2013,41(4):608-617.
[10] Lu H S,Ruan L W,Xu X.An immediate-early protein of white spot syndrome virus modulates the phosphorylation of focal adhesion kinase of shrimp [J]. Virology,2011,419(2):84-89.
[11] Zhang M C,Wang H F,Li D F,et al. A novel focal adhesion kinase fromMarsupenaeusjaponicusand its response to WSSV infection [J]. Developmental & Comparative Immunology,2009,33(4):533-539.
[12] Karunasagar I,Ababouch L. Shrimp viral diseases,import risk assessment and international trade[J]. Indian Journal of Virology,2012,23(2):141-148.
[13] Kumar B K,Deekshit V K,Raj J R M,et al. Diversity ofVibrioparahaemolyticusassociated with disease outbreak among culturedLitopenaeusvannamei(Pacific white shrimp) in India [J]. Aquaculture,2014,433(1):247-251.
[14] Pan X,Zhou G,Wu J H,et al.Wolbachiainduces reactive oxygen species (ROS)-dependent activation of the Toll pathway to control dengue virus in the mosquitoAedesaegypti[J]. Proceedings of the National Academy of Sciences,2012,109(1):23-31.
[15] Jones R,Luo L,Leoni G,et al.VibrioparahaemolyticusVopA is a potent inhibitor of cell growth and cell migration in the intestinal epithelium[J]. The FASEB Journal,2013,27(1):137.
[16] Sarlin P J,Philip R. Efficacy of marine yeasts and baker's yeast as immunostimulants inFenneropenaeusindicus:a comparative study[J]. Aquaculture,2011,321(3):173-178.
[17] Yin X L,Li Z J,Yang K,et al. Effect of guava leaves on growth and the non-specific immune response ofPenaeusmonodon[J]. Fish & Shellfish Immunology,2014,40(1):190-196.
[18] Zhang Z F,Shao M Y,Kang K H. Changes of enzyme activity and hematopoiesis in Chinese prawnFenneropenaeuschinensis(Osbeck) induced by white spot syndrome virus and zymosan A [J]. Aquaculture Research,2005,36(7):674-681.
[20] Du J,Zhu H X,Liu P,et al.Immune responses and gene expression in hepatopancreas fromMacrobrachiumrosenbergiichallenged by a novel pathogen spiroplasma MR-1008[J]. Fish & Shellfish Immunology,2013,34(1):315-323.
[21] Shi H,Ruan L W,Yan X F,et al.The role ofLitopenaeusvannameip38 in white spot syndrome virus infection[J]. Developmental & Comparative Immunology,2014,44(1):180-185.
[22] Wang W N,Zhou J,Wang P,et al.Oxidative stress,DNA damage and antioxidant enzyme gene expression in the Pacific white shrimp,Litopenaeusvannameiwhen exposed to acute pH stress[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2009,150(4):428-435.
[23] Liang S,Luo X,You W,et al. The role of hybridization in improving the immune response and thermal tolerance of abalone[J]. Fish & Shellfish Immunology,2014,39(1):69-77.
[24] Wang D L,Zuo D,Wang L M,et al. Effects of white spot syndrome virus infection on immuno-enzyme activities and ultrastructure in gills ofCheraxquadricarinatus[J]. Fish & Shellfish Immunology,2012,32(5):645-650.
[25] 刘岩,江晓路,吕青,等. 聚甘露糖醛酸对中国对虾免疫相关酶活性的溶菌溶血活性的影响[J]. 水产学报,2000,24(6):549-553.
[26] Lu X,Wang C,Liu B Z. The role of Cu/Zn-SOD and Mn-SOD in the immune response to oxidative stress and pathogen challenge in the clamMeretrixmeretrix[J]. Fish & Shellfish Immunology,2015,42(1):58-65.
[27] Zhang Q,Li F,Wang B,et al. The mitochondrial manganese superoxide dismutase gene in Chinese shrimpFenneropenaeuschinensis:cloning,distribution and expression [J]. Developmental & Comparative Immunology,2007,31(5):429-440.
[28] Mohankumar K,Ramasamy P. White spot syndrome virus infection decreases the activity of antioxidant enzymes inFenneropenaeusindicus[J]. Virus Research,2006,115(1):69-75.
[29] Lin Y C,Yeh S T,Li C C,et al.An immersion ofGracilariatenuistipitataextract improves the immunity and survival of white shrimpLitopenaeusvannameichallenged with white spot syndrome virus [J]. Fish & Shellfish Immunology,2011,31(6):1239-1246.
[30] 张涛,黄建华,温为庚,等. WSSV+斑节对虾的血清免疫相关酶对人工感染 WSSV 粗提液的反应[J]. 南方水产科学,2013,9(1):35-42.
cDNACloningofFocalAdhesionKinaseandImmuneResponsetoCo-injectioninPacificWhiteLegShrimpLitopenaeusvannamei
WANG Gang1, SUN Chengbo1,2
( 1.College of Fisheries, Guangdong Ocean University, Zhanjiang 524025, China; 2.Tropical Invertebrates Aquaculture Research Center of Guangdong Colleges and Universities, Zhanjiang 524025, China )
Focal adhesion kinase (FAK) gene of Pacific white leg shrimpLitopenaeusvannameiwas cloned by RACE method to study the immune response of Pacific white leg shrimp under co-infection of pathogenic bacteriumVibrioprahaemolyticusand white spot syndrome virus (WSSV). The cDNA sequence was jointed, compared and constructed for phylogenetic tree by software tools, and the tissue distribution and the response under co-infection were studied via real time PCR techniques. The results showed that the full-length cDNA of LvFAK was 4919 bp with an open reading frame of 3036 bp encoding 1012 amino acids. There were two special domain in LvFAK gene, PTK domain and FAT domain. The real-time PCR revealed that the transcrips of LvFAK were detected in all tissue, the maximal relative expression in eyes, and the inimal relative expression in muscle. The LvFAK was regulated byV.prahaemolyticusor WSSV infection or co-infection, first increase and then decrease, and always higher transcrips in co-infection group than in WSSV single infection group.The shrimp had the maximal activity of acid phosphatase (ACP) under co-infection group in all groups, and there was higher alkaline phosphatase (AKP) activity inVibriosingle infection group than in co-infection group, and higher peroxidase (POD) activity in co-infection group than in WSSV single infection group at the end of experiment. The superoxide dismutase (SOD) activity was found to be higher inVibriosingle infectious group than in the other groups.
Litopenaeusvannamei;Vibrioprahaemolyticus; white spot syndrome virus; focal adhesion kinase (FAK); co-infection; enzyme activity
10.16378/j.cnki.1003-1111.2016.02.012
S917
A
1003-1111(2016)02-0162-07
2015-04-17;
2015-09-06.
广东省重点科技计划项目(2013B020501004).
王刚(1989-),男,硕士研究生;研究方向:水产经济动物学及种苗工程.E-mail:wgang2015@126.com.通讯作者:孙成波(1970-),男,教授,博士;研究方向:对虾养殖和病害防治.E-mail:suncb@gdou.edu.cn.
